脐带采集液中抗生素的合理选择
史丽,郁春艳,李岩,许现辉,杨栋林,沈洋洋,邓为民
(1.天津医科大学基础医学院免疫学系,国家教育部免疫微环境与疾病重点实验室,天津300070;2.协和干细胞基因工程有限公司,天津300384;3.中国医学科学院血液学研究所血液病医院,天津300020)
间充质干细胞(MSCs)是成体干细胞的一种,具有自我更新、高度增殖和多向性分化潜能[1-2]。研究表明MSCs在神经系统疾病、血液系统疾病、糖尿病等疾病的治疗中应用前景广阔[3-10]。目前,骨髓被认为是MSCs的经典来源,人脐带间充质干细胞(human umbilical cord mesenehymal stem cells,HUCMSCs)因具有数量丰富、繁殖力强、安全可靠、免疫原性低、治疗疾病种类多、取材方便等优点被认为是替代骨髓源MSCs的理想选择[11-13]。然而在脐带采集过程中,脐带污染的风险较高,因此如何控制脐带污染成为HUCMSCs应用中一个亟待解决的问题。本研究对脐带间充质公共库386份微生物培养阳性标本进行鉴定和药敏分析,选择敏感性较高的抗生素加入培养基中,观察其对HUCMSCs生长、增殖和多向诱导分化的影响,为脐带采集液中抗生素的合理添加提供科学依据。
1 材料与方法
1.1 材料 菌株来源为386份脐带采集液微生物培养阳性标本。天津市中心妇产科医院采集的1 562份脐带,放入脐带采集液中保存,送至脐带间充质公共库;HUCMSCs由脐带间充质公共库提供。
1.2 仪器 BacT/Alert 3D全自动血培养仪(法国梅里埃公司);ATB微生物鉴定及药敏分析仪(法国梅里埃公司);CO2培养箱(Thermo);超净工作台(北京冠鹏净化设备有限公司);OLYMPUS倒置显微镜X70(日本OLYMPUS公司);MultiskanTM FC型酶标仪(Thermo);Fj-2008全自动免疫计数仪(西安262厂)。
1.3 试剂与药品 BacT/Alert系统专用需氧厌氧瓶(法国梅里埃公司);血琼脂培养基、麦康凯琼脂培养基、沙保罗琼脂培养基(天津金正公司);API系统的细菌鉴定卡与药敏试验卡(法国梅里埃公司);细胞培养基(DMEM∶F12=1∶1)(GIBCO公司);青霉素(GIBCO公司);两性霉素B(GIBCO公司);头孢西丁、台盼蓝、地塞米松、吲哚美辛、油红O、β-磷酸甘油、2-磷酸-L-抗坏血酸和胰岛素(Sigma公司)。
1.4 方法
1.4.1 微生物鉴定和药敏 脐带采集后放入脐带采集液中保存,然后送至脐带间充质库。注射器抽取12 mL脐带采集液,需氧瓶、厌氧瓶各6 mL进行微生物培养。凡系统报告为阳性瓶时,应从菜单扩展功能项进入观察曲线状态,并及时转种血琼脂培养基、麦康凯琼脂培养基、沙保罗琼脂培养基,置恒温孵箱35℃培养18~24 h。按照标准化操作流程,将细菌或真菌制成菌悬液,接种于相应的鉴定卡和药敏卡,35℃温箱培养18~24 h,其中ATB STAPH药敏卡需培养48 h,读取结果。
1.4.2 HUCMSCs形态、生长和增殖情况 根据细菌及真菌的鉴定和药敏结果选择头孢西丁、青霉素、两性霉素B。随机选取10份标本观察加入的抗生素对细胞生长和增殖是否有影响。将已培养2~3 d生长旺盛的HUCMSCs,用0.25%胰酶消化后,用含10%胎牛血清的DMEM/F12培养液(D培养液)将其稀释成1×104/mL,加入24孔培养板,每孔1 mL,置于37℃的5%二氧化碳培养箱中24 h后,吸出培养液。分组处理如表1。倒置相差显微镜下观察各组细胞培养4 d后的形态。再更换培养液第0、1、3、5、7天台盼蓝染色作活体计数,10份标本取均值绘制HUCMSCs的生长曲线。
1.4.3 HUCMSCs体外向脂肪细胞诱导分化 按1.4.2 分5组,取第3代HUCMSCs,按每孔1×104/mL细胞浓度接种于6孔板中,按表1分组加入抗生素。待细胞融合达80%时分别更换为加入成脂诱导液(1μmol/L地塞米松+100μmol/L吲哚美辛+10 mg/L胰岛素+0.5 mmol/L1-甲基-3-异丁基黄嘌呤)的D培养液。每3 d或4 d换液1次,连续诱导3周,去除含诱导液的D培养液,PBS洗涤液洗涤2次,用多聚甲醛固定,油红O染色。另设一空白对照孔为a组,也按每孔1×104/mL细胞浓度接种于6孔板中,只加D培养液,不加诱导液,油红O染色。加入异丙醇作用10 min,洗脱细胞内的脂滴,转移到96孔板,酶标仪490 nm处读取OD值。
1.4.4 HUCMSCs向骨细胞诱导分化 按1.4.2分5组,取第3代HUCMSCs,按每孔1×104/mL细胞浓度接种于6孔板中,用D培养液培养,按表1分组加入抗生素。待细胞融合达80%时分别更换为加入成骨诱导液(0.1μmol/L地塞米松+10 mmol/Lβ-磷酸甘油+50μmol/L 2-磷酸-L-抗坏血酸)的D培养液。每3 d或4 d换液一次,连续诱导4周,其他处理同步骤1.4.3,茜素红染色。另设一空白对照孔为a组,也按每孔1×104/mL细胞浓度接种于6孔板中,只加D培养液,不加诱导液,茜素红染色。
收集成骨诱导分化4周后的细胞培养基,采用放射免疫法检测各组培养基中骨钙素含量。
1.5 统计学处理 使用GraphPad prism 5进行统计学分析并绘图。符合正态分布的计量资料用±s表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 污染菌分布和药敏 微生物培养阳性的386份脐带采集液,共检出细菌及真菌438株。其中革兰阴性菌193株(44.1%),主要为大肠埃希菌;革兰阳性菌210株(48.0%),主要为肠球菌,其次是葡萄球菌和链球菌;真菌35株(8.0%),主要为白假丝酵母菌。转种后检出的主要污染菌分布见图1。其中,4例转种未生长判定为假阳性。56例转种发现有两种微生物污染,其中剖腹产10份,顺产46份。未发现2种以上微生物污染的情况。脐带采集液主要检出菌对3种抗生素的敏感率见表2。
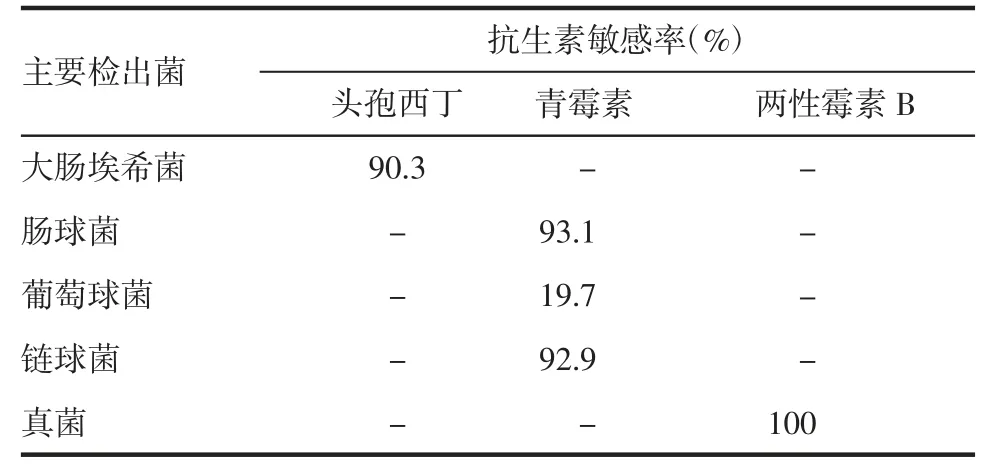
表2 脐带采集液主要检出菌对抗生素的敏感率Tab 2 Sensitivity rate of main bacteria detected in umbilical cord collection fluid to antibiotics
2.2 HUCMSCs形态 各组细胞培养4 d后的形态显示:试验组c组、d组、e组和f组细胞形态良好,为梭形和多角形,涡旋状排列生长,并可见圆形分裂细胞,表明细胞生长旺盛,细胞折光性强,与对照b组相似(图2)。各组进行细胞计数,绘制细胞的生长曲线(图3),各组加抗生素分别与不加抗生素对照组比较,差异均无统计学意义(P=0.57)。结果表明头孢西丁、青霉素、两性霉素B和头孢西丁+青霉素+两性霉素B对HUCMSCs生长和增殖无显著影响。

图2 各组人脐带间充质干细胞培养4 d后的形态(40×)Fig 2 Morphology of HUCMSCsin each group after 4 daysof culture(40×)
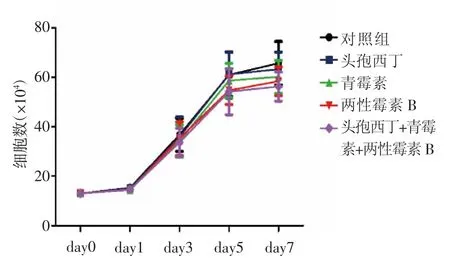
图3 各组人脐带间充质干细胞增殖情况的比较Fig 3 Comparison of theproliferation of HUCMSCsin each group
2.3 HUCMSCs向脂肪细胞分化 显微镜下可见细胞胞浆中充满明亮橙红色油滴。试验组b组、c组、d组、e组和f组与对照组a组无明显差别(图4)。酶标仪定量检测细胞内脂滴,加抗生素各组分别与不加抗生素对照组比较,差异均无统计学意义(P=0.89)。
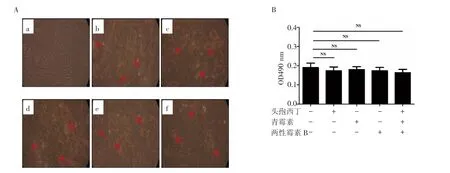
图4 各组人脐带间充质干细胞成脂分化潜能Fig 4 Theadipogenic differentiation ability of HUCMSCsin each group
2.4 HUCMSCs向骨分化 显微镜下可见红色骨结节。试验组b组、c组、d组、e组和f组与对照组a组无明显差别(图5)。检测各组培养基中骨钙素含量,各组加抗生素分别与不加抗生素对照组比较,差异均无统计学意义(P=0.71)。
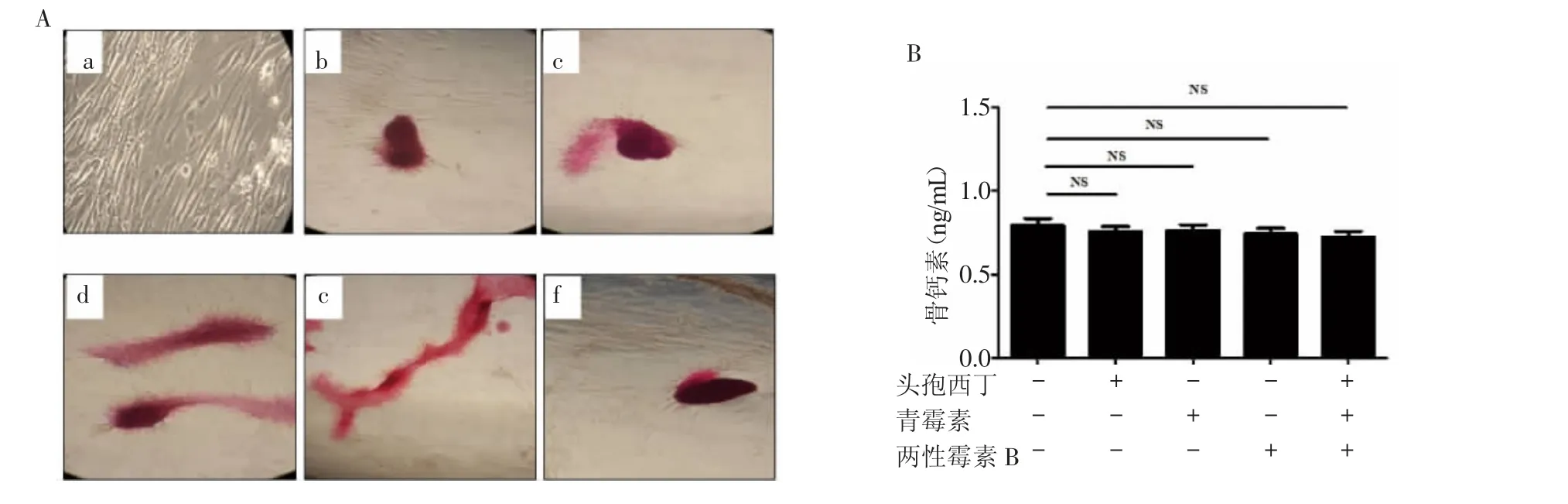
图5 各组人脐带间充质干细胞成骨分化潜能Fig 5 Theosteogenic differentiation ability of HUCMSCsin each group
3 讨论
本研究通过对386份脐带采集标本的研究发现,共检出细菌及真菌438株。其中革兰阴性菌193株(44.1%),主要为大肠埃希菌;革兰阳性菌210株(48.0%),主要为肠球菌,其次是葡萄球菌和链球菌;真菌35株(8.0%),主要为白假丝酵母菌。
细胞培养时常出现污染现象,常在培养基中加青霉素和链霉素预防污染[14]。本研究发现,大肠埃希菌对头孢西丁的敏感率为90.3%,肠球菌、葡萄球菌、链球菌对青霉素的敏感率分别为93.1%、19.7%、92.9%,真菌对两性霉素B的敏感率为100%。因此,保存脐带的采集液中加入头孢西丁、青霉素和两性霉素B,可有效减少脐带污染。
HUCMSCs的生长曲线和细胞形态均反映头孢西丁、青霉素、两性霉素B和三者混合使用(终浓度均为16 mg/L)对HUCMSCs生长和增殖无影响,也不影响HUCMSCs经诱导向脂肪细胞分化和向骨细胞的分化。头孢西丁的药理机制是通过与一个或多个青霉素结合蛋白(PBPs)结合,抑制细菌分裂活跃的细胞的细胞壁生物合成,从而起抗菌作用。青霉素所含的青霉烷能使细菌细胞壁的合成发生障碍,导致细菌溶解死亡。两性霉素B为多烯类抗真菌抗生素,通过影响细胞膜通透性发挥抑制真菌生长的作用。人体细胞没有细胞壁,仅有细胞膜,头孢西丁、青霉素均作用于细胞壁,故不损害人体细胞。本研究结果提示16 mg/L头孢西丁和青霉素对HUCMSCs形态、生长、增殖和诱导分化无影响;16 mg/L两性霉素B既能抑制真菌生长,又对HUCMSCs形态、生长、增殖和诱导分化无影响。与黄文敬等[15]研究认为两性霉素B在剂量高于30 mg/L时才有细胞毒性结果一致。
综上,本研究证实,保存脐带的采集液中加入头孢西丁、青霉素和两性霉素B(终浓度均为16 mg/L),可有效减少脐带采集细菌和真菌污染,很大程度上避免脐带HUCMSCs因被污染而废弃。本研究可为脐带采集液中抗生素的合理添加提供实验依据,为HUCMSCs的应用提供保障。

