白细胞介素-18在小鼠缺血性脑卒中的损伤作用及其机制
乌日吉木斯,刘啸轩,苏悦,阎涛,2
(天津医科大学总医院1.神经病学研究所;2.神经内科,天津300052)
脑卒中是我国第一位死亡原因,具有高发病率、高复发率、高致残率、高死亡率的特点,显著增加了患者家庭和社会的经济负担。脑卒中的疗法主要集中于局部缺血区域神经元的保护和血流再通,但因为其治疗时间窗窄和技术要求高,只有极少数患者能够受益。卒中后组织损伤引发的免疫炎症反应贯穿卒中后各个阶段,如何通过干预免疫炎症以减轻脑卒中患者的脑损伤而改善预后,是未来卒中研究的重点方向之一[1]。白细胞介素-18(interleukin-18,IL-18)是一种多效性促炎细胞因子,也被称为干扰素γ诱导因子,能够被半胱氨酸天冬氨酸蛋白水解酶-1(cysteine-requiring aspartate protease,caspase-1)激活成为成熟有活性的糖蛋白,在固有免疫和获得性免疫中起关键作用,在人体各种免疫细胞中均有广泛表达[2]。研究表明,IL-18参与多种神经系统疾病,包括视神经脊髓炎谱系疾病、多发性硬化、脑内出血等[3-4]。然而,尚不明确IL-18在缺血性脑卒中的作用机制。因此,本研究通过光化学法诱导局灶性大脑皮层缺血性脑卒中模型,探讨IL-18在缺血性脑卒中的损伤作用及其机制,对将来临床治疗缺血性脑卒中提供新的思路。
1 材料与方法
1.1 实验动物及分组 成年雄性C57BL/6J小鼠,20~22 g,7~8周龄;购买自北京维通利华实验动物技术有限公司。实验动物[许可证号:SCXK(京)2016-0006,批号:110011200109844553]全部饲养于天津医科大学总医院神经病学研究所动物实验中心SPF级专业鼠房。小鼠随机分为对照组、脑梗死组、IL-18分泌型结合蛋白(IL-18BP)治疗组(IL-18BP是一种分泌的糖蛋白,通过与IL-18结合并阻断其生物学活性而充当IL-18拮抗剂,购自美国R&D公司),每组18只。IL-18BP治疗组在造模后1 h、24 h及48 h腹腔注射IL-18BP(4μg/次),而对照组和脑梗死组分别注射等量的生理盐水。所有小鼠提供充足的食物和水,并维持昼夜节律的稳定。
1.2 实验方法
1.2.1 缺血性脑卒中模型 本实验采用光化学法诱导局灶性大脑皮层缺血性脑卒中模型。主要步骤:称重小鼠,在手术前5 min行腹腔注射给予玫瑰红染料(50 mg/kg,0.9%生理盐水溶解,光敏感物质,可在绿光诱导下诱导特定区域的血管阻塞)。腹腔注射5%水合氯醛(70μL/10 g)麻醉小鼠,之后将麻醉好的小鼠固定于立体定位仪上,下方需放置小鼠体温维持板用以维持体温,红霉素眼药膏涂抹小鼠双眼予以保护。沿颅骨中缝切开小鼠颅骨表面皮肤,约1cm,充分暴露小鼠颅骨表面,利用棉签清除所需要诱导梗塞部位的颅骨外骨膜并标记。将绿光光源的光纤头部固定于标记部位,在光纤头部与小鼠颅骨间放置中空的黑色橡胶垫来防止光线露出。开启绿光光源照射20 min,期间注意小鼠生命体征。照射结束后取下光纤头部,生理盐水冲洗颅骨表面,缝合切口,利用碘伏再次对缝合伤口消毒,维持小鼠体温至彻底清醒,恢复自由进食水。
1.2.2 动物处理 分别于第3天和第14天处死小鼠,深度麻醉小鼠后进行冰磷酸盐缓冲液(phosphate buffered saline,PBS)心脏灌注,后取出脑组织。第14天的脑组织制成石蜡标本,进行后续染色。第3天的脑组织,分别用于RNA提取和流式细胞术检测。
1.2.3 神经功能评分 采用改良神经功能缺损量表评分(modified neurological severity score,mNSS)和足错步实验(foot-fault test),通过评价其运动功能以及感觉功能,判断缺血性脑损伤后损伤程度和恢复情况。分别于造模后第1、3、7、14天进行神经功能评分。
1.2.4 苏木紫和伊红(hematoxylin-eosin staining,HE)染色 小鼠脑组织保存于4%组织固定液中固定24 h后,进行后续脱水石蜡包埋后制备成石蜡切片。脑切片行HE染色,测量脑梗死面积大小。
1.2.5 实时荧光定量PCR检测炎性指标 使用实时荧光定量PCR技术检测IL-1β、肿瘤坏死因子(TNF)-α、IL-6和IL-10的表达水平。在第3天处死小鼠,取新鲜脑组织,加入TRIzol裂解液,研碎充分,制备RNA,检测其浓度及纯度保证在可用范围内。使用反转录试剂盒将RNA反转录成cDNA。由生工生物工程(上海)股份有限公司负责合成引物。引物浓度稀释至10μmol/L。20μL的反应体系由2.5μL的cDNA、1μL的正向引物、1μL的反向引物、5.5μL的无酶水和10μL的SYBR green PCR Master Mix组成。在Option 2Real-Time PCR检测系统进行定量分析。引物序列见表1。

表1 引物序列Tab 1 Primer sequences
1.2.6 流式细胞术 在造模后第3天处死小鼠,收集脑组织以制备单细胞悬液。将脑组织在冰冷的PBS中切成小块。将组织碎片与胶原酶D4(1 g/L,Sigma-Aldrich)和Dispase(1 g/L,Roche)孵育,并在37℃消化60 min。使匀浆通过70μm过滤器,并将滤液以2 000 r/min离心3 min。离心的细胞重悬于30%Percoll(GE)中,然后以700 r/min离心10 min。用冰PBS以2 000 r/min洗涤沉淀10 min。将单细胞悬液与以下荧光标记的抗体孵育:分别孵育CD45、CD11b、CD86和CD206抗体。其中,CD45+CD11b+CD86+标记M1型小胶质细胞,CD45+CD11b+CD206+标记M2型小胶质细胞。流式细胞仪数据从FACSAria流式细胞仪(BD Biosciences,San Jose,CA,USA)收集,并使用Flowjo_V 10进行分析。
1.3 统计学处理 利用Graphpad Prism5.0进行统计分析,以±sx表示结果。两组独立样本比较采用非配对t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠脑梗死后神经功能情况 与脑梗死组比较,在第7天和14天,IL-18BP治疗组小鼠mNSS评分显著降低(t=2.750,P<0.05;t=3.789,P<0.05),见图1。与脑梗死组比较,在造模后的第3、7、14天,IL-18BP治疗组小鼠的足错步实验评分显著降低(t=2.518,P<0.05;t=2.767,P<0.05;t=3.114,P<0.05),见图1。
2.2 各组脑梗死面积情况 与脑梗死组比较,IL-18BP治疗组脑梗死面积显著降低(t=2.235,P<0.05),见图2。
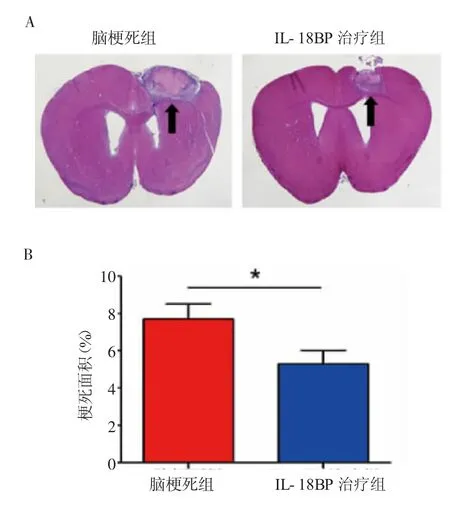
图2 HE染色检测小鼠脑梗死面积Fig 2 Theinfarct sizedetected by HE staining
2.3 各组小鼠脑组织中炎性因子的表达 与对照组比较,脑梗死组小鼠脑组织中的TNF-α、IL-1β和IL-6的水平升高(t=4.289,P<0.05;t=3.276,P<0.05;t=3.687,P<0.05),IL-10的水平降低(t=3.134,P<0.05),见图3。而与脑梗死组比较,IL-18BP治疗组小鼠脑组织中的TNF-α、IL-1β和IL-6的水平显著降低(t=3.091,P<0.05;t=2.328,P<0.05;t=3.443,P<0.05),IL-10的水平显著升高(t=4.997,P<0.05),见图3。
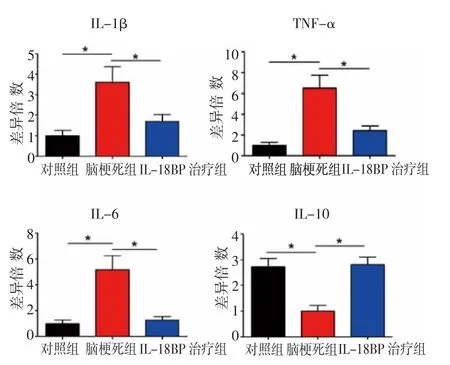
图3 小鼠脑组织内炎性因子表达变化Fig 3 Thechangeof inflammatory factorsin brain tissueof mice
2.4 各组小鼠脑组织内小胶质细胞表型变化 与对照组比较,脑梗死组M1型小胶质细胞数量显著增加(t=5.971,P<0.05),M2型小胶质细胞数量增加(t=2.823,P<0.05)。与脑梗死组比较,IL-18BP治疗组M1型小胶质细胞数量明显降低(t=4.779,P<0.05),M2型小胶质细胞数量明显升高(t=2.619,P<0.05)。
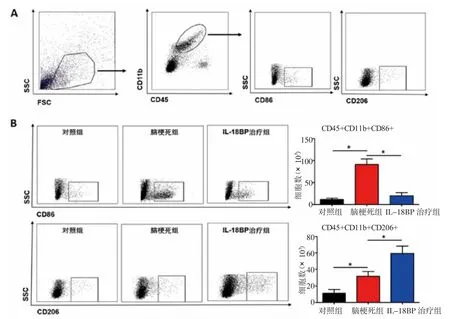
图4 流式细胞术检测各组小鼠脑组织M 1/M2型小胶质细胞的变化Fig 4 Thechangesof M1/M2 typemicroglia in thebrain tissueof micedetected by flow cytometry
3 讨论
卒中导致神经元细胞死亡,并激活损伤相关的分子模式,释放的因子在受伤的大脑区域引起局部炎症[5-6]。这种局灶性大脑炎症会加剧血-脑屏障损害、微血管衰竭、脑水肿、氧化应激并直接导致神经元细胞死亡,从而加剧继发性脑损伤[1]。IL-18在缺血性脑损伤中发挥重要作用,参与炎症反应的启动与扩增。IL-18启动的单核细胞中促炎因子和趋化因子可介导免疫细胞向缺血损伤部位募集,触发炎症级联反应,加剧缺血后的损伤[7]。IL-18 mRNA在成年大鼠脑缺血后的晚期被诱导[8],参与脑卒中后脑内炎症的诱导和发展[9]。在脑卒中患者中,血清IL-18水平升高与颅脑计算机断层扫描中低密度区域的范围以及功能障碍相关[3]。研究表明用抗IL-18单克隆抗体或IL-18BP可改善缺血再灌注引起的心肌损伤[10-11]。本研究通过光化学法诱导局灶性大脑皮层缺血性脑卒中模型,应用IL-18BP阻断IL-18作用并评估神经功能及脑梗死面积变化。结果显示,IL-18BP治疗脑梗死小鼠后不仅能改善小鼠神经功能障碍,还能显著降低脑梗死面积。
卒中后大脑中多种细胞类型可产生炎性介质,包括细胞因子和趋化因子。细胞因子是中枢神经系统各种病理条件下神经炎症和急性、慢性神经退行性变的重要介质。在急性缺血性卒中的小鼠模型中,缺血后急性期在对侧半球中观察到的一系列细胞因子,包括IL-1β、IL-6、TNF-α和转化生长因子-β,是各种神经病理条件下神经炎症的重要介质[1,6]。对脑出血发作后2 h至5 d死亡的30例脑出血患者的大脑进行组织病理学病例对照研究,发现对侧海马中的核因子-κBp65亚基、巨噬细胞炎性蛋白2和基质金属蛋白酶-9上调[1]。因此细胞因子介导的神经炎症与神经元细胞死亡和不良结果相关。研究表明,腹腔注射IL-18BP可改善炎症反应,促进血管再生修复[12]。本研究应用IL-18BP阻断IL-18作用,实时荧光定量PCR检测脑组织中炎性因子表达。发现IL-18BP治疗脑梗死小鼠可通过降低IL-1β、IL-6和TNF-α的表达水平,增加抗炎因子IL-10的表达,从而改善卒中后的神经功能损伤。
小胶质细胞是脑内表达炎症体基因的主要细胞,占中枢神经系统细胞的10%~15%[13-14]。活化的小胶质细胞/巨噬细胞由于其M1/M2表型不同,在脑卒中后神经损伤中发挥着双刃剑的作用[15]。通常被认为具有神经毒性的M1型小胶质细胞表达促炎因子,具有清除死细胞和组织碎片的功能[16];而被认为具有神经保护和修复作用的M2型小胶质细胞主要表达抗炎和生长因子,修复受损的脑组织[17-18]。血-脑屏障破坏也可能与小胶质细胞的激活状态密切相关。有实验已经显示脑卒中后,炎症性小胶质细胞通过上调包括IL-1β、TNF-α和IL-6在内的促炎性细胞因子而大大降低了血-脑屏障的完整性[19]。小胶质细胞还可以与星形胶质细胞或脑微血管内皮细胞相互作用。活化的小胶质细胞通过直接吞噬内皮细胞并引起血管解体,最终导致血-脑屏障的破坏,进一步引入循环免疫细胞并增加其对脑实质的浸润[20]。本研究应用IL-18BP阻断IL-18作用,应用流式细胞术检测脑组织中小胶质细胞表型变化,发现IL-18BP治疗脑梗死小鼠后可通过促进小胶质细胞表型由促炎表型M1向抗炎表型M2转化,从而减少促炎因子的分泌,增加抗炎因子的分泌,改善卒中后的炎症反应。但其具体影响的信号通路尚未明确,有待今后进一步完善。
综上所述,缺血性脑卒中后IL-18介导了免疫反应从而引起卒中后的继发性免疫炎性损伤。IL-18主要通过介导小胶质细胞从促炎表型向抗炎表型转化,影响脑卒中后神经功能的恢复。本研究揭示了IL-18在脑卒中的免疫炎性损伤中发挥关键的调节作用,为临床脑梗死救治提供新的视角和治疗方法。

