急性心肌梗死后心力衰竭的特异性靶点基因研究
李树杰,宋昱
(1.天津医科大学研究生院,天津300070;2.天津泰达国际心血管病医院ICU,天津300457)
急性心肌梗死是我国50~75岁人群中多发疾病, 而且死亡率居高不下[1]。急性心肌梗死主要是由持续性缺血缺氧、冠状动脉急性缺血缺氧所导致的心肌梗死。目前临床主要采取保守治疗和经皮冠状动脉介入治疗(percutaneouscoronary intervention,PCI)[2]。心力衰竭是急性心肌梗死后常见的并发症,并且与多种严重的不良预后密切相关[3-4]。然而,目前针对急性心肌梗死后心力衰竭的发病机制尚不明了。其特异性预测生物标志物和候选治疗靶点尚未完全建立。针对于此,本研究利用GEO数据库进行急性心肌梗死后心力衰竭靶点基因的筛选,并开展临床初步验证。
1 资料与方法
1.1 生物信息方法筛选差异基因
1.1.1 数据源 本研究分析数据来源于GEO数据库(http://www.ncbi.nlm.nih.gov/geo/),编号GSE59867。芯片中包含65个样本,记录了17例急性心肌梗死患者在发病后6个月随访期间内心力衰竭发展的详细情况。本研究生物信息部分针对芯片中17例急性心肌梗死患者入院、出院(4~6 d)、1个月和6个月后外周血单个核细胞的转录谱进行分析。芯片中急性心肌梗死发生后心力衰竭患者(n=9)与非心力衰竭患者(n=8)在临床基本特征上无显著差异(P>0.05)。芯片数据是利用GPL6244平台进行分析。
1.1.2 差异基因分析 本研究以R语言中limma软件包来分析不同组之间差异表达的mRNA和miRNA,以对数转换的差异表达倍数(Log2FC)的绝对值>1和P<0.05为标准[5]。
1.1.3 miRNA靶点基因的预测 miRNA的靶点基因通过miRNA数据库(miRDB,版本6.0)进行预测[6]。Cytoscape软件(3.7.2版)用于miRNA-mRNA相关性可视化调控网络建立。
1.2 针对重点基因的临床验证
1.2.1 研究对象 回顾性分析天津泰达国际心血管病医院2018年1月—2020年12月经病理确诊的急性心肌梗死患者。纳入标准:所有病例均经病理证实;有完整的影像学检查资料。排除标准:存在其他心血管疾病;存在重大疾病;未得到患者或者家属同意。患者出院后跟踪记录观察6个月,研究对象共61例,根据心力衰竭与否分为:心力衰竭组[共32例,男性20例,女性12例,年龄(51.2±8.3)岁]与非心力衰竭组[共29例,男性18例,女性11例,年龄(47.3±7.2)岁]。组间患者临床基本特征上无显著差异(P>0.05)。
1.2.2 ELISA检测 差异基因浓度测定采用ELISA双抗体夹心法,具体操作严格按照商用试剂盒说明书进行(Abcam公司)。待测样品源于两组患者的外周血。实验进行3次独立检测,最终进行统计分析。
1.3 统计学处理 采用Excel 2013软件建立数据库,SAS 9.4和SPSS 19.0统计软件进行数据分析。对连续性变量进行正态分布检验,符合正态分布的变量以±s表示,采用SAS 9.4中的t检验方法用于数据比较。P<0.05为差异有统计学意义。
2 结果
2.1 芯片中心力衰竭组差异基因筛选与非心力衰竭组比较 心力衰竭组共显示703个差异表达基因(mRNAs),包括567个上调基因和136个下调基因(图1A和图1B)。其中SPI1、MCUR1、ZBTB7A、IRF8和PPARG表现出最显著上调。与此同时,心力衰竭组患者表现出12个差异miRNAs,其中上调的miRNAs 5个,下调的miRNAs 7个(图1C和图1D)。miR-133、miR-124-3和miR-9-1显著下调,差异均具有统计学意义(P<0.05)。

图1 急性心肌梗死患者心力衰竭组差异基因分析Fig 1 Differential geneanalysisof heart failuregroup in patientswith acutemyocardial infarction
2.2 芯片中心力衰竭组miRNA-mRNA调控网络 本研究利用Cytoscape软件将3种选定的miRNA(miR-133、miR-124-3和miR-9-1)和5个差异最为显著的mRNA(SPI1、MCUR1、ZBTB7A、IRF8和PPARG)构建基因调控网络。从图2可以看出,miR-133参与SPI1和MCUR1功能的调控,而miR-124-3和miR-9-1分别控制ZBTB7A、PPARG以及IRF8。

图2 急性心肌梗死患者心力衰竭组mRNA-miRNA基因网络图Fig 2 Construction of mRNA-miRNA interaction network of heart failuregroup in patientswith acutemyocardial infarction
2.3 差异基因临床检测 与非心力衰竭组比较,SPI1、MCUR1、ZBTB7A、IRF8和PPARG蛋白表达浓度在心力衰竭组中显著升高。与差异基因筛选结果一 致,差异均具有统计学意义(P<0.05),见表1。
表1 差异基因的水平检测(±s)Tab 1 Detection of differentially expressed genes(±s)
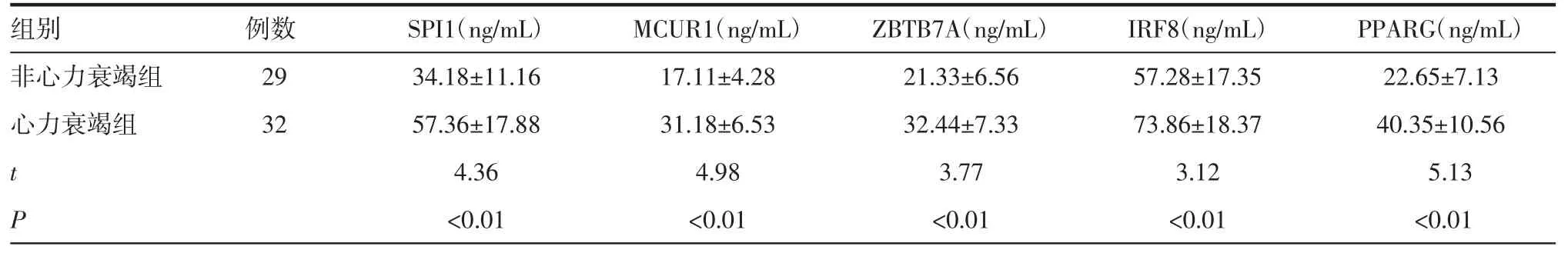
表1 差异基因的水平检测(±s)Tab 1 Detection of differentially expressed genes(±s)
?
3 讨论
急性心肌梗死是临床常见危重症,起病急骤,病情变化迅速,死亡率高。心力衰竭是急性心肌梗死最常见的并发症。近年来,中国发布了心肌梗死和心力衰竭的诊疗指南[7]。指南中明确指出:中国心肌梗死后心力衰竭仍然存在很高的发病率。虽然近些年随着治疗手段的发展,心肌梗死后心力衰竭患者的预后得到一定改善,但是其死亡率、心血管事件发生率仍然居高不下。这与该类患者治疗手段和发现的时间密切相关[8]。目前临床上针对急性心肌梗死后心力衰竭的有效标记物研究较少。本研究利用生物信息学和临床验证的方式,提出了若干潜在心力衰竭标志物,并构建了基因调控网络。本研究确定SPI1、MCUR1、ZBTB7A、IRF8和PPARG可以作为急性心肌梗死后心力衰竭的主要特征性基因。最近一项研究表明,SPI1在心肌重塑的发病机制中存在明显的过量表达[9]。MCUR1是线粒体钙单向转运蛋白调节因子1,主要在心肌细胞内离子调控方面发挥重要作用[10]。ZBTB7A是一种含POZ结构域的蛋白质,直接结合到许多基因组调控位点,控制染色质结构和基因组启动子的招募。ZBTB7A主要通过核因子-κB通路,调节心肌细胞的功能[11]。IRF8是来自干扰素调节因子(IRF)家族的一员。除了调节先天性免疫反应外,IRF8还被证实涉及某些癌症的肿瘤抑制基因调节。IRF8心肌特异性过表达的小鼠可以对主动脉缩窄引起的心肌肥大具有保护作用[12]。PPARG是核受体的过氧化物酶体的亚家族成员之。目前,PPARG已经证实与许多疾病的形成密切相关,例如肥胖、糖尿病、动脉粥样硬化和癌症。PPARG还可以通过抑制炎症、氧化应激和凋亡发挥心脏保护作用[13]。
本研究另一个重点是miRNA和急性心肌梗死后心力衰竭的密切联系。miR-133、miR-124-3和miR-9-1是心力衰竭组的主要差异miRNAs。miR-133在之前的研究中已经被证明可以控制心肌纤维类型转换并诱导肌源性分化程序[14]。miR-124-3和miR-9-1也在一项生物信息报道中列为心力衰竭的主要参与mRNAs[15]。值得注意的是,本研究发现的5个主要差异基因在心力衰竭组中的表达均明显增加。这或许可以用3个主要miRNAs的下调来解释(图2)。这些都值得进一步调查。总体而言,本研究全面比较了急性心肌梗死后心力衰竭组与非心力衰竭组主要的差异基因图谱,并建立了差异基因网络图,为今后了解急性心肌梗死患者后心力衰竭的发病机制提出了新的思路。本研究为单中心研究,样本量有限,尚存在一定的局限性。为了差异标志物更有效的进行临床推广,未来还需要进行多中心、大样本量研究。

