海藻提取物的农业应用研究进展
陈芊如 褚德朋 Ilyas Naila 张鑫 荆常亮 王鹏
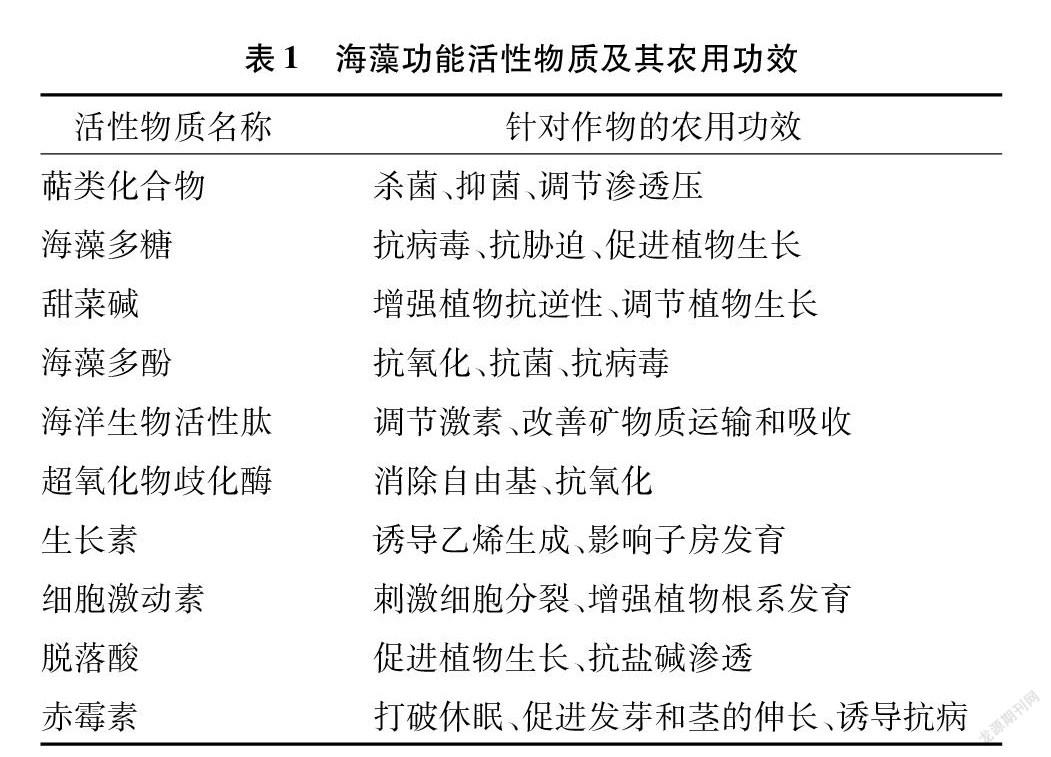
摘要:海藻以其丰富多样的营养物质成分,在植物生长发育中发挥了重要作用。近年来,随着食物安全重要性的不断上升,海藻提取物因其绿色、无毒、环保等特性,在现代有机农业和综合农业中应用范围逐渐扩大,具有极为广阔的前景。因此,阐述近年来海藻提取工艺的研究概况,包括传统提取工艺和绿色友好的新型提取工艺。此外,还综述海藻提取物在农业生产中的作用,包括提高种子发芽率,促进植物生长;促进作物增产和根系发育;改善作物胁迫管理(水、盐、温度)以提高作物品质和抵御植物病害;促进土壤有机质形成和修复土壤理化结构等。
关键词:海藻提取物;提取工艺;促进植物生长;植物病害防御;修复土壤
中图分类号: TQ452;S188 文献标志码: A
文章编号:1002-1302(2021)20-0049-07
收稿日期:2021-01-08
基金项目:中国农业科学院科技创新工程(编号:ASTIP-TRIC07);山东青岛烟草有限公司重点项目(编号:QDYC202101)。
作者简介:陈芊如(1996—),女,山东烟台人,硕士研究生,主要从事资源利用与植物保护研究。E-mail:ycscqr@163.com。
通信作者:王 鹏,硕士,政工师,主要从事烟叶生产经营管理。E-mail:0539wangpeng@163.com。
海洋是地球上不可或缺的组成部分,孕育了20多万种生物,是一个独特的生态系统。海洋由于其高压、高盐、低光照等特殊环境,产生了许多与陆地生物完全不同的结构新颖的生物活性物质[1],在很多领域都具有重要价值。目前,海洋已经成为最具开发潜力的领域之一。海洋中的活性物质,主要分为海洋生物源蛋白多肽类,多集中在海星、海藻、鱼、虾与贝类等海洋生物中;活性脂质类,主要包括脂肪酸、甾醇、磷脂和甘油酯等;碳水化合物类,别称糖类化合物,主要有单糖、低聚糖和多聚糖;海洋生物抗氧化剂,包括多糖及其衍生物、超氧化物歧化酶、不饱和脂肪酸、多酚类和光合色素等[2](表1)。这些海洋来源的活性物质目前被发现具有抗氧化、抗菌、抗衰老、抗癌、抗凝血、抗心脑血管疾病、抗肿瘤、抗炎等生理活性[3-4]。当前,由于化肥、农药的过度使用,农田生态环境恶化。海藻提取物作为一种新型的生物刺激剂在农业生产中发挥了重要作用,近几年的关注程度日益提升,本文主要针对海藻提取物工艺研究进展以及在农业生产中的作用进行简要概述。
1 海藻提取物概况
海藻是海洋中的低等隐花植物,海洋中大型藻类包括红藻门、绿藻门、轮藻门和褐藻门,微藻则主要包括蓝藻和绿藻。海藻是海洋中重要的生物资源,富含多种天然活性物质。根据欧盟新规定,植物生物刺激剂的定义如下:植物生物刺激剂应是一种肥料产品,其功能是刺激植物的营养过程,其功能独立于产品的养分含量,唯一目的是改善植物或植物根际的养分利用效率、对非生物胁迫的耐受性、质量特征、土壤或根际中受限养分的可用性中的1个或多个特征[5]。作为一种典型的天然有机植物生物刺激剂,海藻提取物因其可促进植物生长以及生态友好等特点,在综合有机农业中得到了广泛应用[6]。从海藻中提取的生化物质种类也比较多,包括糖类化合物(低聚糖等)、抗氧化剂(多糖及其衍生物等)、脂肪酸、卤代化合物、生物碱、萜类和凝集素等[7]。目前报道表明,海藻类提取物可以促进生根,提高作物产量、耐寒、耐旱和耐盐性,改善养分吸收和同化的能力,增强光合作用活性,以及抵抗真菌、细菌和病毒等[8-10]。当前,海洋来源的活性物质在农业生产中表现出了巨大的应用潜力,今后需进一步加大对海洋资源的探索研究,以期在更多领域发挥它们的作用。
2 海藻提取物的提取工艺研究概况
2.1 物理提取法
物理提取法是提取海藻功能物質的一类传统方法,也称为机械破碎法。主要是通过高温高压、低温冷冻等方法来破碎海藻的细胞壁,获取内容物[11]。一直以来都存在成本高、技术复杂等不足。然而随着科学技术的提升,一些绿色现代的物理提取方法也逐渐被广泛应用。例如,超临界流体萃取(SFE)、亚临界水萃取(SWE)、超声辅助提取(UAE)和微波辅助提取(MAE)等。这些方法的主要优点是可以通过调整工艺参数来获得不同的目标化合物[12],其中,超临界流体萃取法是提取富含脂肪酸和类脂(包括类胡萝卜素)提取物的好方法。超声辅助提取主要用于提取多酚类物质,水和乙醇是提取多酚类物质的最佳溶剂。在亚临界水萃取过程中,会发生美拉德反应和焦糖作用形成新的抗氧化剂,它们有助于提取物的抗氧化能力[13]。微波辅助提取法是目前研究最多、最成功的海洋大型藻类生物活性成分的提取方法,所得提取物富含岩藻多糖硫酸酯、木聚糖硫酸酯、鼠李糖硫酸盐等,具有抗氧化等活性[14]。当然,以上几种方法在技术和操作上要求相对比较严苛,且耗能较多。
2.2 化学提取法
化学提取法主要包括有机溶剂提取法、碱提法和酸提法[15]。其原理是将海藻细胞壁溶解或促进内源物质增溶,从而获取海藻功能物质。目前,文献中报道的化学提取法差异较大,原料不同或提取物不同都需要相应地调整工艺参数。Foley等采用酸提法,用0.03 mol/L盐酸在 90 ℃条件下提取 4 h,过滤后,用60%乙醇沉淀,收集沉淀冷冻干燥[16];Anastyuk等也采用了酸提法来提取岩藻多糖,先在40 ℃条件下用乙醇对海藻进行3 h的预处理,以去除低分子化合物;然后将藻类在空气和真空中干燥,研磨至粒径为1 mm,用pH值为2.0~23的HCl在60 ℃条件下提取3 h,提取2次;将提取液混合,浓缩至1/5体积,用3% NaHCO3溶液中和,直到pH值为5.7~6.1,用10倍体积的蒸馏水进行透析,最后冻干,得到的岩藻多糖高达40%[17]。Mazumder等采用碱提法,先将干海藻置于0.2%甲醛溶液中浸泡24 h,用0.2 mol/L的HCl将不溶性海藻盐转化成海藻酸,再选用3%碳酸钠以及93%乙醇溶剂在86 ℃条件下提取多酚,最佳提取率为13.57%[18]。化学提取法操作简单、快速、反应较彻底,但是与物理提取法以及生物提取法相比,在提取物分子量、提取物产率及其结构性质中并无较大优势,同时,强酸强碱对某些海藻细胞内活性成分可能具有一定的破坏性,导致其活性降低[19]。
2.3 生物提取法
生物提取法包括酶水解提取和微生物发酵。近年来,酶解法已被广泛应用于陆生植物中生物活性化合物的提取。它具有加工时间短、污染小、提取率高、产品质量好、成本低、目标化合物分解少等优点,是一种很有吸引力的方法。纤维素酶是由 β-葡聚糖酶、内切-β-葡聚糖酶和β-葡聚糖酶等组成的复合产物,该酶通过水解木糖基丝氨酸键,从核心肽中裂解完整的糖胺聚糖,而不裂解纤维二糖或对硝基苯基-β-D-葡萄糖苷。酶解可破坏细胞壁,加速目标化合物从物质向周围的迁移速度,增加接触面积,提高多糖的提取效率[20],与传统提取方法相比,提取能量少,提取率高;微生物发酵是指筛选合适的微生物菌株对海藻进行发酵,发酵过程中微生物产生的酶可以将海藻中的大分子物质降解成所需要的小分子物质,如寡糖等。王明鹏以褐藻酸唯一碳源平板,革兰氏碘液作为产酶指示剂从3种海藻样品表面筛选得到12株产褐藻酸裂解酶的菌株,分别属于类芽孢杆菌属(Paenibacillus)、芽孢杆菌属(Bacillus)、勒克氏菌属(Leclercia)、游动微菌属(Planomicrobium)、白蚁菌属(Isoptericola)、假单胞菌属(Pseudomonas)、赖氨酸芽孢菌属(Lysinibacillus)和鞘氨醇单胞菌属(Sphingomonas),同时,采取优化后的菌株发酵条件,在以铜藻提取液为唯一发酵底物的培养条件下,成功获得聚合度为2~4 的褐藻寡糖[21]。
2.4 復合提取法
复合提取法常见于海藻加工生产,一般是将物理提取法、化学提取法、生物提取法三者中的1种、2种或3种结合使用,从而达到高效提取的目的。李晓等通过复合酶解法来制备海藻酸钠,按照一定比例加入纤维素酶、果胶酶和木瓜蛋白酶的复合酶,调节pH值至5.0,于55 ℃条件下酶解2 h,之后通过消化脱色后,加入10%氯化钙溶液,静置0.5 h后过滤收集沉淀;沉淀中加入盐酸酸化2次,最终形成海藻酸;最后加入碳酸钠中和,形成海藻酸钠;脱水,收集沉淀物;在此基础上,通过优化不同酶的添加量、酶解时间、酶解温度以及pH值,找到最优酶解工艺,海藻酸钠的最高得率达16.8%[22]。张美霞等将超声波辅助提取与复合酶法提取2种独立的方法进行协同作用,首先优化其复合酶的最佳配比:果胶酶1.0%,纤维素酶1.5%,中性蛋白酶10%;然后通过响应曲面法优化提取芦荟凝胶多糖的最佳工艺参数:超声温度为51 ℃,超声时间为 52 min,pH值为4.2;在此条件下芦荟多糖提取率平均值为 8.7%[23]。复合提取法可以提高提取效率,互补劣势,只要获得成熟高效的工艺技术,就能够得到广泛应用。
3 海藻提取物的农业应用研究现状
3.1 海藻提取物对植物种子萌发及根系发育的影响
海藻是海洋中的初级生产者,所含的活性物质丰富,是天然的植物营养调理剂。近年来,化学肥料的减少使用促使海藻提取物广泛应用于农业。根系是植物生长发育的基础,健壮的根系是正常的光合、吸收以及产量形成的保证。研究表明,海藻提取物富含多糖、矿物质、植物激素和微量元素等,对植物种子萌发、根系生长发育有着显著的促进作用[24]。刘培京等研究发现,不同稀释浓度的海藻提取物分别对多种蔬菜的生长量有显著促进作用,主要表现在幼苗根长、叶绿素含量、株高、株鲜质量、株干质量等[25]。金军民等研究发现,适宜浓度的海藻糖能够促进生菜根系的生长,通过增加生菜根系干物质量、表面积、体积、根尖数等提高根系的生长速度,同时,根尖生长素和细胞分裂素等生长类激素含量也相应地增加[26]。在植物生长过程中,海藻提取物还可以通过减少机械损伤的危害,增强植物根对营养物质的吸收能力来促进根的生长和发育,进而改善植物健康,增强活力[27]。Julia等得到一种巨囊藻萃取物,通过灌根对生菜幼苗进行处理,结果发现使用海藻提取物的处理组,幼苗在7 d之内显著促进了根系的生长,作者推断这可能与巨囊藻萃取物中检测到的较高浓度的赤霉酸(CA3)和 6-苄氨基嘌呤(6-BA)等以及其他大量营养物质有关[28]。总体而言,海藻提取物富含多种营养物质,在植物的根生长刺激、提高种子发芽率等方面都有着较为优异的促进和改善作用。
3.2 海藻提取物对作物品质和产量的影响
海藻提取物能够改善植物对营养的吸收能力,因此对植物的品质提升也有促进作用。研究表明,将海藻提取物施用在玉米上,提取物能够显著促进玉米对氮素的营养吸收[29],玉米的N、P、K吸收利用率都明显提高,从而改善了玉米品质[30]。同样,在油菜上浇灌海藻提取物时也发现可以促进油菜对钙、锌等微量元素的吸收,从而提高了油菜的营养价值[31]。最新一项研究表明,海藻提取物在05%的浓度下,可显著提高4个品种洋葱的产量、养分含量和总可溶性固体含量,3%浓度下则可以明显提高抗坏血酸含量[32]。Vasantharaja等发现从褐藻、红藻中得到的提取物可以显著提高豇豆的植物化学成分含量和抗氧化活性,改善豇豆的营养品质[33]。Sami等分别采用叶面喷施及种子浸泡的方式用海藻提取物处理胡萝卜,发现胡萝卜的产量显著提高,营养品质得到改善[34]。以海藻为原料,将海藻提取物作为植物生长剂使用已有较长的历史。研究发现,不同浓度的海藻提取物对番茄的幼苗萌发参数以及番茄生长参数都有显著提升作用,且土壤灌溉比叶面喷施效果更佳[35];Supraja等研究证明用微藻提取物叶面喷施在生长前期的番茄上可以使番茄的根长、株高、干质量等显著增加,品质也得到显著提升[36]。目前的研究表明,喷洒过海藻提取物的作物增产效果最高可达50%[37];在果树上喷施海藻提取物还能促进果实膨大,提高水果的产量、维生素C含量等;褚德朋等的研究表明,在烟草整个生长期中施用海藻提取物能显著促进团棵期和旺长期的烟株生长发育,提高烟叶烤后质量等[38];此外,褐藻寡糖还可以显著提高小麦的株高、叶片叶绿素含量、旗叶的净光合速率、气孔导度以及蒸腾速率等,对小麦产量增加有极为显著的促进作用[39]。多人研究表明,海藻提取物在洋葱[40]、黄瓜[41]、辣椒[25]、樱桃[42]等多种重要作物上均表现出显著的增产作用。由于海藻提取物富含的微量元素可以显著提高总叶绿素含量,促进光合作用,达到增产的效果[43],因此,近年来海藻提取物被越来越广泛地应用于农业。
3.3 海藻提取物防治植物病害研究进展
近年来,海藻提取物应用逐渐扩大丰富,在农业领域不断有新的发现。很多研究表明,海藻提取物在植物病害防治方面也有着巨大潜力[44-45]。海藻提取物因其营养成分丰富多样,其中的抗菌活性物质可以对部分病原菌有良好抑制作用。此外,海藻提取物可作为植物诱导剂,激发植物系统抗性来达到防控植物病害的目的。因此海藻提取物在农业病害防治方面亦有着广泛的应用前景。最近发现,海藻提取物在防治植物病毒病害中有明显的作用。例如,陈芊伊等发现海藻酸能够显著钝化烟草花叶病毒(TMV)并抑制其复制增殖,同时通过提高烟叶中的超氧化物酶(SOD)以及过氧化物酶(POD)等活性来提高烟叶抗氧化能力和抗病能力,从而抵御病毒侵染[46]。Farag等研究发现,海藻提取物在温室和田间条件下,均能够表现出抑制青枯病害的作用,同时,根际和土壤中的微生物多样性也有明显增加,且室内和大田试验显示,二者均增加了植物氮含量[47]。Gunupuru等研究发现,褐藻提取物可以降低由禾谷镰刀菌(Fusarium graminearum)引起的小麦枯萎病的发病程度,显著减少分生孢子数量和坏死面积[48]。此外,最新几项研究也表明,海藻提取物可以通过激活植物体内多个防御相关机制,来防治拟南芥上的疫霉菌[49]、草莓的白粉病[50]和由富氧镰刀菌引起的大豆枯萎病[51]等。这为海藻提取物可以在一定程度上抑制植物病害,同时可能兼具改善根际土壤环境、促进植物生长、提高品质等功效提供有力的理论借鉴。目前,针对植物病害的防治,海藻提取物也发挥着越来越大的作用,多种不同海藻提取物分别在体外抑菌活性和诱导植物系统抗性上有多项研究发现。
3.3.1 海藻提取物对病原菌的体外抑菌活性 越来越多的研究揭示了海藻活性物质的体外抗菌潜力。比如,Esserti等发现3种褐藻提取物都能够显著降低大丽叶枯病菌(Verticillium dahliae)和根癌农杆菌(Agrobacterium tumefaciens)在番茄上的发病程度,其中,海藻甲醇提取物表现出了明显的体外抑菌效果[52]。Indira等还发现了金枪鱼绿藻提取物对黑曲霉、黄曲霉、交链孢霉、青霉和根霉等真菌的抑菌活性[53]。Ara等发现细穗尖舌草提取物中含有脂肪酸酯的组分,该组分对土传病原菌菜豆丝核菌(Macrophomina phaseolina)、立枯丝核菌(Rhizoctonia solani)和茄病镰刀菌(Fusarium solani)的生長有较明显的抑制作用[54]。Paulert等发现,石斛和浒苔等绿藻中的提取物不仅具有能够抑制大豆炭疽病的抑菌活性,同时还能够明显促进大豆的生长[55]。
3.3.2 海藻提取物诱导植物系统抗性防御病害 海藻提取物对于植物的保护作用更多的表现在诱导植物产生系统抗性。植物通过感知外界的病原菌或其他来源的特定诱导因子或激发子来激发植物自身的防御系统,这被称为病原相关分子模式(PAMPS)。这些诱导因子通过与植物细胞质膜上的特定受体相结合,诱发植物自身防御反应,从而能够抵御病虫害或拮抗病原菌。近年来,海藻中的低聚物和多糖激发子等大分子的研究受到了更多的关注。海藻中能够合成陆地植物中没有的多糖,例如海藻酸盐、卡拉胶和岩藻胶等,这些聚合物可以作为激发子激活水杨酸(SA)、茉莉酸(JA)和乙烯等激素胁迫信号通路,并增强对病虫害等生物胁迫的抵抗力。有文献初步研究表明,卡拉胶能够诱导增强烟草的防御反应,同时还能够刺激生长,增加叶片数等[56]。近年来,不断有研究证明,多数海藻多糖都可以作为诱导因子来诱导植物防御[57]。此外,海藻提取物中的海藻低聚糖也可以作为诱导因子在植物系统中激活SA、JA等信号通路,进而介导编码某些蛋白的基因表达增加,如具有抗真菌和抗细菌活性的病程相关蛋白、防御酶系,以及参与合成具有抗微生物活性的萜类或生物碱的酶[58]。因此可以认为,海藻提取物在防治植物病害方面也可以进行进一步探讨研究。
3.4 海藻提取物对植物抗逆的影响
海藻提取物还可以作为一种生物刺激素,提高植物对养分的吸收能力,以此来增强抵御水、盐和温度等非生物胁迫以及生物胁迫带来的不利影响[59]。海藻提取物中含有大量氨基酸、酚类物质、植物激素、以及SOD、过氧化氢酶(CAT)等,具有清除活性氧物种(ROS)、螯合金属离子、稳定细胞膜和蛋白质的能力,可以增强植物的抗逆性。研究表明,通过使用海藻提取物可以使得蔬菜增加含水量,同时增强对干旱的耐受力,增强积累大量营养元素的能力[60],从而提高植物抗逆性[61-62]。施用海藻提取物,还能够在气候环境恶劣的情况下增加樱桃果实硬度,果实横径、纵径等,使作物对冻害、多雨等胁迫的耐受力增强,从而提高果实品质[63]。也有研究表明,海藻酸钠寡糖提取物可以提高猕猴桃的维生素C含量等,从而延长猕猴桃的贮藏期,提高贮藏品质[64-65]。在盐胁迫下,喷施海藻提取物能够使黄瓜的根冠比和干物质含量显著提高,同时增加和活跃根系吸收面积。在预防冻害、干旱等非生物胁迫和病虫害等生物胁迫方面,海藻提取物中富含的微量元素、大量元素及植物激素等也可以通过调节植物新陈代谢来达到增强抗逆的目的[66]。此外,海藻提取物还能够促进幼苗生长、提高生长指标、增加蛋白质含量、降低游离氨基酸含量、促进脯氨酸的积累等,这些也是提高植物的抗逆性以及在胁迫条件下的耐受和恢复能力的表现方式[67]。
3.5 海藻提取物对土壤生态的影响
3.5.1 海藻提取物对土壤微生物的影响 海藻提取物在土壤修复方面的巨大潜力,表现在它可以促进多种土壤微生物生长,通过促进土壤有益微生物的生长来改善土壤微生物菌群丰度变化[68],从而影响土壤生物活性和理化性质,最终不仅可以影响植物生长,还可以通过抑制根际病原菌数量来减少植物病害的发生。此外,研究进一步发现,海藻提取物能够在一定程度上促进根际促生菌(plant growth-promoting rhizobacteria,PGPR)的生长,进而影响植物的生长发育,同时PGPR与海藻提取物这2种生物刺激剂在促生和生防机制上有相同之处,二者同时应用会表现出协同作用[69],从而在植物上表现出更为显著的促生和生物防治作用。
3.5.2 海藻提取物对土壤结构的影响 研究表明,海藻提取物可以通过影响土壤的物理化学性质和生物特性,进而影响植物的生长发育。海藻通常含有丰富的氮养分以及多种独特的物质,如有机成分、植物激素和海藻酸等,这些成分在土壤中可以發挥螯合剂的作用,对改善土壤性质和增强土壤保水能力非常有益,例如海藻酸螯合后可以形成具有凝胶特性的海藻酸盐[70],它可以促进土壤团粒结构以及土壤腐殖质的形成,稳定土壤胶体特征,提高土壤通气性,从而达到修复土壤的目的。而土壤理化结构的改善,又可以提高土壤肥力和土壤保水能力,促进土壤的空气交换,来刺激植物根系的生长,同时反过来提高土壤微生物的活性,间接地影响土壤微生物数量及群落结构[11]。因此,在未来农业应用研究中,海藻提取物将会作为土壤调节剂和土壤生物肥料发挥越来越重要的作用。
3.6 海藻农业增效产品的产业化方向及应用
随着绿色农业市场需求逐渐扩大,海藻提取物的产业开发也逐渐被重视起来。据了解,目前全球的海藻植物营养产品开发商有23家,并且已经获得多家国际组织和机构的认可。与其他各国相比,我国在海藻提取物产品产业化起步较晚[71]。北京雷力海洋生物新产业股份有限公司、青岛明月海藻集团公司、中国科学院海洋研究所、中国海洋大学等高校和企业填补了这一行业空白,在海藻提取物的提取加工、作用机制上进行积极探索,目前已获得了很多重要进展。然而,海藻提取物农业增效产品的大量面世,引起了一些行业乱象,各国对此也制定了新的行业标准和规范。未来海藻农业增效产品的产业化方向主要集中在以下几点:第一,分子生物学水平的机制突破和新功效的开发;第二,行业标准的制定和规范;第三,减少环境污染和保障粮食安全;第四,资源的有机整合以及产业联合发展[72]。此外,海藻产品在农业上的应用也将会逐渐细化和完善,比如研究海藻提取物与微生物在农业生产中的协同作用,从海藻中提取杀菌物质开发生物农药以及海藻提取物的抗冻、增色等作用也有望得到开发。
4 结论和展望
目前,海藻提取物广泛应用于农业生产,商品化趋于成熟,且海藻提取物的功效也逐渐得到广泛认同,前景巨大。然而,海藻提取物的发展和应用仍有很大的进步空间。首先,在植物病害防治方面,作为诱导因子或刺激剂激发植物系统抗性的机制研究不深,作用机制尚不清楚。其次,海藻提取工艺也是影响其应用的一大因素,当前市场环境缺乏针对海藻提取物工艺的行业标准,海藻产品质量参差不齐,极大地影响了海藻提取物进一步推广使用。第三,海藻提取物真正用于实际生产案例的较少,具体的田间应用推广还存在不少问题。因此,以上的不足仍然需要广大科研工作者继续探索,总结规律积累经验。在未来发展过程中,探索研究海藻提取物在植物保护领域的作用功效将会得到更多的关注,此外,建立高效生产海藻提取物的相关工艺并形成产品规范化、标准化也将会是本行业一大研究热点。综上所述,海藻提取物因其促进植物生长、提高作物产量及品质、防治植物病害、抵抗不良环境以及改善土壤环境等优势,将会在绿色现代化农业中成为重要的资源保障。
参考文献:
[1]关星叶,李红权,肖 勤. 海洋天然活性物质的药用研究进展[J]. 承德医学院学报,2017,34(4):332-336.
[2]黄利华,贾 强,欧爱芬. 海洋生物活性物质主要功能特性的研究现状[J]. 现代食品,2020(1):25-28.
[3]黄建设,龙丽娟,张偲偲. 海洋天然产物及其生理活性的研究进展[J]. 海洋通报,2001,20(4):83-91.
[4]许实波. 我国南海海洋天然产物生理活性的研究进展[J]. 中山大学学报论丛,1994(6):38-47.
[5]杨田甜,申继忠. 欧盟各国植物生物刺激剂立法概述[J]. 世界农药,2016,38(5):36-42.
[6]李鹏程. 海洋生物资源高值利用研究进展[J]. 海洋与湖沼,2020,51(4):750-758.
[7]Yakhin O I,Lubyanov A A,Yakhin I A,et al. Biostimulants in plant science:a global perspective[J]. Frontiers in Plant Science,2016,7(1):2049.
[8]Sharma H S,Fleming C,Selby C,et al. Plant biostimulants:a review on the processing of macroalgae and use of extracts for crop management to reduce abiotic and biotic stresses[J]. Journal of Applied Phycology,2014,26(1):465-490.
[9]Mukherjee A,Patel J S. Seaweed extract:biostimulator of plant defense and plant productivity[J]. International Journal of Environmental Science and Technology,2020,17(1):553-558.
[10]张守栋,韩晓弟,张同作,等. 褐藻胶寡糖对大豆种子萌发及幼苗生理的影响[J]. 西北农业学报,2015,24(11):95-100.
[11]耿银银,尹媛红,沈 宏. 海藻功能物质的提取工艺、理化性质以及在农业领域中的应用[J]. 生态学杂志,2017,36(10):2951-2960.
[12]Alboofetileh M,Rezaei M,Tabarsa M,et al. Effect of different non-conventional extraction methods on the antibacterial and antiviral activity of fucoidans extracted from Nizamuddinia zanardinii[J]. International Journal of Biological Macromolecules,2019,124(2):131-137.
[13]Ciko A M,Jokic' S,ubaric' D,et al. Overview on the application of modern methods for the extraction of bioactive compounds from marine macroalgae[J]. Marine Drugs,2018,16(10):348.
[14]Garcia-Vaquero M,Ummat V,Tiwari B,et al. Exploring ultrasound,microwave and ultrasound-microwave assisted extraction technologies to increase the extraction of bioactive compounds and antioxidants from brown macroalgae[J]. Marine Drugs,2020,18(3):172.
[15]Garcia-Vaquero M,Rajauria G,Odoherty J V,et al. Polysaccharides from macroalgae:Recent advances,innovative technologies and challenges in extraction and purification[J]. Food Research International,2017,99(3):1011-1020.
[16]Foley S A,Szegezdi E,Mulloy B,et al. An unfractionated fucoidan from Ascophyllum nodosum:extraction,characterization,and apoptotic effects in vitro[J]. Journal of Natural Products,2011,74(9):1851-1861.
[17]Anastyuk S D,Shevchenko N M,Nazarenko E L,et al. Structural analysis of a highly sulfated fucan from the brown alga Laminaria cichorioides by tandem MALDI and ESI mass spectrometry[J]. Carbohydrate Research,2010,345(15):2206-2212.
[18]Mazumder A,Holdt S L,de Francisci D,et al. Extraction of alginate from Sargassum muticum:process optimization and study of its functional activities[J]. Journal of Applied Phycology,2016,28(6):3625-3634.
[19]Okolie C L,Mason B,Mohan A,et al. The comparative influence of novel extraction technologies on in vitro prebiotic-inducing chemical properties of fucoidan extracts from Ascophyllum nodosum[J]. Food Hydrocolloids,2019,90(5):462-471.
[20]Li S N,Han D D,Row K H. Optimization of enzymatic extraction of polysaccharides from some marine algae by response surface methodology[J]. Korean Journal of Chemical Engineering,2012,29(5):650-656.
[21]王明鵬. 基于褐藻酸降解的铜藻发酵提取技术及其产物农用功效研究[D]. 哈尔滨:哈尔滨工业大学,2017:58-59.
[22]李 晓,高 超,王 颖,等. 复合酶法提取海黍子中海藻酸钠的工艺研究[J]. 中国农业科技导报,2019,21(2):98-103.
[23]张美霞,游玉明,郭 瑶. 超声波协同复合酶法提取芦荟凝胶多糖工艺优化[J]. 食品研究与开发,2019,40(18):133-140.
[24]孙兆法,宋朝玉,张淑霞. 海藻提取物对春大白菜产量的影响[J]. 山东农业科学,2009(5):77-78.
[25]刘培京,王 飞,张树清. 海藻生物有机液肥对蔬菜种子萌发和幼苗生长的影响[J]. 安徽农业科学,2013,41(34):13210-13213.
[26]金军民,彭尔涛,周红卫,等. 外源海藻糖对生菜根系生长的影响[J]. 农业工程,2020,10(2):98-101.
[27]王 杰. 海藻提取物在农业生产中的应用研究[J]. 世界农药,2011,33(2):21-26.
[28]Julia I,Oscar M,Analía L,et al. Biofertilization with Macrocystis pyrifera algae extracts combined with PGPR-enhanced growth in Lactuca sativa seedlings[J]. Journal of Applied Phycology,2020,32(6):4361-4371.
[29]陈迪文,周文灵,敖俊华,等. 海藻提取物对甜玉米产量、品质及氮素利用的影响[J]. 作物杂志,2020(2):134-139.
[30]张朝霞,许加超,盛 泰,等. 海藻寡糖增效肥料(NPK)对玉米生长的影响[J]. 农产品加工(学刊),2013(11):63-66.
[31]周红梅,解素芳,王乃建,等. 海藻提取物对小油菜营养元素的影响[J]. 科技咨询导报,2007(21):249.
[32]Abbas M,Anwar J,Zafar-Ul-Hye M,et al. Effect of seaweed extract on productivity and quality attributes of four onion cultivars[J]. Horticulturae,2020,6(2):28.
[33]Vasantharaja R,Abraham L S,Inbakandan D,et al. Influence of seaweed extracts on growth,phytochemical contents and antioxidant capacity of cowpea (Vigna unguiculata L. Walp) [J]. Biocatalysis and Agricultural Biotechnology,2019,17:589-594.
[34]Sami H M,Dina M S,Ahmed M E,et al. Utilization of seaweed (Sargassum vulgare) extract to enhance growth,yield and nutritional quality of red radish plants[J]. Annals of Agricultural Sciences,2019,64(2):167-175.
[35]Hernández-Herrera R M,Santacruz-Ruvalcaba F,Ruiz-López M A,et al. Effect of liquid seaweed extracts on growth of tomato seedlings (Solanum lycopersicum L.)[J]. Journal of Applied Phycology,2014,26(1):619-628.
[36]Supraja K V,Bunushree B,Balasubramanian P. Efficacy of microalgal extracts as biostimulants through seed treatment and foliar spray for tomato cultivation [J]. Industrial Crops & Products,2020,151(1):112453.
[37]韩丽君,范 晓,房国明. 海藻提取物对蔬菜种子萌芽的影响[J]. 海洋科学,2000,24(11):8-10.
[38]褚德朋,许永幸,高 强,等. 海藻多糖与有机物料对烟草青枯病的防控效果[J]. 中国烟草科学,2020,41(4):58-65.
[39]张运红,和爱玲,杨占平,等. 海藻酸钠寡糖灌根处理对小麦光合特性、干物质积累和产量的影响[J]. 江西农业学报,2018,30(11):1-5.
[40]Lola-Luz T,Hennequart F,Gaffney M. Effect on health promoting phytochemicals following seaweed application,in potato and onion crops grown under a low input agricultural system [J]. Scientia Horticulturae,2014,170:224-227.
[41]李佳琪,湯 洁,李明月,等. 不同分子量的褐藻寡糖对黄瓜幼苗光合作用及生长的影响[J]. 中国农业大学学报,2018,23(9):53-59.
[42]崔维香,林 梅,秦 松,等. 海藻发酵液在樱桃番茄上的施用效果及分析[J]. 分子植物育种,2018,16(13):4387-4394.
[43]赵占周. 海藻以及海藻提取物在农业上的应用建议[J]. 营销界:农资与市场,2018(7):75-77.
[44]郭晓冬,孙 锦,韩丽君,等. 海藻提取物防治番茄CMV病毒效果及其机理研究[J]. 沈阳农业大学学报,2006,37(3):313-316.
[45]张一宾. 非杀菌农药对植物病害的防治机理——包括植物激活剂[J]. 世界农药,2003,25(2):19-23.
[46]陈芊伊,郭 尧,石永春. 海藻酸对烟草花叶病毒的抑制作用研究[J]. 中国农学通报,2016,32(31):123-127.
[47]Farag S A,Elhalag K A,Hagag M H,et al. Potato bacterial wilt suppression and plant health improvement after application of different antioxidants[J]. Journal of Phytopathology,2017,165(7/8):1-16.
[48]Gunupuru L R,Patel J S,Sumarah M W,et al. A plant biostimulant made from the marine brown algae Ascophyllum nodosum and chitosan reduce Fusarium head blight and mycotoxin contamination in wheat[J]. PLoS One,2019,14(9):e0220562.
[49]Islam M T,Gan H M,Ziemann M,et al. Phaeophyceaean (brown algal)extracts activate plant defense systems in Arabidopsis thaliana challenged with Phytophthora cinnamomi[J]. Frontiers in Plant Science,2020,11:852.
[50]Bajpai S,Shukla P S,Asiedu S,et al. A biostimulant preparation of brown seaweed Ascophyllum nodosum suppresses powdery mildew of strawberry[J]. The Plant Pathology Journal,2019,35(5):406-416.
[51]Borba M C,Freitas M B,Stadnik M J. Ulvan enhances seedling emergence and reduces Fusarium wilt severity in common bean (Phaseolus vulgaris L.) [J]. Crop Protection,2019,118:66-71.
[52]Esserti S,Smaili A,Rifai L A,et al. Protective effect of three brown seaweed extracts against fungal and bacterial diseases of tomato[J]. Journal of Applied Phycology,2017,29(2):1081-1093.
[53]Indira K,Balakrishnan S,Srinivasan M,et al. Evaluation of in vitro antimicrobial property of seaweed (Halimeda tuna) from Tuticorin coast,Tamil Nadu,Southeast coast of India[J]. African Journal of Biotechnology,2013,12(3):284-289.
[54]Ara J,Sultana V,Qasim R,et al. Biological activity of Spatoglossum asperum:a brown alga[J]. Phytotherapy Research,2005,19(7):618-623.
[55]Paulert R,Talamini V,Cassolato J,et al. Effects of sulfated polysaccharide and alcoholic extracts from green seaweed Ulva fasciata on anthracnose severity and growth of common bean (Phaseolus vulgaris L.)[J]. Journal of Plant Diseases and Protection,2009,116(6):263-270.
[56]Xu S Y,Huang X,Cheong K L. Recent advances in marine algae polysaccharides:isolation,structure,and activities[J]. Marine Drugs,2017,15(12):388.
[57]Mercier L,Lafitte C,Borderies G,et al. The algal polysaccharide carrageenans can act as an elicitor of plant defence[J]. The New Phytologist,2001,149(1):43-51.
[58]Vera J,Castro J,Gonzalez A,et al. Seaweed polysaccharides and derived oligosaccharides stimulate defense responses and protection against pathogens in plants[J]. Marine Drugs,2011,9(12):2514-2525.
[59]Beckett R,Staden J. The effect of seaweed concentrate on the yield of nutrient stressed wheat[J]. Botanica Marina,1990,33(2):147-152.
[60]Mancuso S,Azzarello E,Mugnai S,et al. Marine bioactive substances (IPA Extract)improve foliar ion uptake and water tolerance in potted Vitis vinifera plants [J]. Advances in Horticultural Science,2006,20:156-161.
[61]Guzmán-Murillo M A,Ascencio F,Larrinaga-Mayoral J A. Germination and ROS detoxification in bell pepper (Capsicum annuum L.) under NaCl stress and treatment with microalgae extracts [J]. Protoplasma,2013,250(1):33-42.
[62]Rathore S,Chaudhary D,Boricha G,et al. Effect of seaweed extract on the growth,yield and nutrient uptake of soybean (Glycine max) under rainfed conditions[J]. South African Journal of Botany,2009,75(2):351-355.
[63]尹皓嬋. 海藻提取物对3种经济作物的生长和抗逆性的影响[D]. 舟山:浙江海洋大学,2019:6-7.
[64]刘同梅,王文霞,胡建恩,等. 海藻酸钠寡糖采前处理对猕猴桃贮藏品质的影响[J]. 辽宁农业科学,2017(6):6-10.
[65]Liu J,Kennedy J F,Zhang X,et al. Preparation of alginate oligosaccharide and its effects on decay control and quality maintenance of harvested kiwifruit[J]. Carbohydrate Polymers,2020,242:116462.
[66]谢尚强,王文霞,张付云,等. 植物生物刺激素研究进展[J]. 中国生物防治学报,2019,35(3):487-496.
[67]王 强,赵小明,官彩红,等. 海藻液肥对黄瓜抗水分胁迫能力的影响[J]. 浙江农业学报,2005,17(5):314-318.
[68]Kousaku K,Leonard S W,Masaru U,et al. Effect of red and green algal extracts on hyphal growth of arbuscular nycorrhizal fungi,and on mycorrhizal development and growth of papaya and passionfruit[J]. Agronomy Journal,2006,98(5):1340-1344.
[69]Trae C. Evaluation of synergy between PGPR and seaweed extracts for growth promotion and biocontrol of Rhizoctonia solani on soybean [D]. Auburn:Auburn University,2018.
[70]María C E,Cesar M R,Guillermo E D. Biological evaluation of seaweed composting[J]. Compost Science & Utilization,1998,6(4):74-81.
[71]李 丹,朱璐璐,钱 爽,等. 海藻的开发现状和应用前景[J]. 广州化工,2016,44(21):13-16,25.
[72]汤 洁. 海藻植物营养剂的开发利用现状和前景[J]. 中国农技推广,2011,27(6):41-43.

