蛋鸡J亚型禽白血病病毒与大肠杆菌共感染的诊断
张世成,严天行,袁世玉,成子强
(山东农业大学动物医学院,山东 泰安 271018)
禽白血病(Avianleukosis, AL)是由禽白血病病(Avian Leukosis Virus, ALV)引起的禽多种肿瘤性疾病的统称[1]。根据囊膜糖蛋白的不同,ALV可以分为A-K等11个亚群,其中A、B、J亚群是最常分离到的病毒[2]。AL可以通过水平和垂直方式传播,可以诱导鸡的淋巴细胞瘤、髓样细胞瘤、血管内皮细胞瘤以及其他形式的肿瘤[3]。尽管许多种禽公司实施了多年的检疫和净化,但ALV仍在商品代鸡呈亚临床感染状态存在,不仅影响鸡群的生产性能,而且导致免疫抑制,易继发其他致病原的共感染。J亚群禽白血病病毒(Subgroup J Avian Leukosis Virus, ALV-J)是20世纪80年代从肉用型鸡中分离鉴定的新亚群,主要引起肉用型鸡的髓细胞瘤[2]。20世纪90年代,ALV-J在全球范围内广泛传播,并对全球家禽业造成巨大的损失[3]。杜岩[4]等首次从我国大型肉用型种鸡场分离鉴定出ALV-J,2004年中国首次报道蛋鸡自然感染ALV-J[5]。近年来,禽病的发生和流行特点往往表现为多病原性,常见表 现为病毒病和细菌病的共感染[6]。大肠杆菌病是部分或全部由禽致病性大肠杆菌(Avian Pathogenic E. Coli,APEC)所引起的局部或全身性感染的疾病,给养禽业造成了严重的经济损失[7]。
内蒙古某养殖合作社送检一批海兰褐蛋鸡,该养殖合作社为全自动现代化笼养,养殖规模30万只。发病鸡产蛋高峰期产蛋率下降至20 %,死亡率30 %,出现精神沉郁,虚弱,缩颈嗜睡,消瘦,排白色稀状粪便,鸡冠发白。为了明确病因,本研究对该批病鸡采用大体剖检、血象学、细菌学、病理组织学、分子生物学及病原学方法对该场发病鸡进行系统检测与分析,确诊为J亚型禽白血病病毒与大肠杆菌共感染,为揭示两者之间致病的关联性和两者共感染导致的ALV-J致病特征提供了依据和参考。
1 材料与方法
1.1 材料
1.1.1 病料来源与样品采集 内蒙古某父母代种 鸡场送检的海兰褐蛋鸡,分别无菌采取心脏、肝脏、肺脏、肾脏、脾脏、小肠等器官置于1.5 ml离心管中,用手术剪将病变明显的组织固定于10%福尔马林溶液中。
1.1.2 主要试剂与实验器材 2×Accurate Taq预混液购自宝生物(大连)生物科技有限公司;组织DNA提取试剂盒(购于天根生物科技有限公司);组织RNA提取试剂盒(购于天根生物科技有限公司);血琼脂平板购自于江门市凯林贸易有限公司;光学显微镜和数码成像系统购自奥林巴斯公司;石蜡切片机购于德国徕卡公司;电热恒温干燥箱购自江苏吴淞五金厂;PCR仪购自赛默飞世尔公司;电子天平购自上海精天电子仪器有限公司;生物安全柜购自上海博讯医疗器械公司;电泳仪购自上海市六一仪器厂。
1.2 方法
1.2.1 临床观察 将病鸡自然平放在地上,安静自然地观察其精神状态、饮食饮水、运动情况及粪便形态等。
1.2.2 血象学观察 将病鸡固定好,用1 ml注射器从翅下采血,滴一滴于载玻片上,用轻柔的力量迅速均匀推出,形成一薄层,自然晾干,瑞氏姬姆萨染色,显微镜观察。
1.2.3 ELISA-P27病原学检测 采集病鸡泄殖腔棉拭子,按照IDEXX ALV-P27抗原检测试剂盒步骤进行ELISA抗原检测。
1.2.4 大体剖检与病理组织学观察 无菌采取心脏、肝脏、肾脏、胸腺、法氏囊、脾脏和小肠等,并将病健交界处的组织固定于10%福尔马林溶液中,然后经二甲苯透明后进行浸蜡、包埋、冷却、切片,最后将切片进行烘干和HE染色,将染色好的组织切片置于显微镜下进行组织学观察。
1.2.5 细菌分离与鉴定 将接种环置于火焰外焰灼烧,将组织用烙铁烫一区域,切开一小口,无菌取病料划线接种于血琼脂平板培养基上,于37 ℃ 培养箱培养24 h,挑取单个菌落接种到营养肉汤培养基上,摇菌至菌液浑浊,提取菌液DNA,16S rRNA 鉴定引物进行PCR扩增。反应体系25 µl:2×Accurate Taq Mix 12.5 µl,上游引物0.5 µl,下游引物0.5 µl,样品1 µl,ddH2O 10.5 µl。PCR反应条件为:95 ℃ 预变性5 min;95 ℃ 变性30 s,55 ℃ 退火30 s,72 ℃ 延伸120 s,共35个循环;72 ℃ 延伸10 min。将PCR扩增后阳性样品送至华大生物工程有限公司测序,将测序回来的序列结果与NCBI GenBank的参考序列进行BLAST分析验证。
1.2.6 常见病毒的分子生物学检测 采集黄豆状大小的肝脏、脾脏、肾脏等,研磨成细胞悬液后,分别进行DNA和RNA提取,并把RNA逆转录为cDNA,使用HEV、REV、MDV、IBDV、AIV(H9N2)、ALV-A、ALV-B和ALV-J引物进行PCR扩增,以合成的cDNA和DNA为模板进行PCR扩增(引物如表1所示)。PCR反应体系及反应条件同上,PCR产物经1%琼脂糖凝胶电泳检测分析。
2 结果与分析
2.1 临床观察与大体剖检结果
临床观察病鸡精神沉郁,缩颈嗜睡,消瘦,排白色稀状粪便,无法站立,鸡冠发白。剖检观察主要表现为:鸡肝脏肿大破裂;肾脏淡灰色肿胀;输卵管充血,内有大量干酪样渗出物填充整个输卵管;脾脏和卵巢萎缩(图1)。
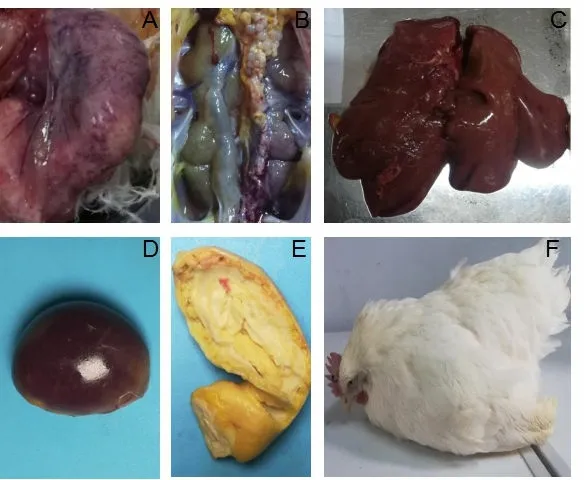
图1 临床和大体剖检观察结果 A.输卵管充血肿胀;B.肾脏呈淡灰色肿胀;C.肝脏肿胀破裂;D.脾脏萎缩; E.输卵管填充的黄色干酪状物质;F.病鸡精神沉郁、缩颈嗜睡
2.2 血象学检查结果
血象学检查可见血液中幼稚红细胞、单核细胞、淋巴细胞、异嗜性粒细胞、粒性髓细胞和成红细胞增多(图2)。

图2 血象学检查结果 A.单核细胞和淋巴细胞增多;B.淋巴细胞增多;C.成红细胞和粒性髓细胞增多;D为异嗜性粒细胞减少; E.淋巴细胞、骨髓成红细胞和异嗜性粒细胞增多;F.成红细胞和成髓细胞增多
2.3 病原学检测
P27 ELISA病原学检测结果显示1-3号病鸡检测为肛拭子ALVp27抗原阳性,4号病鸡检测为肛拭子ALVp27抗原阴性,5号病鸡判定为可疑(表2)。

表2 ELISA病原学检测
2.4 病理组织学观察结果
病理组织学观察病鸡肝细胞颗粒变性、坏死,淋巴细胞和异嗜性粒细胞浸润,血管内和血管外集聚有大量的成髓细胞,肠绒毛上皮细胞脱落以及脾脏淋巴细胞和网状细胞发生流失、透明变性和坏死(图3)。
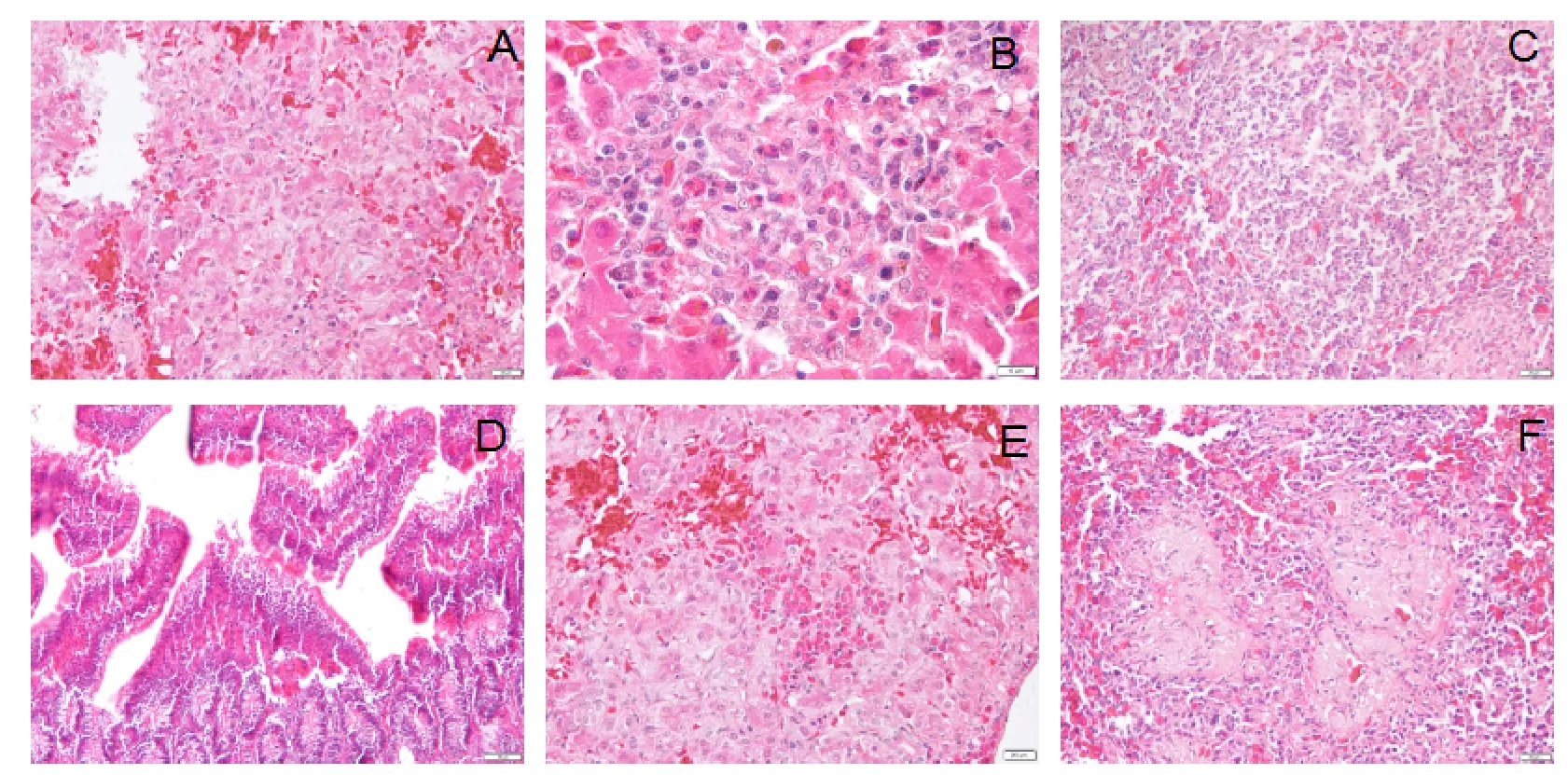
图3 病理组织学观察结果 A.鸡肝细胞颗粒变性、坏死,肝细胞肿胀,肝窦间隙充盈大量红细胞;B.鸡肝脏淋巴细胞浸润变性坏死区; C.鸡脾脏淋巴细胞和网状细胞脾脏大量流失,发生透明变性和坏死;D.鸡小肠肠绒毛上皮细胞脱落明显;E.鸡肝脏局部肝窦空隙充满大量红细胞,肝细胞变性坏死区明显;F.鸡脾脏淋巴细胞和网状细胞透明变性、坏死
2.5 细菌分离鉴定结果
2.5.1 细菌培养结果 细菌分离培养观察到主要为灰白色、圆形、透明、表面光滑、边缘整齐、露珠状的菌落,经鉴定菌株为大肠杆菌(图4)。
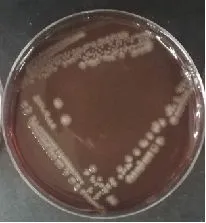
图4 细菌培养结果
2.5.1 细菌序列比对结果 将菌液DNA经细菌16S rRNA 通用引物进行PCR扩增后,将扩增后的产物送华大生物工程公司进行测序,序列回来的结果与NCBI GenBank已发布的参考序列进行BLAST分析,结果显示分离的菌株与大肠杆菌ST95-32株和OW1E2株同源性为100 %,结合临床观察、大体剖检、血象学和病理组织学结果确定大肠杆菌是引起发病的致病菌。
2.6 PCR鉴定结果
根据大体剖检、血象学和病理组织学结果,怀疑是戊肝病毒或禽流感病毒或免疫抑制病毒与细菌病混合感染,因此将HEV、REV、MDV、IBDV、AIV(H9N2)、ALV-A、ALV-B、ALVJ、ALV-E和ALV-K进行PCR或RT-PCR扩增,结果显示病鸡HEV、REV、MDV、IBDV、AIV(H9N2)、ALV-A、ALV-B、ALV-E和ALV-K为阴性,ALV-J呈阳性。将凝胶切下送华大生物工程有限公司进行测序,用DNA Star软件进行序列比对分析,结合病理组织学结果、大体剖检结果、血象结果分析及测序比对结果确诊病鸡为ALV-J感染(图5)。
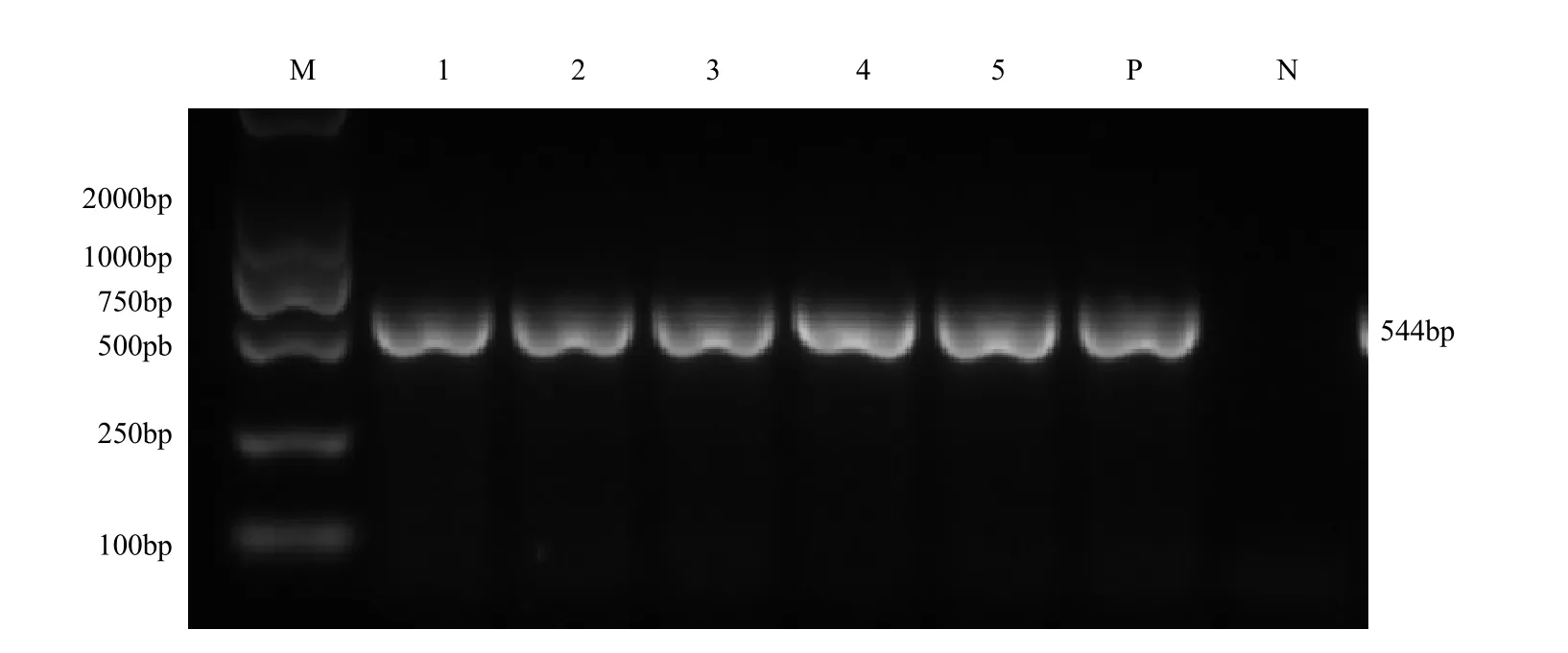
图5 常见病原的PCR检测结果
2.7 ALV-J env发育进化树分析
将 ALV-Jenv扩增序列在 NCBI进行BLAST,应用DNAStar基因分析软件,对测序结果进行核苷酸序列剪切、拼接。应用MEGA分析软件,将扩增拼接后的ALV env保守序列与GenBank中已公开的ALVenv保守序列进行系统发育分析,用Neighbor-joining生成系统发育树,用Bootstrap值来评估进化树的可靠性。结果显示均有5株ALV env保守序列同源性较低,其中两株ALVenv保守序列同源性较高,可能同一毒株在不同个体产生了变异(图6)。
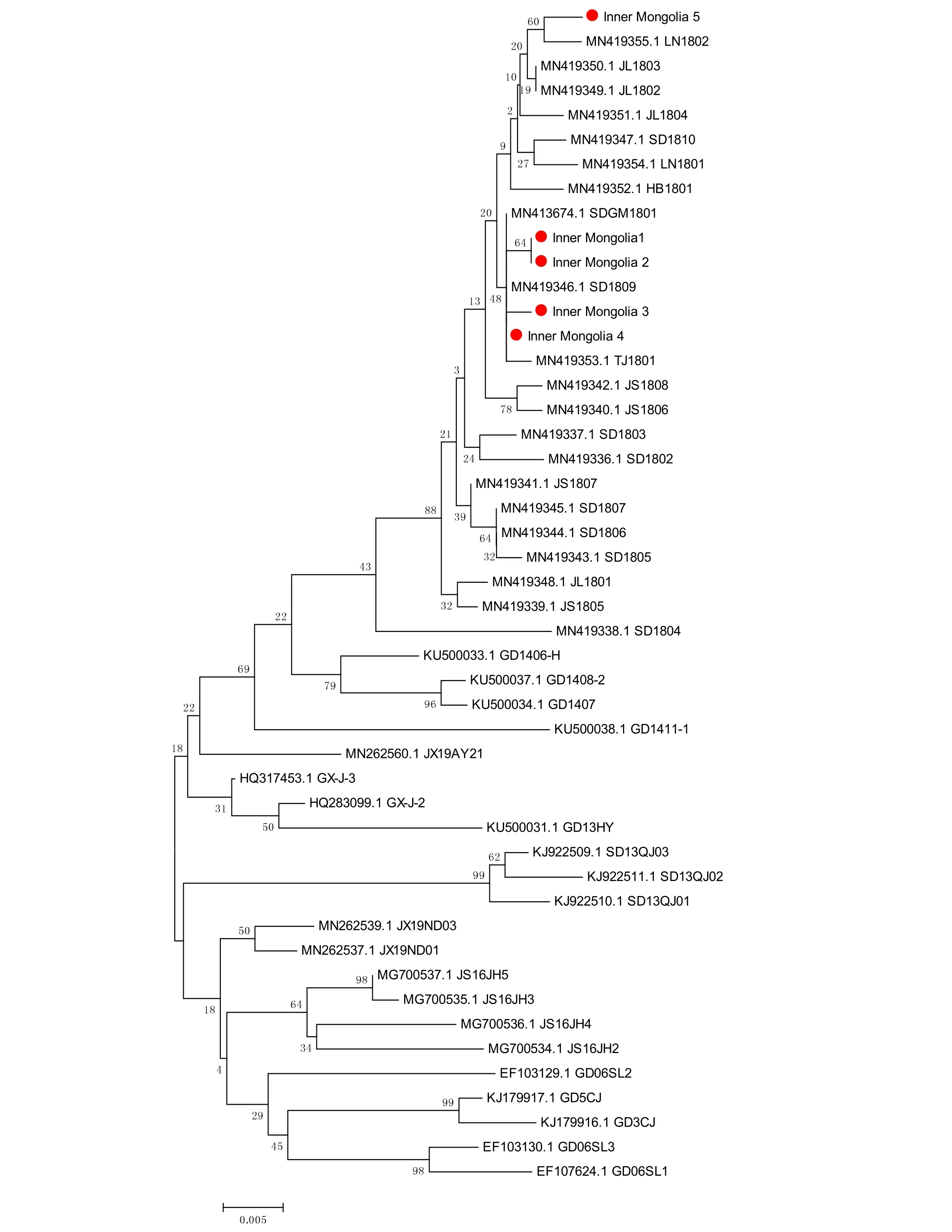
图6 ALV-Jenv系统发育进化树分析
3 讨论
禽白血病是由禽白血病病毒(ALV)引起的一种肿瘤性免疫抑制病,J亚群ALV(ALV-J)不仅可以引起鸡的髓样细胞瘤等原发感染,也可以引起免疫抑制,继发其他病原的共感染。本研究对内蒙古某海兰褐父母代发病蛋鸡进行了系统检测、分析,最终确诊为ALV-J与大肠杆菌的共感染,这为揭示两者之间致病的关联性和两者共感染导致的ALV-J致病特征提供了依据和参考。
本研究从临床发病的蛋鸡分离到5株ALVJ。对发病鸡场调查发现,5株ALV-J来自三个不同鸡舍,同源性较高的毒株来自同一鸡舍,同源性相近的ALV-J株可能是同一毒株在不同个体适应性不同而发生了变异。经调查该发病鸡场养殖模式为全封闭全自动笼养,因此推测病鸡很可能是引种时没有注重检测,使得雏鸡带毒,且在生长过程中处于亚临床感染状态,环境或其他因素使得机体抵抗力降低,从而造成了ALV-J的增殖和广泛传播。
临床和大体剖检结果发现,肝脏和肾脏肿大破裂,输卵管填充大量黄色干酪状物质;血象学观察发现,成红细胞、粒性髓细胞、淋巴细胞和异嗜性粒细胞增多;病理组织学观察发现,肝脏和肾脏有粒性髓细胞的增生,脾脏淋巴细胞发生流失和坏死,表明病鸡存在免疫抑制病毒与细菌的共感染。进一步分析发现,粒性髓细胞的大量增生引起肝脏和肾脏的肿大破裂,ALV-J引起的免疫抑制导致大肠杆菌的致病性增强,而大肠杆菌的原发感染使得机体处于免疫功能低下的状态,从而导致ALV-J由亚临床感染到大量暴发的过程,进一步降低了机体的免疫功能,从而增强了两者的致病性,说明两者之间存在相互增强的关联。验证试验发现,通过将分离到的大肠杆菌液腹腔接种3只1日龄SPF鸡,发现雏鸡精神状态良好,采食饮水正常,仅1只雏鸡排白色稀状粪便,这表明ALV-J与大肠杆菌的共感染增强了大肠杆菌的致病性。
近年来禽病的发生和流行特点往往表现为多种病原混合感染的现象[8-13]。临床生产中需要重视和加强免疫抑制病毒和细菌病的防控。目前未有有效的疫苗预防ALV-J的发生,防控该病的关键是加强对免疫抑制性病毒的检测,不断剔除鸡群中阳性鸡,从而实现种群净化[14]。除了加强对免疫抑制性病毒的检测外,还应加强饲养管理,做好预防雏鸡的早期感染,严格执行消毒制度,避免鸡群发生继发感染,提高鸡群的抵抗力等措施[14-17]。
4 结论
本研究分别从临床观察、大体剖检、血象学、病理组织学、病原学、细菌学和分子生物学等角度对病鸡进行了系统的检测分析,确诊该病鸡群为ALV-J与大肠杆菌混合感染,对于禽大肠杆菌和ALV-J之间是否存在一定的规律和相互增强致病的关联性还需后续进一步研究。

