不同区域的ADC值、rADC值对原发性中枢神经系统淋巴瘤诊断与鉴别及其与Ki⁃67相关性
耿磊 孙毅 赵妍 万金鑫 许磊 叶永盛 汪秀玲 徐凯
1蚌埠医学院附属连云港市第二人民医院(江苏大学附属连云港医院)(连云港市第二人民医院)(连云港市肿瘤医院)医学影像科(江苏连云港222000);2徐州医科大学附属医院医学影像科(江苏徐州221002)
原发性中枢神经系统淋巴瘤(PCNSL)是较为少见的脑内恶性肿瘤[1],通常局限于脑、眼睛、软脑膜和脊髓,其有效的诊断对于术前治疗计划的制定具有决定性参考意义。PCNSL 治疗主要以化疗为主[2-3],而高级别胶质瘤(high⁃grade glioma,HGG)以手术治疗为主,两者的准确鉴别诊断对治疗方案的选择,特别是早期干预性治疗,提高生存率有着重要意义[4]。部分PCNSL 的常规MRI 表现与HGG 存在一定的重叠,常规MRI 从形态学层面并不能完全鉴别两者[4-5],且PCNSL 与HGG 均呈侵袭性生长,瘤周虽有肿瘤细胞浸润,但常规MRI 很难从形态学准确判断肿瘤的浸润范围[6]。磁共振弥散加权成像(DWI)可从分子弥散水平先于形态学反映病变特征,并且其不同区域表观扩散系数(apparent diffusion coefficient,ADC)值可以定量反映肿瘤细胞的密度和恶性程度[7]。以往国内外研究多以PCNSL 与HGG 肿瘤实质区域的ADC 值对比研究为主[8-9],但利用ADC 值对两组肿瘤瘤周水肿区域瘤细胞浸润特征与差异的对比研究未见报道。本研究首次从分子影像学层面探讨了两种肿瘤不同区域的ADC 值、相对表观扩散系数(rADC)值在PCNSL 与HGG 鉴别诊断中的应用价值,首次对近侧及远侧瘤周进行分类,探讨不同区域ADC 值的变化规律,以期为常规MRI 鉴别困难的病例提供补充方案,同时为瘤周肿瘤细胞的微观浸润状态提供分子影像学依据,亦可从分子水平反应PCNSL 的增殖活性。
1 资料与方法
1.1 一般资料收集本院与徐州医科大学附属医院2015年1月至2020年12月期间经临床及病理证实的PCNSL患者30例及HGG患者35例的临床及影像资料。PCNSL 患者均为弥漫大B 细胞淋巴瘤,其中男20 例,女10 例,年龄分布在15~74 岁,平均年龄(59.13±6.25)岁。患者多因头痛、恶心、肢体及语言障碍等临床症状初次就诊。所有患者免疫功能均正常,经骨髓细胞学及影像学检查除外系统性淋巴瘤。HGG 患者中,男23 例,女12 例,年龄16~73 岁,平均年龄(50.6±11.3)岁。
1.2 方法
1.2.1 MRI 检查方法采用GESignal3.0T 磁共振扫描仪,平扫参数:SE 序列T1WI(TR 200 ms,TE 15 ms),T2WI(TR 4 300 ms,TE 120 ms),SE⁃EPI 序列DWI(TR 4 500 ms,TE 100 ms),层厚5 mm,间隔1.5 mm。视野FOV:240×240,矩阵:256×256。经肘静脉注入0.20 mmol/kg 的对比剂Gd⁃DTPA 行增强扫描。由两名经验丰富的影像科医师观察分析肿瘤的分布、实质及内部信号、占位及瘤周水肿程度(参照罗国栋等[10]研究结果)、强化方式及形态、DWI 信号特征。利用图像工作站后处理软件,选择肿瘤明显强化的实质区域,分别测量肿瘤实质、近侧瘤周(瘤周1 cm 以内的水肿区)、远侧瘤周(瘤周1 cm 以外水肿区)及对侧正常脑白质的平均ADC 值,感兴趣区域(region of interest,ROI)面积约20~40 mm2,每个层面数据取样3 次;rADC 值=肿瘤不同区域ADC 值/对侧正常脑白质的ADC 值。
1.2.2 增殖细胞核抗原(Ki⁃67)染色采用Envision二步法进行免疫组化染色并检测Ki⁃67,每张切片随机选取5 个视野(400 倍光镜下)进行观察,Ki⁃67标记指数=阳性染色细胞/总细胞数×100%,Ki⁃67标记指数≤70%为低表达;> 70%的肿瘤细胞着色为高表达。
1.3 统计学方法运用SPSS 22.0 软件进行统计分析。采用单因素方差分析比较PCNSL 组不同区域的差异,采用最小显著差异法(LSD)(方差齐性)或Dunnett T3 法(方差不齐)进行两两比较。PCNSL 与HGG 之间不同区域的差异用独立样本t检验进行比较,Ki⁃67 与ADC 值相关性用spersman等级相关分析。绘制ROC 曲线,分析比较ADC 与rADC 值对两组肿瘤的诊断效能。检验水准α =0.05。
2 结果
2.1 DWI 表现30 例PCNSL 均为单发,DWI 序列示肿瘤多表现为高或稍高信号(26/30,图1A),ADC 图呈低信号(图1B)。35 例HGG 均为单发,DWI 呈稍高及高信号15 例(图1C);等信号16 例,ADC 图呈等低信号(图1D)。

图1 PCNSL 与HGG 的DWI 成像表现及不同肿瘤区域ADC 值、rADC 值Fig.1 DWI imaging findings of PCNSL and HGG,ADC and rADC values of different tumor regions
2.2 两组肿瘤不同区域ADC 值及rADC 值比较PCNSL 组与HGG 组肿瘤实质、近、远侧瘤周、对侧脑白质的ADC 值总体差异有统计学意义(F= 278.758、243.324,均P< 0.001),组间两两各自比较差异有统计学意义(均P< 0.001)。PCNSL与HGG 组肿瘤实质ADC 值,近、远侧瘤周ADC 值变化趋势分别为:先升后降抛物线型与折线上升型。
PCNSL 组肿瘤实质与远侧瘤周ADC 值、rADC值均显著低于HGG 组(P< 0.001),而PCNSL 组近侧瘤周ADC 值、rADC 值均显著高于HGG 组(P<0.001),见表1-2。肿瘤实质rADC 值=1.045 时,鉴别诊断PCNSL 与HGG 的敏感度、特异度、准确率分别为:96.7%、85.7%、90.8%,rADC 值曲线下面积最大(AUC=0.964),诊断效能最高(表3 和图2)。

图2 两组肿瘤不同区域ADC 值、rADC 值绘制ROC 曲线比较Fig.2 Comparison of ADC values and rADC values in different regions of two groups of tumors by ROC curve
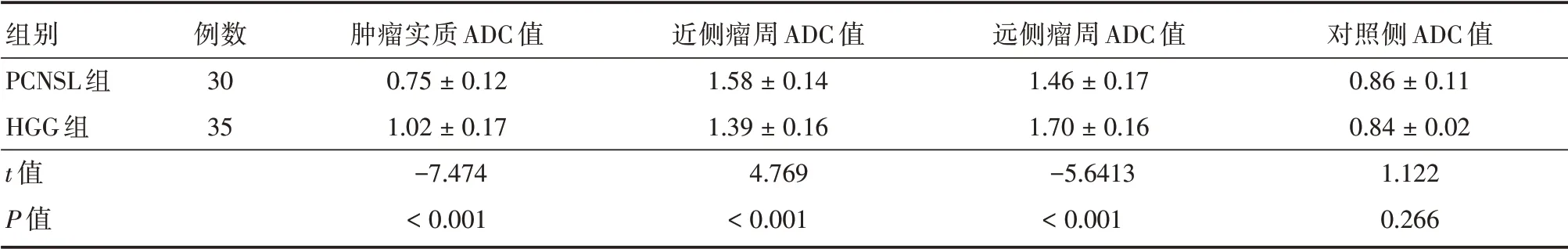
表1 两组肿瘤不同区域ADC 值相比较Tab.1 Comparison of ADC values in different regions of tumors between the two groups x±s,×10-3 mm2/s
表2 两组肿瘤不同区域rADC 值相比较Tab.2 Comparison of rADC values in different regions of the two groups of tumors ±s

表2 两组肿瘤不同区域rADC 值相比较Tab.2 Comparison of rADC values in different regions of the two groups of tumors ±s
组别PCNSL 组HGG 组t 值P 值例数30 35肿瘤实质rADC 值0.86±0.12 1.22±0.20-8.711<0.001近侧瘤周rADC 值1.84±0.19 1.66±0.21 3.587 0.001远侧瘤周rADC 值1.71±0.21 2.02±0.21-5.915<0.001

表3 不同区域ADC值、rADC值对PCNSL 与HGG 鉴别诊断效能分析Tab.3 Efficiency analysis of ADC values and rADC values in different areas for differential diagnosis of PCNSL and HGG
2.3 Ki⁃67 与ADC 值相关性30 例PCNSL 中,Ki⁃67 高表达18 例,低表达12 例,ADC 值、rADC 值与PCNSL Ki⁃67的表达程度呈显著负相关(r=-0.612、-0.648,P<0.001)。
3 讨论
DWI 是一种无创性MRI 功能成像的方法,可以观察组织中水分子的微观弥散状态,并利用ADC 值进行定量测量。以往研究多以PCNSL 与HGG 肿瘤实质区域的ADC 值对比研究为主[11-12],但是利用ADC 值对两组肿瘤瘤周水肿分子扩散状态的对比研究甚少,尚不能从ADC 值层面对两者进行定性鉴别。 本组研究显示PCNSL 组与HGG组不同区域(包括对侧脑白质)的ADC 值总体差异及两两对比差异均有统计学意义。同时本组研究首次发现PCNSL 与HGG 组肿瘤实质ADC 值、近侧瘤周ADC 值、远侧瘤周ADC 值变化趋势分别为:先升后降抛物线型与折线上升型。笔者分析其原因为PCNSL 虽属于侵袭性肿瘤,但瘤细胞浸润及破坏血管壁,血管周围渗出形成血管源性为主的水肿的机制,致使近侧瘤周血管渗透压明显降低,水分子弥散不受限,导致ADC 值明显升高,而PCNSL 远侧瘤周水肿渗透压逐渐回升,导致ADC值较近侧减低;而胶质瘤存在肿瘤细胞浸润形成肿瘤源性水肿,使得近侧瘤周较远侧水分子弥散受限明显,故近侧瘤周水肿ADC 值较远侧瘤周水肿ADC 值减低。本研究首次对瘤周水肿区域进行近侧与远侧分类,笔者认为这种变化规律在一定程度上弥补了ADC 值仅针对两者的定量鉴别。ANWAR 等[9]研究发现rADC 比值对HGG 与PCNSL诊断准确率分别为85.7%、100%(AUC = 0.93),其诊断效能高于ADC值(AUC=0.86)。本组研究显示PCNSL 组病灶实质和远侧瘤周ADC 值、rADC 值均显著低于HGG 组(P< 0.001),而PCNSL 近侧瘤周ADC 值、rADC 值均显著高于HGG 组(P< 0.001)。当肿瘤实质rADC 值=1.045 时,鉴别诊断PCNSL 与HGG 的敏感度、特异度、准确率分别为96.7%、85.7%、90.8%,诊断效能最高(AUC = 0.964)。其肿瘤实质rADC 值对两组肿瘤的诊断效能与AN⁃WAR 等[9]研究结果基本一致。因PCNSL 高细胞密度、高核浆比,细胞外间隙较小,同时伴有大量的网状纤维,使其组织内的水分子弥散明显受限[13],导致ADC 值明显降低[14],弥散较HGG 更受限[15],故PCNSL 肿瘤实质的ADC 值较HGG 明显减低。两组肿瘤近侧及远侧瘤周水肿对比差异均有统计学意义,可能是由于各自瘤周水肿机制形成的不同所致。肿瘤实质rADC 值对两组肿瘤的鉴别的诊断效能最高(AUC = 0.964),结合以往的研究结果[9],进一步说明rADC 值有利于消除微循环灌注、白质纤维弥散各异向性的影响,增加不同个体间的可比性,改善系统误差。有研究表明肿瘤的最小ADC 值更能准确反映肿瘤组织内部生物学特性及恶性程度,从而成为近些年来肿瘤鉴别诊断研究的“热点区”[16-17],多模态检查亦能提高对PCNSL 与HGG 鉴别诊断的效能[18-19],笔者下一步针对以上两种方法将做进一步研究。
Ki⁃67 是最具代表的细胞核增殖抗原之一,可以反映淋巴瘤的增殖活性及恶性程度[20]。本研究显示Ki⁃67 表达程度与ADC 值呈显著性负相关,与KHAN 等[20]研究结果一致,表明Ki⁃67 高表达的肿瘤细胞增殖能力更强,细胞密度及核浆比更高,故ADC 值较低表达显著降低。
本研究的局限性一是样本量较少及机器的型号不同,存在样本误差和统计偏倚;二是ADC 值选取区域与肿瘤病理标本因肿瘤的异质性可能存在一定误差。综上所述,ADC 值、rADC 值测量技术为PCNSL 与HGG 的诊断与鉴别提供可靠依据,同时为无创性判断肿瘤及瘤周的微观浸润状态提供病理基础及分子影像学依据,亦可从分子水平反应PCNSL 的增殖活性。

