颗粒细胞双阶段共培养模式对性成熟前绵羊卵母细胞体外成熟的影响
王海波,孙 鹏,李玉杰,潘庆杰,董焕声
(1.青岛农业大学动物科技学院,山东青岛 2 661091;2.山东畜牧兽医职业技术学院,山东潍坊 261061)
哺乳动物胚胎早期发育能力取决于母源mRNA、蛋白质及营养物质等在卵母细胞中的积累[1],而卵母细胞质量是影响胚胎发育能力的关键内因。有研究指出,性成熟前绵羊卵母细胞的发育能力低于成年绵羊[2],在奶牛上也有相似发现[3]。因此,提高体外成熟(IVM)后成熟卵母细胞的质量是改善胚胎发育能力的先决途径。
在排卵前卵泡中,颗粒细胞产生的cGMP 通过间隙连接扩散到卵母细胞中,维持减数分裂前期停滞[4]。在IVM 过程中,脱离了卵泡液环境的卵母细胞会恢复减数分裂,但卵母细胞易发生核质成熟不同步的现象。据报道,延长IVM 时间可提高第一极体排出率,但IVM 后未受精的卵母细胞将经历随时间变化的质量老化过程[5]。卵母细胞的IVM 可通过模拟卵泡液环境来改善[6]。Zhang 等[7]通过构建绵羊卵母细胞双阶段IVM体系(C 型利钠肽孵育液孵育4 h,第二阶段转入成熟液IVM24 h)提高了卵母细胞发育能力。Adeldust 等[8]研究发现,将卵母细胞与颗粒细胞IVM 24 h 后转移至成熟液中IVM 12 h,可显著提高卵母细胞核成熟率和卵裂率。本研究构建的颗粒细胞双阶段共培养模式为卵母细胞与颗粒细胞预共培养6 h 后转移到常规成熟液中IVM 21 h,旨在构建颗粒细胞双阶段共培养模式并探究其对性成熟前绵羊卵母细胞IVM 的影响,为改良性成熟前绵羊卵母细胞IVM 体系提供新思路。
1 材料与方法
1.1 实验材料 促卵泡素(FSH)、促黄体素(LH)为RayBiotech 公司产品;雌二醇(E2)、丙酮酸钠、表皮生长因子(EGF)、透明质酸酶、矿物油等为Sigma公司产品;DME/F-12、Medium199/EBSS 为Hyclone公司产品;线粒体红色荧光探针(Mito Tracker Red CMXRos)为大连美仑公司产品;活性氧检测试剂盒(ROS Assay Kit)为碧云天公司产品。
体外成熟培养基:M199 基础培养基、1% 青链霉素混合液、10% FBS、10 μg/mL FSH、10 μg/mL LH、1 μg/mL E2、2 mmol/L 丙酮酸钠、100 ng/mL EGF。
1.2 样品采集及预处理
1.2.1 卵母细胞的采集 性成熟前绵羊(3 月龄)卵巢采集自山东省日照市东港区的绵羊屠宰场,将采集的新鲜绵羊卵巢存放在装有含青链霉素、38.5℃生理盐水的保温桶内,在3 h 内运回实验室。用含有青链霉素的生理盐水清洗卵巢数次,剪去除卵巢多余组织,采用抽吸法采集卵母细胞。用5 mL 注射器吸取1~2 mL 的38.5℃预热的采卵液,抽取卵巢表面卵泡的卵泡液,将抽取的卵泡液注射到60 mm 的培养皿中。
1.2.2 卵母细胞IVM 提前向四孔板中加入500 μL 成熟液,然后放入38.5℃、5%CO2培养箱中预热2 h 以上。使用口吸管在体视镜下从采卵液里挑选优质的卵母细胞,将卵母细胞移入洗卵液洗涤3~5 遍,随机分成2 组,然后转移到四孔板成熟液,放入38.5℃、5%CO2培养箱里分别IVM 24 h 和27 h。
1.2.3 颗粒细胞双阶段共培养 将培养到第2 代的成年绵羊颗粒细胞传至四孔板内,在38.5℃、5%CO2培养箱里用成熟液培养24 h 至接触抑制。在卵母细胞IVM前更换新的成熟液,并预热2 h 以上,然后按照上述方法收集卵母细胞并进行体外成熟。共培养体系随机分为2 组:一组在共培养6 h 后,将卵母细胞转移至普通成熟液中继续IVM 18 h,共24 h;另一组在共培养6 h 后,将卵母细胞转移至普通成熟液中继续IVM 21 h,共27 h。
1.3 实验设计
1.3.1 实验分组 将进行IVM 的性成熟前绵羊卵母细胞分为4 组,即对照组(常规IVM 24 h)、27 h IVM 组(常规延时IVM 27 h)、6 h pre-IVM+18 h IVM 组(预共培养6 h 后,将卵母细胞转移至普通成熟液中继IVM 18 h)、6 h pre-IVM+21 h IVM 组(预共培养6 h 后,将卵母细胞转移至普通成熟液中继续IVM 21 h)。
1.3.2 不同培养方式对性成熟前绵羊卵母细胞核成熟的影响 收集4 个分组的性成熟前绵羊卵母细胞,用透明质酸去除卵丘细胞后,观察卵母细胞的第一极体排出情况,统计核成熟率。
1.3.3 不同培养方式对性成熟前绵羊卵母细胞老化的影响 收集4 个分组的性成熟前绵羊卵母细胞,用透明质酸去除卵丘细胞后,观察统计卵母细胞老化情况。
1.3.4 不同培养方式对性成熟前绵羊卵母细胞线粒体分布的影响 收集4 个分组的性成熟前绵羊卵母细胞,用透明质酸去除卵丘细胞,收集核成熟的卵母细胞,在0.01%PVA 的PBS 缓冲液中洗涤3 次,转到400 nmol/L线粒体红色荧光探针(Mito Tracker Red CMXRos)中37.5℃孵育30 min,洗涤3次后转移到激光共聚焦专用皿,共聚焦激光扫描显微镜下观察检测DsRed(Ex:579 nm;Em:599 nm)并采集图像,使用Image J 软件分析。
1.3.5 不同培养方式对性成熟前绵羊卵母细胞胞质内ROS 水平的影响 收集4 个分组的性成熟前绵羊卵母细胞,用透明质酸去除卵丘细胞,收集核成熟的卵母细胞,在无血清MI99 基础培养基中洗涤3 次,转入200 µL 10 mmol/L ROS 水平检测工作液(DCFH-DA) 中38.5℃孵育30 min,转移到激光共聚焦专用皿,在共聚焦激光扫描显微镜下观察检测FITC(Ex:495 nm,Em:519 nm)并采集图像,使用Image J 软件分析平均荧光强度。
1.4 统计分析 数据采用SPASS 25.0 LSD 法进行单因素方差分析(ANVOA),以P<0.05 作为差异性显著判断标准。结果用平均值±标准差表示。
2 结果
2.1 不同培养方式对性成熟前绵羊卵母细胞核成熟的影响 如表1 所示,与对照组相比,27 h IVM 组性成熟前绵羊卵母细胞的第一极体排出率显著提高,6 h pre-IVM+18 h IVM 组显著降低,而6 h pre-IVM+21 h IVM组无显著变化。因此,颗粒细胞双阶段共培养模式不会降低卵母细胞的核成熟率。
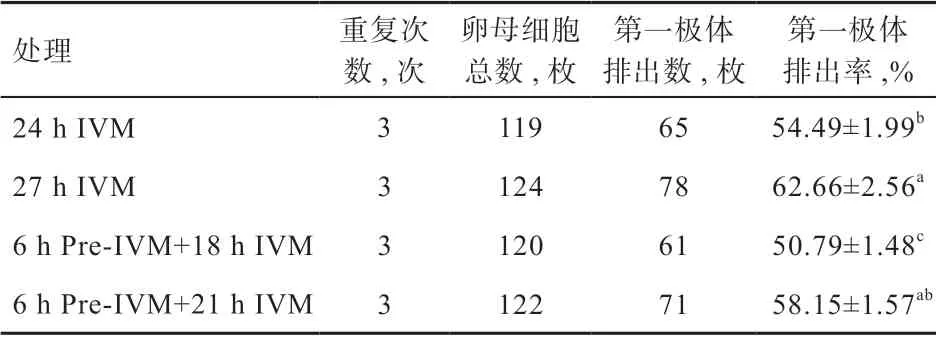
表1 不同培养方式下性成熟前绵羊卵母细胞第一极体排出率
2.2 不同培养方式对性成熟前绵羊卵母细胞老化的影响如表2 和图1 所示,27 h IVM 组的老化率(31.00%)高于其他处理组(P<0.05)。与对照组相比,6 h pre-IVM+21 h IVM 组的老化率(17.40%)有所上升(P>0.05),低于27 h IVM 组(P<0.05)。结果表明,颗粒细胞双阶段共培养模式能够降低延时IVM 对卵母细胞老化的影响。
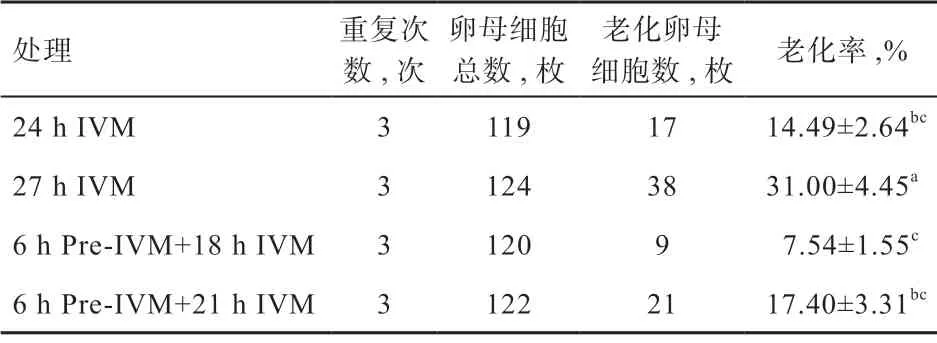
表2 不同培养方式下性成熟前绵羊卵母细胞老化率
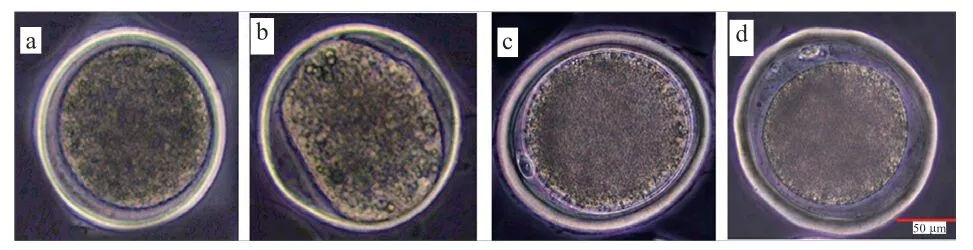
图1 性成熟前绵羊卵母细胞老化代表图
2.3 不同培养方式对性成熟前绵羊卵母细胞线粒体分布的影响 如图2-A 所示,在MII 期的绵羊卵母细胞内有3 种线粒体分布模式:皮质/ 核周(pericortical/perinuclear,P/P)分布(胞质完全成熟)、均匀分布(胞质成熟不完全)和萎缩分布(线粒体异常分布)。如图2-B 所示,6 h pre-IVM+21 h IVM 组的皮质/核周分布比例(56.25%)高于其他组(P<0.05),且均匀分布模式比例(32.29%)低于对照组(51.00%)(P<0.05)。因此,颗粒细胞双阶段共培养有利于卵母细胞线粒体的正常排布,可以促进胞质成熟。
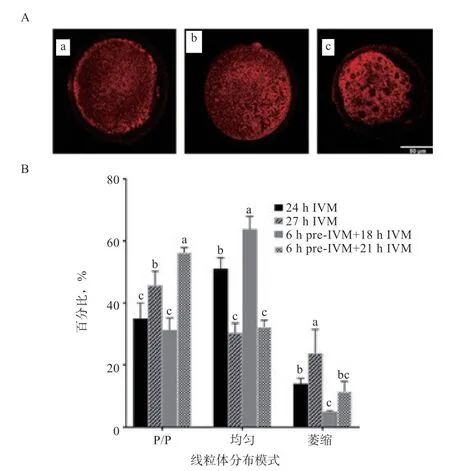
图2 不同培养方式对性成熟前绵羊卵母细胞线粒体分布的影响
2.4 不同培养方式对性成熟前绵羊卵母细胞胞质内ROS水平的影响 如图3 所示,与对照组(9.00%)相比,6 h pre-IVM+21 h IVM 组卵母细胞胞质内ROS 水平(9.78%)有所升高(P>0.05),且低于27 h IVM 组(15.24%)(P<0.05)。结果表明,颗粒细胞双阶段共培养能降低延时IVM 的卵母细胞胞质内ROS 水平。
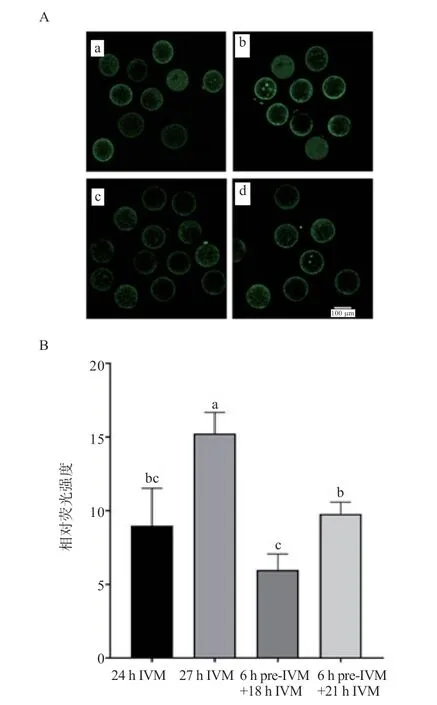
图3 不同培养方式对性成熟前绵羊卵母细胞胞质内ROS 水平的影响
3 讨 论
颗粒细胞与卵母细胞共培养,在体外可产生一系列抑制减数分裂及延缓核成熟的物质。在小鼠和猪上,颗粒细胞来源的C 型利钠肽(CNP)对卵母细胞的减数分裂恢复有抑制作用[9]。本研究发现共培养阶段颗粒细胞对卵母细胞的减数分裂同样有抑制作用,但预先共培养一段时间后,将卵母细胞转移到普通成熟培养基中进行常规IVM 可解除抑制作用,使减数分裂恢复。本实验中,在预先共培养6 h 后,转移到普通成熟培养基中IVM 21 h 的卵母细胞第一极体排出率高于继续IVM 18 h的卵母细胞,这说明颗粒细胞双阶段共培养模式下,常规IVM 阶段卵母细胞依然需要充足的时间去完成核成熟进程。
线粒体是真核细胞中一个重要的细胞器,在能量代谢和ATP 生产中起着重要作用[10],线粒体的活化和迁移是卵母细胞胞质成熟过程中的关键标志之一[11]。研究表明,包括绵羊在内的大多数哺乳动物的健康卵母细胞中,线粒体呈皮质/核周分布模式,是核染色体迁移和皮质颗粒反应所必需的,是胞质完全成熟的表现[12]。相反,线粒体分布不规则,是卵母细胞严重损伤的标志,而线粒体分布均匀,有分散的小线粒体聚集体,表明细胞没有能力正确组织线粒体[13]。本研究结果表明,在6 h pre-IVM+21 h IVM 双阶段共培养模式下,线粒体呈皮质/核周分布的性成熟前绵羊卵母细胞的比例显著提高,这表明6 h pre-IVM+21 h IVM 颗粒细胞双阶段共培养模式可以使卵母细胞胞质得到充足发育,促进卵母细胞正确组织线粒体的迁移排布。
另外,本研究结果表明,延长IVM 时间可以有效提高性成熟前绵羊卵母细胞的核成熟率,但IVM 27 h卵母细胞的老化率远高于常规IVM 24 h 的卵母细胞。据报道,卵母细胞老化会导致卵周隙增大、透明带硬化、胞膜空泡化、胞质破碎以及线粒体和纺锤体等细胞器形态结构异常[14-15]和功能紊乱。无论在体内还是体外的卵母细胞如果长时间没有受精,都会呈现出时间依赖性的质量下降并发生老化[16]。这与本研究结果一致,即IVM 27 h 卵母细胞的老化率增高,而6 h pre-IVM+21 h IVM颗粒细胞双阶段共培养模式可以减少性成熟前绵羊卵母细胞的老化率。由ROS 组成的自由基是氧化反应的主要产物,卵母细胞的老化伴随着氧化应激的过度积累,老化的卵母细胞容易发生凋亡或胚胎发育迟缓[17]。本研究结果显示,延长IVM 时间会使卵母细胞胞质内ROS 水平显著升高,相应地,卵母细胞的老化率也随之上升,原因可能是随着培养时间延长,胞质内ROS 不断积累,导致包括线粒体为主的诸多细胞器受到ROS 的诱导损伤[18],造成卵母细胞的老化凋亡。与IVM27 h 的卵母细胞相比,6 h pre-IVM+21 h IVM 颗粒细胞双阶段共培养模式有可以抑制性成熟前卵母细胞胞质ROS 水平升高的趋势。
目前,颗粒细胞双阶段共培养模式对抑制ROS 水平升高和促进线粒体成熟分布的具体机制尚不清楚,下一阶段的研究计划探究颗粒细胞双阶段共培养模式对体外成熟影响的具体机制以及对性成熟前绵羊早期胚胎发育的影响。
4 结 论
本实验结果显示,6 h pre-IVM+21 h IVM 颗粒细胞双阶段共培养模式并不抑制性成熟前绵羊卵母细胞的核成熟,但常规成熟阶段IVM 时间不足会抑制第一极体的排出。同时,此双阶段共培养模式下,有利于性成熟前绵羊卵母细胞线粒体的正确迁移分布,能够促进核质成熟同步,并通过抑制卵母细胞胞质内ROS 水平升高,减缓卵母细胞的老化率。

