多浪羊与卡拉库尔羊FSHR 基因启动子区甲基化水平差异研究
刘 波,芮 雪,方 翟,黄 飞,陶维昆,赵建清,李宏健,高庆华,3*
(1.新疆塔里木大学动物科学学院,新疆阿拉尔 843300;2.新疆塔里木大学生命科学学院,新疆阿拉尔 843300;3.新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300;4.新疆乌鲁木齐畜牧兽医总站,新疆乌鲁木齐 830000)
多浪羊有较高的繁殖能力,性成熟早,且为常年发情,一般两年产三胎,而且双羔率较高,繁殖成活率在220%左右;卡拉库尔羊繁殖率较低,一般发情受季节影响,产羔率在110%左右[1]。生殖激素受体基因是影响繁殖率的因素之一,促卵泡素受体(FSHR)基因介导促卵泡激素(FSH)作用于卵巢,是卵泡发育、成熟以及最终引发排卵的必需物质[2]。研究FSHR基因如何加快卵泡的生长分化、促进优势卵泡的形成以及提高低繁殖家畜的繁殖率具有重要意义。王惠娥等[3]研究多浪羊和卡拉库尔羊卵巢FSHR基因发现多浪羊对FSH的敏感性高于卡拉库尔羊,表明FSHR 含量越高繁殖率越高。早期的研究表明缺乏FSH 或FSH 受体的卵泡未能进展到排卵前阶段,导致不孕[4]。目前认为,FSHR基因的组织特异性表达与转录因子的作用、DNA 甲基化、染色体的重建、染色体组蛋白的修饰及mRNA、蛋白的转换有关[5],其中DNA 甲基化对基因表达水平的调控尤其受到关注。Priya 等[6]对大鼠FSHR基因启动子研究中观察到了FSHR基因启动子区甲基化带,且研究DNA 甲基化可能有助于更好地理解绵羊生殖能力的表观遗传调控。DNA 甲基化是调节FSHR基因细胞特异性沉默的主要因素之一,但是目前DNA 甲基化与FSHR基因表达的研究尚处于早期,还不完全了解其调控机制。本实验通过亚硫酸氢盐测序(Bisulfite Genomic se-quencing PCR,BSP)技术检测不同绵羊FSHR基因启动子区DNA 甲基化水平差异来探究绵羊FSHR基因启动子区DNA 甲基化水平与繁殖性状的关系,为进一步研究绵羊FSHR基因启动子区DNA 甲基化水平与FSHR基因表达量的关系提供重要实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 血液/ 组织/ 细胞基因组提取试剂盒(DP304)、RNaseA(100 mg/mL)溶液(RT405-12)、DH5α感受态细胞(CB101)、红细胞裂解液(RT122)、10×Loading Buffer、DL 2000(8000)Marker 分子量标记、快捷性琼脂凝胶DNA 回收试剂盒、pMD19-T 载体、Hot Start Taq 聚合酶、琼脂、琼脂糖、乙二胺四乙酸二钠(EDTA)、无水乙醇等均购自天根生化科技有限公司。甲基化处理试剂盒(D5005)购置于ZYMO RESEARCH 公司。
1.1.2 主要仪器 PCR 仪(BIO RAD,C100);核酸浓度检测仪(Thermo,ND-One);-80℃超低温冰箱(Thermo,ExF24086V);低温高速冷冻离心机(Sigma,3K30);高压蒸汽灭菌锅(TOMY,SX-500);超净工作台(Boxum,SHC-CT-22);恒温水浴锅(上海博讯,HHS-21-4);电泳仪;凝胶成像仪。
1.1.3 试剂配制 试剂配制均以灭菌蒸馏水为溶剂,高压灭菌条件:高压蒸汽灭菌30 min。其余参考《分子克隆实验指南》第三版李载平等[7]。
1.2 实验方法
1.2.1 样品的采集 本实验使用的动物分别为多浪羊和卡拉库尔母羊各3 只,均为1 岁母羊,且同品种间无血缘关系。血液采自塔里木大学动物实验站,使用一次性采集容器(EDTA-K2)静脉采血后送回实验室-20℃保存备用。
1.2.2 基因组DNA 的提取与检测 使用试剂盒DP304按照步骤提取不同绵羊血液组织基因组DNA。提取前所用器具高温高压灭菌并做烘干处理;使用DNA 提取试剂盒时,应该按照使用说明提取DNA;提取完成后使用1%的琼脂糖凝胶进行电泳检测质量,使用凝胶成像仪观察基因组DNA 的片段大小及亮度情况,使用核酸浓度检测仪检测提取的绵羊血液组织DNA 浓度和纯度,并拍照记录。
1.2.3 基因启动区引物设计合成与预测 参考绵羊FSHR基因序列(Gene ID:443299),根据FSHR基因启动子区,使用MethPrimer 在线网站(www.bioon.com.cn/sub/showarticle.asp)预测FSHR基因启动子序列存在的CpG 岛检测区域是否符合实验要求,根据符合要求的区域设计FSHR基因启动子区的引物,上游引物:5'-GTGTTTTTGTTTGGAGAATTTTAGG-3',下游引物:5'-TCAATCAAAAAACCATCTACTTTCA-3',送往广州伯信生物科技有限公司进行合成。
1.2.4 基因启动子区的扩增及回收纯化 以BSP 处理后的绵羊血液DNA 为模板,对FSHR基因设置最佳PCR扩增体系,PCR 扩增程序设置为95℃预变性5 min;94℃变性30 s,68~53℃退火,每个循环降3℃,10 个循环;94℃变性30 s,51℃退火30 s,72℃延伸30 s,循环30 次;72℃终延伸10 min;4℃保存备用。扩增完成后,2%琼脂糖凝胶电泳检测,舍弃扩增失败引物,并拍照做好记录。按琼脂糖凝胶回收纯化试剂盒说明进行产物回收纯化。
1.2.5 T-A 克隆及热激转化 将绵羊FSHR基因启动子区PCR 扩增后回收产物与pMD19-T 载体连接,加DH5α感受态细胞进行单克隆筛选。
1.2.6 阳性克隆鉴定 过夜培养后会产生蓝白色菌斑。吸取1 mL 的LB 液体培养基加入到1.5 mL 离心管内,用灭菌处理过的牙签或者枪头挑取饱满的白色菌落放于离心管中,放置于恒温摇床(37℃,200 rpm)中振荡培养8 h 左右。参照DNA 模板PCR 扩增体系将DNA模板换成菌液进行PCR 鉴定,2%凝胶电泳检测,挑选优质(单一清晰,片段大小与目的片段一致的条带)对应菌液送至测序。
1.2.7 统计分析 CpG 位点的甲基化水平=各CpG 位点的甲基化/ 克隆数;应用QUMA(http://quma.cdb.riken.jp/)在线软件分析克隆测序结果。
2 结果与分析
2.1 CpG 岛在线预测 预测结果为:CpG 岛长度>100 bp,GC 含量>50%,期望值>0.6,检测区域符合实验要求,预测结果如图1 所示。
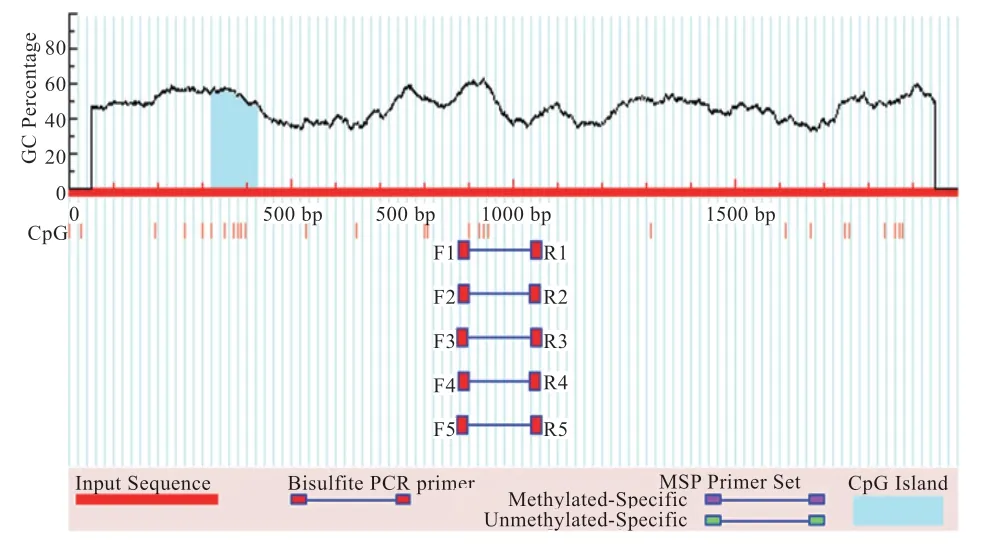
图1 FSHR 基因启动子区CpG 岛预测结果
2.2 基因组DNA 的提取 利用基因组提取试剂盒按照操作步骤提取基因组DNA,使用1% 的琼脂糖凝胶电泳以及核酸浓度检测仪分别检测其浓度、纯度。提取的基因组DNA 浓度均可达到200 ng/μL 以上,OD260/OD280值均在1.8~2.0 之间。因此,提取的血液组织基因组DNA 质量较好,满足后续的实验条件,电泳检测结果如图2 所示。

图2 绵羊基因组DNA
2.3 基因组DNA 甲基化BSP 扩增 分别以重亚硫酸盐修饰处理过的多浪羊与卡拉库尔羊血液组织基因组DNA 为模板,对FSHR基因启动子区进行BSP-PCR 扩增,产物用2%琼脂糖凝胶电泳检测,扩增片段长度为189 bp,扩增片段大小均与预期扩增片段大小相符(图3)。
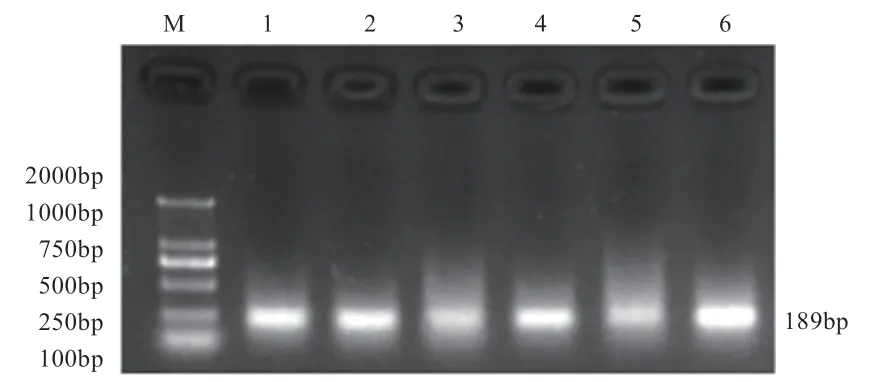
图3 BSP 处理后FSHR 扩增产物电泳结果
2.4 DNA 甲基化BSP 扩增产物纯化回收 对FSHR基因扩增产物进行切胶回收纯化,回收纯化的DNA 产物片段长度为189 bp,与预期结果一致(图4)。

图4 纯化后FSHR 扩增产物电泳结果
2.5 DNA 甲基化BSP 克隆 回收纯化的DNA 片段分别进行TA 克隆和菌液PCR 检测,菌液PCR 扩增产物使用2%琼脂糖凝胶电泳检测,片段长度都为189 bp(图5),表明重组克隆载体pGM-T 构建成功。

图5 重组克隆载体菌液PCR 产物电泳结果
2.6 测序结果及分析 如图6 所示,非甲基化位点中的非甲基化的“C”均转化为“T”,而其余碱基完全一致。

图6 DNAMAN 序列比对结果
运用QUMA 在线网站(http://quma.cdb.riken.jp/)对6 个测序序列进行分析后发现,目的片段中的4 个位点为甲基化位点,如图7 所示,多浪羊中28、49、71位点均不发生甲基化,61 位点发生甲基化。卡拉库尔羊中1-3、1-4 羊在28、71 位点不发生甲基化,在49、61 位点发生甲基化。1-5 号卡拉库尔羊在28 位点不发生甲基化,而在49、61、71 位点均发生甲基化(图7)。

图7 甲基化位点QUMA 分析结果
由图8 可知,多浪羊FSHR基因启动子区中的目的序列甲基化位点低于卡拉库尔羊。
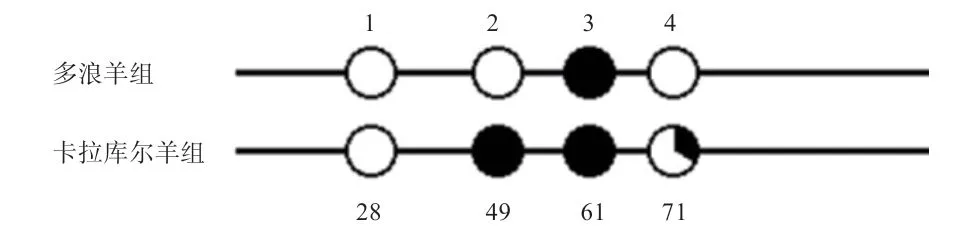
图8 甲基化位点QUMA 分析结果
如图9 所示,多浪羊组与卡拉库尔羊组FSHR基因在启动子区目的片段中的28 位点都不发生甲基化;在49 位点只有卡拉库尔羊发生甲基化,甲基化率100%,而多浪羊组不发生甲基化;61 位点多浪羊组与卡拉库尔羊组全部发生甲基化,甲基化率100%;71 位点只有卡拉库尔羊发生甲基化,甲基化率33.3%,多浪羊组的平均甲基化率为25.0%,卡拉库尔羊组的平均甲基化率为58.3%。

图9 甲基化位点QUMA 分析结果
3 讨 论
本实验通过DNA 甲基化检测的“黄金标准”BSP检测了多浪羊与卡拉库尔羊FSHR基因启动子区甲基化水平,结果显示在多浪羊和卡拉库尔羊FSHR基因启动子区目的片段中发现4 个甲基化位点,且多浪羊甲基化发生率显著低于卡拉库尔羊,推测在多浪羊与卡拉库尔羊中FSHR基因表达与DNA 甲基化水平及甲基化位点具有一定的相关性。
研究发现,在哺乳动物中,DNA 甲基化模式似乎在分化和分化细胞的基因调控方面起着关键作用[8]。DNA 甲基化通过图式和数量的改变对生物信息学进行调节,在基因表达调控等方面发挥重要作用[9]。基因启动子区及附近区域CpG 岛的甲基化是许多基因完成表达与沉默的调控方式,通过对启动子区CpG 岛甲基化状态检测来反映出基因表达情况。通过对大鼠FSHR基因的核心启动子区研究发现,7 个CpG 二核苷酸位点与小鼠FSHR基因启动子区的4 个CpG 二核苷酸位点,经BSP 测序发现,在表达FSHR的大鼠/小鼠细胞中这些潜在甲基化位点均未被甲基化,而在不表达FSHR的大鼠/ 小鼠的组织细胞中这些位点的CpG 二核苷酸均被甲基化[10]。尽管大鼠/ 小鼠FSHR启动子中CpG 二核苷酸并不丰富,但启动子中非特定位点的DNA 甲基化与基因失活相关,DNA 甲基化在大鼠/ 小鼠FSHR基因的调节过程中起着主要作用[11]。蒋曹德等[12]利用甲基敏感扩增多态技术(MSAP)分析了甲基化与生长性状的关系,在检测到的1 274 个甲基化位点中,有252 个多态性甲基化位点,其中有81 个位点对1 个或多个生长性状有显著影响。本实验在绵羊血液FSHR基因启动子区目的片段中找到4 个甲基化潜在位点,其中在多浪羊组中只有在61 位点发生甲基化,而卡拉库尔羊组中分别在49、61 位点发生甲基化,71 位点部分卡拉库尔羊发生甲基化,推测在不同位点发生甲基化可能对FSHR基因的表达与繁殖力具有一定的影响。研究发现,源自睾丸肿瘤的小鼠睾丸支持细胞株(MSC-1)具有非活性的FSHR启动子[13],并且MSC-1 细胞中转录的非活性状态与FSHR基因核心启动子的胞嘧啶甲基化相关[14]。张燕丽等[15]对绵羊卵巢与多产性相关的DNA甲基化谱进行全基因组分析,发现一些与激素功能相关的差异甲基化区域相关基因,如FSHR和FST,高繁殖力群体组与低繁殖力群体组相比卵巢组织中的甲基化水平(FSHR和FST上调,LHCGR下调)有显著差异,这可能会影响这些基因的mRNA 表达。本实验发现,在高繁殖力的多浪羊与低繁殖力的卡拉库尔羊中FSHR基因启动子区的目的片段中49 位点差异极显著,这可能是影响FSHR基因表达量的因素之一,这一甲基化位点与FSHR基因的表达量是否相关还需进一步研究。
研究表明,基因的启动子区域和外显子的低甲基化和高表达呈负相关,即甲基化密度高抑制基因表达,密度低促进基因表达[16]。梁慧慧等[17]对绵羊下丘脑GNAQ基因研究发现适量的叶酸浓度使DNMT1基因表达上调,GNAQ启动子区CpG 位点甲基化水平上调,引起GNAQ表达下调,进而间接调控了GnRH的分泌。罗荣松等[18]对奶绵羊与蒙古羊全基因组DNA 甲基化研究中发现,奶绵羊和蒙古羊肌肉和尾脂组织具有一致的DNA 甲基化动态;尾脂组织的甲基化水平高于肌肉组织。启动子区的GC 含量从转录起始位点向侧翼区域逐渐降低随后趋于稳定,并与DNA 甲基化水平呈负相关,GC 含量越高甲基化水平越低。王小莉等[19]通过对大鼠不同细胞的研究,得到大鼠胰岛和INS-1细胞中INS-1基因高表达,启动子区域的甲基化程度非常低,然而在大鼠其他组织和WB 细胞中INS-1基因不表达,启动子区域的甲基化程度很高。本实验研究结果为在卡拉库尔羊血液中FSHR基因甲基化水平显著高于多浪羊,而基因的甲基化一般对基因的表达量有负调控作用,推测多浪羊与卡拉库尔羊DNA 甲基化水平可能与FSHR基因的表达呈一定负相关。FSHR基因的DNA 甲基化水平及位点差异可能是影响繁殖力的重要因素之一,本研究结果为进一步探究FSHR基因在绵羊卵巢中的表达与DNA 甲基化水平的关系提供依据。
4 结 论
多浪羊FSHR基因启动子区中目的片段平均甲基化水平为25%,卡拉库尔羊FSHR基因启动子区目的片段平均甲基化水平为58.3%,多浪羊与卡拉库尔羊在目的片段CpG 岛上49 号位点甲基化水平差异较大,2 个品种间FSHR基因启动子区目的片段DNA 甲基化水平差异显著,推测FSHR基因甲基化水平与绵羊FSHR基因的表达呈负相关。

