氟尿嘧啶注射液与5种药物配伍的稳定性研究
朱辉娅,谢永忠,凌志刚,姚 玲,方先骏
(1.黄山市人民医院药剂科,黄山 245000;2.黄山市食品药品检验中心药品部,黄山 245000;3.安徽医科大学第一附属医院药剂科,合肥 230022)
氟尿嘧啶注射液是临床应用最多的嘧啶类抗代谢药,在抗肿瘤治疗中占有重要地位[1-7]。根据药品说明书中用法用量的要求,氟尿嘧啶注射液静脉滴注时间每次不得少于6~8 h,或者用输液泵连续静脉滴注给药维持24 h。在临床实际应用中,常用输液泵进行24 h持续静脉给药。肿瘤患者在使用氟尿嘧啶注射液的同时,通常还需静滴止吐药、糖皮质激素等其他药物,为减轻病人的痛苦,临床上常用双通管或三通管配合输液泵进行氟尿嘧啶注射液和其他药物的同时静脉输注[8-10]。本研究将氟尿嘧啶注射液与临床常用的注射用泮托拉唑钠、地塞米松磷酸钠注射液、盐酸阿扎司琼注射液、盐酸格拉司琼注射液和盐酸甲氧氯普胺注射液进行配伍,考察其稳定性,旨在为临床安全合理用药提供理论依据。
1 仪器与试药
1.1仪器 UV-2550型紫外分光光度计(日本岛津仪器有限公司);PB-10型酸度计(德国Sartorius公司);GWJ-6型不溶性微粒检测仪(天津天大天发科技有限公司);SMC 30D型渗透压仪(天津天河分析仪器有限公司)。
1.2试药 氟尿嘧啶注射液(上海旭东海普药业有限公司,批号FA200201);注射用泮托拉唑钠(武汉人福药业有限公司,批号20200414-1);地塞米松磷酸钠注射液(辰欣药业股份有限公司,批号2003092212);盐酸阿扎司琼注射液(南京制药厂有限公司,批号20200501);盐酸格拉司琼注射液(北京协和药厂,批号190201);盐酸甲氧氯普胺注射液(上海禾丰制药有限公司,批号05200303);9 mg·mL-1氯化钠注射液(批号E20060706)和50 mg·mL-1葡萄糖注射液(批号E20060501),均购自四川科伦药业股份有限公司。
2 实验方法
2.1供试品溶液的制备 根据临床实际用药的溶媒情况,将质量浓度为25 mg·mL-1的氟尿嘧啶注射液1 mL溶于25 mL生理盐水中,经过稀释制成质量浓度为10 μg·mL-1的溶液①;将注射用泮托拉唑钠80 mg溶于15 mL生理盐水中,经过稀释制成质量浓度为26.67 μg·mL-1的溶液②;将质量浓度为5 mg·mL-1的地塞米松磷酸钠注射液1 mL溶于100 mL生理盐水中,作为溶液③;将质量浓度为5 mg·mL-1的盐酸阿扎司琼注射液1 mL溶于50 mL生理盐水中,作为溶液④;将质量浓度为1 mg·mL-1的盐酸格拉司琼注射液1 mL溶于50 mL生理盐水中,作为溶液⑤;将质量浓度为10 mg·mL-1的盐酸甲氧氯普胺注射液1 mL溶于500 mL 50 mg·mL-1的葡萄糖溶液中,作为溶液⑥。取溶液①和②各50 mL混合制成混合液A,取溶液①和③各50 mL混合制成混合液B,取溶液①和④各50 mL混合制成混合液C,取溶液①和⑤各50 mL混合制成混合液D,取溶液①和⑥各50 mL混合制成混合液E。

2.3外观变化观察 将混合液A、B、C、D和E放置0、0.5、1、2、4、6 h,在各时间点用目视观察法观察溶液外观是否发生变化。
2.4pH值的稳定性考察 用PB-10型pH计分别于0、0.5、1、2、4、6 h测定混合液A、B、C、D和E的pH值。每次使用前用蒸馏水将玻璃电极球冲洗多次,再用滤纸吸干,将玻璃球浸入待测溶液。测定时,待数值出现“S”时表明读数稳定,读取数值,每个样品重复测定3次取平均值。
2.5渗透压的稳定性考察 在室温条件下,分别于 0、0.5、1、2、4、6 h使用渗透压仪测定待测液的渗透压摩尔浓度,每个样品重复测定3次取平均值。
2.6不溶性微粒的稳定性考察 分别于0、0.5、1、2、4、6 h用不溶性微粒检测仪测定混合液A、B、C、D和E的微粒数量,每个样品重复测定3次取平均值。
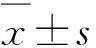
3 结果
3.1紫外吸光度值A测定结果 分别于0、0.5、1、2、4、6 h测定混合液A、B、C、D和E的紫外吸光度值A,各溶液紫外吸收变化及RSD值见表1,稳定性比较见表2。

表1 不同时间吸光度检测结果(n=3)

表2 不同时间稳定性比较
由表2可知,混合液B、C、D和E在0~6 h内吸光度值A无明显变化(RSD<5%),说明混合液B、C、D和E在0~6 h内含量稳定。混合液A在0~6 h内稳定性有所改变,这与注射用泮托拉唑钠的性质有关。注射用泮托拉唑钠为强碱性化合物,在强碱性条件下制剂才稳定[12-14]。注射用泮托拉唑钠配成混合液后,随着pH值的降低,药物的稳定性逐渐下降。但在0~2 h内,混合液A在266、293 nm波长处吸光度RSD值分别为3.9%、4.6%,说明混合液A在2 h内含量较稳定。在测定吸光度值A的同时,对各混合液进行紫外扫描(200~400 nm)。结果显示,混合液A、B、C、D和E在紫外吸收图谱中吸收曲线未发生改变。
3.2外观性状 混合液A、B、C、D和E在6 h内外观性状均为澄明溶液。
3.3pH值变化 混合液A、B、C、D和E在0~6 h内pH值无明显变化,RSD<5.0%,表明稳定性较好。pH值变化见表3。

表3 不同时间pH值检测结果 (n=3)
3.4渗透压变化 混合液A、B、C、D和E在0~6 h内渗透压无明显变化,RSD<5.0%,表明稳定性较好。渗透压变化见表4。

表4 不同时间渗透压检测结果 (n=3)
3.5不溶性微粒检测结果 不溶性微粒检测结果见表5。
4 讨论
由表5可知,5种混合液在4 h内微粒数大部分高于《中国药典》的规定值[15],在6 h时基本都处于正常值范围。微粒数从0~6 h呈明显减少的趋势。如果不溶性微粒是由于两者输液配伍后产生,随着时间的推移,不溶性微粒的检测值应逐渐上升[16],因此,5种混合液配伍后在0 h时测定的不溶性微粒不应是2种药物的接触发生化学变化而产生的,出现此种情况的原因可能是刚开始时由于2种输液在拿取时的振摇以及输液混合过程中而产生大量的微小气泡,仪器检测时误将气泡当成微粒进行计数,导致计数结果偏高[17-19]。在输液静置一段时间排除了小气泡的干扰后,不溶性微粒的测定值达到《中国药典》的规定值。为提高输液的安全性,建议临床在输液时采用终端过滤器[20]。
氟尿嘧啶注射液与地塞米松磷酸钠注射液、盐酸阿扎司琼注射液、盐酸格拉司琼注射液和盐酸甲氧氯普胺注射液混合后的溶液在6 h内吸光度值A、外观、pH值和渗透压均无明显变化,说明其混合液在6 h内稳定性良好,临床在使用氟尿嘧啶注射液时可以配合双通管或三通管输入地塞米松磷酸钠注射液、盐酸阿扎司琼注射液、盐酸格拉司琼注射液和盐酸甲氧氯普胺注射液。而氟尿嘧啶注射液与注射用泮托拉唑钠配伍后的混合液在0~2 h内含量无明显变化,2~6 h内含量变化明显,但外观、pH值、渗透压及不溶性微粒数量无明显变化。建议注射用泮托拉唑钠尽量单独输注,若要使用氟尿嘧啶注射液泵配合双通管或三通管输注注射用泮托拉唑钠时应保证输液在2 h内输注完,若超过2 h则不建议使用。本实验对临床用注射液配伍后其理化性质的变化进行了研究,结果可供临床配伍使用时参考。

