长春西汀注射剂及其原料和辅料中15种微量元素的测定
陈小英,薛晓文,妙 苗,王嫦鹤,刘海静*
(1.陕西中医药大学,咸阳 712046;2.陕西省食品药品检验研究院,西安 710065)
长春西汀是从夹竹桃科植物小蔓长春花中提取分离的生物碱长春胺并对其结构进行改造得到的衍生物[1-3]。长春西汀是吲哚类生物碱[4-5],脂溶性好,易通过血脑屏障[6],可增加脑血流量,促进脑内单胺代谢的转换,改善血液流动性和修复脑损伤。临床上常用于改善脑梗死后遗症[7]、脑动脉硬化症、脑出血后遗症、慢性脑缺血[8]、中风后遗症[9-10]以及认知能力等[11-12],其疗效好、耐受性好,被广泛应用于临床治疗中[13]。
微量元素是指占生物体总质量0.01%以下的元素,如铁(Fe)、铜(Cu)、碘(I)、溴(Br)、硅(Si)、锰(Mn)等。人体中存在的微量元素总量极低,每日对微量元素的需求量很少,微量元素摄入过量会不同程度地引起人体生理异常,并对身体造成较大的危害。微量元素的种类不仅包括对人体生命活动不可或缺的微量元素,还包含对人体有害的微量元素和重金属。有害微量元素会对人体产生致癌、致畸作用,比如铅(Pb)、铝(Al)、砷(As)、汞(Hg)、镉(Cd)等。重金属是指密度大于5 g·cm-3的金属,对人体有害的重金属主要包括Cd、Hg、Pb、镍(Ni)等[14]。重金属极易从原料辅料、生产工艺和药品包材等引入药品中[15]。重金属元素及有害元素可能会引起身体各部位的病变,包括消化系统、神经系统、血液系统等,可能引起肠胃损伤、肾功能衰竭、中枢麻痹等病理现象[16],甚至致癌,是影响注射剂安全性的一项重要考察因素,因此有必要将微量元素种类及含量(尤其是重金属及有害元素含量)作为注射剂质量标准的重要指标之一。国内外的药品标准中对微量元素的种类及限度有相应的规定。
重金属元素及有害元素常用的检测方法有原子吸收分光光度法[17]、原子荧光分光光度法[18]、电感耦合等离子体法[19]。电感耦合等离子体质谱法(ICP-MS)是将电感耦合等离子体与质谱联用,利用电感耦合等离子体使样品离子化,将待测金属分离出来,从而进入质谱测定,可进行同位素分析,该方法灵敏度高、检出限低、线性范围宽,广泛用于检测痕量元素[20-21]。
1 仪器与试药
1.1仪器 Thermo ICAPRQ型电感耦合等离子体质谱仪(赛默飞世尔科技公司);ME204型电子分析天平(万分之一,梅特勒-托利多公司);G-400型智能控温电加热器(上海屹尧仪器科技发展有限公司);MULT MAVE 3000型微波消解仪(安东帕(上海)商贸有限公司);TTL-10B型超纯水系统(北京同泰联科技公司)。
1.2试药
1.2.1供试品 包括长春西汀注射剂、 长春西汀原料和辅料(L-酒石酸、焦亚硫酸钠、山梨醇、维生素C和甘露醇)。
1.2.1.1长春西汀注射剂 A 企业,批号191108;B企业,批号分别为:1901241、1904274、1805152、1904273、1901212、1901262、1712012、1811281、1904252、1611102、1707142、1805144、1701121、1901231、1904263、1901261、1909232、1909231、1704142、1604221、1901212、1904242、1901262、1711302、1901211、1812202、1901261、1901262、1904262、1909251;C企业,批号分别为 11904042、11812102、11812031、11908152、11812122、11908151、11812122、11904041、11807171、11901281、11904032、11908161、11812102;D 企业,批号分别为:200201A、181202A、190303A、2002205A、2002204A、2002202A、190301A、190104A、200201A、180506A、190106A;E 企业,批号分别为: 1910121、1904038、1912127、1912131、1905066、1911124、1912134、1910112、1912135、2004024、2004025、1912142、2001009;F企业,批号分别为:21911011、11911014、11904021、1200102、1200101、21911014;G企业,批号分别为:190713、31190203、190713、190710、31190310、31190205、190709、190712、190703、190701、190912、190913、190914、190915、190124;H企业,批号:190214;I 企业,批号分别为:DB190205、DB190101、DB190201、DB190201、20180601、20171201;J企业,批号分别为: 1911012、1905192、1905202、1905222、19092721、19111821、19121521、19100821、19120721、20010221、19121721、1906181、1811071、1804201、1809121、1906141、1811061、1903211、1811021、1904171、1903201、1906181、1905091、1906121、1906131、1811031;K企业,批号分别为:11190502、11181107、9190701、9190702、9190601、9190301、11190506、9190302、11190502; L 企业,批号分别为:1911025、1911024;M企业,批号分别为: 20190201、20190303、20190301;N 企业,批号分别为:1902211、1902201、1902161、1902171、1902181、1903171、1903181、1903191、1902191;O企业,批号分别为: 19022707、19080706、19022706; Q企业,批号分别为: A92055A、A84067A、A94129A、A92056A;R企业,批号分别为: D190263、D190924、D191091、D191083;S 企业,批号分别为:30619004、30619005; T企业,批号分别为: P1/20190901、P1/20190901;U企业,批号分别为 190701、190101。
1.2.1.2长春西汀原料 长春西汀原料分别来源于A企业、B企业、D企业、G企业、I企业、J企业、K企业、M企业、N企业、O企业、P企业、Q企业、R企业、S企业、T企业。
1.2.1.3辅料 L-酒石酸分别来源于B企业、J企业、P企业、Q企业;焦亚硫酸钠分别来源于 B企业、J企业、P企业、Q企业;山梨醇分别来源于B企业、J企业、Q企业;维生素C分别来源于 B企业、J企业、Q企业;甘露醇来源于J企业。
1.2.2对照品 ICP分析用多元素对照品溶液[Al、As、硼(B)、铍(Be)、钙(Ca)、Cd、钴(Co)、铬(Cr)、Cu、Fe、Hg、钾(K)、镁(Mg)、Mn、钼(Mo)、钠(Na)、Ni、Pb、锑(Sb)、硒(Se)、钛(Ti)、钒(V)、锌(Zn)](100 μg·mL-1,批号GNM-M25748-2013),钯(Pd)单元素对照品溶液(1 000 μg·mL-1,批号GSB 04-1743-2004),铋(Bi)、锗(Ge)、铟(In)、锂(Li)、铼(Re)、铑(Rh)、钪(Sc)、钇(Y)多元素对照溶液(100 μg·mL-1,批号GNM-M081395-2013),均购自国家有色金属及电子材料分析测试中心;硝酸(色谱纯,德国默克公司);水为高纯水。
2 方法与结果
2.1实验条件 射频功率:1 549 W;等离子气流量:14 L·min-1;辅助气流量:1.08 L·min-1;泵速:40 r·min-1;进样延迟时间:30 s;氧化物:CeO/Ce<0.02;双电荷:Ce++/Ce+<0.02;样品重复次数:3次;测量模式:动能歧视(KED)模式。
2.2溶液的制备
2.2.1多元素对照品溶液和Pd对照品溶液 多元素对照品溶液:精密量取ICP分析用多元素(质量浓度均为100 μg·mL-1)的对照品溶液(Al、As、B、Be、Ca、Cd、Co、Cr、Cu、Fe、Hg、K、Mg、Mn、Mo、Na、Ni、Pb、Sb、Se、Ti、V、Zn)适量,用50 mL·L-1硝酸溶液定量稀释,并制成含各元素质量浓度分别为1.0、2.0、5.0、10.0、15.0、20.0 ng·mL-1的溶液,作为多元素对照品溶液。Pd对照品溶液:精密量取的Pd单元素对照品溶液质量浓度为1 000 μg·mL-1的适量,用50 mL·L-1硝酸溶液定量稀释,制成含Pd元素质量浓度分别为1.0、2.0、5.0、10.0、15.0、20.0 ng·mL-1的溶液,作为对照品溶液。
2.2.2内标溶液 精密量取Bi、Ge、In、Li、Re、Rh、Sc、Y多元素对照品溶液适量,用50 mL·L-1硝酸稀释成质量浓度为20 ng·mL-1的溶液。选择其中的Bi、Ge、In元素作为本次实验的内标元素。
2.2.3供试品溶液及空白溶液 精密称取长春西汀原料药0.25 g,加硝酸5 mL,置于90 ℃电热板上,加热1 h,放冷,置于消解仪中消解,消解程序见表1。消解完毕后冷却至室温,转移至50 mL离心管中,用少量高纯水洗涤消解罐3次,合并洗液,用高纯水定容至50 mL,摇匀,以12 000 r·min-1离心10 min,经0.22 μm微孔滤膜过滤,即得长春西汀原料供试品溶液。同法制备空白溶液。
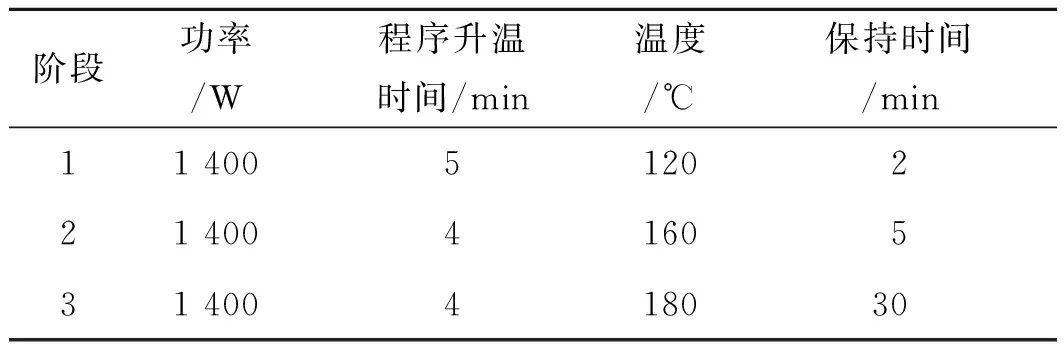
表1 微波消解程序
精密称取辅料0.1 g,置于10 mL量瓶中,加甲醇1 mL使其溶解,用50 mL·L-1的硝酸稀释至刻度,摇匀,作为长春西汀原料供试品溶液。同法制备空白溶液。
取长春西汀注射剂1支,置于10 mL量瓶中,用50 mL·L-1的硝酸稀释至刻度,摇匀,作为长春西汀注射剂供试品溶液。同法制备空白溶液。
2.3方法学考察
2.3.1线性关系考察 取2.2.1项下制备的多元素对照品溶液和Pd对照品溶液,按照2.1项下实验条件进行测定,以各元素测量值与内标测量值的比值(y)为纵坐标、相应检测质量浓度(x)为横坐标绘制标准曲线,得到各元素的线性方程和相关系数。结果见表2和表3。结果表明,各元素的质量浓度在1.0~20.0 ng·mL-1范围内与其测量值呈良好的线性关系。
2.3.2检测限 取空白溶液连续测定10次,按照2.1项下实验条件进行测定,记录各元素强度,计算空白溶液10次测定中各元素质量浓度的标准偏差,以3倍标准偏差为检测限。结果见表2和表3。
2.3.3精密度、重复性实验 取多元素对照品溶液(10 ng·mL-1)和Pd对照品溶液(10 ng·mL-1),连续进样6次,按照2.1项下实验条件进行测定,结果见表2和表3。结果符合规定,表明仪器精密度良好。取样品6份,按照2.2.3项下供试品溶液制备方法制得供试品溶液,按照2.1项下实验条件进样检测分析,结果符合规定,表明该方法重复性良好。
2.3.4加样回收率试验 分别称取长春西汀原料、辅料0.25 g,长春西汀制剂(批号191108)1支,分别精密加入多元素对照品溶液和Pd对照品溶液,按照2.2.3项下方法制得供试品溶液,按照2.1项下实验条件进样检测分析,计算得加样回收率为90.3%~101.6%。结果见表2和表3。

表2 15种元素线性方程、检测限和加样回收率(长春西汀注射剂及辅料)
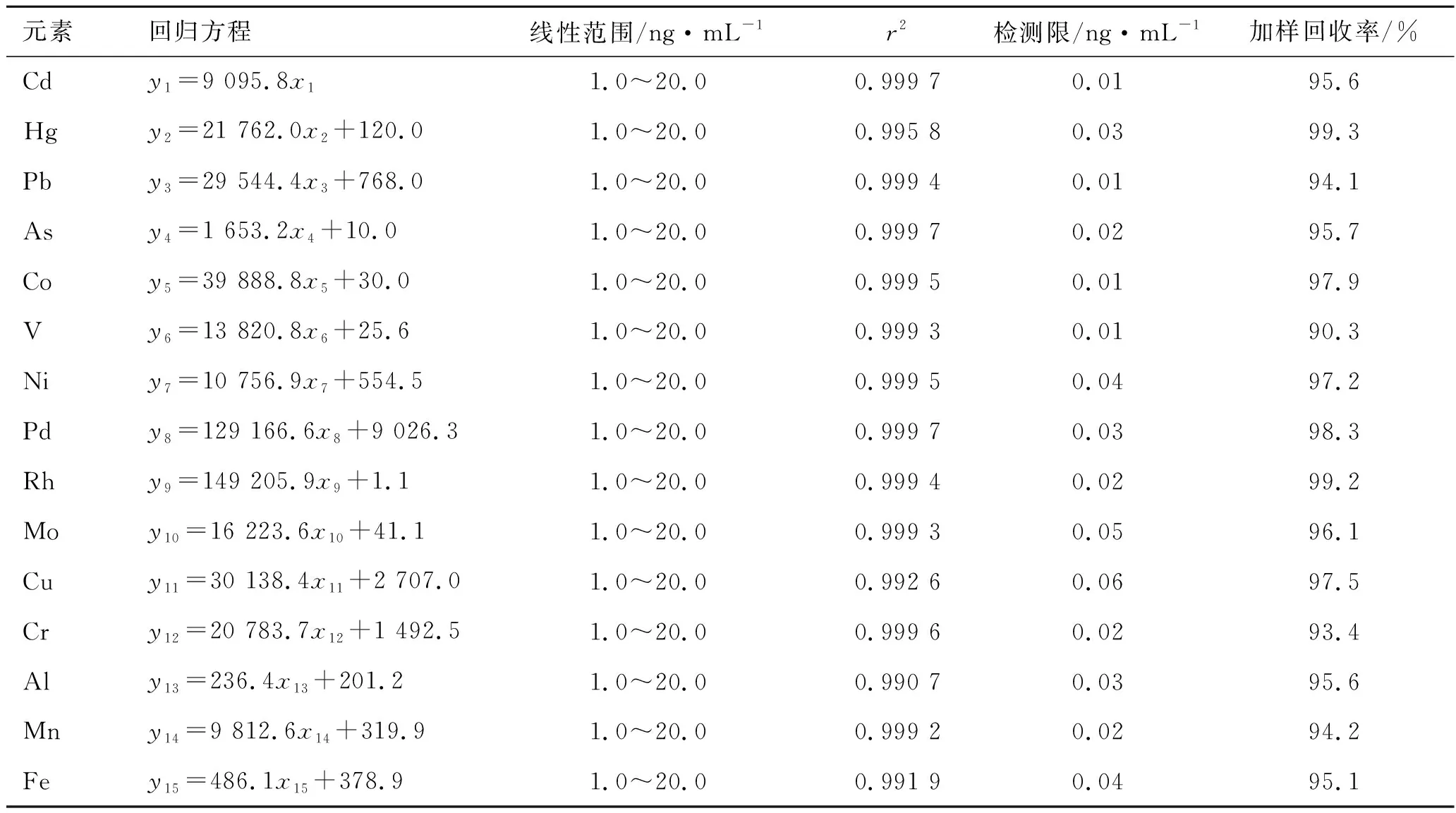
表3 各元素线性方程、检测限和加样回收率(长春西汀原料)
2.4样品含量测定及结果分析
2.4.1样品含量测定结果 分别精密称取各样品适量,按照2.2.3项下供试品溶液制备方法分别制备注射剂样品溶液,原料及辅料样品溶液,按照2.1项下实验条件,测定样品中Cd、Hg、Pb、As、Co、V、Ni、Pd、Rh、Mo、Cu、Cr、Al、Mn、Fe 15种元素的含量。结果见表4和表5。
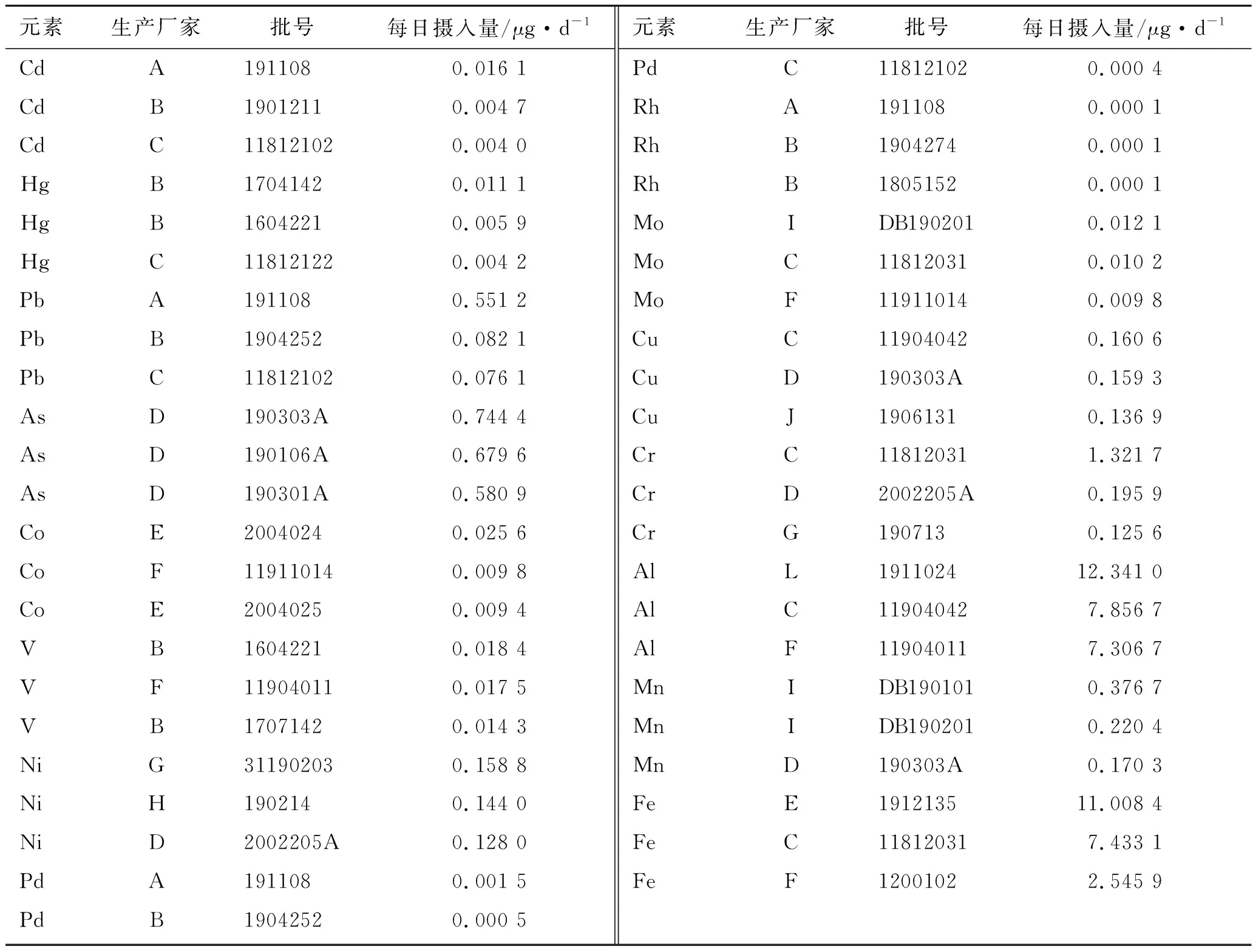
表4 长春西汀注射液剂中微量元素每日摄入量结果(排名前3)
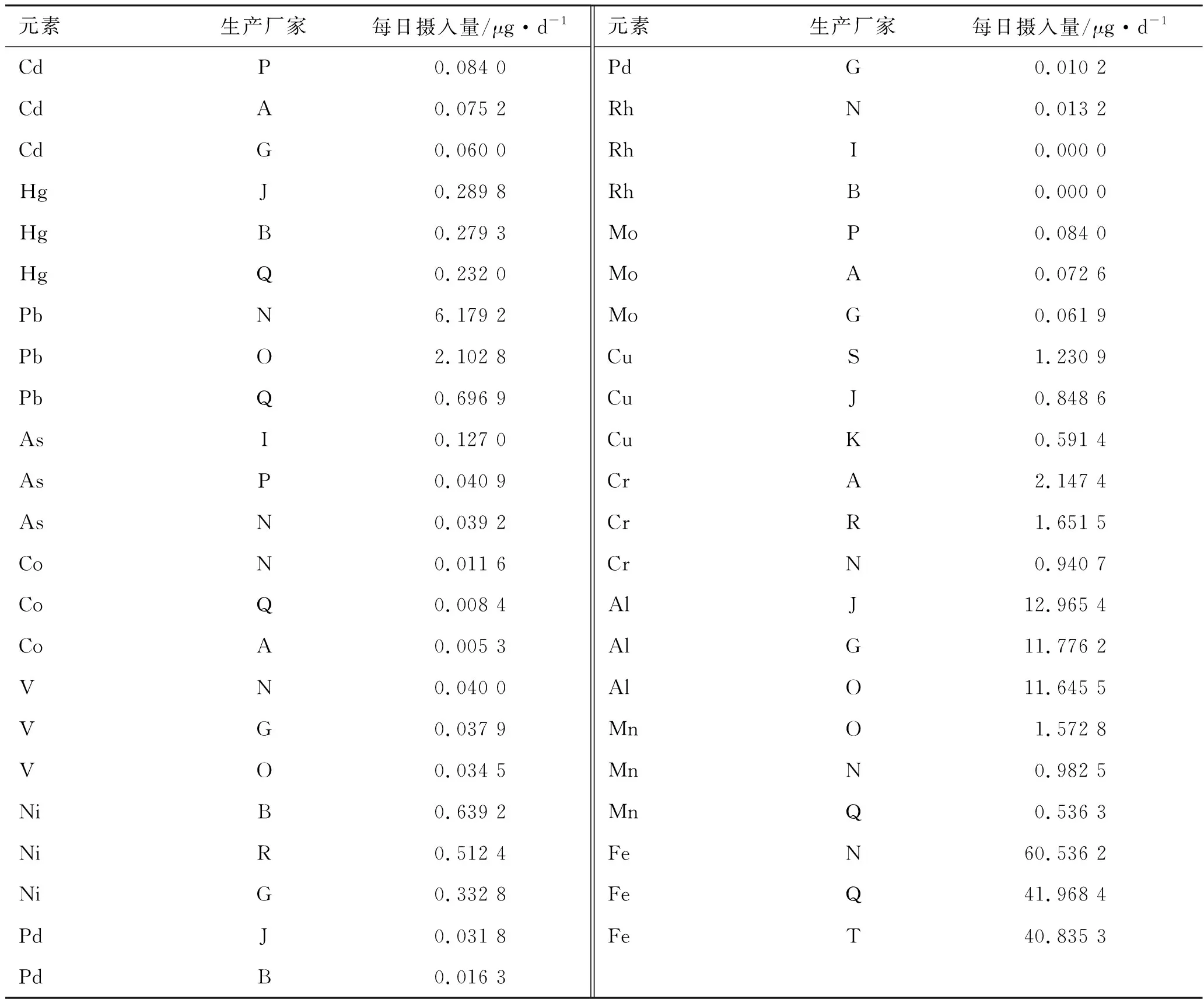
表5 长春西汀原料中微量元素每日摄入量结果(排名前3)
2.4.2注射剂微量元素测定结果分析 15种待测元素的国际人用药品注册技术协调会(ICH)毒性分类以及每日允许暴露量或允许含量见表6。根据药品说明书,按长春西汀注射剂最大日剂量为30 mg计算样品中各微量元素的每日摄入量,结果显示,所有批次样品中微量元素每日摄入量均低于“表6微量元素杂质及每日允许暴露量”,但是有部分生产企业样品中微量元素含量较高。

表6 部分微量元素杂质及每日允许暴露量或允许含量
根据每日摄入量排名前3的制剂样品中微量元素结果(见表4),A企业(批号191108)样品中Cd、Pb含量均较高,特别是Pb为每日允许暴露量的11%。考虑到长春西汀注射剂在临床存在的超剂量用药情况(3~4倍),而且Pb在人体中较容易蓄积不易排出,注射剂中Pb的风险需要进行考虑。
B企业的Cd、Hg、V含量均较高,特别是批号为1604221的样品,其Hg、V含量均较高。对药品生产企业工作人员进行访谈,该药品生产企业的长春西汀原料来源是企业自制的长春西汀原料和进口原料。2016年生产的样品其原料多为自制原料,2017年以后多采用进口原料。
D企业As含量较高,其中4批As的每日摄入量为0.48~0.74 μg,约为每日允许暴露量的8.0%~12.4%,考虑到该品种在临床存在的超剂量用药情况(3~4倍),制剂中As的风险需要进行考虑。
C企业的Cd、Hg、Pb、Cr的含量均较高。
此外,虽然该品种的原料在合成过程中用到了金属催化剂Pd,但是此次所有批次样品中Pd的残留远低于每日允许暴露量。此外重金属Rh和Mo均较低,均远低于每日允许暴露量。
2.4.3原料和辅料微量元素测定结果分析 对15个生产企业的长春西汀原料药进行ICP-MS测定,对其数据进行分析,表5是每日摄入量排名前3的长春西汀原料药中微量元素结果,其中N企业原料中的Pb为6.179 2 μg·d-1,超出了ICH规定的每日允许量(5 μg·d-1)的限度。
分别对4个生产企业的L-酒石酸、焦亚硫酸钠、山梨醇、维生素C、甘露醇5种辅料进行ICP-MS测定,15种微量元素测定结果均较低,均远低于每日允许暴露量。
由于企业提供的原料、辅料与抽样制剂中所用的原料、辅料不一致,其微量元素在原料、辅料和制剂中的相关性无法进行分析,但是部分原料样品中元素超出限度应引起重视。
2.5风险评估 药品中微量元素主要来源于原料、辅料、溶剂、生产设备、无机试剂、直接接触包装材料等。有些微量元素具有毒性,会影响药品的安全性,其中重金属可在人体器官内大量蓄积,导致人体代谢受到破坏,引发人体损伤[22]。所以药品监管机构对药品微量元素的控制越来越严格。ICH Q3D元素杂质指导原则是比较完整的法规。在ICH Q3D的基础上,各国药典对微量元素进行控制,美国药典(USP)收载了〈232〉元素杂质限度,《中国药典》2020年版四部通则9102中提到,无机杂质应按照Q3D的要求进行研究,并确定检查项目[23]。
ICH Q3D元素杂质指导原则是对潜在元素毒性的评估,根据元素毒性及在药品中出现的可能性,将元素分为3类,并建立了元素允许日暴露量。第1类包括As、Cd、Hg和Pb,这些元素具有明显的毒性,对人体有害,在药品生产中禁用或限制使用,因此必须对所有的潜在来源及摄入途径进行安全性风险评估。第2类根据其出现在药品的相对可能性,进一步分为2A和2B。2A包括Co、V和Ni,这些元素在自然界较丰富,出现在药品中的可能性高,需要对所有潜在来源和摄入途径进行风险评估。2B包括Pd、Rh、Au、TI、Pt、Ir和Os,这些元素在自然界存在较少,出现在药品中的可能性较低,只有在生产中刻意添加才需要风险评估。第3类包括Mo、Cu、Cr、Ba、Li、Sb、Sn,此类元素只有在药品生产过程中刻意加入,才需要进行风险评估。药品中包含的其他元素也会对身体产生损害,如Al导致肾功能损伤和肺纤维化,Mn和Zn导致肝功能损伤等。需要考虑的元素包括Al、Mn、Fe、B、Ca、K、Mg、Na、W和Zn。USP42-NF37通则〈232〉也规定了24种金属元素杂质的每日允许接触限值(PDE),元素种类和限度与ICH Q3D一致。
《中国药典》[24]2020年版四部通则0102注射剂中重金属及有害元素残留量项下仅规定了Pb、Cd、As、Hg和Cu 5种元素的限度,未规定其他有害元素的限度。《中国药典》[25]2015年版四部增加了除矿物药或含矿物药的制剂以外的中药中Al、Cr、Fe、Ba元素的测定。
通过查阅文献可知,长春西汀注射液的不良反应主要表现在皮肤、消化系统、呼吸系统、血液系统及造血器官、神经系统、内分泌系统等方面。可引起黄疸、严重腹泻、便秘、发热、昏迷、休克、喘息、胸闷、白细胞急速减少、头痛、头晕、下肢抽搐、致亚急性甲状腺炎等不良反应[26-27]。
Cd、As、Hg、Pb、Cu等元素在人体内蓄积时,Cd毒性主要造成对血液和神经系统的损害,As的毒性对中枢神经具有损害,可引起恶性、呕吐、抽搐、昏迷等,Hg的毒性主要破坏中枢神经;Pb的毒性可损害甲状腺功能,过多的摄入Cu元素可引起黄疸[28-30]。这些元素对人体的不良反应和长春西汀注射剂的不良反应有一定的重合性,又因为长春西汀注射剂是静脉滴注,直接进入血液,不经过肝脏的首过效应,很少量的元素进入机体都会引起不良反应。
长春西汀注射剂及其原料和辅料虽然检出多种微量元素,但未超出ICH Q3D元素杂质指南、《中国药典》四部2020年版及USP42-NF37通则〈232〉的相关规定。近年来微量元素的不良反应已经威胁到临床用药安全,其中有害元素对人体有很大的损害,引发相关疾病甚至导致死亡。我国对微量元素的规定不健全,多借鉴国外的标准。ICH Q3D元素杂质指南、《中国药典》2020年版四部通则0102及USP42-NF37通则〈232〉中的规定是对微量元素最低的要求,但是长春西汀注射剂临床上多用于病情严重的老年病人,注射剂在临床使用中具有高风险的特点,应该适当地提高微量元素的限度。
参考ICH Q3D元素杂质指南、《中国药典》2020年版四部通则0102及USP42-NF37通则〈232〉的相关要求,结合样品实际情况,拟定出12种微量元素的限度。
在所测的元素中,Cd、Hg、Pb、As、Co、Cr、V、Ni、Pd、Rh为有害元素。其中,Pb、As、Hg、Cd在《中国药典》2020年版四部中有严格的限度规定,而Co、Cr、V、Ni、Pd、Rh均未规定。随着人们生活水平以及认知水平的提高,应完善和增加其他有害元素的限量和限度制定。虽然所有制剂样品测定结果均符合规定,但是部分药品生产企业的制剂中Cd、Hg、Pb、V、As和Ni含量较高,应引起重视。
N企业的原料中的Pb为6.18 μg·d-1,超出了ICH规定的每日允许量(5 μg·d-1)的限度。因此,不合格的原料、辅料样品应引起重视。
3 小结
IPC-MS法操作简单,检测结果准确,可用于长春西汀注射剂及原料、辅料中15种微量元素的检测。参考ICH Q3D元素杂质指南、《中国药典》2020年版四部通则0102及USP42-NF37通则〈232〉的相关要求,本研究拟定了其中12种微量元素的限度,确保长春西汀注射剂临床用药的安全。

