中国抗癌协会乳腺癌诊治指南与规范(2021年版)
中国抗癌协会乳腺癌专业委员会
1 乳腺癌筛查指南…………………………………………………………………………………………954
2 常规乳腺X线检查和报告规范…………………………………………………………………………956
3 乳腺超声检查和报告规范………………………………………………………………………………960
4 常规乳腺MRI检查和报告规范…………………………………………………………………………964
5 影像引导下的乳腺组织学活检指南……………………………………………………………………967
6 乳腺癌病理学诊断报告规范……………………………………………………………………………968
7 浸润性乳腺癌保乳治疗临床指南………………………………………………………………………973
8 乳腺癌前哨淋巴结活检临床指南………………………………………………………………………978
9 乳腺癌全乳切除术后放疗临床指南……………………………………………………………………981
10 乳腺癌全身治疗指南…………………………………………………………………………………983
11 乳腺癌患者随访与康复共识…………………………………………………………………………999
12 乳房重建与整形专家共识…………………………………………………………………………1003
13 乳腺原位癌治疗指南………………………………………………………………………………1005
14 HER2阳性乳腺癌临床诊疗专家共识……………………………………………………………1008
15 乳腺癌局部和区域淋巴结复发诊治指南……………………………………………………………1012
16 乳腺癌骨转移的临床诊疗指南………………………………………………………………………1014
17 乳腺癌患者BRCA1/2基因检测与临床应用 …………………………………………………………1019
18 乳腺癌多基因精准检测和精准治疗指南……………………………………………………………1020
19 乳腺肿瘤整合医学的其他问题 …………………………………………………………………………1021
附 录………………………………………………………………………………………………………1027
1 乳腺癌筛查指南
1.1 乳腺癌筛查的定义、目的及分类
⑴ 肿瘤筛查,或称作普查,是针对无症状人群的一种防癌措施,而针对有症状人群的医学检查称为诊断。
⑵ 乳腺癌筛查是通过有效、简便、经济的乳腺检查措施,对无症状妇女开展筛查,以期早期发现、早期诊断及早期治疗。其最终目的是要降低人群乳腺癌的死亡率。
⑶ 筛查分为机会性筛查(opportunistic screening)和群体筛查(mass screening)。机会性筛查是指医疗保健机构为因各种情况前来就诊的适龄女性进行的乳腺筛查,或女性个体主动或自愿到提供乳腺筛查的医疗保健机构进行检查;群体筛查是社区或单位实体借助医疗保健机构的设备、技术和人员有组织地为适龄女性提供乳腺筛查服务。
1.2 女性参加乳腺癌筛查的起始和终止年龄
⑴ 虽然有些国外指南建议50岁以上,但大部分指南建议40岁作为乳腺癌筛查的起始年龄。中国女性乳腺癌的发病高峰年龄为45~54岁,比欧美国家要提前10年左右,因此本指南建议一般风险人群乳腺癌筛查的起始年龄为40岁。但对于乳腺癌高危人群可将筛查起始年龄提前到40岁以前。
⑵ 对于乳腺癌影像学筛查的终止年龄,大部分国外群体筛查都推荐把65~70岁作为筛查的上限。但是,老年人乳腺癌的发病率仍然较高,因此本指南认为老年人是否停止筛查需要考虑个人的身体健康状况、预期寿命及各种合并症情况。如果合并症多,预期寿命有限,则可适当减免乳腺癌筛查。因此对于70岁以上老年人可以考虑机会性筛查。
1.3 用于乳腺癌筛查的措施
1.3.1 乳腺X线检查
⑴ 乳腺X线检查对降低40岁以上女性乳腺癌死亡率的作用已经得到了国内外大多数学者的认可。
⑵ 建议每侧乳房常规应摄2个体位,即头足轴(craniocaudal,CC)位和内外侧斜(mediolateral oblique,MLO)位。
⑶ 乳腺X线影像应经过2名以上专业放射科医师独立阅片。
⑷ 乳腺X线筛查对50岁以上亚洲妇女准确性高,但对40岁以下及致密乳腺诊断的准确性欠佳。不建议对40岁以下、无明确乳腺癌高危因素或临床体检未发现异常的女性进行乳腺X线检查。
⑸ 常规乳腺X线检查的射线剂量低,不会危害女性健康,但正常女性无需短期内反复进行乳腺X线检查。
1.3.2 乳腺超声检查
目前已经有较多的证据提示在乳腺X线检查基础上联合乳腺超声检查较之单独应用乳腺X线检查有更高的筛查敏感度,尤其是针对乳腺X线筛查提示致密型乳腺(c型或d型),因此乳腺超声检查可推荐作为乳腺X线筛查的有效补充。但在人群筛查中,增加超声检查显然会增加筛查的成本,其成本效益也相应减弱。此外,乳腺超声检查单独作为筛查措施的有效性尚未得到充分的证据证实。
1.3.3 乳腺临床体检
目前尚无证据显示,乳腺临床体检单独作为乳腺癌筛查的方法可以提高乳腺癌早期诊断率和降低死亡率。但在经济欠发达、设备条件有限及女性对疾病认知度较不充分的地区仍可以作为一种选择。
1.3.4 乳腺自我检查
⑴ 乳腺自我检查不能提高乳腺癌早期诊断的检出率和降低死亡率。
⑵ 由于可以提高女性的防癌意识,故仍鼓励基层医务工作者向女性传授每月1次乳腺自我检查的方法,建议绝经前妇女选择月经来潮后7~14 d进行。
1.3.5 乳腺磁共振成像(magnetic resonance imaging,MRI)检查
⑴ MRI检查可作为乳腺X线检查、乳腺临床体检或乳腺超声检查发现的疑似病例的补充检查措施。
⑵ 可与乳腺X线联合用于BRCA1/2基因突变携带者的乳腺癌筛查。
1.3.6 其他检查
目前的证据不支持近红外线扫描、核素扫描、导管灌洗及血氧检测等检查作为有效的乳腺癌筛查方法。
1.4 一般风险女性乳腺癌筛查指南
乳腺癌一般风险女性即除了乳腺癌高危人群(定义见1.5.1节)以外的所有女性。
1.4.1 20~39岁
不推荐对该年龄段人群进行乳腺筛查。
1.4.2 40~70岁
⑴ 适合机会性筛查和群体筛查。
⑵ 每1~2年进行1次乳腺X线检查,对致密型乳腺(乳腺X线检查提示腺体为c型或d型)推荐与B超检查联合。
1.4.3 70岁以上
⑴ 适合机会性筛查。
⑵ 每1~2年进行1次乳腺X线检查。
1.5 乳腺癌高危人群筛查意见
建议对乳腺癌高危人群提前进行筛查(小于40岁),筛查频度推荐每年1次,筛查手段除了乳腺X线检查外,还可采用MRI等影像学手段。
1.5.1 罹患乳腺癌高危人群的定义
存在下列情况之一者被认为是罹患乳腺癌高危人群:
⑴ 有明显的乳腺癌遗传倾向者,主要判断内容如下:
①一级亲属有乳腺癌或卵巢癌史;② 二级亲属50岁前,患乳腺癌2人及以上;③二级亲属50岁前,患卵巢癌2人及以上;④ 至少1位一级亲属携带已知BRCA1/2基因致病性遗传突变,或自身携带BRCA1/2基因致病性遗传突变(需要行BRCA遗传检测的对象见附录Ⅰ)。
⑵ 既往有乳腺导管或小叶不典型增生或小叶原位癌(lobular carcinomain situ,LCIS)的患者。
⑶ 既往30岁前接受过胸部放疗。
⑷ 根据评估对象的年龄、种族、初潮年龄、初产年龄、个人乳腺疾病史、乳腺癌家族史和乳腺活检次数等多个风险因子,利用Gail模型进行罹患乳腺癌风险评估。如果受试者5年内发病风险≥1.67%,则被认为是高风险个体。
注:一级亲属指母亲、女儿及姐妹;二级亲属指姑、姨、祖母和外祖母。
1.5.2 乳腺癌高危人群的筛查推荐策略与管理
⑴ 推荐起始年龄更早(<40岁)开展乳腺筛查。
⑵ 每年1次乳腺X线检查。
⑶ 每6~12个月1次乳腺超声检查。
⑷ 每6~12个月1次乳腺体检。
⑸ 必要时联合乳腺增强MRI。
2 常规乳腺X线检查和报告规范
2.1 乳腺X线检查技术规范
2.1.1 投照前准备工作
医技人员应耐心地向被检查者说明拍片过程以及拍片时夹板压迫乳房给被检查者带来的不适,令其放松,从而使受检者理解并予以配合。
2.1.2 常规投照体位
正确摆位是获得高质量乳腺X线片的基础。乳腺X线摄片的常规投照体位为双侧MLO位及CC位。一张好的MLO位片显示如下:乳房被推向前上,乳腺实质充分展开,胸大肌可见,较松弛,下缘达乳头水平,乳头在切线位,部分腹壁包括在片中,但与下部乳腺分开,绝大部分乳腺实质显示在片中。一张好的CC位片显示如下:乳房在片子的中央,乳头在切线位,小部分胸大肌可见,内侧乳腺组织充分显示,外侧乳腺组织可能不包括在片中。
2.1.3 补充投照体位和投照技术
对于MLO位及CC位显示不良或未包全的乳腺实质,可以根据病灶位置的不同选择以下体位予以补充:外内侧(lateromedial,LM)位、内外侧(mediolateral,ML)位、内侧头足轴(medial craniocaudal,MCC)位、外侧头足轴(lateral craniocaudal,LCC)位、尾叶(CLEO)位及乳沟位。为了进一步评价在以上常规摄影中显示出的异常改变,可采用一些特殊摄影技术。其可在任何投照位上进行,包括局部加压摄影、放大摄影或局部加压放大摄影,目的是使病灶得以更好地显示而明确病变性质。
2.2 诊断报告规范
参照美国放射学会的乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)分类标准,描述乳腺内肿块、钙化等异常表现的X线征象。
2.2.1 肿块
在两个相互垂直(或近似垂直)的投照位置上均能见到的有一定轮廓的占位性病变,仅在1个投照位置上见到,在其被确定具有三维占位特征之前,应描述为“不对称”。X线所见肿块并不一定与临床所触诊的肿块完全一致。X线图像上所发现的肿块,临床不一定能够触及(因病灶太小、质软或腺体重叠形成伪影);临床所触及的肿块,X线图像上亦可能因为患者乳腺实质丰富而未能显示。部分患者肿块周边伴有浸润和水肿,触诊常比X线图像所显示的肿块范围要大。肿块的描述包括边缘、形态和密度3个方面,其中肿块的边缘征象对判断肿块的性质最为重要。
2.2.1.1 肿块边缘描述
⑴ 清楚:超过75%的肿块边界与周围正常组织分界清晰、锐利。
⑵ 遮蔽:超过25%的肿块边界被邻近的正常组织遮盖而无法对其作出进一步判断。
⑶ 小分叶:肿块边缘呈小波浪状改变。
⑷ 模糊:边缘与周边组织分界不清,但并非被周边正常组织遮盖所致。
⑸ 星芒状:从肿块边缘发出放射状线影。
2.2.1.2 肿块形态描述
肿块形态描述包括圆形、卵圆形和不规则形。
2.2.1.3 肿块密度描述
以肿块与其周围相同体积的乳腺组织相比分为高、等、低(不含脂肪)和含脂肪密度4种。大多数乳腺癌呈高密度或等密度,极少数可呈低密度。
2.2.2 钙化
对钙化病变的描述应从类型和分布两方面进行。
2.2.2.1 钙化类型
可分为典型的良性钙化和可疑钙化。良性钙化可不描述,但当这些钙化可能会引起临床医师误解时,这些良性钙化需要描述。
⑴ 典型的良性钙化有以下表现:
①皮肤钙化:粗大、典型者呈中心透亮改变。② 血管钙化:管状或轨道状。③粗糙或爆米花样钙化:直径>2.0 mm,多为退变的纤维腺瘤。④ 粗棒状钙化:连续呈棒杆状,偶可呈分支状,直径通常>0.5 mm,沿导管分布,聚向乳头,常为双侧乳腺分布,多见于分泌性病变,常见于60岁以上的妇女。⑤ 圆形(直径≥0.5 mm)和点状钙化(直径<0.5 mm)。⑥ 环形钙化:壁厚<1.0 mm,常见于脂肪坏死或囊肿;壁厚≥1.0 mm,可见于油脂性囊肿或单纯性囊肿。⑦ 钙乳样钙化:为囊肿内钙化,在CC位表现不明显,为绒毛状或不定形状,在90°侧位上边界明确,根据囊肿形态的不同而表现为半月形、新月形、曲线形或线形,形态随体位而发生变化是这类钙化的特点。⑧ 缝线钙化:由于钙质沉积在缝线材料上所致,尤其在放疗后常见,典型者为线形或管形,绳结样改变常见。⑨ 营养不良性钙化:常出现于放疗后、外伤后及自体脂肪移植整形术后的乳腺,钙化形态不规则,大多数钙化大于0.5 mm,呈中空状改变。
⑵ 可疑钙化有以下表现:
①不定形钙化:小而模糊,双侧、弥漫分布多为良性表现,如呈段样、线样及成簇分布时宜进一步活检,其恶性的阳性预测值(positive predictive value,PPV)约为20%,BI-RADS分类应为4B类。② 粗糙不均质钙化:钙化多介于0.5~1.0 mm之间,比营养不良性钙化小些,多有融合,形态不规则可能为恶性表现,也可能出现在纤维腺瘤、外伤后及纤维化的乳腺内,大量、双侧成簇的粗糙不均质钙化,也有可能是良性的。单处集群分布有恶性的可能,其恶性的PPV约为15%,BI-RADS分类应为4B类。③细小多形性钙化:比不定形钙化更可疑,缺乏细的线样颗粒,大小形态不一,直径小于0.5 mm,其恶性的PPV约为29%,BI-RADS分类应为4B类。④ 细线样或细线样分支状钙化:表现为细而不规则线样钙化,直径小于0.5 mm,常不连续,有时也可见分支状,提示钙化是由于被乳腺癌侵犯在导管腔内形成,其恶性的PPV约为70%,BI-RADS分类应为4C类。
2.2.2.2 钙化分布
⑴ 散在分布:钙化随意分散在整个乳腺中。双侧、散在分布的点样钙化和不定形钙化多为良性钙化。
⑵ 区域状分布:指较大范围内(>2 cm3)分布的钙化,与导管走行不一致,常超过1个象限的范围,这种钙化分布的性质需结合钙化类型综合考虑。
⑶ 集群分布:指至少有5枚钙化占据在1个较小的空间内(<2 cm3),良性、可疑钙化都可以有这样的表现。
⑷ 线样分布:钙化排列成线形,可见分支点,提示来源于同一个导管,多为可疑钙化。
⑸ 段样分布:常提示病变来源于同一个导管及其分支,也可能出现在1叶或1个段叶上的多灶性癌中。段样分布的钙化,恶性的可能性会增加,比如点状和不定形钙化。尽管良性分泌性病变也会有段样分布的钙化,但如果钙化的形态区别于特征性良性病变时,首先考虑其为可疑钙化。
2.2.3 结构扭曲
结构扭曲是指正常结构被扭曲但无明确的肿块可见,包括从一点发出的放射状影和局灶性收缩,或在实质的边缘扭曲。结构扭曲也可以是一种伴随征象,可为肿块、不对称致密或钙化的伴随征象。如果没有局部的手术和外伤史,结构扭曲可能是恶性或放射状瘢痕的征象,应提请临床考虑活检。
2.2.4 对称性征象
2.2.4.1 不对称
仅在一个投照位置上可见的纤维腺体组织,80%可能是伪影或正常组织的重叠所致。
2.2.4.2 球形不对称
较大范围腺体量的不对称,至少达1个象限,不伴有其他征象,多为正常变异。但当与临床触及的异常相吻合时,则可能有意义。
2.2.4.3 局灶性不对称
两个投照位置均显示且表现相仿,但缺少真性肿块特有的外凸边缘改变,常为内凹,较球形不对称范围小。它可能代表的是1个正常的腺体岛(尤其当其中含有脂肪时)。但在缺乏特征性的良性征象时,往往需要进一步检查,由此可能会显示1个真性肿块或明显的结构扭曲改变。
2.2.4.4 进展性不对称
新发、增大的或比以前更明显的局灶性不对称。约15%的进展性不对称被证实是恶性的,其恶性的PPV约为13%。进展性不对称,除非有特征性的良性改变,都需要进一步的影像学评估和活检。
2.2.5 乳腺内淋巴结
乳腺内淋巴结典型表现为肾形,肉眼可见淋巴结门脂肪所致的透亮切迹,常小于1 cm。当淋巴结较大,但其大部分为脂肪替代时,仍为良性改变。可以是多个,也可能是1个淋巴结由于明显的脂肪替代看上去像多个圆形结节影。对于乳腺外上部的特征性改变可以作出正确诊断。偶尔也可出现在其他区域,多与静脉伴行。
2.2.6 皮肤病变
皮肤病变投照在乳腺组织内,尤其是两个投照体位都有显示的时候,应该在评估报告中提及。摄片的技术员应该在皮肤病变处放一个不透X线的标志。
2.2.7 单侧导管扩张
管状或分支样结构可能代表扩张或增粗的导管。虽然少见,但即使不同时伴有其他可疑的临床或影像征象,其恶性的PPV也可达10%[常见于不含钙化的导管原位癌(ductal carcinomain situ,DCIS)]。
2.2.8 合并征象
合并征象包括皮肤凹陷、乳头凹陷回缩、皮肤增厚、小梁结构增粗、腋窝淋巴结肿大、结构扭曲和钙化等。
2.3 病灶的定位
一个明确的病灶必然是三维立体地存在于乳腺内的,如在两个投照位上均被看到即可以证实,尤其在两个相互垂直的投照位均显示时则更确定。需要明确4点:
①哪一侧乳腺:左侧、右侧或双侧。② 部位:根据钟面和象限两者结合定位。象限定位包括外上象限、外下象限、内上象限和内下象限4个区域。12点钟为正上方,6点钟为正下方,3点钟或9点钟可以是外侧或内侧(根据左、右侧乳房的不同)。另外,乳晕下区、中央区和尾叶区不要求钟面定位。③深度:根据与胸壁的平行分成前1/3、中1/3、后1/3。乳晕下区、中央区和尾叶区不要求深度定位。④ 与乳头的距离。
2.4 乳腺X线报告的组成
应包括病史、检查目的、投照体位、乳腺分型、任何重要的影像学所见及与既往检查片对比的结果,最后是评估类别和建议。报告措辞应当简洁,使用术语词典中的标准词汇。应清楚地描述任何有意义的发现,如有前片,应对比有无变化,最有意义的是新发现的病灶。如果同时进行过超声和乳腺MRI检查,在报告中应予提及。乳腺X线诊断报告范本见附录Ⅱ。
2.4.1 检查目的
对本次检查作一个简单的说明,如对无症状妇女的筛查、筛查后的回召检查、评估临床发现或随访等。
2.4.2 乳腺分型
乳腺分型是指对整个乳腺构成的简明描述,有助于判断X线诊断的可靠程度,即病灶隐藏在正常乳腺组织中的可能性。对X线致密型乳腺,X线片对小病灶的检出效能随着乳腺腺体致密程度的上升而下降。可分为4型:
①a型:脂肪型,乳腺组织几乎完全被脂肪组织所替代;② b型:乳腺组织内有散在的纤维腺体;③c型:乳腺组织呈密度不均匀增高,很有可能遮蔽小肿块;④ d型:致密型,乳腺组织非常致密,会降低乳腺X线检查的敏感性。
2.4.3 清晰地描述任何重要的发现
⑴ 肿块:大小,形态(形状、边缘),密度,伴随的钙化,其他伴随征象,定位。
⑵ 钙化:形态(典型良性或可疑钙化),分布,伴随征象,定位。
⑶ 结构扭曲:伴随钙化,其他伴随征象,定位。
⑷ 不对称征象:伴随钙化,其他伴随征象,定位。
⑸ 乳内淋巴结:定位。
⑹ 皮肤病变:定位。
⑺ 单个扩张的导管:定位。
2.4.4 与前片比较
本次检查结果需与前片比较。
2.4.5 评估分类
应对每个病灶进行完整的评估和分类,常用的是BI-RADS分类法。
2.4.5.1 评估是不完全的
BI-RADS 0类:需要召回(recall)补充其他影像学检查,进一步评估或与前片比较。常在普查情况下应用,作为最终诊断仅用于需要对比前片的情况。推荐的其他影像学检查方法包括局部加压摄影、放大摄影、特殊投照体位和超声等。在中国,一些妇女乳房内脂肪较少,实质丰富,乳腺组织缺乏自然对比,可采用其他影像学方法(如超声、乳腺X线断层摄影、对比增强乳腺X线摄影及MRI等)进一步检查,也可将其归为0类。
2.4.5.2 评估是完全的—最后分类
⑴ BI-RADS 1类:阴性,无异常发现。乳腺是对称的,无肿块、结构扭曲,无可疑钙化。恶性的可能性为0%。
⑵ BI-RADS 2类:也是“正常”的评价结果,但有良性改变,如钙化的纤维腺瘤、皮肤钙化、金属异物(活检或术后的金属夹)及含脂肪的病变(积乳囊肿、脂肪瘤及混合密度的错构瘤)等。乳腺内淋巴结、血管钙化、植入体及符合手术部位的结构扭曲等亦归为此类。总体而言,并无恶性的X线征象。恶性的可能性为0%。
⑶ BI-RADS 3类:只用于几乎可以确定的良性病变。有很高的良性可能性,放射科医师通常期望此病变在短期(小于1年,一般为6个月)随访中稳定或缩小以证实先前的判断。这一类病变的恶性可能性为0%~2%。包括不可触及的边缘清楚的无钙化的肿块、局灶性不对称、孤立集群分布的点状钙化。对这3类病变的常规处理程序为:首先X线摄片短期随访(一般为6个月),6个月后再常规随访,此后再12个月乃至2年以上,如连续2~3年保持稳定则可将原先的3类判读(可能良性)改为2类判读(良性)。如果短期随访后病灶缩小或消失,可以直接改判为2类或1类,随后常规随访。
⑷ BI-RADS 4类:广泛用于判定绝大部分需要介入性诊断的影像学发现。其恶性的可能性为2%~95%。可再细分为:
①4A类:其恶性的可能性为2%~10%,包括一组介入手段干预但恶性可能性较小的病变。活检或细胞学检查为良性的结果比较可靠,可以常规随访或6个月后随访,此类病变包括一些可触及的、部分边缘清楚的实性肿块,如超声提示的纤维腺瘤、可扪及的复杂囊肿或可疑脓肿。② 4B类:其恶性的可能性为10%~50%。需要对病理学检查结果与影像学表现严格对照,良性病变的判定取决于影像学与病理学检查的一致性,如果病理学检查结果与影像学表现符合,且病理学检查结果为具有排他性的典型良性病变,如纤维腺瘤、脂肪坏死及肉芽肿性病变等,则可进行观察;如穿刺病理学诊断结果为乳头状瘤、不典型增生等,则进一步的切除活检就是必需的。③4C类:更进一步怀疑为恶性,但还未达到5类那样典型的一组病变,其恶性的可能性为50%~95%,此类中包括边界不清、形态不规则的实性肿块或新出现的微细线样钙化,此类病变往往是恶性的,对于病理学检查结果为良性的病例,需要与病理科协商,作进一步的分析。
⑸ BI-RADS 5类:高度怀疑恶性(几乎肯定的恶性),临床应采取适当措施。这一类病变的恶性可能性≥95%。常为形态不规则星芒状边缘的高密度肿块、段样和线样分布的细小线样和分支状钙化、不规则星芒状肿块伴多形性钙化。
⑹ BI-RADS 6类:已活检证实为恶性,应采取积极的治疗措施。用来描述活检已证实为恶性的影像评估,主要是评价先前活检后的影像学改变,或监测术前治疗的影像学改变。根据BIRADS的描述,BI-RADS 6类不适合用来对恶性病灶完全切除(肿块切除术)后的随访。手术后没有肿瘤残留不需要再切的病例,其最终的评估应该是BI-RADS 3类(可能良性)或2类(良性);与活检不在一个区域的可疑恶性病变应单独评估。其最终的评估应该是BI-RADS 4类(可疑恶性)或5类(高度提示恶性),可建议活检或手术干预。
注:本规范的制定,以美国放射学会的BI-RADS第5版作为参考。
3 乳腺超声检查和报告规范
3.1 超声检查的仪器
常规检查采用彩色多普勒超声仪的实时线阵高频探头,探头频率为7.5~10.0 MHz,有条件时可用到10.0~15.0 MHz或更高,但对于乳腺组织过厚或有假体时,可适当降低探头频率。超声探头和频率的选择原则是在保证足够探查深度的前提下,尽量提高频率,从而保证超声图像的分辨率。
3.2 超声检查的方法
检查前一般无需特殊准备,有乳头溢液者最好不要将液体挤出。根据需要,患者取仰卧或侧卧位。如果患者自觉特殊体位有肿块的感觉,可以让患者采取特殊体位进行超声检查,如直立或坐位等。检查时患侧手臂尽量上抬外展,充分暴露乳房及腋下,探头直接放在乳房表面,对乳头、乳晕及乳房外上、外下、内上、内下4个象限进行全面扫查,次序可由操作者自行确定,扫查方式包括放射状、反放射状、旋转式和平行移动等,可根据检查者的习惯选择。注意检查范围全面,不要漏检,同时应检查腋下淋巴结情况。必要时可检查锁骨上下及颈部淋巴结。
3.3 超声检查的程序
3.3.1 基本要求
检查时应先对乳腺及周围组织进行全面的常规二维超声检查,然后对发现病灶的区域进行重点的二维超声检查,检查内容包括:病灶的位置、大小或范围的测定,边界、边缘、形状、内部及后方回声、钙化和周围组织包括皮肤,胸肌及韧带等结构的变化等。病灶的大小或范围的测量应该选取其最大平面,测量两条互相垂直的最长径线,然后在与此切面垂直的最大平面上测量第三个径线。测量时,游标应该放置在病灶边缘的外侧,病灶边界清晰时按照边界测量,肿块边界模糊时,应该根据肿块的最大边缘部分或周边的声晕测量。在二维声像图的基础上应辅助彩色及能量多普勒超声检查,观察血流的走向及分布并在多普勒频谱上测量各种血流参数。在具备条件的情况下,可采用三维重建成像、弹性成像和造影增强对比成像等技术,观察病灶和乳腺组织的硬度变化、空间关系和血管分布,了解病灶和组织的质地变化及血流灌注情况,帮助完善诊断。
3.3.2 图像的存储
图像的存储内容应该包括:患者的姓名、年龄、性别和诊疗记录号码(门诊号或住院号、超声登记号),设备名称和检查条件标识。体位标记包括:乳腺的方位(左或右),病灶的位置,包括与乳头中央的距离、钟面形式的标记及显示病灶时的探头切面标识。病灶图像存储至少应记录2个以上有特征的不同方向切面,应尽量完整地存储记录病灶各种超声特点的声像图,如钙化、血流、能量图、多普勒频谱、弹性成像、三维重建及造影增强对比成像等,必要时可存储动态图像。对于超声检查没有异常的乳腺,可以仅存储各象限的放射状切面的声像图以证明对患者做过全面的超声检查。
3.3.3 报告书写
以上各项检查结果及所测参数均应在超声报告中加以详细描述,最后综合各种检查结果得出超声的诊断结论,包括乳腺正常或异常的判断,如有异常的局灶性病变应明确病灶的物理性质、对应的诊断分类(参照BI-RADS)及相应的处理建议(在分类中默认),并尽可能作出合理的病理学性质判断。
3.4 超声诊断报告的规范
为了使超声报告既个体化又标准化,应首先对超声报告中的描述性语言进行统一定义(附录Ⅲ)。
3.4.1 乳腺超声的回声模式
乳腺声像图表现存在个体差异,因此,通常将自身皮下脂肪组织回声定义为等回声,没有回声定义为无回声,有回声的与脂肪组织回声对比,按照回声的强弱分别定义为弱回声、低回声、中等回声、高回声及强回声。
3.4.2 正常的乳腺组织声像图表现
正常乳腺的声像图由浅入深依次为:
①皮肤:呈带状高回声,厚2~3 mm,边缘光滑整齐。② 浅筋膜和皮下脂肪:浅筋膜呈线状高回声,脂肪组织呈等回声,由条索状高回声分隔,边界欠清。③乳腺腺体:因人而异,厚薄不一,老年人可萎缩至仅3 mm,腺体呈等回声带夹杂有低回声,排列较整齐。腺体与皮肤间有三角形的高回声韧带,称为库柏(Cooper)韧带,其后方回声可衰减。④ 深筋膜:筋膜呈线状高回声,光滑整齐,筋膜间脂肪呈等回声。⑤ 胸肌及肋骨:胸肌为梭形的均质低回声区,肋骨为弧形强回声,其后方衰减为声影。整体的乳腺超声表现有均匀和不均匀之分:均匀的乳腺在声像图上表现为连续一致的脂肪、韧带、纤维及腺体组织回声,从乳头、乳晕至周边组织腺体逐渐变薄;不均匀的乳腺可以表现为局部性或弥漫性,声像图表现为腺体不规律的增厚、回声的增强或减弱等。
3.4.3 异常的乳腺组织声像图表现
乳腺的异常应从不同的切面上全面观察以排除正常的组织及结构,如脂肪组织和肋骨等,局灶性的病变声像图表现需按照以下征象描述。
3.4.3.1 肿块
形状(声像图上病灶的外形)分为:
⑴ 规则:包括圆形、椭圆形。
⑵ 不规则:除规则以外的。
纵横比(平行于皮肤表面的病灶最大径线和与之垂直的最大径线的比值)分为:
⑴ 垂直:纵横比小于2∶1,甚至接近1。
⑵ 平行:纵横比大于2∶1。
边界(病灶与周围组织交界的部分在声像图上的表现)分为:
⑴ 清晰:病灶与周围组织间有明确的界限,包括包膜、声晕,定义为边界清晰。
⑵ 不清晰:如病灶与周围组织间没有明确的界限则定义为不清晰,同一病灶可部分边界清晰,部分边界不清晰。
边缘(病灶与周围组织交界线的走向和形态在声像图上的表现)分为:
⑴ 光整:病灶的边缘光滑整齐,可以有2~3个大的光滑波浪。
⑵ 不光整:病灶的边缘不整齐,可简单地分为3种模式:
①小叶:病灶的边缘有较多短小的弧形波纹,呈扇贝状。② 成角:病灶的边缘部分有尖锐的转角,通常形成锐角,类似蟹足,故亦可称蟹足状。③毛刺:病灶的边缘有锐利的放射状线条样表现。同一病灶的边缘可并存上述多种表现。
回声模式(病灶的内部回声,按照前述乳腺超声回声模式定义,内部回声可以是单一的,也可以是多种回声复合的)分布的表现可以分为:
⑴ 均匀:病灶内部回声为分布均匀的单一回声,分为无回声、弱回声、低回声、等回声、高回声及强回声。
⑵ 不均匀:病灶内部回声为分布不均匀单一回声或几种混合的回声。
病灶后方回声(对比周围同等深度的正常组织出现的声像图特征,代表病灶在声学传导方面的特性)分为:
⑴ 增强:病灶后方回声高于周围同等深度的正常组织,表现为病灶后方回声增强。
⑵ 不变:病灶后方回声与周围同等深度的正常组织相同,表现为病灶后方回声无增强或无衰减。
⑶ 衰减:病灶后方回声弱于周围同等深度的正常组织,表现为病灶后方为低回声或无回声,后者即声影。
⑷ 混合:部分病灶后方回声有不止一种的表现,表明肿块内部成分不均匀。
3.4.3.2 周围组织部分病灶对周围组织的影响在声像图上的表现:
⑴ 皮肤及皮下脂肪组织层水肿增厚:局部或弥漫的皮肤及皮下脂肪组织的增厚,回声增强,皮下脂肪组织层内可见条带状的扩张淋巴管回声。
⑵ 皮肤凹陷、高低不平:皮肤表面高低不平,出现局限性或多处皮肤表面凹陷。⑶ 病灶周围组织水肿:病灶周围组织增厚,回声增强。
⑷ 结构扭曲:病灶引起周围正常解剖层次结构的扭曲或连续性中断,包括病灶处皮肤、浅筋膜层、腺体层、深筋膜层及胸肌层的改变。
⑸ Cooper韧带改变:韧带牵拉或增厚。
⑹ 导管改变:腺体内导管内径的异常扩张或导管走向的扭曲。
3.4.3.3 钙化
乳腺腺体或病灶内显示的强回声谓之钙化,一般认为>0.5 mm的钙化属于粗大钙化,大钙化可能会伴有声影,<0.5 mm的钙化属于小钙化。乳腺组织中的孤立或散在的钙化因为腺体内纤维结缔组织的关系有时难以鉴别。钙化的形态可呈泥沙状、颗粒状、短棒状或弧形等,钙化的分布可为单一、成堆、成簇、散在或弥漫等。
3.4.3.4 血管评估
⑴ 病变区域没有明显的血流信号。
⑵ 病变区域与周围腺体内血流信号相似。
⑶ 病变区域有明显增强的血流信号。
3.4.4 彩色超声检查
彩色超声用于腺体组织及病灶内血管的检查。病灶的血管分布是一项特征性的分析指标,通常有别于对侧的相同区域或同侧乳房的正常区域。彩色及能量多普勒超声检查会受到各种因素的影响,如血流速度、仪器灵敏度设定等,探头施压可以使小血管特别是静脉闭塞,因此检查时应避免用力过度,通常囊肿内无血流,如加压会出现血流伪像。良性病灶内血流一般较少,恶性病灶内部及周边的血流会明显增多,且走向无规律,部分病灶有从周边穿入的特征性血流。除了对血流形态学的观察,还应对血流的各项多普勒参数进行测定。诊断意义除阻力指数(resistance index,RI)外其他的参数多存在争议,一般恶性病变的RI>0.70。
3.4.5 其他相关技术
可以根据检查的需要选择相关技术。
3.4.5.1 三维成像
乳腺病灶的三维超声最主要的作用不是对病灶的三维重建,而是对病灶冠状面的观察,此切面二维超声无法观测到。恶性病灶在冠状面上最突出的表现是类似于二维图像上病灶边缘出现“结构断裂”现象,酷似星星或太阳及周边的光芒,国内外不同学者称之为汇聚征或太阳征。
3.4.5.2 弹性成像
弹性超声成像是针对不同组织的弹性差别进行的检查,一般认为恶性肿瘤中的组织大部分硬度较高。由于目前各厂家仪器的不同设定,弹性成像未能形成统一的诊断标准。
弹性超声显示不同于二维超声,其反映的是组织硬度的变化,类似医师临床触诊的感觉,通过对比组织的预期变化推测组织成分的不同,从而帮助超声医师完成疾病的发现和诊断。剪切波技术是对组织中横波的检查,以彩色编码技术实时显示出组织弹性图。
3.4.5.3 造影增强对比成像
造影增强对比成像在乳腺疾病诊断中的应用受到探头频率、造影剂谐振及病灶血管生长等因素的影响,目前没有很成熟的标准。
3.5 乳腺超声评估分类
超声对病灶特征描述的专业术语要有统一的规范标准。超声描述的专业术语需要体现对病灶良恶性的判断和分类的影响,且对多个特征指标进行综合分析优于单个指标的判断。随着超声技术的发展,相应的专业术语内涵也将会有所改变。本指南分类标准参照2013年美国放射学会的BI-RADS,并结合中国的实际情况制定了以下分类标准。
3.5.1 评估是不完全的
BI-RADS 0类:需要其他影像学检查(如乳腺X线检查或MRI等)进一步评估。
在多数情况下,超声检查可对乳腺进行全面评估。当超声作为初次检查时,下列情况则需要进一步做其他检查:一种情况是超声检查乳腺内有明显的病灶而其超声特征又不足以作出评价,此时必须借助乳腺X线检查或MRI;另一种情况是临床有阳性体征,如触及肿块、浆液性溢液或乳头溢血、乳腺癌术后及放疗后瘢痕需要明确是否复发等,超声检查无异常发现,也必须借助乳腺X线检查或MRI对乳腺进行评估。
3.5.2 评估是完全的—分类
⑴ BI-RADS 1类:阴性。临床上无阳性体征,超声影像未见异常,如无肿块、无结构扭曲、无皮肤增厚及无微小钙化等。
⑵ BI-RADS 2类:良性病灶。基本上可以排除恶性病变。根据年龄及临床表现可每6~12个月随诊。如单纯囊肿、乳腺假体、脂肪瘤、乳腺内淋巴结(也可以归入1类)、多次复查图像无变化的良性病灶术后改变及有记录的经过多次检查影像变化不大的结节可能为纤维腺瘤等。
⑶ BI-RADS 3类:可能良性病灶。建议短期复查(3~6个月)及加做其他检查。根据乳腺X线检查积累的临床经验,超声发现明确的典型良性超声特征如实性椭圆形、边界清、平行于皮肤生长的肿块,很大可能是乳腺纤维腺瘤,其恶性危险性应该小于2%,如同时得到临床、乳腺X线检查或MRI的印证更佳。新发现的纤维腺瘤、囊性腺病、瘤样增生结节(属不确定类)、未扪及的多发复杂囊肿或簇状囊肿、病理学检查明确的乳腺炎症及恶性病变的术后早期随访都可归于此类。
⑷ BI-RADS 4类:可疑的恶性病灶。此类病灶的恶性可能性为2%~95%。一旦评估为4类即建议进行病理学检查,包括细针抽吸细胞学检查、空芯针穿刺活检、手术活检以明确诊断。超声声像图上表现不完全符合良性病变或有恶性特征均归于此类,目前可将其划分为4A类、4B类及4C类。4A类更倾向于良性病变,不能肯定的纤维腺瘤、有乳头溢液或溢血的导管内病灶及不能明确的乳腺炎症都可归于此类,其恶性符合率为2%~10%;4B类难以根据声像图来明确良恶性,其恶性符合率为10%~50%;4C类提示恶性可能性较高,其恶性符合率为50%~94%。
⑸ BI-RADS 5类:高度可能恶性,应积极采取适当的诊断及处理措施。超声声像图恶性特征明显的病灶归于此类,其恶性可能性≥95%,应开始进行积极的治疗,经皮穿刺活检(通常是影像引导下的空芯针穿刺活检)或手术治疗。
⑹ BI-RADS 6类:已经活检证实为恶性。此类用于活检已证实为恶性,但还未进行局部治疗的影像评估。主要是评价先前活检后的影像学改变,或监测手术前新辅助化疗引起的影像学改变。
3.6 乳腺超声检查报告的组成
报告用词应当具体而简洁,使用不加修饰的术语;各项术语的定义、阐述性用语无需出现在报告中;报告内容应当尽量详细,包含全部标准的描述;数据测量应该遵守前述规范,其包括下列内容。
3.6.1 患者信息的记录
患者信息的记录包括姓名、年龄和诊疗记录号码等。
3.6.2 双侧乳腺组织总体声像图描述
按乳腺回声组成情况,分为均质的脂肪组织回声、均质的纤维腺体回声和混杂回声3种类型。
3.6.3 有意义的异常及病灶的声像图描述
3.6.3.1 记录病灶
一般信息记录病灶所在侧、位置(需要一致的和可以重复的系统定位,诸如钟表定位、与乳头的距离)和大小(至少两个径线,大者最好三个径线),同性质的病灶较多时可选取较大及有特征的病灶测量,没有必要测量所有病灶。
3.6.3.2 病灶声像图的描述
应按照BI-RADS分类内容标准逐一进行,包括病灶的外形、边界、边缘、内部及后方回声、周围组织、病灶及周围的钙化、血流,以及采用特殊手段检查所见的各项特征,尽量用规范化术语描述,并注意保持与病灶诊断和分类的一致性。
3.6.3.3 结论
结论部分包括乳腺正常或异常、发现病灶的物理性质、对应的诊断分类及相应的处理建议(在分类中默认),如果可能的话应尽量作出适当的临床诊断。
3.6.3.4 病灶图像存储
病灶应当存储2个垂直切面以上的声像图,声像图上有完整的各种条件记述及位置标识。
3.7 报告范例
超声描述:左乳头上方(2 点,距乳头10mm处)腺体表面探及弱回声,大小为8mm×6 mm,边界清楚,边缘光整,形态规则,内部见散在强回声,后方声影不明显,彩色超声未见明显异常血流信号。
超声提示:双乳增生伴左乳实质占位性病变(BI-RADS 3类),可能为良性病变,建议短期随防或复查。
4 常规乳腺MRI检查和报告规范
4.1 乳腺MRI检查适应证
4.1.1 乳腺癌的诊断
当乳腺X线摄影或超声检查发现病变但不能确定其性质时,可以考虑采用MRI进一步检查。
4.1.2 乳腺癌分期
由于MRI对乳腺癌检出的高敏感性,有助于发现其他影像学检查不能发现的多灶和多中心性肿瘤,有助于显示和评价肿瘤对皮肤、胸肌筋膜、胸大肌及胸壁的浸润情况。
4.1.3 新辅助治疗效果评估
对于确诊乳腺癌需进行新辅助治疗的患者,在新辅助治疗前、治疗中和治疗结束手术前行MRI检查有助于对病变治疗反应性进行评估,对治疗后残余病变范围的判断也较常规影像学检查技术更精准。
4.1.4 腋窝淋巴结转移,原发灶不明者
对于腋窝转移性淋巴结,而临床检查、X线摄影及超声检查都未能明确原发灶时,乳腺MRI有助于发现乳房内隐匿的癌灶,确定位置和范围,以便进一步治疗。
4.1.5 保乳术患者的应用
保乳手术前MRI的应用可以更为精准地确定病灶范围;保乳术后随访,则较常规影像技术更有利于鉴别肿瘤复发和术后瘢痕。
4.1.6 乳房成形术后随访
对于乳房假体植入术后者,MRI有助于植入假体完整性的评价和判断是否发生乳腺癌。
4.1.7 高危人群筛查
高危人群乳腺癌筛查年龄较非高危人群更为提前,MRI有助于高危人群的早期筛查。
4.1.8 MRI引导下的穿刺活检
MRI引导的穿刺活检适用于仅在MRI上发现的病灶,并对此靶病灶行超声检查和X线检查确认仍不能发现异常者。
4.2 乳腺MRI检查的禁忌证
⑴ 妊娠期妇女。
⑵ 体内装有起搏器、外科金属夹子等铁磁性物质及其他不得接近强磁场者。
⑶ 幽闭恐惧症患者。
⑷ 有对任何MRI造影剂如钆螯合物过敏史的患者。
⑸ 一般情况很差,无法配合俯卧,不能耐受MRI检查者。
4.3 乳腺MRI检查技术规范
4.3.1 检查前准备
4.3.1.1 临床病史
了解患者发病情况、症状、体征、家族史、高危因素,询问乳腺手术史及病理学检查结果和手术日期,月经状态及月经周期,有无激素替代治疗或内分泌治疗史,有无胸部放疗史,有无前片及其他相关检查(包括乳腺X线摄影、乳腺超声检查)。
4.3.1.2 检查前准备
作好乳腺MRI检查注意事项的宣教、解释。
最佳检查时间:由于正常乳腺组织强化在月经周期的分泌期最为显著,因而对绝经前女性推荐MRI检查尽量安排在月经周期第2周(第7~14天)进行。
4.3.2 MRI检查
4.3.2.1 设备要求
采用高场1.5 T及以上的扫描机进行乳腺MRI检查,以获得较好的信噪比和脂肪抑制效果。必须采用专用的乳腺线圈,推荐采用开放式线圈,以便必要时可以在侧方进行MRI引导的介入操作。
4.3.2.2 扫描体位
俯卧位,双侧乳房自然悬垂于乳腺线圈中央。
4.3.2.3 成像序列
一般包括横断位、矢状位和冠状位定位扫描,T1WI不抑脂序列、T2WI抑脂序列、T1WI增强扫描序列,扩散加权序列扫描,建议b值用800 s/mm2。增强序列一般行包括双乳的横断位扫描,需要有增强前的蒙片,注入造影剂后连续扫描数次,时间分辨率60 s左右(视各厂家的设置而定),增强后总扫描时间不得少于5 min,建议行等体素无间隔横断位增强扫描(可以多平面重建),最后行双乳矢状位高分辨扫描。增强扫描要求Gd-DTPA团注,标准剂量为0.1~0.2 mmol/kg,于10 s内快速团注,继而快速推注0.9%氯化钠注射液10 mL冲洗。
4.3.2.4 后处理
动态增强曲线在工作站上对增强前蒙片和增强后各期图像进行分析,将病灶最可疑的区域设为感兴趣区(region of interest,ROI),一般应避开肉眼可见的病灶内出血、坏死及囊变区,并在对侧正常乳腺组织内选取相同大小的ROI作为对照,绘制动态增强曲线。曲线判读分两部分,即早期强化和延迟强化。早期强化指注入对比剂后最初2 min或曲线开始变化前的强化率,分成缓慢强化(强化率小于50%)、中等强化(50%~100%)和快速强化(大于100%)。曲线后面部分为延迟强化,也分成3种状况,包括持续上升型(随时间的延长而继续强化,且大于早期强化最高点的10%)、平台型(随时间推移呈平台改变,如有轻度升高或流出,则变化在早期强化最高点上下10%范围之内)和流出型(强化达峰值后信号强度迅速下降范围大于峰值10%以上)。
最大信号投影(maximum intensity projection,MIP):有些设备在扫描完成后可以自动生成MIP图,是对同一期别容积扫描的乳腺进行最大信号投影产生的三维图像,可以比较直观地显示乳腺内病灶的空间位置,同时显示双侧乳腺内的血管分布情况,对诊断病灶性质有一定的鉴别诊断价值。
表观扩散系数(apparent diffusion coefficient,ADC)值测量:扩散加权序列扫描完成后,会生成扩散加权图像和相应的ADC图像。基于ADC图像像针对病灶或者对照取ROI可以测量相应的ADC值,单位为mm2/s。
4.4 诊断报告书写规范
目前的诊断报告书写规范参照美国放射学会指定并被大多数国家采用的2013版乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS),需描述病灶形态特征和动态增强曲线特征,一般形态特征的权重要高于曲线类型,但对于形态特征判断困难者,动态增强曲线类型有一定的价值。形态特征需要对增强前T1WI、T2WI上的信号特点及增强后的表现进行综合分析。但病灶形态描述则根据增强后形态进行,并将病灶分为点状强化、肿块和非肿块强化三大类。乳腺MRI诊断报告范本见附录Ⅳ。
4.4.1 点状强化
点状强化指<5 mm的强化,不具有明显的占位效应,平扫时多不显示。可以多发,但不会聚集成簇。点状强化可能由腺体局限性增生所引起,也可以是乳头状瘤、纤维腺瘤及乳内淋巴结等良性改变,<3%的情况可能是恶性病变,可以是浸润性癌或原位癌。对形态可疑、新发或较前增大的点状强化可建议活检。一般对点状强化予以随访即可。
4.4.2 肿块
具有三维空间的占位性病变,伴或不伴周围正常组织移位或浸润。从形态(圆形、卵圆形或不规则形)、边缘(光整、不规则或星芒状)和内部强化情况(均匀、不均匀、环形强化或低信号分隔)三个方面来描述。不规则的形态,不规则和星芒状的边缘,内部强化不均匀,以及不规则的环形强化是偏恶性的征象。
4.4.3 非肿块强化
当乳腺内出现既非点状亦非肿块的强化时,即为非肿块强化,一般占位效应不明显。分类主要依据其形态特征(线状、局灶性、段样、区域性、多区域或弥漫性)、内部强化特征(均匀、不均匀、集群卵石样或簇状小环样强化)、病灶是否双侧对称三个方面进行分析,双侧对称的非肿块强化可能是一种良性改变。形态中的线样强化如沿着导管走行,并且出现分支,则为偏恶性的征象,段样强化也是偏恶性的征象。内部增强特征中的集群卵石样强化和簇状小环样强化为偏恶性的征象。
4.4.4 其他征象和伴随征象
其他征象有乳内淋巴结,皮肤上的病变,含脂肪的病变,一些不强化的病灶如T1WI增强前高信号的导管、囊肿、血肿及不强化的肿块等。
伴随征象有乳头内陷及侵犯、皮肤增厚、内陷和侵犯、胸肌侵犯、淋巴结异常等。伴随征象可与其他异常征象一同出现,亦可单独出现。发现伴随征象的意义在于当与其他异常征象同时出现时,可提高乳腺癌的诊断权重。当确诊为乳腺癌时,某些伴随征象的出现将影响术前分期及治疗方式的选择。
4.4.5 病灶定位
⑴ 先定位病变位于哪一侧乳房。
⑵ 乳房确定后,则继续将病灶定位在以下7个区域:外上、外下、内上、内下4个象限区域,这4个区域也可以面向观察者进行钟面定位;另外3个区域则不需要结合钟面定位,分别是乳晕后区、中央区和尾叶区。乳晕后区和中央区均位于从乳头向胸壁垂直的中轴线上,乳头基底后方2 cm范围内是乳晕后区,2 cm后则是中央区。尾叶区位于乳腺外上近腋下的乳丘内。
⑶ 病变的深度:在横断位或矢状位上,与胸壁平行分前带、中带、后带,给病灶进行深度定位。一般需测量病灶与乳头的距离。
4.5 乳腺MRI报告的组成
乳腺的MRI报告内容应包括病史简述、与既往检查(包括常规影像检查)对比、扫描技术、乳房的纤维腺体构成、实质背景强化及任何相关的影像学发现,最后是评估分类和处理建议。报告措辞应当简洁,使用BI-RADS术语词典中的标准词汇。可行的话,MRI诊断报告应当与临床检查、X线和超声检查结果相参照,特别是对MRI阳性发现与触诊、X线和超声检查的阳性发现在空间位置的对应关系是否一致性的评估,对非一致的病灶尤其需要强调,以引起临床医师的注意。应重视实质背景强化对MRI检出敏感性的影响,实质背景强化分成轻微、轻度、中度和明显4个等级。随着注入对比剂时间的推移,实质背景强化的程度和范围会逐渐增强增大,并且两侧对称。总体上明显的实质背景强化会增加乳腺MRI检查的“回叫率”,但是恶性病灶的检出并不会受太大的影响。与乳腺X线检查一样,乳腺MRI的检查结果即BI-RADS分类也分为0~6类共7个类别。
4.5.1 评估不完全
BI-RADS 0类:需要进一步影像评估。一般MRI检查后较少用这个分类。但在一些特殊的情况下,如使用合适的扫描技术再做一次MRI检查,需参考既往的乳腺X线和超声检查结果,或充分考虑乳腺既往病史,此时可以用这个评估。
4.5.2 评估完全
⑴ BI-RADS 1类:阴性。
⑵ BI-RADS 2类:良性病变,如无强化的纤维腺瘤、囊肿、无强化的陈旧性瘢痕、乳腺假体,以及含脂肪的病变如油性囊肿、脂肪瘤、错构瘤等。这一分类无恶行征象发现。
⑶ BI-RADS 3类:可能是良性病变,建议短期随访,恶性的可能性非常低,小于2%。良性可能性非常大,但需要通过随访确认其稳定性。较可疑者可3个月后随访,一般是6个月后复查。
⑷ BI-RADS 4类:可疑恶性,要考虑活检。不具有乳腺癌的典型表现,但不能排除乳腺癌的可能性,建议做活检,此类病灶的恶性概率为2%~95%。也可以参照乳腺X线检查分类进而将病灶细分为4A类(恶性概率为2%~10%)、4B(恶性概率为10%~50%)和4C类(恶性概率为50%~95%)。
⑸ BI-RADS 5类:高度怀疑恶性,应进行临床干预(恶性概率≥95%)。
⑹ BI-RADS 6类:已经活检证实为恶性,但还是需要再做扩大手术的病例,MRI检查的目的是评估是否有残存病灶。
5 影像学引导下的乳腺组织学活检指南
影像学引导下乳腺组织学活检一般是指在乳腺X线、超声和MRI影像引导下进行乳腺组织的病理学检查(简称活检),特别适合于未扪及的乳腺病灶(如小肿块、钙化灶及结构扭曲等)。具体包括影像引导下空芯针穿刺活检、真空辅助活检和钢丝定位手术活检等。
5.1 适应证
5.1.1 乳腺超声影像引导下乳腺病灶活检
⑴ 乳腺超声发现未扪及的可疑乳腺占位性病变,BI-RADS≥4类或部分3类病灶,若有必要时也可考虑活检。
⑵ 可扪及乳腺肿块,且超声提示相应部位有乳腺内占位性病变,需要行微创活检或微创切除以明确诊断。
5.1.2 乳腺X线影像引导下乳腺病灶活检
⑴ 乳腺未扪及肿块,而乳腺X线检查发现可疑微小钙化病灶,BI-RADS≥4类。
⑵ 乳腺未扪及肿块,而乳腺X线发现其他类型的BI-RADS≥4类的病灶(如肿块、结构扭曲等),并且超声下无法准确定位。
⑶ 部分3类病灶,如果其他影像学检查提示相应部位有可疑病灶,也可考虑活检。
⑷ 乳房体检扪及肿块,且乳腺X线摄影提示相应位置有占位性病变,需要行微创活检或微创切除以明确诊断。
5.1.3 其他
对有条件的单位应积极提倡在手术前进行影像学引导下的微创活检(空芯针穿刺活检或真空辅助活检),如不具备条件可考虑直接行影像学引导下钢丝定位手术活检。
5.2 对影像学引导乳腺活检设备的要求
5.2.1 乳腺X线影像引导
乳腺X线立体定位床或配备定位活检装置的乳腺X线机。
5.2.2 乳腺超声影像引导
高频乳腺超声探头:频率7~15 Hz。
5.2.3 乳腺磁共振成像引导
对于MRI发现的病灶,而X线、超声检查没有发现者,首先建议超声复查。如果超声检查在相应部位发现病灶,建议在超声引导下进行活检,如超声检查未能发现,则在具备条件的单位,可行MRI引导下活检。
5.2.4 用于手术活检的定位导丝
单钩或双钩钢质导丝(推荐规格20~22 G)。
5.2.5 微创活检设备
空芯针弹射式活检枪(推荐规格14 G),真空辅助乳腺定向活检系统(推荐规格8~11 G)。
5.3 影像引导下钢丝定位手术活检
5.3.1 禁忌证
禁忌证为有重度全身性疾病及严重出血性疾病者。
5.3.2 术前准备
⑴ 签署知情同意书。
⑵ 核对和确认影像学资料,建议临床医师用记号笔在乳腺X线片或乳房上勾画出病灶大致的部位,在保乳手术和保留皮肤全乳切除患者中,可标记手术切口。
⑶ 检查影像定位设备,确保精度和准度。
⑷ 术前血常规检查和凝血功能实验室检查。
5.3.3 术中注意事项
⑴ 手术操作在影像引导下放置定位钢丝至病灶中央部位;如有必要,可考虑在病灶周围放置多根钢丝,以利于精确的定位。
⑵ 摄片或录像记录影像定位下病灶和穿刺针的位置,留档。
⑶ 活检穿刺针道和定位钢丝插入点尽量位于外科医师标记的手术切口范围内。
⑷ 术中切除以定位钢丝顶端为中心至少半径2 cm范围内的乳腺组织(2 cm并非绝对,具体切除活检范围应该根据病灶大小、临床医师判断的恶性风险决定)。标本离体时,亦可考虑使用金属标记物标记标本切缘的4个方向再进行摄片,以利于在X线片上评估钙化灶在标本上的确切位置并确定补充切除的方向。
⑸ 微小钙化灶的活检标本应当立即摄片,待手术者确认取到病灶后,并将标本影像片和标本一起送病理学检查。对于所有临床不可触及的微小病灶,避免术中快速冷冻切片病理学检查,应采取常规石蜡切片;对于可完整切除的病灶,对标记切缘也要进行病理学检查。
5.4 影像引导下的乳腺微创活检
5.4.1 禁忌证
禁忌证为有重度全身性疾病及严重出血性疾病者。
5.4.2 术前准备
⑴ 签署知情同意书。
⑵ 核对和确认影像资料,乳腺X线和乳腺超声再次定位,并做相应标记。
⑶ 检查影像引导设备和微创活检设备(活检枪、真空辅助乳腺定向活检系统等),确保精度和准度。
⑷ 术前血液检验指标:血常规检查和凝血功能实验室检查。
5.4.3 术中注意事项
⑴ 选择切口,采用就近原则,同时还需考量活检后的美观性。
⑵ 摄片或录像记录影像定位下病灶和穿刺针的位置,留档。
⑶ 取材足量,保证病理学诊断。有条件的中心,应该在活检部位放置金属标记。
⑷ 活检结束后压迫手术部位5~15 min。
5.4.4 术后乳房和标本的处理
⑴ 术后应加压包扎至少24 h。若出现瘀血斑或血肿可延长包扎1~2 d,一般2~4周后瘀血斑或血肿可消退。
⑵ 微小钙化灶的活检标本应当立即行乳腺X线摄片以确认是否取到病灶。
⑶ 将含有钙化的标本条与不含钙化的标本条分装于不同的容器内,用4%甲醛溶液固定,送检。如一侧乳房有多个肿物行麦默通微创旋切时,应标记手术切除顺序,标本分别标号并分装在不同的容器内,用4%的甲醛溶液固定,送检。
6 乳腺癌病理学诊断报告规范
6.1 标本类型及固定
6.1.1 标本类型
日常工作中常见的乳腺标本类型包括空芯针穿刺活检标本、真空辅助微创活检标本和各种手术切除标本[乳腺肿物切除术、乳腺病变保乳切除术、乳腺单纯切除术和乳腺改良根治术标本、前哨淋巴结活检(sentinel lymph node biopsy,SLNB)标本、腋窝淋巴结清扫术(axillary lymph node dissection,ALND)标本]。
6.1.2 标本固定
穿刺或切除后的乳腺组织应立即固定(不得超过1 h)。应选择足够的磷酸缓冲液配制的4%中性甲醛固定液。对于切除标本,应将其每隔5 mm切开,宜用纱布或滤纸将相邻的组织片分隔开,以保障固定液的充分渗透和固定。固定时间6~72 h。
6.2 取材及大体描述规范
接受标本时,必须核对姓名、床位号、住院号、标本名称及部位。
6.2.1 空芯针穿刺活检标本
⑴ 大体检查及记录:标明穿刺组织的数目,每块组织的大小,包括直径和长度。
⑵ 取材:送检组织全部取材。空芯针穿刺活检标本不宜行术中病理学诊断。
6.2.2 真空辅助微创活检标本
⑴ 大体检查及记录:标明活检组织的总大小。
⑵ 取材:送检组织全部取材。如临床送检组织标记“钙化”及“钙化旁”,需记录注明,并将其分别置于不同的包埋盒中。真空辅助微创活检标本不宜行术中病理学诊断。
6.2.3 乳腺肿块切除标本
⑴ 大体检查及记录:按外科医师的标示确定送检标本的部位。若未标记,应联系外科医师明确切除标本所在的部位。测量标本三个径线的大小;若带皮肤,应测量皮肤的大小。测量肿瘤或可疑病变三个径线的大小。记录肿瘤或可疑病变的部位和外观。记录每块组织所对应的切片总数及编号。
⑵ 术中冷冻取材:沿标本长轴每隔5 mm做一个切面,如有明确肿块,在肿块处取材。如为钙化灶,宜对照X线摄片对可疑病变取材。如无明确肿块,在可疑病变处取材
⑶ 常规石蜡包埋标本取材:若肿块或可疑病变最大径小于或等于5 cm,应至少每1 cm取材1块,必要时(如DCIS)宜将病变全部取材后送检。若肿块或可疑病变最大径大于5 cm,应每1 cm至少取材1块,必要时需补充取材甚至全部取材。乳腺实质的其他异常和皮肤均需取材。
6.2.4 乳腺病变保乳切除标本
6.2.4.1 大体检查及记录
⑴ 按外科医师的标示确定送检标本的部位。若未标记,应联系外科医师明确切除标本所在的部位。
⑵ 测量标本三个径线的大小,若附带皮肤,也需测量皮肤的大小。
⑶ 根据临床标记,正确放置标本,建议将标本各切缘(表面切缘、基底切缘、上切缘、下切缘、内切缘、外切缘)涂上不同颜色的染料。
⑷ 按从表面到基底的方向,沿标本长轴每隔5 mm做一个切面,将标本平行切分为若干块组织,并保持各块组织的正确方向和顺序。
⑸ 仔细查找病灶,并测量肿瘤三个径线的大小;若为化疗后标本,则测量瘤床大小;若为局切后标本,则描述残腔大小及有无残留病灶。
⑹ 测量肿瘤、瘤床或残腔距各切缘的距离,观察最近切缘。
⑺ 记录每块组织所对应的切片编号及对应取材内容。
6.2.4.2 取材
⑴ 切缘取材:保乳标本切缘取材主要有两种方法:垂直切缘放射状取材(radial sections perpendicular to the margin)和切缘离断取材(shave sections of the margin)。两种切缘取材方法各有优缺点。无论采取何种取材方法,建议在取材前将6处标本切缘涂上不同颜色的墨水,以便在镜下观察时能根据不同颜色对切缘作出准确的定位,并正确测量肿瘤和切缘的距离。保乳标本病理学检查报告中需明确切缘状态(阳性或阴性)。“阳性切缘”是指墨染切缘处有DCIS或浸润性癌侵犯。“阴性切缘”的定义并不一致,但多数指南或共识中将墨染切缘处无肿瘤定义为“阴性切缘”。对于切缘阴性者,建议报告切缘与肿瘤的距离,应尽量用客观的定量描述,而不建议用主观描述(如距切缘近等)。
⑵ 垂直切缘放射状取材(图1A):根据手术医师对保乳标本做出的方位标记,垂直于基底将标本平行切成多个薄片(建议间隔5 mm),观察每个切面的情况。描述肿瘤大小、所在位置及肿瘤距各切缘的距离,取材时将大体离肿瘤较近处的切缘与肿瘤一起全部取材,大体离肿瘤较远处的切缘抽样取材,镜下观察时准确测量切缘与肿瘤的距离。“垂直切缘放射状取材”的优点是能正确测量病变与切缘的距离,缺点是工作量较大,且对大体离肿瘤较远的切缘只抽样取材。
⑶ 切缘离断取材(图1B):将6处切缘组织离断,离断的切缘组织充分取材,镜下观察切缘累及情况。切缘离断取材的优点是取材量相对较少,能通过较少的切片对所有的切缘情况进行镜下观察,缺点是不能准确测量病变与切缘的距离。
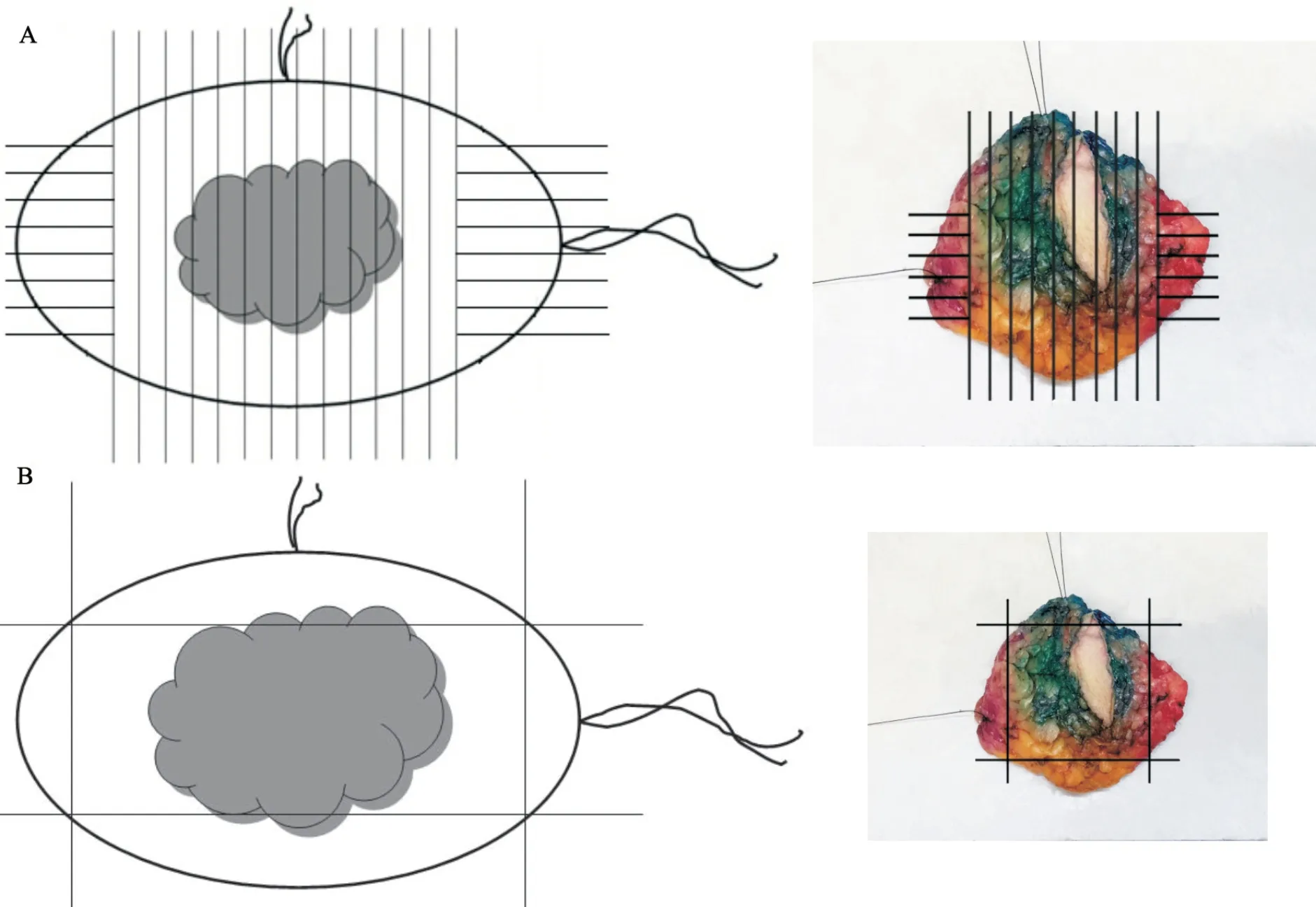
图1 垂直切缘放射状取材(A)和切缘离断取材(B)
⑷ 肿瘤及周围组织取材:若肿块或可疑病变最大径小于或等于5 cm,应沿肿瘤或可疑病变的最大切面至少每1 cm取材1块,必要时(如DCIS)宜全部取材后送检。若肿块或可疑病变最大径大于5 cm,则每1 cm至少取材1块;如已诊断为DCIS,建议将病灶全部取材。若为新辅助治疗后标本,则参照《乳腺癌新辅助治疗的病理诊断专家共识(2020版)》(附录Ⅴ-A)进行取材。若为手术残腔:送检代表性的切面,包括可疑的残留病灶。
⑸ 补充切缘取材:若首次切除时为阳性切缘,需再次送检切缘。补充切缘亦可作为单独的标本同切除组织一同送检。若外科医师已对补充切缘中真正的切缘做了标记,可用染料对真正切缘处进行涂色,垂直于标记处切缘将标本连续切开并送检。如果标本较小,所有组织应全部送检。
6.2.5 乳腺切除术(包括单纯切除术和改良根治术)
6.2.5.1 大体检查及记录
按正确的方向摆放标本以便识别肿瘤所在的象限:改良根治术标本可通过识别腋窝组织来正确定位(腋窝组织朝向外上方)。单纯切除术标本,需根据外科医师的标记来定位,若未标记方向,则应与外科医师联系以确定标本的正确方向。建议标本的基底切缘涂上染料以便镜下观察切缘情况。测量整个标本及附带皮肤、腋窝组织的大小。描述皮肤的外观,如有无手术切口、穿刺点、瘢痕、红斑或水肿等。从基底部水平切开乳头,取乳头水平切面组织一块以观察输乳管的横断面,而后垂直于乳腺表面切开乳头其他组织。描述乳头、乳晕的外观,如有无破溃及湿疹样改变等。垂直于基底将标本切成连续的薄片。记录病灶所在象限位置,描述肿瘤的特征(质地、颜色、边界、与皮肤及深部结构的关系)。若有明确肿块,则测量肿瘤三个径线的大小;若为化疗后标本,则测量瘤床大小;若为局切后标本,则描述手术残腔大小及有无残留病灶。测量肿瘤、残腔、瘤床距最近表面切缘及基底切缘的距离,描述非肿瘤乳腺组织的情况。将腋窝脂肪组织同标本离断后,仔细寻找淋巴结,对规范的腋窝清扫标本宜至少找到10枚淋巴结。描述淋巴结的总数目及最大径范围、有无融合、有无与周围组织粘连。注意需附带淋巴结周围的结缔组织。
6.2.5.2 取材
原发肿瘤和手术残腔的取材:若为肿瘤,送检肿瘤的最大切面;若肿块或可疑病变最大径小于或等于5 cm,应至少每1 cm取材1块,必要时(如DCIS)宜全部取材后送检。若标本肿块或可疑病变最大径大于5 cm,则每1 cm至少取材1块,如已诊断为DCIS,应将病灶全部取材。若为化疗后瘤床,则参照《乳腺癌新辅助治疗的病理诊断专家共识(2020版)》取材。若为手术残腔,送检代表性的切面,包括可疑的残留病灶。对其余组织的异常病灶、乳头、距肿瘤最近处表面被覆皮肤、距肿瘤最近处基底切缘进行取材,尽可能取切缘的垂直切面。周围象限乳腺组织每个象限代表性取材1块。腋窝淋巴结:若淋巴结肉眼观察为阴性,则送检整个淋巴结行组织学检查;若淋巴结肉眼阳性,则沿淋巴结最大径剖开后取组织送检,注意需附带淋巴结周围的结缔组织,以识别淋巴结被膜外的肿瘤转移灶。
6.2.6 SLNB
⑴ 乳腺癌SLNB已逐渐取代传统的ALND来评估早期乳腺癌患者的区域淋巴结情况,SLNB阴性者可避免ALND。
孤立肿瘤细胞(isolated tumor cells,ITC):淋巴结中的肿瘤病灶直径≤0.2 mm,或单张切片上的肿瘤细胞<200个。美国癌症联合会(American Joint Committee on Cancer,AJCC)定义其为pN0(i+)。
微转移:肿瘤转移灶最大径>0.2 mm,但不超过2 mm。AJCC定义其为pN1mi。ITC与微转移有着本质的不同,前者为pN0,后者为pN1。
宏转移:肿瘤转移灶最大径>2 mm。
⑵ 术中病理学评估:前哨淋巴结中术中病理学评估的主要目的是检测出淋巴结中的转移病灶,从而进行ALND,以避免二次手术。术中病理学评估的方法主要包括术中细胞印片和术中冷冻切片:
①术中细胞印片:将淋巴结每间隔2 mm切成若干片组织(图2),仔细检查每片组织上是否存在肉眼可见的转移灶,对每个切面行细胞印片。术中细胞印片的优点是可保全整个淋巴结组织,对组织基本无损耗,可对淋巴结的不同切面取材,价廉,所需时间短,制作流程简单;缺点是在印片的高细胞背景下辨认出分散的癌细胞(如小叶癌)有一定难度。术中细胞印片有很好的诊断特异性,但其诊断敏感性受多种因素的影响。
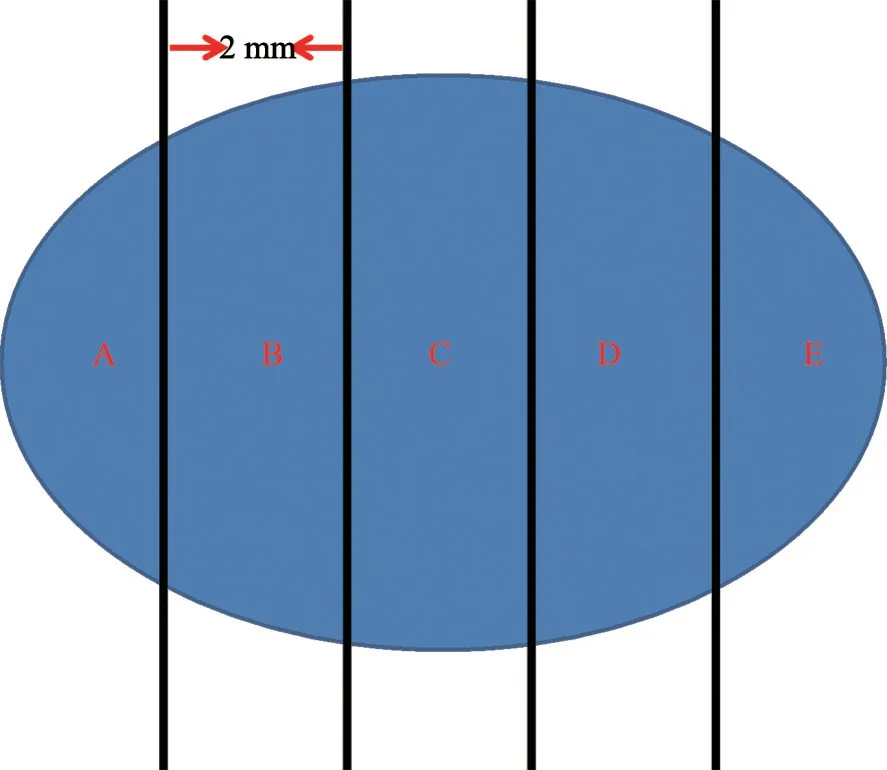
图2 将前哨淋巴结每间隔2 mm切成若干片组织,每片组织均包埋成石蜡组织块
② 术中冷冻切片:将淋巴结每间隔2 mm切成若干片组织,仔细检查每片组织上是否存在肉眼可见的转移灶,每片组织制成冷冻切片行病理学评估。术中冷冻切片的优点是诊断特异性好,能够避免因假阳性而造成不必要的ALND;缺点是组织损耗,用时长,费用较高,且难以评估脂肪化的淋巴结等。
⑶ 术后常规石蜡包埋组织病理学评估:将淋巴结每间隔2 mm切成若干片组织,每个蜡块至少切1张切片。
6.3 病理学诊断分类、分级和分期方案
6.3.1 组织学分型
参见附录Ⅴ-B,组织学分型主要依据2019版世界卫生组织(World Health Organization,WHO)乳腺肿瘤分类,某些组织学类型的准确区分需行免疫组织化学和(或)分子病理学检测后确定。
6.3.2 组织学分级
浸润性乳腺癌和DCIS的组织学分级参见附录Ⅴ-C。
组织学分级是重要的预后因素。推荐采用Nottingham分级系统对浸润性乳腺癌进行组织学分级。根据腺管形成的比例、细胞的异型性和核分裂象计数三项指标分别独立评估,各给予1~3分,相加后根据总分将浸润性癌分为高、中、低三个级别。腺管分化程度的评估针对整个肿瘤,需要在低倍镜下评估。只计数有明确中央腺腔且由有极向肿瘤细胞包绕的结构,以腺管/肿瘤区域的百分比表示。细胞核多形性的评估要选取多形性最显著的区域。该项评估参考周围正常乳腺上皮细胞的细胞核大小、形状和核仁大小。当周边缺乏正常细胞时,可用淋巴细胞作为参照。当细胞核与周围正常上皮细胞的大小和形状相似、染色质均匀分布时,视为1分;当细胞核比正常细胞大,形状和大小有中等程度差异,可见单个核仁时,视为2分;当细胞核的大小有显著差异,核仁显著,可见多个核仁时应视为3分。只计数明确的核分裂象,不计数核浓染和核碎屑。核分裂象计数区域必须根据显微镜高倍视野的直径进行校正。核分裂象计数要选取增殖最活跃的区域,一般常见于肿瘤边缘,如果存在异质性,要选择核分裂象多的区域。
6.3.3 乳腺癌的分期
参见AJCC第8版乳腺癌分期系统。包括传统的解剖学分期和预后分期。解剖学分期包括了肿瘤的大小、累及范围(皮肤和胸壁受累情况)、淋巴结转移和远处转移情况。肿瘤大小的测量有多种方法,包括临床体检、影像学评估、病理大体测量和显微镜下测量。乳腺癌分期中涉及到的肿瘤大小是指浸润癌的大小。由于体检、影像学及大体检查均无法区分浸润性癌和DCIS,因此显微镜下测量应该是最准确的测量方式。如果浸润性癌范围较大,无法用一个蜡块全部包埋,则以巨检时的肿瘤大小为准。若浸润性癌病灶局限,可以用一个蜡块全部包埋,则肿瘤大小以显微镜下测量的大小为准。
⑴ 如果肿瘤组织中有浸润性癌和原位癌两种成分,肿瘤的大小应该以浸润性成分的测量值为准。
⑵ 原位癌伴微浸润:出现微浸润时,应在报告中注明,并测量微浸润灶最大径;如为多灶微浸润,浸润灶大小不能累加,需在报告中注明多灶微浸润,并测量最大浸润灶的最大径。
⑶ 对于肉眼能确定的发生于同一象限的两个以上多个肿瘤病灶,应在病理学报告中注明为多灶性肿瘤,并分别测量大小,以最大浸润病灶作为分期依据。
⑷ 对于肉眼能确定的发生于不同象限的两个以上肿瘤病灶,应在病理学检查报告中注明为多中心性肿瘤,并分别测量大小。
⑸ 如果肿瘤组织完全由DCIS组成,应尽量测量其范围。淋巴结状态是决定乳腺癌患者治疗和预后的重要因素,对于淋巴结转移数位于分期临界值(如1、3和10个转移)附近时,要特别仔细观察淋巴结的转移数目,从而作出准确的pN分期判断。预后分期是在传统解剖学分期基础上增加生物学信息,是解剖学分期的完善和补充。
6.3.4 免疫组织化学和肿瘤分子病理学检测及其质量控制
⑴ 应对所有乳腺浸润性癌病例进行雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)免疫组织化学染色,HER2 2+病例应进一步行原位杂交检测。对DCIS也建议进行ER、PR及HER2免疫组织化学染色。ER、PR的病理学报告需包含阳性细胞强度和百分比。ER、PR检测参考中国《乳腺癌雌、孕激素受体免疫组织化学检测指南(2015版)》(参见附录Ⅴ-D),细胞核ER/PR染色1%~10%定义为“阳性(低表达)”。HER2检测参考中国《乳腺癌HER2检测指南(2019版)》(参见第14章,附录Ⅴ-E)。
⑵ 应对所有乳腺浸润性癌进行Ki-67增殖指数检测,并对癌细胞中阳性染色细胞所占的百分比进行报告。
⑶ PD-L1检测:目前临床研究中采用的PD-L1检测是一套完整的系统,包括所采用的抗体、检测平台和判读系统。常用的PD-L1抗体包括SP142(Ventana)和22C3(DAKO),前者的判读采用免疫细胞评分,后者采用综合阳性评分(CPS评分)。
⑷ 可进行肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)报告。
⑸ 开展乳腺癌免疫组织化学和分子病理学检测的实验室应建立完整有效的内部质量控制体系,具有合格资质的病理实验室应满足以下条件:①应建立完善的标准操作程序,并严格遵照执行,做好每次检测情况的记录和存档工作。应开展同一组织不同批次染色结果的重复性分析。检测相关的仪器和设备应定期维护、校验。任何操作程序和试剂变化均应重新进行严格的验证。② 从事乳腺癌免疫组织化学和分子病理学检测的实验技术人员和病理学医师应定期进行必要的培训、资格考核和能力评估。③实验室外部质控可通过参加有关外部质控活动来实现。外部质控的阳性和阴性符合率应达到90%以上。外部质控活动推荐每年参加1~2次。不具备检测条件的单位应妥善地保存好标本,以供具有相关资质的病理实验室进行检测。
6.3.5 病理报告内容及规范
乳腺浸润性癌的病理报告(参见附录Ⅴ-F)应包括与患者治疗和预后相关的所有内容,如肿瘤大小、组织学类型、组织学分级、有无并存的DCIS、有无淋巴管血管侵犯(lymphovascular invasion,LVI)、切缘和淋巴结情况等,还应包括ER、PR、HER2表达情况及Ki-67增殖指数。若为治疗后乳腺癌标本,则应对治疗后反应进行病理学评估。DCIS的病理学诊断报告应报告核级别(低、中或高级别)和有无坏死、手术切缘情况以及ER、PR和HER2表达情况。对癌旁良性病变,应明确报告病变名称或类型。对保乳标本的评价应包括大体检查及显微镜观察中肿瘤距切缘最近处的距离、若切缘阳性,应注明切缘处肿瘤的类型。LVI需要与乳腺癌标本中经常出现的组织收缩引起的腔隙鉴别。相对而言,收缩腔隙在肿瘤组织内更常见,而在肿瘤主体周围寻找LVI更可靠。
7 浸润性乳腺癌保乳治疗临床指南
7.1 浸润性乳腺癌保乳治疗的外科技术
7.1.1 开展保乳治疗的必要条件
⑴ 开展保乳治疗的医疗单位应该具备相关的技术和设备条件,以及外科、病理科、影像诊断科、放疗科和内科的密切合作(上述各科也可以分布在不同的医疗单位),并有健全的随访机制。
⑵ 患者在充分了解全乳腺切除治疗与保乳治疗的特点和区别之后,知晓保乳后可能的局部复发风险,具有明确的保乳意愿。
⑶ 患者客观上有条件接受保乳手术后的放疗及相关的影像学随访,如乳腺X线、B超或MRI检查等(必须充分考虑患者的经济条件、居住地的就医条件及全身健康状况等)。
7.1.2 保乳治疗的适应证
主要针对具有保乳意愿且无保乳禁忌证的患者。
7.1.2.1 临床Ⅰ、Ⅱ期的早期乳腺癌
肿瘤大小属于T1和T2分期,且乳房有适当体积,肿瘤与乳房体积比例适当,术后能够保持良好的乳房外形的早期乳腺癌患者。对于多灶性乳腺癌(同一个象限的多个病灶),也可尝试进行保乳手术。
7.1.2.2 临床Ⅲ期患者(炎性乳腺癌除外)
经术前治疗降期后达到保乳手术标准时也可以慎重考虑。
7.1.3 保乳治疗的绝对禁忌证
⑴ 妊娠期间放疗。对于妊娠期妇女,保乳手术可以在妊娠期完成,而放疗可以在分娩后进行。
⑵ 病变广泛,且难以达到切缘阴性或理想保乳外型。
⑶ 弥漫分布的恶性特征钙化灶。
⑷ 肿瘤经局部广泛切除后切缘阳性,再次切除后仍不能保证病理切缘阴性者。
⑸ 患者拒绝行保留乳房手术。
⑹ 炎性乳腺癌。
7.1.4 含以下因素时应谨慎考虑行保乳手术
⑴ 活动性结缔组织病,尤其硬皮病和系统性红斑狼疮或胶原血管疾病患者,对放疗耐受性差。
⑵ 同侧乳房既往接受过乳腺或胸壁放疗者,需获知放疗剂量及放疗野范围。
⑶ 肿瘤直径>5 cm等肿瘤与乳房体积比值较大者,易出现满意外型与充分切缘之间的矛盾。
⑷ 多中心病灶(多中心病灶指在2个或2个以上象限存在1个及以上病灶,或病理学类型和分子分型完全不一样的2个乳腺病灶)。
⑸ 侵犯乳头(如乳头Paget病)。
⑹ 切缘接近,墨染切缘与肿瘤的距离<2 mm时(浸润性癌,除外表面、基底等不可能再次补充切除者)。对“切缘接近”的具体标准目前仍然缺乏共识,多数专家倾向于认可切缘距离肿瘤2 mm可能影响保乳患者的局控。
⑺ 已知乳腺癌遗传易感性强(如BRCA1/2基因突变),保乳后同侧乳房复发风险增加的患者。
7.1.5 保乳治疗前的谈话
⑴ 经大样本临床试验证实,早期乳腺癌患者接受保乳治疗和全乳切除治疗后生存率及远处转移的发生率相似。
⑵ 保乳治疗包括保乳手术和术后的辅助放疗,其中保乳手术包括肿瘤的局部广泛切除及ALND或SLNB。
⑶ 术后全身性辅助治疗基本上与乳房切除术相同,但因需配合辅助放疗,可能需要增加相关治疗的费用和时间。
⑷ 同样病期的乳腺癌,保乳治疗和乳房切除术后均有一定的局部复发率,前者5年局部复发率为2%~3%(含第二原发乳腺癌),后者约为1%,不同亚型和年龄的患者有不同的复发和再发乳腺癌的风险。保乳治疗患者一旦出现患侧乳房复发仍可接受补救性全乳切除术±乳房重建,并仍可获得较好的疗效。
⑸ 保留乳房治疗可能会影响原乳房的外形,影响程度因肿块的大小和位置而异;肿瘤整复技术可能改善保乳手术后的乳房外形和对称性。
⑹ 虽然术前已选择保乳手术,但医师手术时有可能根据具体情况更改为全乳切除术(如术中或术后病理学检查报告切缘阳性,当再次扩大切除已经达不到预期美容效果的要求,或再次切除切缘仍为阳性时),应告知患者即刻或延期乳房再造的相关信息。术后石蜡包埋组织切片病理学检查如切缘为阳性则可能需要二次手术。
⑺ 有乳腺癌家族史或乳腺癌遗传易感(如BRCA1、BRCA2或其他基因突变)者,有相对高的同侧乳腺癌复发或对侧乳腺癌再发风险。
7.1.6 保乳手术
7.1.6.1 术前准备
⑴ 乳房的影像学评估,包括双侧乳腺X线和乳房超声检查(对绝经前、致密型乳腺者,在有条件的中心,可考虑行乳房增强MRI检查)。
⑵ 签署知情同意书。
⑶ 推荐在术前行病灶的穿刺活检,有利于与患者讨论术式的选择及手术切除的范围。空芯针活检前应与活检医师密切协商沟通,选取合适的穿刺点,以确保术中肿瘤和穿刺针道的完整切除。没有确诊时,患者可能心存侥幸,不能正确、严肃地考虑保乳和SLNB的优缺点,容易在术后表现出对手术方式和复发风险的不信任。另外,术前行病灶的穿刺活检可以避免外上象限肿块切除活检对腋窝SLNB的影响。
⑷ 体检不能触及病灶者应在手术前行X线、MRI或超声下病灶定位,必要时应在活检部位放置定位标记。
⑸ 麻醉方式宜采用全麻。
⑹ 新辅助治疗后保乳患者,新辅助治疗前可通过影像引导(常用超声)在病灶中心或病灶边缘处放置钛夹,有助于寻找手术区域、病理标本的取材;新辅助治疗后残留病灶较小临床无法触及时推荐通过影像引导下导丝定位或染料标识后行手术切除。
⑺ 其余术前准备同乳腺肿瘤常规手术。
目前对保乳手术前乳腺MRI的价值仍存在一定争议,现有研究结果表明其并不能够降低局部复发风险,对远期生存率无影响,未能降低再手术率,且同时增加了全乳切除率。推荐术前,尤其针对腺体致密型患者行MRI检查。MRI的优势包括:①更全面地掌握乳房的解剖特征,如腺体脂肪比例、皮下脂肪厚度、胸壁结构、腋窝等信息;② 更为准确地评估病灶的位置、形态、累及范围、与周围结构的关系,评估乳头乳晕区域是否受累等情况;③对多灶多中心病变有更高的敏感性;④ 能检出临床触诊阴性以及对侧乳房的可疑病灶,并能够引导穿刺活检;⑤ 评估内乳淋巴结情况。
7.1.6.2 手术过程
⑴ 一般建议乳房和腋窝各取一切口,若肿瘤位于乳腺尾部,也可采用一个切口。切口可根据肿瘤部位、乳房大小和下垂度及肿瘤整复技术的需要来选择。推荐选择符合皮肤自然纹理(langers线)的肿物表面切口。肿瘤位于上象限时,可通过采用弧形切口切除肿瘤,并获得较为理想的术后外形。肿瘤位于下象限时,可使用放射状切口切除肿瘤。在少数情况下,保乳手术的切口设计还需兼顾腋窝区域淋巴结的处理。当肿瘤位于外上象限或乳房近腋窝处时,可考虑采取弧形切口以便在切除肿瘤的同时,对腋窝淋巴结进行活检或清扫。目前肿瘤整形技术发展迅速,切口的选择也愈发多样化,例如双环切口、蝙蝠翼切口、J形切口等个体化设计切口。就术后局部复发率而言,肿瘤整形技术与传统保乳手术相当。肿瘤表面皮肤可不切除或仅切除小片。如果肿瘤侵犯Cooper韧带,需考虑切除凹陷皮肤。
⑵ 乳房原发灶切除范围应包括肿瘤、肿瘤周围一定范围的乳腺组织,并根据肿瘤位置和乳腺厚度决定是否切除部分皮下组织及肿瘤深部的胸大肌筋膜。活检穿刺针道、活检残腔及活检切口皮肤瘢痕应尽量包括在切除范围内。肿瘤与乳房体积比值较大、需要切除组织量较大时,特殊部位的乳腺肿瘤,乳房过大和(或)中-重度下垂时,可联合采用肿瘤整复技术,以改善术后乳房外观。乳腺肿瘤整形手术(oncoplastic surgery,OPS)是将肿瘤外科技术和整形外科技术整合,在切除肿瘤并确保切缘阴性的情况下,修复乳房外形的外科技术。Clough通过预估切除腺体体积将保乳整形手术分为两种类型。Ⅰ型切除体积<20%,通过简单的手术方式—通常是游离腺体,能够修复乳房外观。Ⅱ型切除体积20%~50%,需要较复杂的技术恢复外观,不同象限的手术采取不同的技术。保乳整形手术的方法分为容积移位和容积替代两大类。容积移位技术是在部分乳房切除术后应用剩余的乳腺腺体移位来填充肿瘤切除后的残腔,从而达到塑形和美容的效果。容积替代技术是应用腺体以外的自体组织来填充残腔以达到美容的目的。新辅助治疗后保乳的患者,可根据新辅助治疗后肿块的范围予以切除,并推荐由经验丰富的多学科协作团队实施,推荐在术前进行精确的影像学评估。中-重度下垂、体积较大的乳房是保乳整形手术的适应证,可以根据患者需求同期或分期行健侧乳房对称性塑形手术。
⑶ 对乳房原发灶手术切除的标本进行上、下、内、外、表面及基底等方向的标记。包含钙化灶的保乳手术时,术中应对标本行X线摄片,以明确病灶是否被完全切除及病灶与各切缘的位置关系。
⑷ 对标本各切缘进行评估(如切缘染色或术中快速冷冻切片及印片细胞学检查),术后需要石蜡包埋组织切片的病理学检查以明确诊断。
⑸ 乳房手术残腔止血、清洗,推荐放置惰性金属夹(如钛夹)作为放疗瘤床加量照射时的定位标记(术前告知患者),以便于术后影像随访。建议在各切缘放置钛夹,尽可能在上、下、内、外、基底各放置1枚,上、下、内、外切缘的钛夹应放置在腺体基底与表面之间距离的1/2处。逐层缝合皮下组织和皮肤。
⑹ 腋窝淋巴结处理:腋窝淋巴结临床阴性者行SLNB,根据活检结果决定是否进行ALND;腋窝淋巴结临床阳性者直接行ALND。
⑺ 若术中或术后病理学检查报告切缘阳性,可行全乳切除,或尝试扩大局部切除范围以达到切缘阴性。虽然对再切除的次数没有严格限制,但当再次扩大切除已经达不到美容效果的要求或再次切除切缘仍为阳性时,建议改为全乳切除。
7.1.6.3 术后病理学检查
⑴ 病灶切缘的大体检查和镜下切缘距离测量,推荐同时报告最近切缘的方向、距离和肿瘤的类型。
⑵ 其他同常规病理学检查。
⑶ 术后病理学检查报告提示切缘上存在多形性小叶原位癌、DCIS时,建议行进一步广泛切除手术,以保证切缘阴性。暂不建议通过局部放疗予以替代。
7.1.6.4 随访和局部复发
保乳术后复发的时间及模式与全乳切除术后存在差异,保乳手术后可能会出现局部、区域复发及远处转移,其中术后的局部复发,包括在同侧被保留的乳房内再次出现病灶和(或)区域复发[肿瘤累及同侧区域淋巴结,通常见于同侧腋窝或锁骨上淋巴结,少数位于锁骨下和(或)内乳淋巴结]。因此术后复发监测和随访策略应该根据患者的手术类型综合考量来确定。在保乳术后复发的高峰期内进行更频繁的监测随访可能有助于早期发现术后复发。除常规超声检查随访外,保乳患者术后推荐每年1次行钼靶X线(必要时MRI)影像学随访。
术后局部复发率,每年0.6%~1.5%。近年来,保乳治疗的5年局部区域复发率呈现出下降的趋势。在保乳手术和现代全身治疗以及放疗后,总的5年局部复发率为4.2%。未经新辅助治疗的保乳手术局部复发危险因素包括年龄、分子分型、淋巴结状况、切缘状态以及系统性治疗的规范性等。
乳腺癌保乳手术后的局部复发(local recurrence,LR)包括乳房内复发、皮肤及胸壁的复发,复发的方式有两种:一种是癌前病变或亚临床病灶的癌细胞未被手术或放疗清除所导致的真性复发(ture recurrence,TR);另一种是出现了组织学类型或肿瘤部位不同于第一原发癌的新病灶(new primary,NP),即第二原发癌。这两种复发方式对预后的影响是不同的,发生真性复发会缩短患者的生存时间,真性复发距第一次手术时间越近、预后越差。要根据复发方式及复发间期采取不同的治疗方式,除局部手术外,还需结合病理学分型给予全身系统性治疗。同侧乳房复发后可采取以下手术处理方式:补救性全乳房切除联合或不联合放疗(可联合乳房整形及重建手术)、二次保乳联合或不联合放疗。对于保乳手术及术后放疗后无病间期较长(>5年),同侧乳腺内复发或第二原发肿瘤,如条件允许专家组推荐可行再次保乳,直接腋窝清扫或者再次行SLNB都是可选的腋窝评估方式。
7.2 保乳标本的病理学检查取材规范
保乳标本切缘取材主要包括两种方法:垂直切缘放射状取材和切缘离断取材,详见第六章节,两种切缘取材方法各有优缺点。无论采取何种取材方法,建议在取材前将标本切缘涂上染料,以便在镜下观察时能对切缘作出准确定位,并正确测量肿瘤与切缘的距离。保乳标本病理学检查报告中需明确记述切缘状态(阳性或阴性)。
对于Ⅰ、Ⅱ期浸润性癌保乳手术后行全乳放疗的患者,美国肿瘤外科和放疗学会建议“墨染切缘处无肿瘤”为阴性切缘。对DCIS保乳手术后行全乳放疗的患者,切缘与肿瘤的距离达到2 mm,同侧乳房肿瘤复发率显著降低,即使有少量肿瘤的残留,也可通过后续全乳放疗得到控制,更宽的切缘并不能使复发风险显著降低。美国肿瘤外科、放疗和肿瘤内科学会联合颁布的“接受全乳放疗的DCIS保乳切缘指南”建议墨染切缘距肿瘤2 mm为安全距离。对于切缘阴性者,建议报告切缘与肿瘤的距离,应尽量用客观定量描述,而不建议用主观描述(如距切缘近等)。阴性切缘不一定代表剩余乳腺组织内无癌细胞,而意味着残余肿瘤可以被全乳放疗有效地控制。
阳性切缘是指墨染切缘处有DCIS或浸润性癌侵犯。切缘DCIS累及的范围可分为三类:
①局灶侵犯:切缘上DCIS累及范围最大径小于1 mm,局限于1个蜡块;② 轻-中度侵犯:切缘上DCIS累及范围介于局灶和广泛侵犯之间;③广泛侵犯:切缘上DCIS累及范围≥15 mm,或在5个及以上高倍视野中切缘观察到DCIS,或在8个及以上蜡块的切缘中观察到DCIS。
7.3 乳腺癌保乳术后的放疗
7.3.1 全乳放疗
7.3.1.1 适应证
原则上接受保留乳房手术的患者均需要接受放射治疗。但是,对于同时满足以下特定条件的患者,即符合CALGB9343与PRIMEⅡ两项研究的入组条件,权衡放射治疗的绝对和相对获益,充分考虑患者的方便程度、全身伴随疾病及患者意愿,可以考虑豁免放疗。
⑴ 患者年龄≥70岁。
⑵ 病理学分期为T1N0M0。
⑶ 激素受体阳性。
⑷ 切缘阴性且可以接受规范的内分泌治疗的患者。
7.3.1.2 与全身系统性治疗的时序配合
无辅助化疗指征的患者术后放疗建议在手术后8周内进行。由于术后早期术腔体积存在动态变化,尤其是含有术腔血肿的患者,所以不推荐术后4周内开始放疗。接受辅助化疗的患者应在末次化疗后2~4周内开始。关于内分泌治疗与放疗的时序配合目前没有一致意见,可以同期或在放疗后开展。曲妥珠单抗治疗患者只要放疗前心功能正常,可以与放疗同时使用。卡培他滨已被用于维持治疗及新辅助化疗后的强化治疗中,但辅助放疗期间是否可以同期用卡培他滨,目前仍缺乏有效证据。
7.3.1.3 照射靶区
①ALND或SLNB阴性的患者照射靶区只需包括患侧乳腺;② ALND后有转移的患者,照射靶区除患侧乳腺外,原则上还需要包括乳腺及区域淋巴引流区;③前哨淋巴结(sentinel lymph node,SLN)1~2枚转移[微转移和(或)宏转移],如果未行ALND。根据Z0011与AMAROUS等临床研究结果,可以考虑高位切线野照射(切线野上界位于肱骨头下2 cm以内),具体范围包括低位腋窝的Ⅰ/Ⅱ组,或包含腋窝三组及锁骨上内侧组淋巴引流区照射。其中,对于宏转移的患者,更倾向于腋窝三组及锁骨上内侧组淋巴引流区照射。④ 靶区勾画定义参考RTOG/ESTRO勾画共识,或复旦大学附属肿瘤医院《早期乳腺癌术后靶区勾画共识》。
7.3.1.4 照射技术
⑴ 常规放疗技术:X线模拟机下直接设野,基本射野为乳房内切野和外切野。内界和外界需要各超过腺体1 cm,上界一般在锁骨头下缘,或与锁骨上野衔接,下界在乳房皱褶下1~2 cm。一般后界包括不超过2.5 cm的肺组织,前界皮肤开放,留出1.5~2.0 cm的空隙以避免因摆位误差、呼吸运动以及治疗过程中乳腺肿胀造成的靶区漏照射;同时各个边界需要根据病灶具体部位进行调整,以保证瘤床处剂量充足。
⑵ 射线和剂量分割:原则上采用直线加速器6 MV X线,全乳照射剂量45.0~50.0 Gy,1.8~2.0 Gy/次,5次/周。通常采用直线加速器6 MV X线,全乳常规分割放疗照射剂量为45.0~50.4 Gy/25~28次,1.8~2.0 Gy/次,每周5次;或采用大分割放射治疗40.0~42.5 Gy/15~16次,2.66 Gy/次,每周5次。中国医学科学院肿瘤医院大分割方案为43.5 Gy/15次,2.9 Gy/次,每周5次。
⑶ 瘤床加量:大部分保乳术后患者在全乳照射基础上均可通过瘤床加量进一步提高局部控制率。全乳照射后序贯瘤床加量可以进一步降低局部复发率,对于低危复发患者可以不考虑加量。瘤床加量剂量通常为10.0~16.0 Gy/4~8次,2.0~2.5 Gy/次。瘤床加量可以用电子线照射,瘤床位置深的患者建议采用光子线的三维适形技术。国内有条件的单位也可以开展术中X线、电子线或近距离后装技术加量。
⑷ 三维适形和调强照射技术:有条件的单位,尽可能不要采用二维放疗技术,建议采用计算机体层成像(computed tomography,CT)定位。三维适形或正向调强的野中野技术是目前乳腺癌乳房照射的标准技术。对于心脏和肺的照射剂量高,胸廓形状特殊的患者逆向调强技术优于三维适形或正向调强,有条件的单位可以采用逆向调强放疗技术。具备相应条件的单位也可以采用基于深吸气条件下的呼吸门控技术或者俯卧位照射技术,以进一步降低心脏和肺的照射剂量。
⑸ 区域淋巴结放疗技术见第9章乳腺癌全乳切除术后放疗临床指南。
7.3.2 部分乳腺短程照射(accelerated partial breast irradiation,APBI)
7.3.2.1 适应证
保乳术后APBI可能获得与标准的全乳放疗相当的局部控制率。APBI的优势在于可减少乳腺以及临近正常组织的照射体积,缩短治疗时间。同时接受APBI治疗的患者在局部复发率方面不应低于接受全乳放疗的患者。已经发表的或公开报告的多项Ⅲ期临床研究结果显示,APBI在局部控制率以及美容效果方面有一些冲突的结果。因此,接受APBI治疗的患者仍然需要严格选择,对于符合美国肿瘤放射治疗协会(American Society of Radiation Oncology,ASTRO)2016年共识的低危人群可以考虑部分乳房照射,标准如下:
⑴ 年龄≥50岁。
⑵ 无BRCA1/2基因突变。
⑶ 病理学检查确诊为T1N0M0。
⑷ 单中心单病灶。
⑸ 未接受新辅助治疗。
⑹ 至少2 mm阴性切缘。
⑺ 无LVI。
⑻ 无广泛DCIS成分。
⑼ 激素受体阳性的浸润性导管癌或其他预后良好乳腺癌。
⑽ 或纯的DCIS,满足以下条件:筛查发现的;低中分级;直径≤2.5 cm;阴性切缘≥3 mm。
7.3.2.2 技术选择
临床应用的部分乳房照射技术包括:
⑴ 外照射技术:三维适形以及调强放射治疗技术。外照射技术常见的方案包括:38.5 Gy/10次,每天2次,间隔大于6 h;或40.0 Gy/15次,每天1次;30 Gy/5次,隔日1次。最近的临床试验结果表明,无论选用那种外照射技术,同侧乳房复发与全乳放疗相当。因此,支持外照射在APBI中应用。但鉴于加拿大RAPID研究美容效果的报告,38.5 Gy/10次,每天2次的方案也需要慎重。
⑵ 术中照射技术:包括术中放疗,组织间插植和球囊导管。术中放疗包括千伏X线、电子线两种技术。根据最近的临床试验结果,大部分术中放疗技术的同侧乳房复发风险高于全乳放疗组,因此,需要谨慎选择合适患者。
8 乳腺癌前哨淋巴结活检临床指南
循证医学Ⅰ级证据证实,乳腺癌SLNB是一项评估腋窝分期的活检技术,可准确地评价腋窝淋巴结的病理学状态,对于腋窝淋巴结阴性的患者,可安全有效地替代ALND,从而显著减少手术的并发症,改善患者的生活质量;对于SLN 1~2枚转移的患者,亦可有条件地安全替代ALND。此外,新辅助治疗前后的SLNB也受到越来越多的关注。
乳腺癌SLNB的流程包括适应证的选择,示踪剂的注射和术前淋巴显像,术中SLN的检出,SLN的术中及术后组织学、细胞学和分子病理学诊断,SLN阳性患者的腋窝处理及SLN阴性替代ALND患者的术后随访等。
8.1 开展SLNB的必要条件
8.1.1 多学科协作
SLNB需要外科、影像科、核医学科和病理科等多学科的团队协作。开展SLNB的医疗单位应该尽量具备相关的技术和设备条件。由于SLN 1~2枚转移及新辅助治疗后腋窝降期患者可以有条件地免除ALND,因此也需要肿瘤内科和放疗科医师加入到SLNB的多学科协作团队中来。
8.1.2 学习曲线
完整的学习曲线对于提高SLNB的成功率、降低SLNB的假阴性率非常重要。开展SLNB替代ALND的医疗单位必须通过资料收集和结果分析,以确保整个团队熟练掌握SLNB技术。目前,建议在采用SLNB替代ALND前,应完成一定数量(如40例以上)的SLNB和ALND一致性的研究病例,使SLNB的成功率达到90%以上,假阴性率低于10%。
8.1.3 知情同意
患者术前应在充分了解SLNB的成功率、假阴性率及相关的复发风险之后,自愿接受SLNB替代ALND,并且理解在SLN检出失败时需进行常规ALND。
8.2 SLNB指征
SLNB是早期浸润性乳腺癌的标准腋窝分期手段,具体适应证见表1。随着乳腺癌SLNB研究的不断深入,越来越多的相对禁忌证已逐渐转化为适应证。目前认为,可手术乳腺癌患者SLNB的禁忌证仅包括炎性乳腺癌、临床查体腋窝淋巴结阳性并经穿刺证实为转移且未接受新辅助治疗及腋窝淋巴结阳性新辅助治疗后仍为阳性的患者,cN2-3新辅助治疗后腋窝淋巴结临床阴性患者SLNB的准确性和安全性仍有待验证。腋窝淋巴结阳性和阴性患者均可进行内乳SLNB。
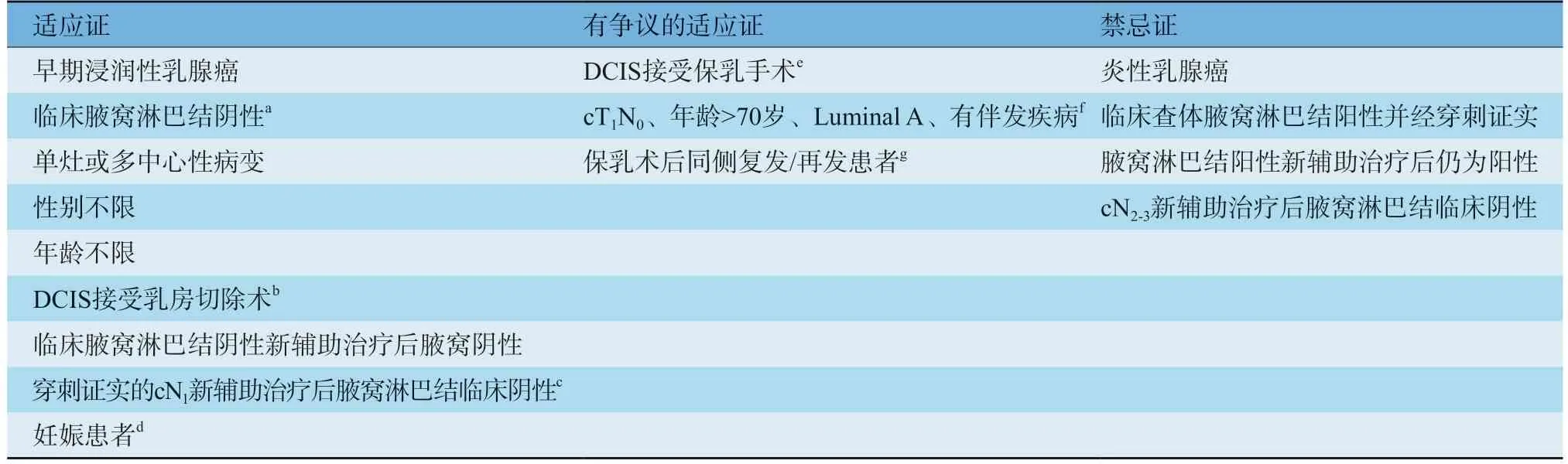
表1 SLNB指征
8.3 SLNB操作规范
8.3.1 示踪剂
乳腺癌SLNB的示踪剂包括蓝染料和核素示踪剂。首先推荐联合使用蓝染料和核素示踪剂,可以使SLNB的成功率提高、假阴性率降低。荧光示踪技术可作为可选的前哨示踪技术。纳米碳作为示踪剂的价值有待进一步证实。经过严格的学习曲线和熟练操作后,也可以单用蓝染料或核素示踪剂。
⑴ 蓝染料:国外较多使用专利蓝和异硫蓝,国内较多使用亚甲蓝(美兰),示踪用米托蒽醌示踪剂的成功率、准确性和安全性获得Ⅲ期临床试验证实。上述蓝染料示踪剂具有相似的成功率和假阴性率。
⑵ 核素示踪剂:推荐使用的是99mTc标记的硫胶体,要求煮沸5~10 min,标记率大于90%,标记核素强度(0.5~1.0)mCi/(0.5~2.0)mL。是否采用220 nm滤网过滤标记的硫胶体并不影响SLNB的成功率和假阴性率。核素示踪剂对患者、胎儿及医务人员均是安全的,不需要特别防护。
⑶ 注射部位:蓝染料和核素示踪剂注射于肿瘤表面的皮内或皮下、乳晕区皮内或皮下及原发肿瘤周围的乳腺实质内均有相似的成功率和假阴性率。如进行内乳区SLNB,需采用核素示踪剂、适当增加示踪剂并在超声引导下确保其注射于乳晕周围较厚的乳腺腺体层内。
⑷ 注射时间:核素示踪剂的注射时间一般要求术前3~18 h,采用皮内注射可以缩短到术前30 min。蓝染料示踪剂术前10~15 min注射。
⑸ 术前淋巴显像:乳腺癌SLNB术前可行淋巴显像,有助于确定腋窝以外的SLN、特别是保乳术后同侧复发/再发患者再次SLNB,但术前淋巴显像对于初次腋窝SLN的完全检出并非必需。
8.3.2 SLN术中确认与检出
无论是乳房切除手术,还是保乳手术,一般情况下,SLNB应先于乳房手术,特别是单用蓝染料示踪剂时。术中SLN的确定因示踪剂而异,染料法要求检出所有蓝染淋巴管进入的第1个蓝染淋巴结,仔细检出所有蓝染的淋巴管是避免遗漏SLN、降低假阴性率的关键。核素法SLN的阈值是超过淋巴结最高计数10%以上的所有淋巴结,术中γ探测仪探头要缓慢移动,有序检测,贴近计数。应用染料法和(或)核素法检出SLN后,应对腋窝区进行触诊,触诊发现的肿大质硬淋巴结也应作为SLN单独送检。
8.4 SLN的病理组织学、细胞学和分子生物学诊断
8.4.1 SLN的术中诊断
准确、快速的SLN术中诊断可以使SLN阳性患者通过一次手术完成ALND,避免二次手术的费用负担和手术风险。推荐使用冷冻快速病理组织学和(或)印片细胞学作为SLN术中诊断的检测方法。专家投票团对一步核酸扩增(OSNA)技术术中检测SLN的价值尚缺乏一致性认同。
由于1~2枚SLN阳性患者可以有条件地避免ALND,SLN术中诊断的必要性有所降低。多数专家认为符合避免ALND条件的患者可以考虑不行SLN术中诊断,但进行术中评估也是合理的选择。
8.4.2 SLN的术后诊断
SLN术后病理组织学诊断的金标准是逐层切片病理学检查,建议所有单位对SLN进行规范化取材。推荐将SLN沿长轴切分成2 mm厚的组织块。不推荐常规应用免疫组织化学技术以提高SLN微小转移灶的检出。
8.5 SLN转移灶类型判定标准、预后意义及临床处理
8.5.1 SLN转移灶类型判定标准[AJCC(第8版)乳腺癌TNM分期]
转移灶的位置不影响宏转移、微转移及ITC的诊断。转移灶可以位于淋巴结内、突破被膜或淋巴结外脂肪侵犯;转移灶伴纤维间质反应时,转移灶大小应为肿瘤细胞和相连纤维化病变的长径。
⑴ 宏转移:淋巴结内存在1个以上>2 mm肿瘤病灶;仅有ITC的淋巴结不作为pN分期阳性淋巴结,但应另外记录为ITC。仅依据SLNB分期或SLN加非前哨淋巴结(non SLN,nSLN)<6个,加标记(sn),如pN1(sn);SLN≥6个,不再另加标记(sn)。不推荐可能含有宏转移的淋巴结接受分子诊断等其他的试验或替代检测,其可能使常规病理学诊断漏诊宏转移;如果使用,应予登记。
⑵ 微转移:肿瘤病灶最大径大于0.2 mm,但≤2.0 mm,或单张组织切片不连续,或接近连续的细胞簇≥200个细胞。记录只发现微转移(无宏转移)的淋巴结数目,标记为pN1mi或pN1mi(sn);多个转移灶时,测量最大转移灶的最大径,不能累计。
⑶ ITC:单个细胞或最大径≤0.2 mm的小细胞簇;单张组织切片不连续或接近连续的细胞簇<200个细胞,淋巴结不同纵/横切片或不同组织块不能累计计数;通常没有或很少组织学间质反应;可通过常规组织学或免疫组织化学法检出。记录ITC受累淋巴结数目,标记为pN0(i+)或pN0(i+)(sn);使用分子生物学技术(实时定量PCR)检出组织学阴性淋巴结的微小转移灶,标记为pN0(mol+)。
8.5.2 SLN不同转移类型的预后意义及腋窝处理
⑴ 宏转移:约30%的患者腋窝nSLN阳性。ALND是标准处理之一,特别是通过ALND进一步获得的预后资料将改变治疗决策。对于未接受过新辅助治疗的临床T1-2期、临床腋窝淋巴结为阴性、病理学检查1~2枚SLN宏转移且会接受后续进一步辅助全乳放疗及全身系统性治疗的保乳患者,可免除ALND。对于接受乳房切除术的1~2枚SLN宏转移患者,如果ALND获得的预后资料不改变治疗决策且患者同意不行ALND,腋窝放疗可以作为ALND的合理替代。
⑵ 微转移:13%~20%的患者腋窝nSLN阳性,且约10%为宏转移,ALND可导致15%的患者分期提高,7%的患者辅助治疗改变。SLN微转移患者接受保乳治疗(联合全乳放疗)时,可不施行ALND;SLN微转移且后续仅行全乳切除未放疗时,大多数中国专家的意见倾向于腋窝处理同宏转移患者。
⑶ ITC:腋窝nSLN转移的概率小于8%(大于5 mm的浸润性导管癌),ALND可导致4%的患者分期提高。目前认为ITC对患者预后有不良影响,与微转移患者一样可以通过辅助全身治疗获益,但ITC患者不接受腋窝治疗其腋窝复发率并无显著升高,故不推荐常规施行ALND。
⑷ 初始SLN阴性:无需进行腋窝处理。
⑸ 新辅助治疗:
①初始临床腋窝淋巴结阴性患者:SLN阴性患者可以避免ALND及区域放疗;SLN阳性,包括宏转移、微转移及ITC患者,ALND仍是标准治疗;新辅治疗前1枚SLN宏转移、微转移及ITC患者,可以考虑腋窝放疗替代ALND。新辅助治疗前还是治疗后实施SLNB,两种方式在SLN检出率、准确性、手术次数、对初始疾病分期的确切性上各有利弊,推荐首选新辅助治疗后SLNB。对于新辅助治疗前行SLNB,病理学检查证实SLN为阴性的患者,新辅助治疗后如临床淋巴结阴性则不再手术评估腋窝状态;新辅助治疗前行SLNB并且病理学检查确认为1~2枚阳性SLN的临床T1-2期乳腺癌、新辅助治疗有效且计划接受保乳术后全乳放疗或乳房切除术后腋窝放疗的患者,可以考虑免除ALND;新辅助治疗前SLNB检出3枚及以上阳性SLN的患者,ALND是标准的腋窝处理。不推荐新辅助治疗前、后进行两次SLNB。② 初始临床腋窝淋巴结阳性患者:并非所有临床淋巴结阳性的患者都适合新辅助治疗降期后的SLNB,临床淋巴结分期为cN2期及以上的患者新辅助治疗后淋巴结活检有效性尚缺乏大样本量的研究。对于新辅助治疗前cN1期的患者,更适合通过新辅助治疗降期保腋窝。满足以下条件的SLN阴性患者,经与患者充分沟通后可以避免ALND:cT1-3N1期,双示踪剂显像,检出≥3枚SLN,新辅助化疗前穿刺活检阳性的腋窝淋巴结放置标记夹并于术中检出。如新辅助治疗后行SLNB并确认为阴性(ypN0),大多数专家目前仍推荐术后对腋窝Ⅰ、Ⅱ群范围予以辅助放疗;若经穿刺证实cN1患者新辅助治疗后SLN病理组织学检查证实转移(包括宏转移、微转移及ITC),应行ALND。经穿刺证实的cN1、新辅助治疗无效患者,ALND仍是最佳的选择。
8.6 SLNB替代ALND患者的随访
除常规复查项目外,常规行双侧腋窝、锁骨区超声检查,有条件的可考虑MRI检查。临床或超声检查发现异常腋窝淋巴结,应在超声引导下行细针穿刺或空芯针活检,必要时行切开活检手术。
9 乳腺癌全乳切除术后放疗临床指南
9.1 适应证
全乳切除术后放疗可以使腋窝淋巴结阳性患者的5年局部-区域复发率降低到原来的1/4~1/3。全乳切除术后,如具有下列预后因素之一,则符合高危复发,具有术后放疗指征,该放疗指征与全乳切除的具体手术方式无关:
⑴ 原发肿瘤最大直径≥5 cm,或肿瘤侵及乳房皮肤、胸壁。
⑵ 腋窝淋巴结转移≥4枚。
⑶ 淋巴结转移1~3枚的T1-2期,现有证据支持术后放疗可降低局部复发率、任何部位的复发及乳腺癌相关死亡,然而对低危亚组需权衡放疗获益和风险。术后放疗可能在存在以下情况的患者中更有意义:年龄≤40岁,ALND数目<10枚时转移比例>20%,激素受体阴性,HER2过表达,组织学分级高,以及LVI阳性等。对于合并存在多个低危复发的因素的患者,如老年,肿瘤大小为T1,脉管癌栓阴性,1枚或少量淋巴结转移(如淋巴结微转移或ITC),组织学分级低,激素受体强阳性及有限生存期等,需要在充分告知患者术后放疗的获益、治疗风险及并发症之后可考虑免除局部放疗。
⑷ T1-2期乳腺单纯切除联合SLNB,如SLN阳性,在不考虑后续腋窝清扫时,推荐术后放疗;如不考虑放疗,则推荐进一步腋窝清扫。
9.2 与全身治疗的时序配合
具有全乳切除术后放疗指征的患者一般都具有辅助化疗适应证,所以术后放疗应在完成末次化疗后2~4周内开始。个别有辅助化疗禁忌证的患者可以在术后切口愈合、上肢功能恢复后开始放疗。内分泌治疗与放疗的时序配合目前没有明确共识,可以在放疗同期或放疗后开始。HER2阳性患者有靶向药物治疗指征者,如曲妥珠单抗等在放疗前评估心功能正常则靶向药物可以与放疗同期使用;同时对于接受靶向治疗的左侧患者内乳区放疗适应证应严格掌握,尽可能采用三维治疗技术以降低心脏照射体积,评估心脏照射平均剂量尽量低于6 Gy。
9.3 照射靶区
⑴ 由于胸壁和锁骨上是全乳切除术后最常见的复发部位,约占所有复发部位的80%,所以这两个区域是术后放疗的主要靶区;但病理学分期为T3N0的患者可以考虑单纯胸壁照射,免除区域淋巴结放疗作为个体化处理。
⑵ 内乳放疗适应证仍有争议,术中内乳淋巴结活检的研究显示,内乳淋巴结阳性率根据肿瘤所在象限不同为10%~40%,但全身系统性治疗后内乳淋巴结复发率小于5%,最近的前瞻性多中心术后辅助放疗的研究都将内乳野纳入治疗靶区,结果显示局部和长期生存获益。因此,对于治疗前影像学诊断内乳淋巴结转移可能性较大或经术中快速冷冻切片病理学检查证实为内乳淋巴结转移的患者,抑或原发肿瘤位于内侧象限同时腋窝淋巴结有转移或其他内乳淋巴结转移概率较高的患者,推荐内乳野照射。原则上对于HER2过表达的患者为避免抗HER2治疗和内乳照射心脏毒性的叠加,推荐采用三维治疗技术,尽可能降低心脏受照平均剂量。
9.4 照射剂量和照射技术
全乳切除术后放疗靶区的常规放疗剂量为50.0 Gy/25次(2.0 Gy/次),对于影像学(包括功能性影像)上高度怀疑有残留或复发病灶的区域可局部加量至60.0~66.0 Gy。
乳腺癌大分割放疗临床研究数据显示,大分割放疗在局部控制、生存及不良反应各方面都与常规放疗相似,因此,对于全乳切除术后的分次放疗剂量在常规剂量的2.0 Gy/次以外,可推荐采用中等程度的分次大分割剂量,即分次剂量为2.5 Gy~3.0 Gy,但最终的放疗总剂量应等效于常规放疗2.0 Gy/次时的总剂量,即50.0 Gy。
9.4.1 三维适形照射技术
与常规二维治疗相比,基于CT定位的三维治疗计划可以显著地提高靶区剂量均匀性和减少正常组织不必要的照射,提高射野衔接处剂量的合理性,因此在医疗软件和硬件许可的情况下,首先推荐采用三维治疗计划和照射技术。可采用的计划类型包括三维适形放疗(3-dimensional conformal radiation therapy,3D-CRT)和适形调强放射治疗(intensitymodulated radiation therapy,IMRT)。调强技术设计包括正向调强、逆向调强及容积弧形调强技术,有条件的单位在计划和治疗时可加入呼吸控制技术-主动呼吸门控或被动呼吸控制,以进一步提高靶区治疗的精确性和降低正常组织的照射剂量。胸壁和区域淋巴结靶区勾画可以参照美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)和(或)欧洲放射肿瘤学会(European Society Therapeutic Radiation Oncology,ESTRO)勾画指南。正常组织的勾画包括脊髓、双侧肺部、心脏及肱骨头等,后续需要在治疗计划中评估正常组织的照射剂量。如果采用逆向优化计划或容积弧形调强计划(Arc计划),需注意控制照射野的角度,尽量避免对侧乳腺和其他正常组织不必要的照射。如选择常规定位(二维定位),也建议定位后在定位CT上扫描并在三维治疗计划系统上进行剂量参考点的优化、楔形滤片角度的选择和正常组织体积剂量的评估等,以更好地达到靶区剂量的完整覆盖和放射损伤的降低。
9.4.2 常规照射技术
⑴ 锁骨上/下野:上界为环甲膜水平,下界位于锁骨头下1 cm与胸壁野上界相接,内界为胸骨切迹中点沿胸锁乳突肌内缘向上,外界与肱骨头相接,照射野需包括完整的锁骨。可采用X线和电子线混合照射以减少肺尖的照射剂量。治疗时头部偏向健侧以减少喉照射,机架角向健侧偏斜10°~15°以保护气管、食管和脊髓。射野内上边界必要时沿胸锁乳突肌走向设铅挡保护喉和脊髓。
⑵ 胸壁切线野:上界与锁骨上野衔接,如单纯胸壁照射上界可达锁骨头下缘,下界为对侧乳腺皮肤皱折下1 cm。内界一般过体中线,外界为腋中线或腋后线,参照对侧腺体附着位置。与保乳术后的全乳照射相同,各边界也需要参考原发肿瘤的部位进行调整,保证原肿瘤部位处于剂量充分的区域,同时需要包括手术瘢痕。胸壁照射如果采用电子线照射,各设野边界可参照高能X线切线野边界。无论采用X线或电子线照射,都需要给予胸壁组织等效填充物以提高皮肤剂量至足量。
⑶ 腋窝照射,非常规根治术后放疗野,如腋下清扫不彻底或存在腋下肿瘤累及/包膜外侵犯等腋下高危复发因素时考虑采用,需注意手术和放疗后腋下臂丛神经损伤及上肢淋巴水肿等长期并发症的可能:①锁骨上和腋窝联合野,照射范围包括锁骨上/下和腋窝,与胸壁野衔接。腋锁联合野的上界和内界都同锁骨上野,下界在第二肋间,外界包括肱骨颈,需保证射野的外下角开放。采用6 MV的X线,锁骨上/下区深度以皮下3~4 cm计算,达到锁骨上区肿瘤量50 Gy(5周,25次)的剂量后,腋窝深度根据实际测量结果计算,欠缺的剂量采用腋后野补量至DT 50 Gy,同时锁骨上区缩野至常规锁骨上野范围,采用电子线追加剂量至50 Gy。② 腋后野作为腋锁联合野的补充,采用6 MV的X线,上界平锁骨下缘,内界位于肋缘内1.5 cm,下界同腋窝-锁骨联合野的下界,外界与前野肱骨头铅挡相接,一般包括约1 cm肱骨头。光栏转动以使射野各界符合条件。
⑷ 内乳野:常规定位的内乳野需包括第一至第三肋间,上界与锁骨上野衔接,内界过体中线0.5~1.0 cm,宽度一般为5.0 cm,原则上2/3及以上剂量需采用电子线以减少心脏的照射剂量。
9.5 乳腺癌新辅助治疗、改良根治术后放疗
放疗指征主要综合参考新辅助治疗前的初始分期和新辅助化疗及术后病理学改变的情况,新辅助治疗前初始分期为Ⅲ期及新辅助治疗前后明确淋巴结持续阳性的患者,推荐术后放疗。对于初始腋下淋巴结临床或病理学穿刺活检阳性患者,如腋下淋巴结在新辅助治疗后达到病理学完全缓解(pathological complete response,pCR),目前仍可推荐术后放疗。对于初始分期Ⅰ、Ⅱ期治疗前腋下淋巴结临床及病理学检查评估为阴性,手术治疗后淋巴结阴性的患者目前不推荐术后辅助放疗。放疗技术与未接受新辅助治疗的改良根治术后放疗相同,放疗剂量推荐为常规放疗剂量50 Gy/25次(2 Gy/次),对于影像学(包括功能性影像)上高度怀疑有残留或复发病灶的区域可局部加量至60~66 Gy。
对于有辅助化疗指征的患者,术后放疗推荐在完成辅助化疗后进行;如果无辅助化疗指征,在切口愈合良好,上肢功能恢复的前提下,术后放疗建议在术后8周内尽早开始。与靶向治疗和内分泌治疗的时间配合同保乳治疗或无新辅助化疗的改良根治术后放疗。
9.6 乳房重建术与术后放疗
原则上无论采用哪种手术方式,乳房重建患者的术后放疗指征和靶区都同于非同期重建的乳房切除术后患者。无论是自体组织或假体重建术,都不是放疗的禁忌证。采用自体皮瓣重建术后放疗后的重建失败率小于3%,因此术后放疗可安全地应用于自体皮瓣重建术后的患者。当采用假体重建时,由于放疗以后组织的血供和顺应性下降,总的放疗后假体植入取出率约为10%。采用扩张器-永久性假体二步法重建的患者,扩张器替换成永久性假体可以在术后放疗之前或之后,该时序目前没有绝对定论,取决于整个团队对技术的熟悉程度和经验。
乳房重建以后放疗的技术可以参照保乳术后的全乳放疗,由于重建的乳房后期美容效果在很大程度上取决于照射剂量,而重建后放疗的患者一般都有淋巴引流区的照射指征,所以尽可能提高靶区剂量均匀性,避免照射野衔接处的热点,是减少后期并发症的关键。在这个前提下,推荐采用三维治疗技术,尽可能将淋巴引流区的照射整合到三维治疗计划之中。重建术后的放疗剂量推荐为常规放疗剂量50 Gy/25次(2 Gy/次),对于影像学(包括功能性影像)上高度怀疑有残留或复发病灶的区域可局部加量至60~66 Gy。
10 乳腺癌全身治疗指南
10.1 乳腺癌术后辅助全身治疗临床指南
10.1.1 乳腺癌术后辅助全身治疗的选择
乳腺癌术后辅助全身治疗的选择应基于复发风险的个体化评估、肿瘤病理学的分子分型以及对不同治疗方案预期的反应性。
乳腺癌术后复发风险的分组见表2。该表可用于全面评估患者手术以后复发风险的高低,是制定全身辅助治疗方案的重要依据。乳腺癌分子分型的判定见表3。医师应根据患者的分子分型及复发风险选择相应的化疗、内分泌治疗、抗HER2治疗,以及选择是否进行和采纳何种强化治疗。

表2 乳腺癌复发转移风险评估

表3 乳腺癌分子分型的标志物检测和判定
10.1.2 乳腺癌术后辅助化疗的临床指南
10.1.2.1 乳腺癌术后辅助化疗的人群选择(表4)

表4 术后推荐辅助化疗的人群
多基因检测工具(Oncotype D X®、MammaPrint®等)有助于指导辅助化疗的决策,但推荐使用具备相应资质的检测工具,并期待基于中国人群的检测数据及其预后预测价值分析。对于不具备条件或不愿意接受多基因检测工具检测的患者,辅助化疗与否应综合考虑肿瘤的临床病理学特征、患者生理条件和基础疾患、患者的意愿、化疗的可能获益和不良反应等进行决策。随着二代测序技术的普及和检测费用降低,易感风险基因检测的成本效益将会显著提高,患者年龄将逐渐成为非限制因素。如需要进行易感性咨询与风险评估、并期望针对BRCA致病突变携带者进行多腺苷二磷酸核糖聚合酶[poly(ADPribose)polymerase,PARP]抑制剂靶向治疗时,推荐行BRCA等遗传易感基因检测。
10.1.2.2 乳腺癌术后辅助化疗的禁忌证
⑴ 妊娠期:妊娠早期患者通常禁用化疗,妊娠中期患者应慎重选择化疗。
⑵ 明显衰竭或恶病质。
⑶ 患者拒绝术后辅助化疗。
⑷ 有严重感染、高热、水电解质及酸碱平衡失调的患者。
⑸ 胃肠道梗阻或穿孔者。
⑹ 骨髓储备功能低下,治疗前白细胞≤3.5×109/L,血小板≤75×109/L者。
⑺ 心血管、肝肾功能严重损害者。
10.1.2.3 乳腺癌术后辅助化疗的治疗前谈话
⑴ 辅助化疗的目的是降低肿瘤复发率,提高总生存率。
⑵ 化疗的不良反应。
⑶ 年龄大于70岁的患者接受化疗可能会有获益,但应慎重权衡化疗的利弊。
10.1.2.4 乳腺癌术后辅助化疗的治疗前准备
⑴ 首次化疗前应充分评估患者的脏器功能,检测项目包括血常规、肝肾功能及心电图等。以后每次化疗前均应进行血常规和肝肾功能检查,使用心脏毒性药物前应常规做心电图和(或)左心室射血分数(left ventricular ejection fraction,LVEF)测定,其他检查应根据患者的具体情况和所使用的化疗方案等决定。
⑵ 育龄妇女应确认妊娠试验阴性并嘱避孕。
⑶ 签署抗肿瘤治疗知情同意书。
10.1.2.5 乳腺癌术后辅助化疗的方案(附录Ⅵ)
常用方案有:
①以蒽环类药物为主的方案,如AC(多柔比星/环磷酰胺)、EC(表柔比星/环磷酰胺)。虽然吡柔比星(THP)循证医学资料有限,但在我国日常临床实践中,用THP代替多柔比星也是可行的,THP推荐剂量为40~50 mg/m2。5-氟尿嘧啶在辅助治疗中的价值已逐渐不被认可(GIM-2试验及NSABP B-36试验)。② 蒽环类与紫杉类药物联合方案,如TAC(T:多西他赛)。③蒽环类与紫杉类药物序贯方案,如AC→紫杉醇(每周1次),AC→多西他赛(每3周1次),剂量密集型AC继以紫杉醇(每2周1次),剂量密集型AC继以紫杉醇(每周1次)。CALGB 9741研究及EBCTCG meta分析提示,剂量密集型化疗可以给患者带来更多的获益,因此临床实践中,对于三阴性乳腺癌及淋巴结阳性的患者,优先推荐剂量密集型化疗作为辅助治疗方案。④ 不含蒽环类药物的联合化疗方案:TC方案(多西他赛/环磷酰胺4或6个疗程),适用于有一定复发风险、蒽环类药物禁忌或不能耐受的患者;PC方案(每周紫杉醇/卡铂,见PATTERN研究),可考虑在三阴性乳腺癌中使用;CMF方案(环磷酰胺/甲氨蝶呤/5-氟尿嘧啶)目前很少采用。⑤ 卡培他滨的强化(联合或序贯)可考虑在三阴性乳腺癌中使用,例如CBCSG010研究中蒽环序贯多西紫杉醇同时联合使用卡培他滨,SYSUCC001研究中在辅助静脉化疗后单药卡培他滨1年,以及CREATE-X研究中新辅助化疗non-pCR人群单药卡培他滨8个疗程等。⑥ 奥拉帕利在致病/疑似致病gBRCA突变高危患者中的强化治疗,OlympiA研究提示在HER2阴性新辅助治疗后nonpCR患者,或直接手术的三阴性乳腺癌[≥pT2和(或)≥pN1]与Luminal型(≥pN2),1年的奥拉帕利可显著改善3年的无侵袭性疾病生存率(invasive disease-free survival,iDFS)达8.8%,但该药目前尚未获得辅助治疗适应证批准。⑦ 白蛋白结合型紫杉醇在出于医学上的必要性时(如减少过敏反应等)可尝试替代紫杉醇或多西他赛,但使用时周疗剂量不应超过125 mg/m²。
⑵ HER2阳性乳腺癌常用方案参见:10.1.4乳腺癌术后辅助抗HER2治疗临床指南中的相应内容。
10.1.2.6 乳腺癌术后辅助化疗的注意事项
⑴ 若无特殊情况,一般不建议减少化疗的周期数。
⑵ 在门诊病历和住院病史中应当记录患者当时的身高、体重及体表面积,并给出药物的每平方米体表面积的剂量强度。一般推荐首次给药剂量应按推荐剂量使用,若有特殊情况需调整时不得低于推荐剂量的85%,后续给药剂量应根据患者的具体情况和初始治疗后的不良反应,可一次性下调20%。每个辅助化疗方案仅允许剂量下调2次。
⑶ 辅助化疗一般不与内分泌治疗或放疗同时进行,化疗结束后再开始内分泌治疗,放疗与内分泌治疗可先后或同时进行。
⑷ 化疗时应注意化疗药物的给药顺序、输注时间和剂量强度,严格按照药品说明和配伍禁忌使用。
⑸ 绝经前患者(包括激素受体阳性或阴性),在辅助化疗期间可考虑使用卵巢功能抑制(ovarian function suppression,OFS)药物保护患者的卵巢功能。推荐化疗前1~2周给药,化疗结束后2周给予最后1剂药物。有妊娠需求的患者,推荐至辅助生殖科咨询。
⑹ 蒽环类药物有心脏毒性,使用时必须评估LVEF,至少每3个月1次。如果患者使用蒽环类药物期间发生有临床症状的心脏毒性,或无症状但LVEF<45%或较基线下降幅度超过15%,可考虑检测心肌肌钙蛋白T(cardiac troponin T,cTnT),必要时应先停药并充分评估患者的心脏功能,后续治疗应慎重。
⑺ 中国专家团认为三阴性乳腺癌的优选化疗方案是含紫杉类药物和蒽环类药物的剂量密度方案。大多数Luminal B(HER2阴性)乳腺癌患者需要接受术后辅助化疗,方案应包含蒽环类和(或)紫杉类药物。
10.1.3 乳腺癌术后辅助内分泌治疗临床指南
10.1.3.1 乳腺癌术后辅助内分泌治疗的人群选择
激素受体ER和(或)PR阳性的乳腺癌患者。皆应接受术后辅助内分泌治疗。依据最新美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)/美国病理学家协会(College of AmericanPathologists,CAP)指南,尽管ER IHC染色为1%~100%的肿瘤皆被视为ER阳性,但ER IHC染色为1%~10%为ER低表达。ER低表达时生物学行为通常与ER阴性乳腺癌相似,在术后辅助内分泌治疗中的获益较少,在做治疗决策时也应当考虑到这一点。
10.1.3.2 乳腺癌术后辅助内分泌治疗前谈话
⑴ 辅助内分泌治疗的目的是降低肿瘤复发率,提高无病生存率和总生存率。
⑵ 内分泌治疗的不良反应。
10.1.3.3 乳腺癌术后辅助内分泌治疗与其他辅助治疗的次序
辅助内分泌治疗与化疗同时进行可能会降低疗效,一般在化疗之后进行,但可以与放疗(他莫昔芬除外)及曲妥珠单抗治疗(±其他抗HER2治疗)同时进行。没有明确证据显示黄体生成素释放激素类似物(luteinizing hormonereleasing hormone analogue,LHRHa)与化疗药物合用会降低疗效,但单独化疗诱导的OFS也许会增加内分泌治疗的效果。
10.1.3.4 乳腺癌术后辅助内分泌治疗的方案
绝经前患者辅助内分泌治疗的方案:
⑴ 辅助内分泌治疗有3种选择:他莫昔芬、OFS加他莫昔芬、OFS加第三代芳香化酶抑制剂。OFS药物推荐用于高复发风险的患者,具体需综合考量年龄、肿块大小、淋巴结状态、组织学分级、Ki-67增殖指数等,亦可采用STEPP评分评估,具体可参见《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2018年版)》。对于年轻(<35岁)的乳腺癌患者,更推荐OFS加芳香化酶抑制剂。根据多基因检测的结果,国内外专家也认为有不利因素的亦可考虑加用OFS药物。
⑵ 使用他莫昔芬的患者,治疗期间注意避孕,并每6~12个月行1次妇科检查,通过B超检查了解子宫内膜厚度。服用他莫昔芬5年后,如患者仍处于绝经前状态,部分患者(如高危复发)可考虑延长服用期至10年。目前尚无证据显示,服用他莫昔芬5年后的绝经前患者,后续应用OFS药物联合第三代芳香化酶抑制剂会进一步使患者受益。托瑞米芬在绝经前乳腺癌辅助治疗中的价值尚待大型临床研究的确认,在中国日常临床实践中,托瑞米芬常被用于代替他莫昔芬。
⑶ OFS方式有药物去势、手术切除卵巢、卵巢放射线照射(推荐药物性卵巢去势作为首选)。若采用药物性OFS,目前推荐的治疗时间是5年,但中危患者也可选择使用2~3年。对于接受了5年药物性OFS+他莫昔芬/AI治疗的特别高危的绝经前患者,尽管没有较强的循证医学证据,后续也可以考虑延长他莫昔芬单药治疗,或继续维持原方案的延长治疗。绝经前患者在使用GnRHa过程中,无需定期进行雌激素水平检测。药物性卵巢去势,专家团投票认为1月剂型和3月剂型疗效基本相似。
⑷ 高危患者应用他莫昔芬5年后,如处于绝经后状态可继续服用芳香化酶抑制剂5年,未绝经可继续使用他莫昔芬满10年。
⑸ 芳香化酶抑制剂和LHRHa可导致骨密度(bone mineral density,BMD)下降或骨质疏松,因此在使用这些药物前常规推荐BMD检测,以后在药物使用过程中,每12个月监测1次BMD,并进行BMD评分(T-score)。T-score小于-2.5,为骨质疏松,可开始使用双膦酸盐或地舒单抗(denosumab)治疗;T-score为-2.5~-1.0,为骨量减低,给予维生素D和钙片治疗,并考虑使用双膦酸盐;T-score大于-1.0,为骨量正常,不推荐使用双膦酸盐。
⑹ 绝经前患者内分泌治疗过程中,因月经状态改变可能引起治疗调整。
绝经后患者辅助内分泌治疗的方案:
⑴ 第三代芳香化酶抑制剂可以向所有绝经后的ER和(或)PR阳性患者推荐,尤其是具有以下情况的患者:①高复发风险患者;② 对他莫昔芬有禁忌的患者或使用他莫昔芬后出现中、重度不良反应的患者;③使用他莫昔芬20 mg/d×5年后的高风险患者。
⑵ 芳香化酶抑制剂可以从一开始就应用5年(来曲唑、阿那曲唑或依西美坦)。不同种类的芳香化酶抑制剂都可选择,药物耐受性和安全性是保障长期内分泌治疗效果的关键。Ⅰ期患者通常建议5年辅助内分泌治疗。对于Ⅱ期淋巴结阴性患者,如初始采用他莫昔芬5年治疗,可推荐芳香化酶抑制剂或他莫昔芬5年;如初始采用5年芳香化酶抑制剂的患者,或采用他莫昔芬治疗2~3年后再转用芳香化酶抑制剂满5年的患者无需常规推荐延长内分泌治疗。对于Ⅱ期淋巴结阳性患者,无论其前5年内分泌治疗策略如何,均推荐后续5年芳香化酶抑制剂的延长治疗。对于Ⅲ期患者,推荐5年芳香化酶抑制剂的延长治疗。延长治疗的患者,其内分泌治疗总时长为8~10年。
⑶ 选用他莫昔芬20 mg/d×5年,是有效而经济的治疗方案。治疗期间应每6~12个月行1次妇科检查,通过B超检查了解子宫内膜厚度。
⑷ 对于≥4个阳性淋巴结的ER阳性乳腺癌患者,无论绝经前或绝经后,均可考虑在标准辅助内分泌治疗基础上增加CDK4/6抑制剂阿贝西利强化2年;1~3个淋巴结阳性且伴有G3/T3/Ki-67≥20%至少一项高危因素的ER阳性患者使用阿贝西利强化也可考虑。
10.1.4 乳腺癌术后辅助抗HER2治疗临床指南
10.1.4.1 乳腺癌术后辅助抗HER2治疗的人群选择
HER2阳性患者的辅助治疗策略可参考表5。

表5 HER2阳性患者辅助治疗策略
HER2阳性是指免疫组织化学法(immunohistochemistry,IHC)检测结果3+,或2+且原位杂交法(in situhybridization,ISH)检测结果阳性。
ISH检测结果判读可参考表6。

表6 ISH检测结果判读
10.1.4.2 乳腺癌术后辅助抗HER2治疗的相对禁忌证
⑴ 治疗前LVEF<50%。
⑵ 患者拒绝术后辅助靶向治疗。
10.1.4.3 乳腺癌术后辅助抗HER2治疗前谈话
⑴ 目前多项临床研究结果显示,对于HER2蛋白过表达或有基因扩增(判定为HER2阳性)的乳腺癌患者,采用为期1年的曲妥珠单抗±帕妥珠单抗辅助治疗可以降低乳腺癌的复发率,部分研究显示,特定人群奈拉替尼延长治疗1年或新辅助治疗后未达pCR的患者使用T-DM1强化可进一步降低复发风险。
⑵ HER2状态确认的重要性及其检测费用。
10.1.4.4 乳腺癌术后辅助抗HER2治疗前准备
⑴ 精确的HER2检测。建议将浸润性乳腺癌组织的石蜡包埋标本(蜡块或白片)送往国内有条件的病理科进行复查。
⑵ 心功能检查(心脏超声或核素扫描,以前者应用更为普遍)。
⑶ 签署抗肿瘤治疗知情同意书。
10.1.4.5 乳腺癌术后辅助抗HER2治疗方案
⑴ 曲妥珠单抗用于HER2阳性患者的辅助治疗;淋巴结阴性、0.5 cm<原发浸润灶≤2.0 cm、HER2阳性时,推荐使用曲妥珠单抗,可以考虑每周紫杉醇或TC×4+曲妥珠单抗辅助治疗使用(此处C为环磷酰胺);淋巴结阴性、原发肿瘤<0.5 cm时,可以考虑使用曲妥珠单抗,但证据有限;肿瘤体积小但有淋巴结微转移的患者,可考虑每周紫杉醇或TC×4+曲妥珠单抗辅助治疗。确定HER2阳性小肿瘤是否选择短程化疗联合曲妥珠单抗时,需注意个体化,具体的浸润灶大小、ER状态、患者年龄等都是决策的参考因素。曲妥珠单抗6 mg/kg(首次剂量8 mg/kg)每3周方案,或2 mg/kg(首次剂量4 mg/kg)每周方案。目前推荐的治疗时间仍为1年,可与化疗同时使用或化疗后序贯使用,更推荐同时使用。6 个月的短疗程用法仅在PERSEPHONE研究中证实与1年疗程相比具有非劣效性,而2年的疗程未得到更佳的预后获益,故这两种时长均暂不推荐。
⑵ 对于有高危复发风险(如淋巴结阳性)的患者,推荐曲妥珠单抗与帕妥珠单抗双靶向治疗联合辅助化疗(常用的化疗方案为:蒽环类药物序贯紫杉类药物EC-P或紫杉类药物联合卡铂TCb),其中帕妥珠单抗,3周1次,剂量为420 mg(首次剂量为840 mg),共1年;淋巴结阴性的HER2阳性患者,当伴有其他不良预后指标(如Ki-67增殖指数>30%、G3、pT2+等)时,也可推荐HP辅助双靶治疗;具有中高复发风险的患者,特别是ER阳性,亦可考虑在曲妥珠单抗治疗结束后,给予1年的酪氨酸激酶抑制剂如奈拉替尼强化治疗。
⑶ 对新辅助治疗未达到pCR的HER2阳性患者,可使用T-DM1(每3周1次,共14次)替代曲妥珠单抗。虽然证据有限,当T-DM1未可及时,可以考虑加用酪氨酸激酶抑制剂(如奈拉替尼)辅助强化治疗。
⑷ 担心心脏毒性者可选择心脏毒性相对较低的去蒽环类药物方案:TCbH、TC4H(此处C为环磷酰胺)和wPH治疗方案(见APT研究:紫杉醇周疗加曲妥珠单抗方案)。
⑸ 曲妥珠单抗生物类似药,可按照国内获批的说明书上适应证使用。
10.1.4.6 乳腺癌术后辅助抗HER2治疗的注意事项
⑴ 首次治疗后观察4~8 h。
⑵ 与蒽环类药物同期应用必须慎重,但可以在前、后阶段序贯应用。与非蒽环类药物化疗、内分泌治疗或放疗都可同期应用。
⑶ 每3个月监测1次LVEF。治疗中若出现LVEF<50%或低于治疗前16%以上,应暂停治疗,并跟踪监测LVEF动态变化,直至恢复到50%以上方可继续用药。若不恢复,或继续恶化或出现心力衰竭症状则应当终止曲妥珠单抗治疗。
10.2 乳腺癌新辅助治疗临床指南
10.2.1 乳腺癌新辅助治疗的人群选择
新辅助治疗的定义为未发现远处转移的乳腺癌患者,在计划中的手术治疗或手术加放疗的局部治疗前,以全身系统性治疗作为乳腺癌的第一步治疗。乳腺癌的新辅助治疗包括新辅助化疗、新辅助靶向治疗及新辅助内分泌治疗。在当前临床实践过程中,乳腺癌新辅助治疗的目的应该从实际的临床需求出发,以治疗的目的为导向,主要包括将不可手术乳腺癌降期为可手术乳腺癌,将不可保乳的乳腺癌降期为可保乳的乳腺癌,以及获得体内药敏反应的相关信息,从而指导后续治疗以期改善患者预后,而并非所有需要行辅助化疗的乳腺癌患者都适合推荐行新辅助化疗。
新辅助治疗适用人群:专家组认为对于新辅助治疗的适用人群,根据新辅助治疗的目的可分为必选人群和优选人群。其中必选对象是以临床降期为目的,降期后手术的患者(如局部晚期不可手术、主观上强烈要求的降期保乳和降期保腋窝);优选对象是能获得体内药敏信息,从而指导后续治疗的患者(如具有一定肿瘤负荷的HER2阳性/三阴性乳腺癌,新辅助治疗non-pCR后可予以辅助强化治疗)。基于目前循证医学的证据,相同方案和疗程的新辅助治疗的效果与辅助治疗的效果是一样的,且可以使部分不能保乳的患者获得保乳的机会,部分不可手术的患者获得手术的机会;新辅助治疗后未达pCR的患者有机会使用强化治疗方案进一步降低复发和死亡风险;但是一部分患者(小于5%)在新辅助治疗的过程中可能出现进展,甚至丧失接受手术治疗的机会。并非所有需要行辅助治疗的乳腺癌患者都适合推荐行新辅助治疗,也不适合将三阴性和HER2阳性型作为优选新辅助治疗的唯一依据,这两种分子分型当同时伴有较高肿瘤负荷时(如cT2及以上或cN1及以上)可考虑优选新辅助治疗。新辅助治疗有时亦可使不可保腋窝的乳腺癌有机会降期为可保腋窝,中国专家对此持审慎观点,认为实际操作过程中存在SLN评估假阴性率高、长期安全性数据不足等风险,并不常规推荐将已证实转移的区域淋巴结进行降期保腋窝作为新辅助治疗的目的。
对不可手术的隐匿性乳腺癌行新辅助治疗是可行的(其中隐匿性乳腺癌定义为腋窝淋巴结转移为首发症状,而乳房内未能找到原发灶的乳腺癌)。对于需要延迟手术的患者(如制订手术计划需要等待基因检测结果,以便有时间考虑重建方案)或不可避免地需要延迟手术的患者[2019冠状病毒(COVID-19)疫情],可以先行新辅助治疗。
10.2.2 乳腺癌新辅助治疗的禁忌证
⑴ 未经组织病理学确诊的乳腺癌。推荐进行组织病理学诊断,并检测ER、PR、HER2及Ki-67等免疫组织化学指标,不推荐将细胞学检查作为病理学诊断标准。
⑵ 妊娠早期女性为绝对禁忌。而妊娠中后期女性患者应慎重选择新辅助治疗,为相对禁忌,这方面国外有成功应用的个案报道。
⑶ 心血管、肝肾功能显著损害者。
⑷ 原位癌成分太多造成无法确认浸润性癌的大小或无法临床评估疗效者需谨慎使用。
⑸ 肿瘤的范围难以界定者。
⑹ 患者拒绝术前新辅助治疗。
⑺ 有严重感染、高热、水电解质及酸碱平衡紊乱的患者。
⑻ 骨髓储备不足,治疗前中性粒细胞≤1.5×109/L,血小板≤75×109/L者。
10.2.3 乳腺癌新辅助治疗前谈话
⑴ 为什么要做新辅助治疗:①新辅助治疗是局部晚期乳腺癌或炎性乳腺癌的规范疗法,可以使肿瘤降期以利于手术,或变不能手术为能手术;② 对于肿瘤较大且有保乳意愿的患者,新辅助治疗可以提高保乳率,需要严格掌握保乳适应证、遵照保乳手术规范综合治疗;③不可保腋窝的乳腺癌有机会降期为可保腋窝,中国专家对此持审慎观点,认为实际操作过程中存在SLN评估假阴性率高、长期安全性数据不足等风险,并不常规推荐将已证实转移的区域淋巴结进行降期保腋窝作为新辅助治疗的目的。④ 获得体内药物敏感性的相关信息,若新辅助治疗能达到pCR,则预示较好的远期效果(pCR和长期预后相关性较强的是三阴性和HER2阳性型乳腺癌);如未能达到pCR,可以指导后续强化治疗方案以期改善患者预后。
⑵ 新辅助治疗存在一定的疾病进展概率,推荐患者每个周期行临床查体评估,每2个疗程要进行1次影像学评估,以监测治疗反应。部分乳腺癌对新辅助治疗初始治疗方案不敏感:若2个周期化疗后肿瘤无变化或反而增大时,应根据实际情况考虑是否需要更换化疗方案或采用其他疗法。目前无充分证据表明血液和组织的生物学标志物可用于监测新辅助治疗的效果。
⑶ 接受有效的新辅助治疗之后,即便临床上肿瘤完全消失,也必须接受既定的后续治疗,包括手术治疗,并根据手术前后病理学检查结果决定进一步辅助治疗的方案。
10.2.4 乳腺癌新辅助治疗的实施
10.2.4.1 治疗前准备
⑴ 病灶基线体检。精确测量乳腺所有原发灶最长径和腋窝淋巴结的短径。
⑵ 基线影像学评估。超声和乳腺X线检查是不可或缺的,乳腺MRI准确率可达84%,对于需降期保乳的患者,应常规进行乳腺MRI检查。
⑶ 血常规、肝肾功能、心电图、胸部CT(平扫或增强)及肝脏超声检查。局部晚期乳腺癌或炎性乳腺癌患者建议加做全身骨扫描、胸部CT。脑评估或PET/CT尽管具有一定的提示意义,但由于影像学评价指标不统一和临床可及性欠佳,并非接受新辅助治疗患者的常规推荐检查项目。基线心功能检查(如心超测LVEF)是推荐的。
⑷ 治疗前必须对乳腺原发灶行空芯针活检(或真空辅助活检),诊断为浸润性癌或原位癌(可能存在组织学低估)同时伴有细针(或空芯针)穿刺证实的同侧腋窝淋巴结转移,明确组织学诊断及免疫组织化学检查(隐匿性乳腺癌除外)。
⑸ 肿大的区域淋巴结是否为乳腺癌转移,应通过细针(或空芯针)穿刺获得病理学证实。
⑹ 育龄妇女应确认妊娠试验阴性并嘱避孕。
⑺ 告知抗肿瘤治疗的不良反应,签署抗肿瘤治疗知情同意书。
⑻ 对患者原发灶的范围采用超声引导下放置金属标记物或表皮纹身的方式进行标识,为确定手术范围提供信息。
⑼ 可在新辅助治疗前对临床淋巴结阴性的患者进行腋窝SLNB,可以为后续的手术和全身治疗提供更多的参考。当前专家组推荐对于临床淋巴结阴性拟行新辅助治疗的患者,倾向在新辅助治疗后行SLNB手术,特别是三阴性及HER2阳性患者。
10.2.4.2 乳腺癌新辅助治疗的方案(附录Ⅵ)
应当依据患者乳腺癌分子分型、药物的可获得性、患者的个体情况进行新辅助治疗方案的设计。新辅助治疗方案包括:化疗联合或不联合靶向治疗(如HER2阳性联合抗HER2治疗、三阴性联合免疫治疗)、内分泌治疗联合或不联合靶向治疗(如HR阳性/HER2阳性可两者联合使用)、单纯抗HER2治疗(如HR阴性/HER2阳性)。
⑴ 对于HR阳性/HER2阴性的乳腺癌患者,有降期或保乳等需求的,如无需术后病理学检查结果和(或)肿瘤特异性基因检测结果就可以判断需要术后辅助化疗,优先推荐辅助化疗提前到新辅助阶段。新辅助内分泌治疗与新辅助化疗具有相似的临床缓解率,现有证据不支持新辅助内分泌治疗时常规联合CDK4/6抑制剂。特别需要指出的是,这类乳腺癌达到pCR的很罕见。绝经后患者通常使用AI进行新辅助内分泌治疗;绝经前患者除非进入临床研究或有化疗禁忌(可选OFS+AI/氟维司群),不应常规进行新辅助内分泌治疗。新辅助内分泌治疗的最佳持续时间尚不清楚,应该通过仔细评估患者的临床状态和随着时间推移的临床反应来确定个体化的给药时间,一般应持续3~6个月或至最佳疗效。
⑵ 对于拟行新辅助治疗的HER2阳性乳腺癌患者,应采用曲妥珠单抗联合帕妥珠单抗进行新辅助治疗,优选的化疗配伍为紫杉类药物联合卡铂(TCbHP、PCbHP),而蒽环类药物序贯紫杉类药物也是一种可选的方案(ECHP-THP)。不能耐受或不愿接受化疗的患者,HR阳性/HER2阳性可考虑内分泌治疗联合抗HER2治疗,HR阴性/HER2阳性可考虑单纯抗HER2治疗。
⑶ 对于拟行新辅助治疗的三阴性乳腺癌患者,推荐含蒽环类药物和紫杉类药物的常规方案(EC-T、EC-P)。铂类药物可作为三阴性乳腺癌患者新辅助治疗方案的一部分(TCb、PCb或EC-TCb、EC-PCb),以增加肿瘤退缩的概率和pCR的可能性,但决策加铂类药物应该权衡潜在的获益与伤害,因为未必能转化为DFS的远期获益。单纯BRCA1/2致病或疑似致病性突变,不足以成为选择含铂类药物治疗的理由。对于有心脏基础疾患的患者,可以考虑单纯紫杉类+铂类药物的新辅助治疗。虽然Keynote522和IMpassion031研究提示,早期三阴性乳腺癌新辅助治疗添加PD-1/PD-L1抗体治疗可改善pCR,但因远期毒性和获益未明,且PD-1/PD-L1抗体在国内尚未获批相关适应证,不常规推荐在此类患者新辅助治疗中添加免疫检查点抑制剂。
10.2.4.3 乳腺癌新辅助治疗的注意事项:
⑴ 在门诊病历和住院病史中需记录患者当时的身高、体重及体表面积,并给出药物给药剂量强度。一般推荐首次给药剂量不得低于推荐剂量的85%,后续给药剂量应根据患者的具体情况和初始治疗后的不良反应,可以1次下调20%~25%,每个新辅助化疗方案仅允许剂量下调2次。
⑵ 在治疗有反应或疾病稳定的患者中,推荐手术前用完所有的既定周期数。
10.2.4.4 乳腺癌新辅助治疗的疗效评估和方案调整
⑴ 建议在治疗第1个周期的最后1天,亦即计划第2个周期治疗之前,进行细致的临床体检,初步了解治疗后的反应,如果肿瘤明确增大,要考虑早期进展的可能。
⑵ 一般情况下,建议在治疗第2个周期末,即计划第3个周期之前全面评估疗效。新辅助治疗前后的检查手段应该一致,评价结果按照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumor,RECIST)1.1标准分为完全缓解(complete response,CR)、部分缓解(partial response)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。
⑶ 可根据新辅助治疗中疗效评估结果决定后续新辅助治疗方案执行既定计划还是进行方案调整。新辅助治疗期间应重视早期疗效的评估和判断(2~4个疗程),当判断为较显著增大的SD或PD时,建议分为两种情况,一种为不可手术的,建议立即经验性更换新辅助治疗方案并密切评估;一种为可手术的,可以考虑尽早手术(特别是Luminal型,或采用了标准方案4疗程后疗效不佳的三阴性和HER2阳性患者,专家组建议尽早完成根治性手术)。部分专家也认同可以经验性更换新辅助治疗方案并密切评估,后者仍然具有体内药敏测试的价值。
⑷ 对CR或部分缓解或未显著增大的SD的患者,目前推荐完成既定的新辅助治疗疗程,即便肿瘤退缩明显,也应完成原计划疗程(除非不能耐受),避免因治疗有效而临时中断新辅助治疗、立即手术的情况。推荐新辅助化疗±靶向治疗总疗程数为6~8个周期,完成的患者可不再进行术后辅助化疗,部分未达pCR的患者可考虑强化治疗。
⑸ 根据新辅助治疗结束后的疗效评估结果决定随后的辅助治疗方案,对未达到pCR的患者,尤其是三阴性及HER2阳性患者,可采用辅助强化治疗。
10.2.5 乳腺癌经新辅助治疗降期后的局部和全身处理
10.2.5.1 局部处理
⑴ 乳房手术:手术可根据个体情况选择保留乳房或全乳切除。
⑵ 腋窝淋巴结手术:新辅助治疗前的SLN为阴性,新辅助治疗后可免去腋窝淋巴结评估。新辅助治疗前,腋窝淋巴结穿刺活检证实为转移或SLN有转移的,大多数中国专家建议即使降期仍需谨慎行SLNB以替代腋窝清扫。新辅助治疗后腋窝SLNB若有宏转移或微转移,以及新辅助治疗前T4或N2/3的患者一般都推荐行腋窝清扫,详见《乳腺癌前哨淋巴结活检临床指南》。
⑶ 术后辅助放疗:推荐根据化疗前的肿瘤临床分期来决定是否需要辅助放疗及放疗范围。放疗范围包括全胸壁和锁骨上和锁骨下范围,临床上内乳淋巴结有累及或临床上高度怀疑内乳淋巴结可能会累及的病例需添加内乳区放疗。
10.2.5.2 全身处理
⑴ 新辅助治疗结束后的疗效评估结果决定随后的辅助治疗方案,对未达到pCR的患者(已完成足疗程的新辅助治疗),尤其是三阴性乳腺癌患者,可考虑术后追加6~8个疗程卡培他滨治疗(采用单药铂类或其他静脉化疗的强化方案目前证据不足);HER2阳性患者,优先考虑采用T-DM1(每3周1次,共14次)强化辅助治疗的方式,T-DM1不可及时可采用含TKI方案予以辅助强化,部分专家认为可依据之前新辅助治疗的反应性(如术后MP分级等)以及患者情况(治疗费用和不良反应)协助判断选用何种方式更佳,但目前前者的循证医学证据仍不够充分,在退缩较好(譬如退缩>90%以上,MP=4时)也可采用继续完成曲妥珠单抗联合帕妥珠单抗共1年的方式。无论是否达到pCR,ExteNET试验显示,特定人群奈拉替尼延长治疗1年可进一步降低复发风险。对于HR阳性的患者,需要给予内分泌治疗,内分泌治疗是否需要强化,以及强化的方式可主要依据患者新辅助治疗前的状态进行评估,并参考10.1.3进行。
10.3 晚期乳腺癌解救性全身治疗临床指南
晚期乳腺癌包括复发和转移性乳腺癌,是不可治愈的疾病。治疗的主要目的是缓解症状、提高生活质量和延长患者生存期。应尽可能在决定治疗方案前对复发或转移部位进行活检,尤其是孤立性病灶,以明确诊断和重新评估肿瘤的ER、PR和HER2状态。局部治疗,如手术和放疗在初治为Ⅳ期乳腺癌中的价值还不明确。只有当全身药物治疗取得较好的疗效时,才可考虑姑息性的局部治疗,以巩固全身治疗的效果。局部及区域复发而没有远处转移的患者,对于经过全面评估后认为适合根治性局部治疗的局部区域复发的乳腺癌,应当给予根治性治疗。例如,保乳术后复发的患者可行全乳切除,胸壁或区域淋巴结复发的可行受累部位及淋巴结切除,之前未经放疗的可加用局部放疗,再次辅助化疗(主要为激素受体阴性患者)、靶向治疗和内分泌治疗具有一定的价值。复发或转移性乳腺癌常用的化疗和靶向治疗方案见附录Ⅶ。
10.3.1 晚期乳腺癌内分泌治疗临床指南
10.3.1.1 晚期乳腺癌内分泌治疗的人群选择
⑴ ER和(或)PR阳性的复发或转移性乳腺癌。受体状态不明的患者,如临床病程发展缓慢,也可以试用内分泌治疗。
⑵ 非内脏危象的患者。内脏危象定义为:由症状、体征、实验室检查及疾病快速进展确认的数个脏器功能异常。内脏危象并非单纯指存在内脏转移,而指危重的内脏情况需快速、有效地治疗以控制疾病进展,尤其指进展后就失去化疗机会的情况。无症状的内脏转移和(或)骨软组织转移更推荐内分泌治疗。
⑶ 复发距开始辅助内分泌治疗的时间较长(一般大于2年,联合部分靶向药物时可适当突破该界限)。
10.3.1.2 晚期乳腺癌内分泌治疗前谈话
⑴ 复发或Ⅳ期乳腺癌的全身治疗主要以延长无进展生存期(progression-free survival,PFS)及总生存期(overall survival,OS)、提高生活质量为目的,而非治愈。因此,应优先选择毒性较小的治疗方案。已有数据显示,内分泌联合靶向治疗的疾病控制率和PFS并不劣于甚至优于化疗。内分泌治疗有多种选择,可以依次进行,尽量延长患者进入化疗的时间。
⑵ 内分泌治疗不良反应的患者宣教。
10.3.1.3 晚期乳腺癌内分泌治疗的相关概念
⑴ 原发性内分泌治疗耐药:指早期乳腺癌术后辅助内分泌治疗2年内出现疾病复发转移,或转移性乳腺癌内分泌治疗6个月内出现疾病进展。
⑵ 继发性内分泌治疗耐药:指早期乳腺癌术后辅助内分泌治疗2年后至治疗结束后1年内出现疾病复发转移,或转移性乳腺癌内分泌治疗6个月或以上出现疾病进展。
⑶ 内分泌治疗敏感:指初治Ⅳ期未经内分泌治疗,或早期乳腺癌术后辅助内分泌(至少2年)治疗结束后1年以上出现疾病复发转移。
⑷ 内分泌一线治疗和二线治疗:通常分别对应复发转移后接受的第一个和第二个内分泌治疗方案;但考虑到定义要为后续治疗决策服务,推荐将内分泌一线治疗定义为内分泌治疗敏感的复发转移患者后续进行的第一个内分泌治疗方案,而将已判断为原发性或继发性内分泌治疗耐药的复发转移患者后续接受的内分泌治疗解救方案定义为二线治疗。
10.3.1.4 晚期乳腺癌内分泌治疗的药物(绝经定义参见附录Ⅷ)
⑴ 绝经后患者的内分泌治疗推荐:芳香化酶抑制剂包括非甾体类(阿那曲唑和来曲唑)、甾体类(依西美坦)、ER调变剂(他莫昔芬和托瑞米芬)、ER下调剂(氟维司群)、孕酮类药物(甲地孕酮和甲羟孕酮)、雄激素(氟甲睾酮)及大剂量雌激素(乙炔基雌二醇)。
⑵ 绝经前患者的内分泌治疗推荐:在OFS基础上(主要是使用LHRHa和手术去势),可参照绝经后乳腺癌处理。未行OFS的,可考虑ER调变剂(他莫昔芬和托瑞米芬)、孕酮类药物(甲地孕酮和甲羟孕酮)、雄激素(氟甲睾酮)及大剂量雌激素(乙炔基雌二醇)。
⑶ 绝经前和绝经后患者均可考虑在内分泌治疗的基础上联合靶向治疗(CDK4/6抑制剂、mTOR抑制剂、HDAC抑制剂等,PI3Kα抑制剂尚未在国内上市)。
10.3.1.5 晚期乳腺癌一线内分泌治疗的选择和注意事项
⑴ 芳香化酶抑制剂联合CDK4/6抑制剂(帕柏西利、阿贝西利和瑞波西利)是HR阳性/HER2阴性绝经后(自然绝经或手术去势)或绝经前但经药物去势后乳腺癌患者一线内分泌治疗的优先选择,多项研究已证实联合CDK4/6抑制剂可显著改善患者的PFS,甚至部分研究可改善OS。
⑵ 氟维司群(±OFS)联合CDK4/6抑制剂并非优选,在PARSIFAL研究中未能证实比芳香化酶抑制剂(±OFS)联合CDK4/6的抑制剂更优。他莫昔芬+OFS联合CDK4/6抑制剂在MONALEESA-7试验中也证实了PFS和OS的获益,特定情况下亦可选用。
⑶ 当CDK4/6抑制剂不可及时,单药内分泌治疗也是可行的;绝经后(自然绝经或手术去势)患者可使用氟维司群、AI、ER调变剂(他莫昔芬和托瑞米芬);绝经前患者可使用OFS联合氟维司群、OFS联合AI、OFS联合ER调变剂、单纯ER调变剂。
⑷ 绝经前患者在使用OFS药物后,可按照绝经后模式处理。
10.3.1.6 晚期乳腺癌二线内分泌治疗的选择和注意事项
一线内分泌治疗失败后,非内脏危象的患者仍然可以选择二线内分泌治疗±靶向治疗。不推荐重复使用辅助治疗或一线治疗已被证明耐药的内分泌治疗药物。绝经前患者在使用OFS药物后,可按照绝经后模式处理。
⑴ 对于尚未使用过CDK4/6抑制剂的患者:①氟维司群联合CDK4/6抑制剂(帕柏西利、阿贝西利和瑞波西利)是HR阳性/HER2阴性绝经后(自然绝经或手术去势)或绝经前但经药物去势后乳腺癌患者二线内分泌治疗的优先选择,多项研究已证实,联合CDK4/6抑制剂可显著改善患者的PFS和OS。对于原发性内分泌治疗耐药的患者,氟维司群联合特定的CDK4/6抑制剂阿贝西利获益证据相对充分。② 甾体/非甾体芳香化酶抑制剂(±OFS)或他莫昔芬(±OFS)联合CDK4/6抑制剂在特定情况下亦可选用。对于已经使用过CDK4/6抑制剂的患者,目前并无充分证据支持CDK4/6抑制剂的跨线治疗。
⑵ mTOR抑制剂依维莫司、HDAC抑制剂西达本胺可考虑在二线治疗中联合内分泌治疗使用。PI3Kα抑制剂Alpelisib在PI3Kα突变(经肿瘤组织或外周血ctDNA检测)的患者中联合内分泌治疗的效果有一定证据,已在美国和欧盟取得适应证,国内尚未获批。
⑶ 原发性内分泌治疗耐药患者,如以上联合的小分子靶向药物不可及时,可采用化疗予以解救治疗。
10.3.2 晚期乳腺癌化疗±靶向治疗的临床指南
10.3.2.1 晚期乳腺癌化疗±靶向治疗的人群选择
属于以下1种情况即可考虑化疗±靶向治疗:
⑴ 激素受体阴性或低表达。
⑵ 内脏危象或有症状的内脏转移。
⑶ 激素受体阳性但已证实对内分泌治疗耐药(特别是原发性耐药)。
10.3.2.2 晚期乳腺癌化疗±靶向治疗前谈话
⑴ 化疗±靶向治疗的目的是改善生活质量,延长PFS及OS。
⑵ 化疗±靶向治疗不良反应的患者宣教。
10.3.2.3 晚期乳腺癌化疗±靶向治疗前准备
⑴ 首次化疗前应进行血常规、肝肾功能及心电图检查。以后每次化疗前均应进行血常规检查,肝肾功能异常者需持续监测。使用蒽环类药物者还需进行心电图和LVEF检查,异常者需持续监测。
⑵ 育龄妇女应确认妊娠试验阴性并嘱避孕。
⑶ 签署抗肿瘤治疗知情同意书。
10.3.2.4 HER2阴性晚期乳腺癌化疗±靶向治疗的选择和注意事项(附录Ⅶ)
⑴ 推荐的首选化疗方案包括单药序贯化疗或联合化疗,其中序贯使用单药为优选,可保障治疗耐受性和生活质量。与单药化疗相比,联合化疗通常有更好的缓解率和PFS,然而联合化疗的毒性较大且未能证实总生存获益。需要使肿瘤迅速缩小或症状迅速缓解的患者可选择联合化疗。
⑵ 蒽环类(紫杉类)药物治疗失败的常用定义为使用蒽环类(紫杉类)药物解救化疗过程中疾病进展,或辅助治疗结束后12个月内发生复发转移。对于既往蒽环类药物治疗失败的患者,通常首选以紫杉类药物(如紫杉醇、多西他赛及白蛋白结合型紫杉醇)为基础的单药或联合方案;对于既往蒽环类药物和紫杉类药物治疗均失败的患者,目前尚无标准化疗方案,可考虑其他单药或联合方案。
⑶ 常用单药包括:蒽环类药物,如多柔比星、表柔比星、吡柔比星及聚乙二醇化脂质体多柔比星;紫杉类药物,如紫杉醇、多西他赛及白蛋白结合型紫杉醇;抗代谢类药物,如卡培他滨和吉西他滨;非紫杉类微管类抑制剂,如长春瑞滨、艾立布林、优替德隆(UTD1);铂类药物,如顺铂和卡铂;DNA拓扑异构酶抑制剂依托泊苷等。
⑷ 联合化疗方案:联合化疗方案多种多样,主要基于既往循证医学的证据、联合药物之间的相互作用、联合药物的毒性谱、患者的个体状态来综合制定,不推荐联合3种或3种以上的化疗药物。对于三阴性乳腺癌,可选择GP方案(吉西他滨联合顺铂,尤其是携带BRCA1/2等同源重组修复基因缺陷的患者)、GC方案(吉西他滨联合卡铂)、AP方案(白蛋白结合型紫杉醇联合顺铂/卡铂)、PC方案(其他紫杉类药物联合卡铂/顺铂)。
⑸ 单药或联合化疗均可在循证医学证据支持下联合靶向治疗。如依据IMpassion130和Keynote355研究,可尝试白蛋白结合型紫杉醇+阿替利珠单抗(PD-L1 IHC阳性时)、白蛋白结合型紫杉醇/紫杉醇/GC+帕博利珠单抗(PD-L1 CPS≥10时),但因PD-1/L1抗体治疗尚未获得相应适应证,临床实践中应慎重选择患者。化疗联合抗血管生成药物贝伐珠单抗可在疾病缓解及PFS方面得到获益,但OS未见延长,不推荐常规使用,但可在急需肿瘤或症状控制的患者中谨慎选择。
⑹ 联合化疗时,是采用持续方式还是4~8个疗程后停药或维持治疗需权衡疗效、药物不良反应和患者生活质量。联合化疗有效但不能耐受或无意愿继续联合化疗者可考虑维持治疗,可选择原先联合方案中的一个单药化疗维持(如口服卡培他滨、长春瑞滨),激素受体阳性者还可考虑内分泌治疗±靶向治疗维持。
⑺BRCA1/2胚系致病性或疑似致病性突变的患者,可以选择PARP抑制剂(奥拉帕利/talazoparib,其中奥拉帕利已在国内上市,但尚未获批相应适应证)进行治疗,或考虑参加相应临床试验。
⑻ 对于三阴性乳腺癌,以TROP2为靶点、与DNA拓扑异构酶Ⅰ抑制剂偶联的戈沙妥珠单抗(sacituzumab govitecan-hziy)是一种新的治疗选择,此药已获得美国食品药品管理局(Food and Drug Administration,FDA)批准,正在中国开展临床研究。
10.3.3 HER2阳性晚期乳腺癌治疗临床指南
10.3.3.1 晚期乳腺癌抗HER2治疗的人群选择
HER2阳性的复发或转移性乳腺癌。HER2的规范化检测和阳性的判定应参照ASCO/CAP指南或中国相关的指南。HER2阳性是指免疫组织化学法检测结果3+,或2+且原位杂交法检测结果阳性。原发灶和转移灶之间、多次转移灶之间如HER2检测结果不一致的,以最近1次的转移灶检测为准,同时考虑到HER2状态的时空异质性问题,不完全排斥在即使最近1次转移灶检测HER2转阴的情况下,继续谨慎选择抗HER2治疗并持续监测疗效。
10.3.3.2 抗HER2单抗使用的注意事项
⑴ 曲妥珠单抗、帕妥珠单抗:治疗前LVEF<50%。应用前应进行心功能基线评估,对于心血管事件高危人群应尽量避免使用。
⑵ 同时进行蒽环类药物化疗。应尽量避免同时使用蒽环类等也具有心血管毒性的药物。
⑶ 治疗过程中应定期进行心功能评估,若LVEF较基线下降≥15%或低于正常范围且下降≥10%,应暂停抗HER2治疗,于3~4周内复查LVEF,再次评估是否能继续抗HER2治疗。
⑷ T-DM1:基线及用药期间应行血小板规范监测,若出现血小板减少应及时减量或停药。出现2级及以上血小板减少时应警惕发展为持续性血小板减少症的可能,若常规升血小板治疗效果不佳,应及时请专科医师会诊并处理。
10.3.3.3 晚期乳腺癌抗HER2治疗前谈话
⑴ 充分告知HER2阳性乳腺癌患者及时进行抗HER2治疗的获益。抗HER2治疗的国内外常用药物包括:曲妥珠单抗及其生物类似物、帕妥珠单抗、伊尼妥单抗、Margetuximab、拉帕替尼、吡咯替尼、奈拉替尼、图卡替尼、T-DM1、DS8201等。
⑵ 单抗类药物曲妥珠单抗及其生物类似物、帕妥珠单抗、伊尼妥单抗等的总体安全性良好,但有可能影响心脏射血功能和增加充血性心力衰竭的概率;使用TKI类药物(拉帕替尼、吡咯替尼、奈拉替尼、图卡替尼)有腹泻等消化道反应;使用T-DM1有发生血小板减少症的风险;使用DS8201有发生间质性肺病的风险。使用以上药物时需遵医嘱配合定期随访监测(如使用单抗类药物时每3个月复查一次LVEF)。
10.3.3.4 晚期乳腺癌抗HER2治疗前准备
⑴ 准确的HER2检测。必要时将蜡块或白片送往国内广泛认可的医院病理科进行复核。有条件时尽量行转移灶的再次活检,以明确转移灶的HER2状态。
⑵ 心功能检查(心脏超声或核素扫描,前者应用更普遍)。
⑶ 签署抗肿瘤治疗知情同意书。
10.3.3.5 晚期乳腺癌抗HER2治疗的选择和注意事项(详见14.2章节内容)
持续的抗HER2治疗是HER2阳性晚期乳腺癌重要的治疗原则。
⑴ 对于未使用过曲妥珠单抗或符合曲妥珠单抗再使用条件(曲妥珠单抗辅助治疗结束后超过1年以上复发转移的)的患者,应首选以曲妥珠单抗±帕妥珠单抗为基础的一线治疗,优选联合紫杉类药物。紫杉类药物联合曲妥珠单抗、帕妥珠单抗双靶一线治疗较紫杉类药物联合曲妥珠单抗可延长PFS和OS。伊尼妥单抗联合长春瑞滨等化疗也可作为曲妥珠单抗非耐药患者的抗HER2治疗选择之一。
⑵ 对于曲妥珠单抗±帕妥珠单抗治疗失败患者,单药T-DM1可延长PFS和OS;吡咯替尼(或奈拉替尼)联合卡培他滨较拉帕替尼联合卡培他滨单药可延长PFS。单纯两种靶向药物的联合(如拉帕替尼联合曲妥珠单抗)也有证据表明可改善OS。专家组推荐,对于帕妥珠单抗+曲妥珠单抗辅助治疗结束1年后复发转移的乳腺癌患者,可选的一线解救治疗策略包括:吡咯替尼+卡培他滨、T-DM1、或帕妥珠单抗+曲妥珠单抗+多西紫杉醇等。Margetuximab、图卡替尼和DS8201在多线治疗后的临床研究中有一定效果,但国内尚未上市,需谨慎选择。
⑶ 曲妥珠单抗允许进行跨线治疗。
⑷ 对于HR阳性/HER2阳性的患者,不能耐受/拒绝化疗或化疗后维持治疗时,可以选用内分泌治疗+抗HER2(单靶或双靶)治疗,但无明确证据显示能改善OS。
⑸ 生物类似药是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。曲妥珠单抗生物类似药国内已获批,可适当外推用于HER2阳性乳腺癌相关的适应证。
⑹ 对于脑转移的患者,TKI类药物和ADC药物可优先选择。
⑺ 多线抗HER2治疗失败,无标准治疗或无法获得进一步治疗药物的,建议参加临床试验。
10.4 终末期乳腺癌姑息治疗临床指南
姑息治疗是一门临床学科,通过早期识别、积极评估、控制疼痛和治疗其他疾病相关症状,包括躯体、社会心理和心灵的困扰来预防和缓解身心痛苦,改善因疾病而威胁生命的患者及其家属的生活质量。
10.4.1 适应人群
⑴ 有未控制的肿瘤相关症状,如疼痛、呼吸困难、厌食和恶病质、恶心和呕吐等。
⑵ 有与肿瘤诊断和治疗相关的中、重度生理和心理问题。
⑶ 有严重的伴发疾病、精神和社会心理状况。
⑷ 预期生存时间少于或等于6个月。
⑸ 患者及家属有了解疾病发展过程和参与治疗决定的需求。
⑹ 患者及家属有姑息治疗的需求。
10.4.2 终末期乳腺癌患者姑息治疗前谈话
⑴ 与患者及家属沟通,使他们了解该疾病发展的自然病程和预后,抗肿瘤治疗的意义和可能带来的不良反应及并发症,理解后续治疗的性质和方法。
⑵ 了解患者及家属对姑息治疗的预期和要求,作出相应的治疗决定并制定具体措施。
⑶ 治疗过程中反复与患者及家属沟通,及时了解他们的治疗预期和要求的变化。
10.4.3 主要措施
⑴ 提供疼痛控制与其他痛苦症状的临床医疗服务,使患者尽可能减轻痛苦。
⑵ 维护和尊重生命,把死亡看作一个正常的过程。不提倡放弃治疗和安乐死,也反对过度治疗。既不刻意加速死亡,也不刻意延缓死亡。
⑶ 整合患者的精神、心理和心灵为一体,进行姑息性照护。
⑷ 提供支持系统,帮助患者尽可能以积极的态度生活直到死亡。同时帮助患者家属正确对待患者的疾病过程和他们的居丧。运用团队工作满足患者及其家属的整体需求,包括居丧服务与咨询。
⑸ 同样适用于疾病过程的早中期,主要目的仍然是减轻患者身心痛苦,提高生活质量。
10.4.4 肿瘤相关症状的控制
10.4.4.1 疼痛
肿瘤晚期疼痛的处理应遵循三阶梯治疗原则。所谓癌痛三阶梯治疗,就是在对疼痛的性质和原因作出正确的评估后,根据患者的疼痛程度适当选择相应的镇痛药。即对于轻度疼痛的患者主要选用非阿片类镇痛药±辅助药物;对于中度疼痛的患者主要选用低剂量强阿片类药物±非阿片类镇痛药±辅助药物;对于重度疼痛的患者选用强阿片类药物±非阿片类镇痛药±辅助药物。
⑴ 按阶梯用药:按阶梯用药是指镇痛药物的选用应根据患者疼痛程度由轻到重,按顺序选择同强度的镇痛药物重度疼痛可以直接从强阿片类药物开始,以使疼痛快速减轻,缓解症状。另外,对一些患者有神经疼痛或精神心理症状的可以适当加辅助药物以提高疗效。
⑵ 按时用药:按时用药是指镇痛药有规律地按规定间隔时间给予,在稳态情况下大多使用控释剂型。每一种镇痛药必须先对患者疼痛的控制进行滴定剂量,由小到大调整至最佳剂量,这对于血药浓度的控制、药物剂量的计算和疼痛持续性缓解有益。如果患者在使用镇痛药同时有突发性剧痛,可以在原来的用药剂量基础上适当追加剂量,并在以后用药时重新滴定患者的总剂量。
⑶ 口服或无创用药:提倡无创用药,以口服给药为主。口服给药方法简便,且不易产生药物依赖性。在不能口服或口服反应过大的情况下也可选用另外的给药方法。
⑷ 个体化用药:药物的使用需因人而异,具体分析。
⑸ 注意具体细节:对用镇痛药的患者要注意监护,密切观察其疼痛的缓解程度和药物的不良反应,并及时采取必要的措施,目的是使患者获得最佳疗效而不良反应最小。并且随着疼痛控制及症状缓解,有的患者还可以逐步减少用药剂量而达到最优化治疗。
⑹ 癌痛管理应达到“4A”目标,即优化镇痛(optimize Analgesia)、优化日常生活(optimize Activities of daily living)、使药物不良反应最小化(minimize Adverse effects)和避免不恰当给药(avoid Aberrant drug taking)。
⑺ 为了达到4A目标,近年来的指南将小剂量三阶梯药物(如每日剂量≤30 mg的吗啡和每日剂量≤20 mg的羟考酮)划分到第二阶梯,临床上可用小剂量三阶梯药物处理中度癌痛。
麻醉性镇痛药的不良反应及处理包括:
⑴ 总体而言,阿片类药物用于癌性疼痛是安全有效的,但需要使用高剂量麻醉性镇痛药的患者或长期使用麻醉性镇痛药的患者,会出现一些症状如便秘、嗜睡和尿潴留等;其他症状包括有毒代谢产物蓄积而产生中毒现象,症状包括难治性恶心、嗜睡和瘙痒;神经性中毒症状包括幻觉、谵妄、肌颤和感觉异常;严重时可致呼吸抑制。
⑵ 治疗和预防这些不良反应的方式包括给予足够的水分及改变麻醉性镇痛药的种类,还要停止使用其他会增加不良反应的药物,事先对于预期会发生的不良反应进行预防性处理,对于已经出现的症状做相应的对症处理,并可使用解毒拮抗剂。
⑶ 谨慎对待脏器功能不全,尤其是肝肾功能不全的患者,麻醉性镇痛药的剂量要削减,避免可能发生的代谢产物蓄积造成对机体的伤害。
麻醉性镇痛药的耐药性和依赖性包括:
⑴ 麻醉性镇痛药的耐药性:一方面癌症患者因疾病进展导致疼痛的加重而必须增加麻醉性镇痛药的剂量,另一方面可能因患者产生耐药性而需要增加先前镇痛药的剂量才能达到相同的镇痛效果,其机理可能与麻醉性镇痛药受体水平的改变或代谢产物有关。
⑵ 生理上的依赖性:对于长期使用麻醉性镇痛药的患者,生理上的依赖是常见的反应。若突然中断麻醉性镇痛药或突然减低剂量,或应用麻醉性镇痛药的拮抗剂,患者可能会产生戒断症状及体征,如焦躁不安、颤抖、发热、出汗、瞳孔放大、心跳加快、肌肉和腹部痉挛。此时需要减量或停用麻醉性镇痛药,必须以每天10%~20%的速度缓慢递减。
⑶ 心理上的依赖性(成瘾性):这是一种用某种物质后产生的心理变态强迫症,结果造成使用者生理、心理和社会学方面的伤害,而且即使发生伤害,使用者仍会强迫性地持续使用药物。实际上,无酒精或药物依赖病史的癌症患者若合理地使用适当的麻醉性镇痛药很少出现心理上的成瘾性。
10.4.4.2 厌食和恶病质
终末期癌症患者常发生厌食和营养不良,又称为厌食-恶病质综合征,主要是肿瘤导致的机体代谢功能紊乱,包括细胞因子分泌异常,胰岛素、肾上腺皮质激素代谢紊乱,免疫功能抑制,脂肪和蛋白质分解增加等,也可能归因于肿瘤治疗的影响或心理因素。
临床表现包括体重明显减轻、肌肉萎缩、厌食、乏力、味觉异常、贫血、低蛋白血症、水肿、褥疮及精神萎靡等。
治疗原则主要考虑纠正代谢的异常,适当营养支持,加强心理支持和护理。在具体临床实践中要注意既不能给予过少的营养成分和能量而达不到营养支持的目的,也不能给予太多的支持,特别是对于老年和脏器功能障碍的患者。
根据实验室检查指标和出入量给予一定的营养物质和能量,建议以肠内营养为主,为纠正水电解质异常或肠内营养不足可适当进行静脉营养,此外固醇类皮质激素、孕激素(甲地孕酮、甲羟孕酮)及胃动力药物等可适当作为辅助治疗。
10.4.4.3 恶心和呕吐
⑴ 明确呕吐原因,如治疗相关性呕吐(如化疗、放疗等)、疾病相关性呕吐(如脑转移、胃肠道梗阻等)。
⑵ 针对原因进行治疗,如放疗和化疗前预防性给予止吐药物、脑转移者给予脱水、胃肠道梗阻者给予胃肠减压等处理。
⑶ 非特异性的恶心呕吐给予多巴胺受体拮抗剂或苯二氮卓类药物,尤其适用于焦虑所致的恶心和呕吐。
⑷ 顽固性恶心和呕吐可持续静脉给药或皮下给药,如可进行多巴胺受体拮抗剂的剂量滴定至最大获益和耐受水平。若恶心仍持续存在,可考虑加用5-羟色胺受体拮抗剂、抗胆碱能药物和(或)抗组胺药物、糖皮质激素、安定类药物甚至大麻类药物。针灸和镇静剂也可以考虑。
⑸ 注意剧烈呕吐有可能引起上消化道出血,另需注意电解质平衡。
10.4.4.4 疲乏
疲乏是肿瘤晚期一种很常见的严重症状,几乎所有的晚期患者都有疲乏现象,特别是病情进展至终末期。它能使患者心理和生理承受能力降低,失去正常的生活能力。患者可能在病程的早期就有疲乏现象,也可能因肿瘤相关治疗而加重疲乏症状。
临床表现为体力不足、倦怠不适、嗜睡及智能减退,这些严重影响患者的生活质量。疲乏也可能使患者的其他症状如疼痛、抑郁及睡眠障碍等更加严重。
疲乏多数由营养不良、恶病质、药物和放疗、疼痛、情绪和睡眠障碍、水电解质紊乱(如低血钾、低血钠及脱水等)、缺氧、代谢障碍(如肿瘤消耗、血糖变化及酸中毒)、血象过低(如贫血)、心肝肾功能衰竭、内分泌紊乱或感染等引起。
治疗一般先针对病因(如镇痛、抗感染及保护心肝肾功能),纠正不足(如水电解质、血糖、红细胞、白细胞、血小板及血氧),支持治疗中可考虑加用一些肾上腺皮质激素如地塞米松或孕激素如甲地孕酮、甲羟孕酮,也可佐以精神兴奋剂如哌甲酯。
10.4.4.5 昏迷
昏迷是脑功能严重障碍的一种临床表现,其生命体征尚存而持续性意识丧失,终末期患者尤其是生命时间无多的患者多见。根据对疼痛有无退缩反应、瞳孔反射与角膜反射是否存在等可将昏迷程度分成浅昏迷和深昏迷。
临床表现:①浅昏迷时,患者意识大部分丧失,无自主活动,受强刺激时,可出现痛苦表情和肢体退缩反应,受到疼痛刺激时可出现防御反射,角膜反射、眼球运动和吞咽反射尚存在,常有病理性反射,可发生尿失禁或尿潴留。② 深昏迷时,患者意识完全消失,所有深浅反射均消失,四肢松弛性瘫痪,仅维持呼吸、循环功能。
肿瘤患者出现昏迷的常见原因为颅脑占位性病变、恶性肿瘤中枢神经系统受侵犯、高热、感染、代谢障碍、电解质紊乱及脑出血等。
癌症患者出现昏迷多数预示病情已晚,预后极差,治疗宜适度。①病因治疗:对颅脑占位性病变,恶性肿瘤中枢神经系统受侵犯行脱水、激素等治疗,高热、感染、代谢障碍、电解质紊乱及脑出血等应针对病因支持治疗,浅昏迷可用局部姑息性放疗。② 支持治疗:保证糖分和营养适度,维持静脉通路,纠正酸碱失衡,保持水和电解质的平衡。③加强护理:尽量使患者头部偏向一侧,注意保暖,留置导尿管,保持皮肤干燥清洁,注意防治褥疮。另外,保持呼吸道通畅,缺氧或呼吸困难可给予氧气,有感染时合理选用抗生素,必要时可酌情使用醒脑静等药物。但深昏迷时,患者已无多大痛苦,若家属同意或有要求,可不进再一步处理。
11 乳腺癌患者随访与康复共识
乳腺癌患者随访的目的在于了解患者的生存状况,评估疾病是否复发转移,以及患者对辅助治疗的依从性和不良反应等,以采取相应的临床和干预措施,更好地康复并改善预后。
乳腺癌患者的康复包括生理功能的康复、心理状态的调整及社会活动能力的恢复。乳腺癌的康复治疗就是在乳腺癌正规治疗的同时或结束后,帮助患者恢复机体生理功能、调整心理状态,并且能够回归社会,重建被疾病破坏了的生活。
11.1 随访和评估
11.1.1 随访频率
乳腺癌患者的随访需要根据复发的风险来决定随访的频率,参照建议如下:
⑴ 术后2年内,一般每3个月随访1次。
⑵ 术后3~5年,每6个月随访1次。
⑶ 术后5年以上,每年随访1次,直至终身。
如有异常情况,应当及时就诊而不拘泥于固定时间。
11.1.2 随访检查项目
随访检查项目的具体内容见表7。
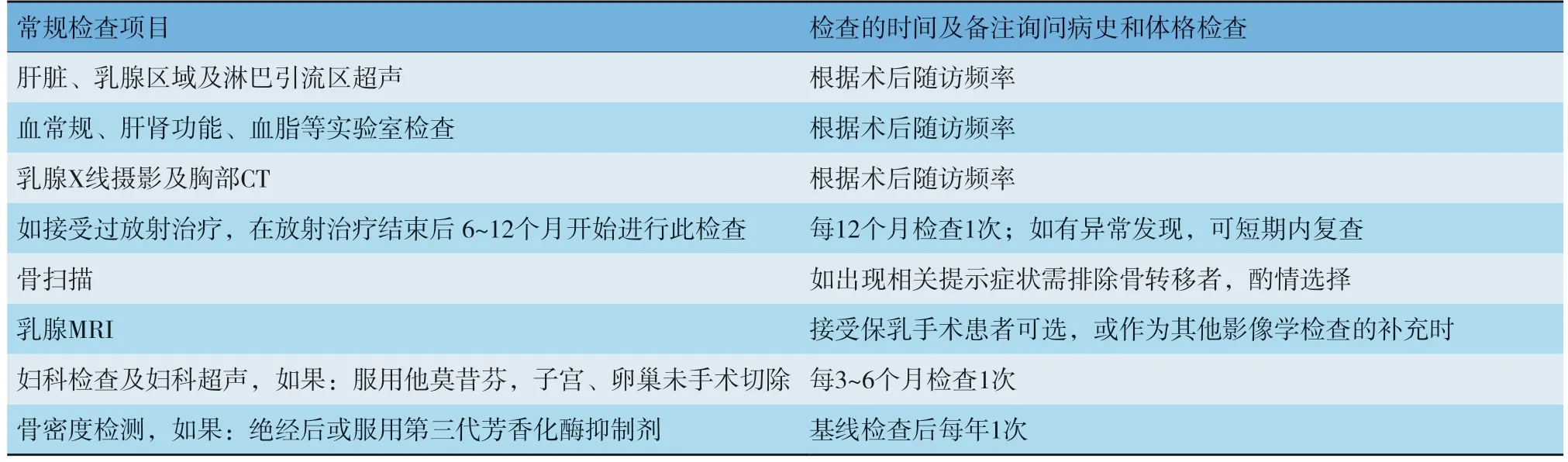
表7 随访检查项目
11.1.3 随访评估项目
11.1.3.1 上肢功能评估
⑴ 上肢活动范围:应当在乳腺癌术后1~2个月内恢复正常水平。如运动受限,则需要强化功能锻炼或进一步就诊治疗。
⑵ 患肢淋巴水肿:接受腋窝手术的乳腺癌患者需要在术后随访期间评估上肢淋巴水肿的情况。淋巴水肿评估方法较多,临床主要通过询问患者主观感受或体检并进行多节段臂围测量判断。一般认定患侧上肢周径比对侧上肢周径长<3 cm为轻度水肿,3~5 cm为中度水肿,>5 cm为重度水肿。
11.1.3.2 并发疾病风险评估
⑴ 心脑血管事件风险评估:
①心脏毒性:接受过含蒽环类药物(尤其含多柔比星)方案化疗或曲妥珠单抗、帕妥珠单抗等抗HER2靶向药物治疗的患者需定期进行心电图及心脏超声(左心室射血分数)检查,蒽环类药物使用后还需考虑心肌酶谱检查,及时发现用药可能带来的心脏毒性及心脏事件风险。
② 血脂异常:接受内分泌治疗(如他莫昔芬或第三代芳香化酶抑制剂等)的患者,应当评估血脂(胆固醇、甘油三酯、低密度脂蛋白等)情况以判断是否存在血脂异常。
⑵ 骨折事件风险评估:服用第三代芳香化酶抑制剂或卵巢去势的患者需在药物使用前及每年随访时进行骨密度检测及骨折风险评估,以判定骨折风险属低危、中危或高危。
11.1.3.3 生活方式评估
⑴ 体重评估
第一次随访时,测量患者的身高和体重。以后每次随访都测量体重。每次测量后计算患者的体重指数(body mass index,BMI),按照《中国成人超重和肥胖症预防控制指南》评价患者的BMI是否过低、正常、超重或肥胖。
⑵ 营养与运动
询问患者每日食物摄入情况。推荐使用24 h回顾法,连续记录3 d饮食量。评价患者的食物摄入量、主要营养素是否符合推荐、膳食结构合理程度。如果患者没有特殊情况,按《中国居民膳食指南》推荐的摄入量进行评估。
询问患者每天的体力活动情况,是否有规律地进行快走、慢跑、跳舞、游泳等体育锻炼,如有,每天或每周一共进行多长时间。
⑶ 其他
询问患者是否吸烟,是否被动吸烟,是否饮酒,如有,询问频率和数量。
询问患者是否使用保健品或膳食补充剂,如有,具体什么产品及使用频率。
11.1.3.4 心理和社会支持评估
乳腺癌患者的不良情绪主要集中在自尊、身体影响、焦虑和抑郁。随访时应当通过问诊或量表等形式对患者的心理状态及社会支持状态进行评估。
11.1.3.5 性生活和生育评估
乳腺癌治疗和由治疗而引发的不良反应,如乳房切除使自身形象改变、更年期症状提前出现等会在一定程度上影响性生活,而治疗的持续或不良反应也会影响育龄期乳腺癌患者生育功能的康复。因此,需要以问诊、量表等形式评估并随访其性生活及生育需求。
11.2 临床处理和康复指导
11.2.1 患侧肢体功能的康复
11.2.1.1 循序渐进的患侧上肢功能锻炼
功能锻炼对于恢复患者肩关节功能和预防及减轻水肿至关重要,但必须严格遵守循序渐进的顺序,不可随意提前,以免影响伤口的愈合。
循序渐进方法:①术后1~2 d,练习握拳、伸指、屈腕;② 术后3~4 d,前臂伸屈运动;③术后5~7 d,患侧的手摸对侧肩、同侧耳(可用健肢托患肢);④ 术后8~10 d,练习肩关节抬高、伸直、屈曲至90°;⑤ 术后10 d后,肩关节进行爬墙及器械锻炼,一般应在1~2个月内使患侧肩关节功能达到术前或对侧同样的状态。
功能锻炼的达标要求:2周内患侧上臂能伸直、抬高绕过头顶摸到对侧耳朵。达标后仍需继续进行功能锻炼。
值得注意的是,术后7 d内(尤其腋下引流管拔除前)限制肩关节外展。严重皮瓣坏死者,术后2周内避免大幅度运动。皮下积液或术后1周引流液超过50 mL时应减少练习次数及肩关节活动幅度(限制外展)。植皮及行背阔肌皮瓣乳房重建术后要推迟肩关节运动,避免在术后早期进行过度锻炼。
11.2.1.2 上肢淋巴水肿的预防
⑴ 预防感染:保持患侧皮肤清洁;不宜在患侧手臂进行有创性的操作,如抽血、输液等;洗涤时戴宽松手套,避免长时间接触有刺激性的洗涤液;避免蚊虫叮咬;衣着、佩戴首饰或手表时一定要宽松。
⑵ 避免高温环境:避免烫伤;患侧手臂不要热敷,沐浴时水温不要过高,避免长时间热浴或桑拿;避免强光照射等高温环境。
⑶ 避免负重:术后2~4周内避免上肢负重,一般不超过500 g。4周后,需缓慢、逐渐增加肌肉及肌耐力的活动,尤其是抗阻力训练。但仍需避免提、拉、推过重的物品;避免从事重体力劳动或进行较剧烈的体育活动。
⑷ 避免上肢近端受压:避免紧身衣、测量血压、患侧卧位。
⑸ 注意睡姿,保证睡眠质量:平卧位患侧肢体垫高,手臂呈一直线,手掌高度要超过心脏平面;健侧卧位,患肢放于体侧或枕头垫高超过心脏水平。良好的睡眠能够帮助患者放松心情,兴奋迷走神经,激活淋巴系统,预防并改善淋巴水肿。
⑹ 其他:建议进行患者教育以帮助患者早期识别水肿及水肿风险,根据手术类型、是否放疗、生活方式等进行风险评定,不要忽视轻微的手指、手背、上肢的肿胀,对于高危患者进行早期干预。建议鼓励患者尽快恢复手臂功能;乘坐飞机、长途旅行或是处于高海拔地区时穿戴预防性弹力袖套;在医师指导下进行适当的体育锻炼,避免过度疲劳。
11.2.1.3 上肢淋巴水肿的治疗
包括保守治疗和手术治疗。保守治疗指综合消肿疗法,包括人工淋巴引流、压力绷带治疗、皮肤护理、功能锻炼等,需要多学科共同参与。手术治疗包括淋巴结移植、淋巴管吻合等,疗效尚有待大规模研究证实。如患侧手臂出现红肿热痛等症状,亦或水肿突然加重等应考虑淋巴管炎可能,应及时检查血常规并予以抗炎处理。
11.2.2 并发疾病
11.2.2.1 心脑血管事件风险管理
⑴ 心脏毒性管理
应当充分评估心脏基础疾病,避免心脏毒性药物在此类人群中的使用。可考虑在蒽环类药物治疗同时给予右雷佐生;若疑似存在心功能异常,则可使用血管紧张素转换酶抑制剂、血管紧张素受体阻断剂以及特定β受体阻断剂,有助于防止蒽环类药物诱导的心肌病发生。
治疗期间及治疗后随访期间如发现心脏症状体征、心肌酶谱异常或心脏超声异常,应当及时停药并复查,如持续存在异常则需即刻停止使用导致心脏损害的药物并及时给予治疗,并需要多学科专家共同参与诊疗。
⑵ 血脂管理
生活方式干预有助于预防血脂异常的发生;同时注意定期对血脂进行检测。结合临床病史和(或)危险因素决定是否开始调脂药物治疗。他汀类药物是临床上最常用于调脂的药物,且他汀类药物与内分泌治疗药物间无相互作用。有研究证实,同时使用第三代芳香化酶抑制剂与他汀类药物不仅可降低血脂,还能延长乳腺癌患者的无病生存期(disease-free survival,DFS)。
11.2.2.2 骨折风险管理
应当对所有绝经后及使用第三代芳香化酶抑制剂的患者宣教骨折事件的预防方法,并进行生活方式干预。骨折风险评估为中高危的患者,除需改善生活方式外,还应及时给予适当的药物(补充钙剂、维生素D及使用双膦酸盐制剂或地舒单抗等),并密切监测骨密度。
11.2.3 生活方式管理
越来越多的循证医学证据表明,乳腺癌患者的生活方式影响预后。乳腺癌患者诊断以后的膳食营养状况、BMI变化、体力活动状况及吸烟饮酒等个人生活方式相关因素与乳腺癌患者的转移复发、无病生存和死亡率相关。乳腺癌患者长期生存,不仅需要长期的医疗和康复服务,而且需要对其日常生活进行指导,帮助乳腺癌患者形成并坚持健康的生活方式,从而提高治疗效果,改善预后,提高生活质量和生存率。
11.2.3.1 BMI管理
乳腺癌患者在治疗结束后,应尽量使BMI恢复到正常范围,即BMI在18.5~23.9 kg/m2的范围内,或按照《中国成人超重和肥胖症预防控制指南》达到体重正常标准。
对于已经超重或肥胖的乳腺癌患者而言,推荐降低膳食的能量摄入和接受个体化的运动减肥指导。
对于积极抗癌治疗之后处于营养不良或体重过轻状态的患者,必须由专科医师和营养师进行评估,制订和实施营养改善计划;也推荐这些患者进行一定的体力活动,帮助改善身体机能和增加体重,但应避免剧烈运动。
11.2.3.2 营养与运动
按照“中国居民平衡膳食宝塔”选择食物,安排一日三餐的食物量。推荐富含水果、蔬菜、全谷类食物、禽肉和鱼的膳食结构,减少精制谷物、红肉和加工肉、甜点、高脂奶类制品和油炸薯类食物的摄入。
建议乳腺癌患者在诊断后应避免静坐生活方式,尽快恢复诊断以前的日常体力活动;18~64岁的成年人,每周坚持至少150 min的中等强度运动(大致是每周5次,每次30 min),或者75 min的高强度的有氧运动;力量性的训练(大肌群抗阻运动)每周至少2次。建议每次锻炼以10 min为一个间隔,最好每天都锻炼。超过65周岁的老年人应尽量按照以上指南进行锻炼,如果患有使行动受限的慢性疾病,则根据医师指导适当调整运动时间与运动强度,但应避免长时间处于不运动状态。
11.2.3.3 吸烟饮酒、保健食品和膳食补充剂
建议乳腺癌患者不吸烟,避免被动吸烟,不饮酒,避免含有酒精的饮料。对于保健食品和膳食补充剂,建议如下:
⑴ 应尽量从饮食中获取必需的营养素。
⑵ 在临床(血浆维生素D浓度低、维生素B12缺乏)或生化指标(骨密度低)提示营养素缺乏时,才需要考虑在营养师的指导下服用相应的营养素补充剂。
⑶ 经营养师评估,当患者无法从食物中摄取足够的营养素,摄入持续下降到只有推荐量的2/3时,可以考虑服用营养素补充剂。
11.2.4 心理和社会支持
11.2.4.1 心理支持
医护人员需要了解患者的心理变化特点及心理状态调整的过程,以提供必要的心理干预。
医护人员可以在认知、决策、应对技能等方面提升患者的自我控制能力,指导患者合理地运用暗示、宣泄等应对技巧,以增加对于困境的忍耐力。避免给予患者过多的同情与怜悯,向患者强调保持常态的重要性,帮助患者尽快摆脱患者角色,积极面对生活。
⑴ 提供充分信息,帮助患者理性接受患病事实。医护人员可参与患者的认知矫正,帮助患者进行适当的反思,摒弃错误的想法,减轻患者的恐惧。
⑵ 帮助患者寻找积极的生存目的,重建生活的信心。医护人员必须及时且正确地评估患者当前的期望,包括患者与其家属之间的依赖关系。帮助患者意识到自身的价值,对家庭其他成员的重要性,以增加其与疾病抗争的信心。鼓励患者参加社会活动,提供社会角色恢复的机会。
⑶ 激发患者的承担意识,协助其有效地控制自我。实施以患者为中心的医疗护理模式,帮助患者充分发挥她们的决策权,激发她们的自我承担意识。
评估中如发现中重度心理异常患者,需要包括药物治疗在内的跨学科综合治疗手段介入并密切随访。
11.2.4.2 社会支持
医护人员可以根据患者的需要,积极调动社会资源,给患者提供帮助、鼓励和支持,最大限度地恢复患者的社会功能。建议所有的女性都应该得到治疗小组的情感支持和社会支持,也应该得到同辈支持小组的信息和支持。乳腺癌患者的社会支持网络应涵盖专业支持、家庭支持和同辈支持。
⑴ 专业支持:以提供医学信息和心理支持为主,可以开设康复课程、专业讲座,设立康复热线、康复值班室、康复网站,出版康复相关的书籍等,同时利用各种新媒体平台、手机应用程序等。
⑵ 家庭支持:以鼓励家属参与患者的诊治和康复过程为主,可以开设家属信息咨询窗口,为家属提供交流平台等。
⑶ 同辈支持:以康复病友志愿者的参与为主,可以采用病房探视或新病友座谈会的形式,建议在医护人员的专业指导和监督下进行。
11.2.5 性生活和生育
11.2.5.1 性生活
乳腺癌患者健康及适度的性生活有利于身心康复。唯一需要提醒的是严格进行避孕,而避孕方法推荐物理屏障避孕法,避免使用激素类药物避孕法。
⑴ 要让患者认识到,无论将采用何种治疗手段,经爱抚获得愉悦的能力不会改变。
⑵ 提醒患者,可试着享受其他感觉性愉悦的方式,伴侣间应该互相帮助,通过触摸和爱抚来达到性高潮。
⑶ 与伴侣进行关于性问题的交流,或向专业人员咨询。
11.2.5.2 生育及生育功能保留
虽然目前没有证据显示生育会影响乳腺癌患者的预后,但在选择是否生育,以及何时生育时必须充分考虑患者疾病复发的风险和治疗对后代的影响,与患者也要有充分的沟通。以下情况可考虑生育:
⑴ 乳腺原位癌患者手术和放疗结束后。
⑵ 淋巴结阴性的乳腺浸润性癌患者手术后2年。
⑶ 淋巴结阳性的乳腺浸润性癌患者手术后5年。
⑷ 需要辅助内分泌治疗的患者,在受孕前3个月停止内分泌治疗(如戈舍瑞林、亮丙瑞林、他莫昔芬等),直至生育后哺乳结束,再继续内分泌治疗。
在全身治疗前应当考虑生育功能保留的手段实施,目前较为广泛使用的手段包括:胚胎冻存、冻卵、低温保存卵巢组织。使用促性腺激素释放激素类似物用于化疗期间卵巢功能保护的疗效尚待大规模临床研究证实。
12 乳房重建与整形临床指南
12.1 乳房重建的目的
女性因各种原因,特别是接受乳房恶性肿瘤手术治疗和其他局部治疗后,可能造成乳房的缺失或乳房外形的毁损。乳房重建可以帮助乳腺癌患者重塑乳房外形、轮廓、解剖标志,恢复身体外形的完整性,并尽量实现两侧乳房外形基本对称。
12.2 乳房重建的指征
乳房重建适合于因各种原因准备或已经接受乳房切除的女性,或因为保乳手术导致乳房明显变形的患者。
12.3 乳房重建的类型
根据重建的时机,乳房重建可以分为即刻重建、延期重建及分期即刻乳房重建3类。乳房重建可以在全乳切除的同时,通过一次麻醉过程完成,称为即刻重建。即刻重建的优点主要有:可以保留乳房原有的重要解剖结构,如乳房下皱襞、乳房皮肤甚至乳头乳晕;节省手术费用,患者不会经历失去乳房的痛苦。乳房重建也可以在全乳切除术后的数月或数年后进行,称为延期重建。延期重建中受区的组织条件相对较差,患者经受了失去乳房的痛苦,对乳房重建有明确需求和心理准备,通常不会影响乳腺癌的治疗;但是需要多次手术,才能达到理想的美容效果。如果乳房全切术前无法确定是否术后需要放疗,可先植入扩张器,根据术后病理学诊断和辅助治疗等情况,择期更换永久乳房假体或选择自体组织乳房重建。这种通过两个阶段完成的乳房重建,称为分期即刻乳房重建。乳房重建的时机选择取决于很多因素,包括医护团队的能力,以及患者的意愿、身体状况和肿瘤治疗方案。
根据重建的材料,乳房重建可以分为自体组织(皮瓣)重建、植入物重建及联合两种材料(如背阔肌联合植入物)的重建。
12.4 乳房重建的原则与注意事项
⑴ 乳腺癌的手术方案决策应该遵循一定的顺序。早期乳腺癌保乳治疗与全乳切除相比,能够获得同样的远期生存效果;同时,总体手术并发症低于全乳切除±乳房重建,患者生活质量、术后满意度和费效比也有优势。因此,有保乳指征的患者应首先建议保乳治疗,而非乳房重建。
⑵ 乳腺癌手术后的乳房重建应该由一支专业的多学科团队完成,在术前对患者进行充分评估,评估内容包括:①肿瘤负荷;② 肿瘤的生物学类型;③综合治疗方案;④ 既往疾病史(包括精神心理疾病史);⑤ 药物服用史和吸烟史;⑥ 肥胖(高BMI和ASA指数);⑦ 糖尿病;⑧ 高血压;⑨ 既往手术并发症史(如深静脉血栓等)。这些因素决定了全乳切除方式、乳房重建的最佳时机和方法、手术与辅助治疗的顺序安排等。任何乳房重建手术不应该干扰乳腺癌的标准手术治疗及其他综合治疗;有长期吸烟史、肥胖的患者发生植入物和自体组织重建并发症的风险增加,因此建议将有长期吸烟史和BMI超重视为乳房重建手术的相对禁忌;炎性乳腺癌患者需要切除大量的乳房皮肤,其生物学行为不良,患者在接受新辅助系统治疗和全乳切除术后,需要尽快接受辅助放疗,应慎重选择即刻乳房重建。患者应充分了解各种保乳整形和乳房重建手术的过程、风险和获益,可能面临的后续修整手术以及延期重建的可能性。主诊医师应尽可能提供手术效果的图示或照片,给患者和家属充足的时间进行讨论和决策,签字前患者对于手术预期效果有清晰的认识。
⑶ 保留皮肤的全乳切除可以使接受即刻乳房重建后乳房的美容效果得到极大的改善。证据显示,与传统的全乳切除手术比较,保留皮肤的全乳切除不会增加局部和区域的肿瘤复发风险。保留乳头乳晕复合体的全乳切除手术日益受到关注,其有助于提高乳房重建术后的患者满意度。回顾性研究显示,乳头乳晕复合体受肿瘤累及的比例较低,随访中重建患者该区域的局部复发率较低,有丰富经验的多学科团队可以开展保留乳头乳晕复合体联合即刻乳房重建术,建议限定疾病分期早、肿瘤与乳头有一定距离,术中乳头乳晕下病理学评估无肿瘤累及者;乳头Paget氏病提示乳头乳晕有肿瘤累及应作为禁忌证。伴有乳头血性溢液的乳腺癌不常规推荐保留乳头乳晕全乳切除。
⑷ 保乳手术过程中,通常采用肿块广泛切除或更大范围的区段/象限切除术,足够安全的切缘距离意味着切除较大范围的正常乳腺组织,有可能导致乳房局部腺体缺失,术后或放疗后出现乳房变形、乳头乳晕复合体移位等乳房外观的不满意。在不影响肿瘤局部治疗效果的前提下,术前由肿瘤外科医师或整形外科医师对乳房的缺损进行评估,并做好相应准备,术中采用肿瘤整形手术技术,运用容积移位或容积置换技术,在缺损部位进行局部的充填;根据肿瘤部位、乳房大小和乳房下垂情况设计相应的切口。这一术式可以通过一次麻醉和手术过程完成,能在一定程度上改善乳房的形态与外观;与常规保乳手术相同,也需要在原术腔放置4~6枚惰性金属夹以备术后放疗时作为瘤床的标记。手术标本应该常规标记切缘,进行术后的病理学评估;应该在术前与患者充分沟通,一旦出现切缘阳性的情况,应补充进行区段切除,甚至可能行全乳切除,并考虑即刻乳房重建。根据患者的乳房形态、患侧肿瘤整形保乳手术方式、意愿,可同期或分期实施健侧乳房对称性手术。肿瘤整形技术也可以在已经完成保乳治疗而存在乳房局部凹陷、乳头移位、轮廓畸形的患者中,采用延期的方式进行重建。针对保乳术后乳房畸形的患者,也可以采用游离脂肪移植技术进行局部外形修复,大样本回顾性研究证实,脂肪移植并未增加局部复发和远处转移的风险。已经接受放疗的乳房如存在明显畸形,局部皮瓣修复可能导致切口愈合不良、重建失败的风险,应考虑使用远处组织(皮)瓣进行修复重建,最为常用的是部分背阔肌肌(皮)瓣。
⑸ 全乳切除术后乳房重建的方法包括植入物、自体组织及联合上述两种材料。植入物重建可考虑两步法,即先行放置组织扩张器,再择期更换为永久假体;也可在部分乳房皮肤缺损不多的患者中,一步法即刻置入永久假体。植入物通常应该放置于胸大肌后方或前方;文献报道将植入物经合成补片或脱细胞真皮包裹后直接放置于胸大肌前方,能够保留完整胸大肌,减少术后疼痛,防止产生运动畸形,具有较低的包膜挛缩率,目前尚缺乏大样本长期的安全性研究数据。植入物联合脱细胞真皮、合成补片(如TiLOOP BRA)可缩短组织扩张时间,有利于直接置入假体,改善重建乳房的外观,降低严重包囊挛缩的发生率,提高患者满意度。植入物首选硅胶假体,其手感、美观度要优于盐水囊假体;假体选择对于再造术后乳房形态具有决定性作用,应根据患侧的乳房体积形态选择合适的乳房假体,兼顾对侧乳房的对称度;近年来文献报道一种与乳房硅胶假体相关的罕见T细胞淋巴瘤,称为间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL),国内尚未见报道;如果患者在假体重建多年后出现突发的乳房疼痛、肿块、肿胀,应予以重视。自体组织重建可以选择多种带蒂或游离皮瓣,转移至胸壁进行乳房塑形;最为常用的自体组织皮瓣包括:扩大背阔肌肌皮瓣、带蒂横型腹直肌肌皮瓣(transverse rectus abdominis musculocutaneous flap,TRAM flap)、游离横型腹直肌肌皮瓣(free transverse rectus abdominis musculocutaneous flap,F-TRAM flap)、保留肌束的游离TRAM(muscle-sparing transverse rectus abdominis musculocutaneous flap,MS-TRAM flap)、腹壁下血管穿支皮瓣(deep inferior epigastric artery perforator flap,DIEP flap)、臀上动脉穿支皮瓣(superior gluteal artery perforator flap,SGAP flap)等。游离皮瓣乳房重建涉及显微外科技术,以及游离皮瓣的术后监测团队的建立。
⑹ 乳腺肿瘤整形和乳房重建手术方案的决策过程中,还需要考虑到对称性手术方式,包括对侧乳房的缩乳成型、乳房提升、隆乳,联合脂肪移植技术,目的是达到双侧乳房的对称效果,这些手术可以考虑与患侧乳房重建分期进行,在部分患者中也可同期进行;乳头乳晕重建也是乳房重建手术的重要组成部分,通常延期实施,以便获得更为理想的对称度。术者与患者的沟通非常重要,乳房重建是一个有序的治疗过程,可能需要多次修整方能达到形态、轮廓美观、对称的最终目标。
12.5 术后放疗与乳房重建的关系
明确需要接受术后辅助放疗的患者,建议其考虑进行延期重建或分期乳房重建。放疗可能对重建乳房的外形造成不利影响,并有可能导致重建失败。有经验的团队可在与患者充分沟通的基础上行即刻重建后再给予放疗,一般建议采用自体组织皮瓣,以期降低放疗对重建乳房的影响程度。当考虑进行组织扩张和植入物即刻重建时,建议先放置组织扩张器,在放疗开始前或结束后更换为永久性假体。假体置换手术在放疗前完成,能够降低切口相关的并发症和放疗期间的扩张器破裂风险。如果组织扩张器置换为永久假体在放疗结束后进行,建议在放疗后6个月左右,待放疗导致的皮肤反应缓解后为妥;采用这一策略,可能改善最终的重建乳房美观效果。近期有研究显示,胸肌前植入物乳房重建对放疗的耐受性更佳,但这一结论有待进一步大样本研究证实。曾经接受放疗的患者如果采用植入物重建,常发生较严重的包囊挛缩、移位、重建乳房美观度差和植入物暴露,因此,放疗后的延期乳房重建,不宜使用组织扩张器和植入物的重建方法,而应该首选自体组织皮瓣。
12.6 乳房重建术后评价系统
评估乳腺癌患者乳房重建术后满意度,不仅可以反映患者的生活质量,还可以指导临床医师对重建手术的选择和实施。对于乳房重建手术的效果评价中,推荐包含患者报告结局的测评工具。使用国外乳房重建术后满意度评估量表前,应使用经过授权、汉化和信效度检验的量表,应用于临床研究和临床实践。
目前应用比较广泛的患者报告结局工具主要有密歇根乳房重建结果研究满意度问卷(Michigan breast reconstruction outcomes study satisfaction questionnaire,MBROS-S)、密歇根乳房重建结果研究身体形象问卷(Michigan breast reconstruction outcomes study body image questionnaire,MBROS-BI)、乳腺癌治疗结局测评(breast cancer treatment outcome scale,BCTOS)和BREAST-Q问卷。建议术前对患者进行基线调查,术后3、12个月以及之后每年进行1次调查。
13 乳腺原位癌治疗指南
13.1 乳腺原位癌的诊断
13.1.1 定义与分类
13.1.1.1 LCIS
经典型LCIS中的小叶内终末导管或腺泡呈实性膨大,其中充满均匀一致的肿瘤细胞。肿瘤细胞体积小而一致,黏附性差。细胞核呈圆形或卵圆形,染色质均匀,核仁不明显。细胞质淡染或淡嗜酸性,可含黏液空泡致细胞核偏位呈印戒细胞样,细胞质也可透亮。LCIS包括多形性型、旺炽型、透明型、肌样细胞型等多种亚型。其中较为重要的是多形性亚型。多形性LCIS中的肿瘤细胞黏附性差,细胞核显著增大,有明显的多形性,可有显著的核仁和核分裂象,有时可见粉刺样坏死或钙化,需与高级别DCIS相鉴别。非典型性小叶增生(atypical lobular hyperplasia,ALH)和LCIS在形态学上具有相似之处,但累及终末导管小叶单位(terminal ductal lobular unit,TDLU)的程度不同。当TDLU单位中≥50%的腺泡被诊断性细胞所充满并扩张时可诊断为LCIS,<50%时则诊断为ALH。根据AJCC(第8版),将LCIS当作乳腺良性病变,然而专家团认为仍需谨慎对待,推荐对非经典型LCIS患者积极处理。
13.1.1.2 DCIS
DCIS为非浸润性癌,多数发生于TDLU,也可发生于大导管,是局限于乳腺导管内的原位癌。典型的DCIS在乳腺X线摄影检查时多表现为不伴肿块的簇状微小钙化灶,恶性钙化还可表现为细小点样、线状、分支状钙化等。在实际工作中,多采用以核分级为基础,兼顾坏死、核分裂象及组织结构的分级模式,将DCIS分为3个级别,即低级别、中级别和高级别。高级别DCIS往往由较大的多形性细胞构成,核仁明显、核分裂象常见。管腔内常出现伴有大量坏死碎屑的粉刺样坏死,但腔内坏死不是诊断高级别DCIS的必要条件。低级别DCIS由小的单形性细胞组成,细胞核圆形,大小一致,染色质均匀,核仁不明显,核分裂象少见。肿瘤细胞排列成僵直搭桥状、微乳头状、筛状或实体状。中级别DCIS结构表现多样,细胞异型性介于高级别和低级别DCIS之间。
13.1.2 自然病程和预后
13.1.2.1 发展为浸润性癌的风险
LCIS发展为浸润性癌的风险相对较小,具有癌变间期长、双侧乳房和多个象限发病的特点。一些研究发现,在诊断为ALH和LCIS的妇女中,终生发生癌变的概率为5%~32%,平均癌变率为8%。LCIS癌变发生于双侧乳房的机会均等,而不仅仅局限于原发LCIS部位。多数观点认为,LCIS是癌变的危险因素,有些研究则认为LCIS是癌前病变。有研究显示,LCIS多数进展为浸润性小叶癌,但是也可进展为浸润性导管癌(invasive ductal carcinoma,IDC)。这是一个值得重视的癌前病变,对其治疗需要更有效而确切的方法。
DCIS被普遍认为是IDC的前驱病变,DCIS不经治疗最终可能会发展为IDC。对最初误诊为良性病变而导致未能获得治疗的DCIS研究显示,从DCIS进展为IDC的比例为14%~53%。
13.1.2.2 发展为浸润性癌的危险因素
有关LCIS发展为浸润性癌的危险因素研究较少,可能与患者年龄、种族和手术方式有关。此外,一些研究表明,有乳腺癌家族史的LCIS患者,发生癌变的风险增加。
DCIS进展为浸润性癌的危险因素与患者年龄、肿瘤体积、切缘状况及组织病理学分级有关。
13.1.3 诊断
13.1.3.1 LCIS的诊断
LCIS可无任何临床症状,亦可没有乳房肿块、乳头溢液、乳头肿胀及皮肤改变等体征,有时仅有类似增生样改变。依据中国女性乳腺特点,应完善乳腺钼靶X线摄影、乳腺超声检查,必要时可行乳腺MRI检查;拟行保乳手术患者,术前必须行乳腺X线摄影检查。在乳腺X线摄影检查发现有钙化、肿块、结构紊乱后,其通过空芯针穿刺活检(包括空芯针穿刺及真空辅助穿刺活检)或开放活检均可被诊断。若穿刺活检提示为经典型LCIS患者,则可以进行常规的影像学随访而不行开放活检。若穿刺活检提示为多形性LCIS或穿刺活检结果与影像学检查结果不符,需行开放活检以除外DCIS及浸润癌。LCIS亦可在因其他乳房病变进行手术活检时被发现。典型的LCIS与低级别的DCIS很相似,可采用E-钙黏蛋白及P120免疫组织化学染色来鉴别。
13.1.3.2 DCIS的诊断
依据中国女性乳腺特点,应完善乳腺X线摄影检查、乳腺超声检查,必要时可行乳腺MRI检查。拟行保乳手术的患者,术前必须行乳腺X线摄影检查。至少有90%的DCIS是在乳腺X线摄影筛查中被发现的,多数表现为微小钙化灶,部分表现为微小钙化灶伴肿块影或致密影,约10%的患者有可触及的肿块,约6%的患者乳腺X线摄影检查表现为假阴性。DCIS的典型MRI表现为沿导管分布的导管样或段样成簇小环状强化,也可表现为局灶性、区域性或弥漫性强化,孤立性或多发性肿块。B超下DCIS多表现为边界不清的肿块,内部呈低回声,肿块内多具有弥漫、成堆或簇状分布的针尖样、颗粒状钙化,肿块内血流多较丰富。空芯针穿刺活检及开放活检都是获取DCIS组织学诊断的手段,但穿刺活检提示为DCIS的患者需行完整切除以排除浸润癌。在穿刺活检结果为DCIS的患者中,25%有IDC成分;在穿刺活检结果为LCIS的患者中,开放活检后有17%~27%病理学诊断升级为DCIS或浸润性癌,因此建议穿刺活检后行开放活检。DCIS的病理学诊断,推荐完整取材、规范取材。
13.2 LCIS初诊的治疗
13.2.1 手术治疗
空芯针穿刺活检发现ALH和LCIS后需行病灶切除活检是目前多数研究达成的共识,其主要目的是为了最大限度地降低DCIS和浸润性癌的共存风险。
多形性LCIS可能有与DCIS相似的生物学行为,临床医师可以考虑病灶完整切除及切缘阴性,但这可能导致全乳切除率高而无临床获益的结局。LCIS与IDC或DCIS并存并非保乳的禁忌证。
13.2.2 非手术治疗
LCIS患者病灶切除后,如果没有合并其他癌变,可以考虑随访观察。此外,放射治疗是不被推荐的,也没有数据支持对多形性LCIS进行放射治疗。
13.2.3 预防性治疗
13.2.3.1 药物预防性治疗
他莫昔芬(20 mg/d,口服5年)被认为是绝经前后妇女降低浸润性、ER阳性乳腺癌风险的选择。结合ER状态给予他莫昔芬,目前是预防ER阳性乳腺癌的有效选择。对于预判风险较低的患者,他莫昔芬(5 mg/d,口服3年)也是可选的。
雷洛昔芬(60 mg/d,口服5年)也被认为是降低浸润性、ER阳性乳腺癌风险的选择,同样结合ER检测,但仅适用于绝经后妇女。
依西美坦(25 mg/d,口服5年)和阿那曲唑(1 mg/d,口服5年)被认为是绝经后妇女降低浸润性、ER阳性乳腺癌风险的另一种选择。MAP.3试验中位随访3年的结果显示,依西美坦使绝经后ER阳性高危妇女浸润性乳腺癌发病风险降低65%。在IBIS-Ⅱ研究中位随访5年的数据中,阿那曲唑组乳腺癌发病风险比安慰剂组降低53%。本次推荐是基于以上两项临床试验的结果。
针对35岁以上、有发生乳腺癌高风险(包括既往手术证实为乳腺小叶不典型增生、导管不典型增生、LCIS及DCIS)的女性,都可以考虑以上4种药物的使用可能,讨论可基于危险因素如年龄、家族史、药物史和生育史等。
13.2.3.2 预防性双乳切除术
对于具有乳腺癌高危因素的女性来说,预防性双乳切除术可降低90%~95%的乳腺癌发病风险。LCIS作为乳腺癌的一项高危因素,可以结合患者的其他风险因素(如家族史、有关BRCA基因突变等)行预防性双乳切除。但此类手术目前必须经过伦理委员会批准。
13.3 DCIS初诊的治疗
13.3.1 局部治疗
13.3.1.1 手术
全乳切除术对98%的DCIS患者是一种治愈性处理方法。虽然无临床研究评价全乳切除在DCIS中的疗效,但专家委员会仍考虑其可有效降低局部复发率。
近年来的研究发现,保乳手术(不包括腋窝淋巴结清扫)+全乳放疗与乳房切除术有相似的生存率。有行保乳手术意愿的患者,如切缘阳性可再次扩大切除,乳房肿瘤切除术不能做到切缘阴性时应行全乳切除。在全乳切除或肿瘤再次扩大切除时发现有浸润性病变的患者,应按照浸润性癌的原则进行处理(包括淋巴结分期)。阴性切缘的定义目前仍存在争议。目前ASCO/CAP专家共识认为,切缘小于1 mm是不够的,DCIS的安全切缘距离为2 mm。回顾性研究表明,扩大切缘(大于10 mm)不能进一步降低保乳手术结合术后放疗的局部复发率。根据国内实际情况,未采用“墨汁染色”评估切缘的单位,推荐首先保证阴性切缘,有条件者进一步做到2 mm阴性切缘;对于部分基底或表面切缘不足2 mm又无法进一步补充切缘时,小于2 mm的阴性切缘也是可以接受的。
对于明显为单纯DCIS的患者,在明确诊断没有浸润性癌以及不存在肿瘤转移时,不应当直接进行全腋窝淋巴结清扫。然而,仍有一小部分明显为单纯DCIS的患者最后在进行手术时被发现为浸润性癌。因此,如果明显为单纯DCIS的患者准备接受全乳切除术或进行保乳手术,为避免手术部位(如肿瘤位于乳腺腋尾部)对将来前哨淋巴结活检可能带来的影响,可考虑在手术当时进行前哨淋巴结活检。鉴于国内部分医院尚不能做连续切片的实际情况,前哨淋巴结活检是必需的,对于准备接受全乳切除的患者这一点更为重要。
13.3.1.2 放疗
DCIS保乳手术后行全乳放疗可以降低约50%的同侧乳房内复发风险。对临床医师评估为复发风险“低”的患者,可仅行保乳手术而不接受放疗,譬如低级别DCIS,符合van Nuys预后指数(van Nuys prognostic index,VNPI)低危组的患者,可免除辅助放疗。但目前仅有回顾性研究支持这一观点,而且研究的长期随访结果显示,按危险度分组仅能筛选出部分复发时间点延迟的患者,而非低复发风险患者。即便是部分中危或低危的患者,放疗后的局部复发率也显著低于未放疗的患者。
13.3.2 系统性治疗
13.3.2.1 化疗
目前未见关于DCIS患者进行化疗的大规模临床试验报道,因此化疗未被证明对于DCIS患者的临床管理有明确作用。从逻辑上看,DCIS是局部问题,不存在远处转移风险,因此对其进行系统性治疗的理念并不准确。当前系统性治疗的应用,其主要价值在于利用系统性药物的局部控制效果。
13.3.2.2 内分泌治疗
主要利用内分泌治疗的局部控制和预防对侧原发的效果。以下情形考虑采用他莫昔芬治疗5年,以降低保乳手术后同侧乳腺癌复发风险。
⑴ 接受保乳手术(肿块切除术)加放疗的患者,尤其是ER阳性的DCIS患者;ER阴性的DCIS患者他莫昔芬治疗效果尚不确定。
⑵ 仅接受保乳手术的患者。对于接受全乳切除术的DCIS患者术后可通过口服他莫昔芬或雷洛昔芬来降低对侧乳腺癌风险,但需权衡化学预防的临床获益与不良反应。
绝经后的DCIS患者术后(包括保乳手术及全乳切除术)可考虑通过芳香化酶抑制剂预防并降低对侧乳腺癌风险。具体参照13.2.3预防性治疗。
13.3.2.3 靶向治疗
对于HER2阳性的DCIS患者,目前尚不推荐辅助抗HER2靶向治疗。NSABP B-43Ⅲ期临床试验预计入组2 000例接受乳房肿块切除术和放疗的HER2阳性DCIS患者,随机进入放疗+曲妥珠单抗治疗组或单纯放疗组,随访结果显示抗HER2治疗未能显著降低HER2阳性DCIS的局部复发。
13.4 原位癌复发的风险和处理
全球范围多项前瞻性对照研究提示,保乳手术组的8~10年局部复发率为4%~20%,全乳切除术组为2%~9%,但保乳手术组+放疗后的局部复发率可降低至与全乳切除术相当或略高水平。许多因素决定局部复发的风险:肿块可触及、体积大、分级高、切缘距离肿瘤近或切缘阳性、年龄小于50岁或复发风险指数高。美国南加州大学提出根据VNPI判定复发风险,其中包括肿瘤大小、边缘、核分级和坏死以及患者年龄(评分:4~12分)。目前关于VNPI的研究尚没有前瞻性随机试验,现有试验的研究结果存在不一致性,故VNPI并未被众多学者所认可。临床上,对单纯的LCIS,应进行积极随访。而手术治疗后的DCIS患者,则应接受每6~12个月1次的病情随访和体格检查,持续5年后改为每年1次。每12个月应进行1次乳房X线摄影(保乳手术患者放疗后每6~12个月1次)及乳腺超声检查。
对于乳腺原位癌,复发病例中约一半是乳腺浸润性癌,一半仍为原位癌。对复发后仍为原位癌的患者,则仍按照原位癌治疗。而复发为浸润性癌的患者,则按照浸润性癌的原则进行处理(包括淋巴结分期),本节不再赘述。
13.5 乳腺DCIS治疗方式选择的参考
国外某些学者采用VNPI作为一个客观的指标以协助临床医师对DCIS治疗方式进行决策。VNPI对DCIS按肿瘤大小、患者年龄、手术切缘和肿瘤细胞核分级4个方面综合考虑,每一方面评分分为1分(最佳)至3分(最差),4个方面总分由最低的4分(最佳)至最高的12分(最差)。VNPI 10~12分者建议行全乳切除术,VNPI 4~6分者可行单纯局部切除术,而VNPI 7~9分者则建议行局部广泛切除联合全乳放疗。VNPI的具体评分方法详见附录Ⅸ。
注:目前对于VNPI的临床应用价值仍有争议,因此仅供临床医师参考。
14 HER2阳性乳腺癌临床诊疗专家共识
HER2是乳腺癌明确的预后指标和药物治疗效果的预测指标。针对该靶点的新药不断涌现,极大地改善了这个群体的预后。作为第一个靶向HER2的人源化单克隆抗体,曲妥珠单抗改变了HER2阳性乳腺癌患者的预后局面,影响了乳腺癌的诊治模式,是乳腺癌药物治疗的重要突破。2007年拉帕替尼作为晚期乳腺癌二线治疗药物在欧美批准上市,2013年已在中国上市。2012年在欧美上市的帕妥珠单抗,目前也已被批准在中国上市。我国自主研制的靶向药物吡咯替尼于2018年8月经过优先评审程序被批准用于HER2阳性晚期乳腺癌治疗。恩美曲妥珠单抗(T-DM1)、奈拉替尼已经在国外上市,2020年均获批在中国上市。Trastuzumab deruxtecan(DS8201)、图卡替尼、margetuximab已在国外上市,目前尚未进入中国大陆。曲妥珠单抗生物类似物也已在国内上市,为我国乳腺癌患者提供了更多的治疗选择。为了更好地推广规范的HER2检测,准确评估患者预后,更好地发挥抗HER2靶向治疗药物的效果,减少治疗盲目性,使更多患者获益,中国抗癌协会乳腺癌专业委员会专家组成员,根据现有国内外研究结果讨论后达成以下共识。
14.1 HER2检测和结果判定标准
⑴ HER2是乳腺癌重要的预后指标,同时也是抗HER2药物疗效的预测指标。
⑵ 抗HER2靶向药物治疗的适应证是HER2阳性浸润性乳腺癌。
⑶ HER2阳性的定义,按照中国《乳腺癌HER2检测指南(2019版)》,为免疫组织化学检测3+或ISH检测阳性。
⑷ 如果患者免疫组织化学检测显示HER2为3+,可以直接判断为HER2阳性;如果免疫组织化学检测结果HER2为2+,应该再进行ISH检测以明确HER2状态。如免疫组织化学检测结果HER2为1+或HER2为0,则判断为HER2阴性。
⑸ HER2 ISH检测标准。HER2/CEP17比值≥2.0且HER2基因拷贝数≥4.0,或HER2/CEP17比值<2.0且HER2基因拷贝数≥6.0则可判断为HER2阳性;比值≥2.0且HER2基因拷贝数<4.0,或比值<2.0且HER2基因拷贝数<4.0判断为HER2阴性。比值<2.0且HER2基因拷贝数为4.0~6.0时,病理学专家宜增加计数细胞数量且结合免疫组织化学检测结果最后确定HER2状态。
⑹ 如果患者病情发展不符合HER2阴性乳腺癌特点,临床认为有可能是HER2阳性,或者复发转移患者治疗过程中为了争取治疗机会,建议重新检测HER2,可以用原发肿瘤标本,但更提倡对复发转移病灶再活检。当原发灶和转移灶检测结果不一致时,只要有一次HER2阳性,就应推荐相应的抗HER2治疗。
HER2检测及判读标准详见《乳腺癌HER2检测指南(2019版)》。
HER2免疫组织化学检测判读标准、HER2双探针原位杂交检测判读标准见附录Ⅴ-E。
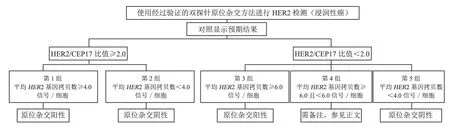
HER2双探针原位杂交检测判读标准
HER2免疫组织化学检测判读标准
临床研究中发现,部分既往判定为HER2阴性的HER2低表达患者同样可以从新型抗HER2靶向治疗中获益,以此为基础,提出了针对HER2低表达这一人群的定义:免疫组织化学检测1+或2+并且ISH检测阴性。HER2低表达判定流程见附录Ⅴ-E。
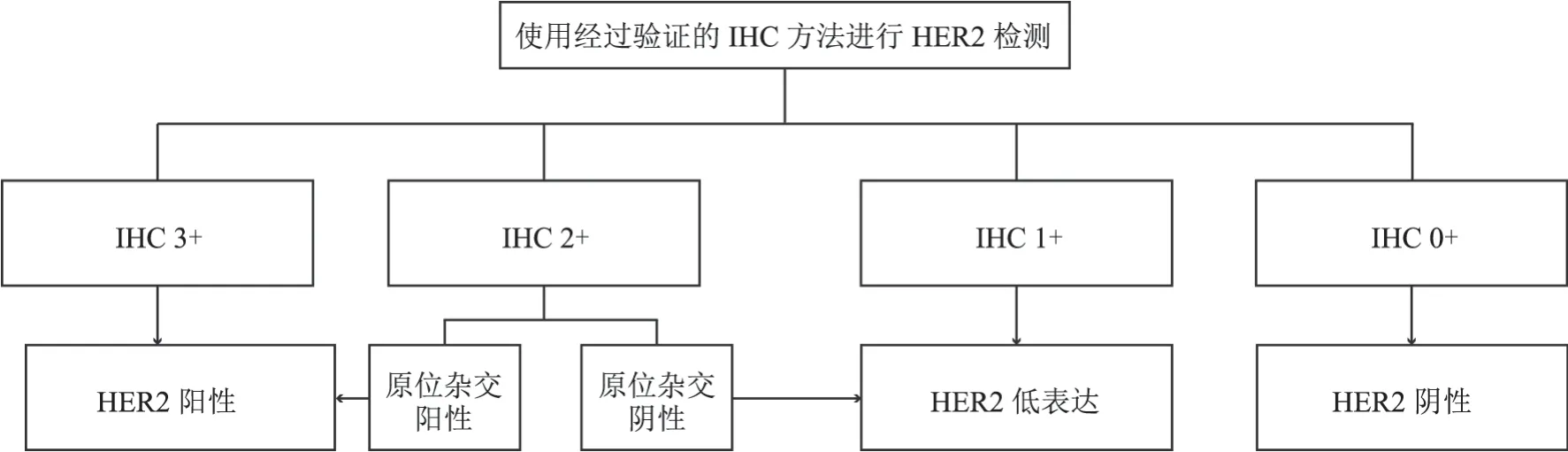
HER2低表达判定流程
14.2 HER2阳性复发转移乳腺癌治疗原则
14.2.1 治疗原则
⑴ HER2阳性复发转移乳腺癌,首选治疗应该是以抗HER2为基础的治疗,根据患者激素受体状况、既往(新)辅助治疗用药情况,选择治疗方案,使患者最大程度受益。
⑵ 曲妥珠单抗与帕妥珠单抗双靶向治疗联合化疗应作为一线治疗的标准方案,若条件不允许,也可考虑曲妥珠单抗单靶向治疗联合化疗。新辅助/辅助治疗接受过曲妥珠单抗或者曲妥珠单抗、帕妥珠单抗双靶治疗的复发转移性乳腺癌患者,复发转移后仍应接受抗HER2治疗。对停用曲妥珠单抗或者双靶治疗大于12个月的患者选用一线抗HER2治疗方案见下文,对停用曲妥珠单抗或者双靶治疗小于12个月的或在辅助靶向治疗期间内复发的患者可选用二线抗HER2治疗方案,如吡咯替尼联合卡培他滨、T-DM1等,具体见下文。
⑶ 研究结果显示,抗HER2药物联合内分泌治疗HER2阳性同时ER/PR阳性晚期乳腺癌,无进展生存期、临床获益率和至疾病进展时间均显著优于内分泌单药治疗;因此,HER2与激素受体均阳性的绝经后转移性乳腺癌患者,在不适合化疗或疾病发展缓慢的患者中也可以采用抗HER2治疗联合芳香化酶抑制剂等内分泌治疗药物。在一线化疗停止但疾病未进展的患者中可考虑内分泌治疗联合抗HER2药物的维持治疗。
14.2.2 方案选择
⑴ 一线治疗方案:首选帕妥珠单抗、曲妥珠单抗双靶向治疗联合紫杉类药物。可考虑方案包括曲妥珠单抗单靶联合紫杉类药物,曲妥珠单抗也可联合长春瑞滨、卡培他滨等其他化疗药物。其他可选方案包括吡咯替尼联合卡培他滨、T-DM1等。
⑵ 二线治疗方案:
吡咯替尼联合卡培他滨:吡咯替尼是我国自主研发的小分子酪氨酸激酶抑制剂,吡咯替尼联合卡培他滨对比拉帕替尼联合卡培他滨可以显著延长HER2阳性晚期乳腺癌患者的PFS,无论患者既往是否使用过曲妥珠单抗,均能从中获益。因此,对于抗HER2为基础治疗进展的患者,吡咯替尼联合卡培他滨是二线治疗优选方案。
恩美曲妥珠单抗(T-DM1):临床研究表明,与拉帕替尼联合卡培他滨相比,恩美曲妥珠单抗可显著延长PFS及OS。此方案也是国际标准二线治疗。
拉帕替尼联合卡培他滨:临床研究证明,对比曲妥珠单抗为基础的方案治疗失败的乳腺癌患者,拉帕替尼联合卡培他滨比单用卡培他滨的至疾病进展时间延长,所以曲妥珠单抗方案治疗后疾病进展的HER2阳性患者可以选择拉帕替尼联合卡培他滨。但目前吡咯替尼及奈拉替尼联合卡培他滨都证明优于此方案,因此并非首选。
曲妥珠单抗联合其他化疗药物:多项研究显示,一线使用曲妥珠单抗疾病进展后,继续使用曲妥珠单抗比停止使用曲妥珠单抗治疗效果更好。因此,HER2阳性乳腺癌经曲妥珠单抗联合化疗药物治疗出现疾病进展后,可保留曲妥珠单抗继续使用,而换用其他化疗药物。
双靶向治疗:有研究显示多线治疗后,不含化疗药物的曲妥珠单抗与拉帕替尼双靶向联合方案,较单药拉帕替尼有显著获益,因此,对经多线治疗后或不能耐受化疗不良反应的患者可考虑这一策略;帕妥珠单抗与曲妥珠单抗联合卡培他滨在对比曲妥珠单抗联合卡培他滨二线的研究PHEREXA初步结果显示PFS差异无统计学意义,但OS差异有统计学意义,在未使用过帕妥珠单抗的患者中可考虑尝试。
对于多线治疗失败的HER2阳性转移性乳腺癌患者,还可以考虑接受trastuzumab deruxtecan(DS8201)、奈拉替尼联合卡培他滨、图卡替尼联合曲妥珠单抗及卡培他滨、margetuximab联合化疗等,但许多药物国内仍未普及。鉴于该领域的新药研发快,鼓励患者进入相应临床试验以争取最大的生存获益。
14.3 HER2阳性乳腺癌辅助治疗原则
14.3.1 辅助治疗适应证
⑴ 淋巴结阳性。
⑵ 淋巴结阴性:T1c及以上,T1b可推荐,T1a当伴有高危因素者(如激素受体阴性、淋巴管血管侵犯阳性等)。
⑶ 目前尚无HER2阳性微浸润癌患者能从靶向联合化疗中获益的证据。
⑷ 在具体的临床操作中,对T1a~T1b之间的患者,需结合其年龄、心脏状况、肿瘤的组织学分级等因素综合考虑。
14.3.2 HER2阳性乳腺癌辅助治疗用药推荐
14.3.2.1 化疗方案推荐
AC-T+抗HER2治疗(蒽环类药物联合环磷酰胺序贯紫杉类药物,曲妥珠单抗±帕妥珠单抗):蒽环类药物联合环磷酰胺,每3周1次,共4个周期,序贯每周1次紫杉醇共12次或每3周1次多西他赛4个周期,紫杉类药物同时应用抗HER2治疗。或者采用剂量密集方案每2周1次的化疗方案:蒽环类药物联合环磷酰胺4个周期序贯紫杉醇4个周期,紫杉醇同时应用抗HER2治疗,靶向治疗持续1年。
TCb+抗HER2治疗(多西他赛联合卡铂,曲妥珠单抗±帕妥珠单抗):多西他赛75 mg/m2,卡铂AUC为5~6,每21 d为1个周期,共6个周期,同时抗HER2治疗,该方案不含蒽环类药物,心脏不良事件发生率等较AC-T+抗HER2治疗方案低。
wPH(紫杉醇联合曲妥珠单抗周疗):对于一些淋巴结阴性小肿瘤的早期患者,可以选用每周紫杉醇80 mg/m2,共12次,联合曲妥珠单抗1年的辅助治疗。
TCH(多西他赛联合环磷酰胺4个疗程联合曲妥珠单抗):多西他赛联合环磷酰胺(TC)4个疗程,并联合曲妥珠单抗1年的辅助治疗。
14.3.2.2 靶向治疗推荐
曲妥珠单抗周疗剂量为2 mg/kg(首次剂量为4 mg/kg),或3周1次剂量为6 mg/kg(首次剂量为8 mg/kg),共1年。目前认为,HER2阳性乳腺癌曲妥珠单抗辅助治疗,推荐的用药周期为1年,6个月的短期疗程并未证实其疗效相当,2年的疗程未得到更佳的预后获益,故均暂不推荐。术后初始治疗未接受曲妥珠单抗的患者,辅助化疗结束后,处于无疾病复发状态的患者仍可以从延迟使用(中位延迟时间为22.8个月)的曲妥珠单抗治疗中获益。
APHINITY研究最新结果显示,使用帕妥珠单抗与曲妥珠单抗双靶向方案较曲妥珠单抗单靶向方案可降低24%的复发风险,两组6年的iDFS分别为90.6%与87.8%(HR=0.76;95% CI:0.64~0.91),6年iDFS提高2.8%,其中淋巴结阳性患者获益最多。因此,对具有高复发风险的HER2阳性早期乳腺癌患者,推荐辅助帕妥珠单抗与曲妥珠单抗双靶向治疗联合化疗。帕妥珠单抗,3周1次剂量为420 mg(首次剂量为840 mg),共1年。
ExteNET研究结果显示,在Ⅱ~Ⅲ期HER2阳性的乳腺癌患者中,完成1年辅助靶向治疗后再口服1年的奈拉替尼治疗,与对照组相比,奈拉替尼组的5年iDFS提高2.5%,其中激素受体阳性人群获益更大。奈拉替尼剂量为240 mg,每日1次,共1年。国内开展了相似研究,在曲妥珠单抗为基础的辅助治疗结束后,延长1年吡咯替尼治疗,结果尚未公布。
14.3.3 曲妥珠单抗在辅助治疗中的心脏毒性
曲妥珠单抗联合化疗药物可能增加心肌损害,严重者会发生心力衰竭。尽管NSABP B-31、N9831和HERA这3项临床试验中的心脏毒性事件数不高并且可以恢复,但临床研究入选的患者是化疗后经过心脏功能安全筛选的。临床实践中建议在对既往史、体格检查、心电图、超声心动图LVEF基线评估后再开始应用曲妥珠单抗,使用期间应该每3个月监测心功能。若患者存在无症状性心功能不全,监测频率应更高(如每6~8周1次),出现下列情况时,应停止曲妥珠单抗治疗至少4周,并每4周检测1次LVEF。
⑴ LVEF较治疗前绝对数值下降大于或等于16%。
⑵ LVEF低于正常范围并且较治疗前绝对数值下降大于或等于10%。
⑶ 如4~8周内LVEF回升至正常范围或LVEF较治疗前绝对数值下降小于或等于15%,可恢复使用曲妥珠单抗。
⑷ LVEF持续下降(大于8周),或3次以上因心肌病而停止曲妥珠单抗治疗时,应永久停止使用曲妥珠单抗。
14.4 HER2阳性乳腺癌的新辅助治疗
多项临床试验研究证明,HER2阳性患者术前新辅助治疗达到pCR者DFS和OS均优于同样治疗未达到pCR的患者。曲妥珠单抗联合化疗与单用化疗相比能够显著提高pCR率。NOAH研究结果进一步证实了曲妥珠单抗的新辅助治疗获益,pCR、5年无事件生存率和总生存率均显著提高。Neosphere研究、PEONY研究证实曲妥珠单抗和帕妥珠单抗双靶向治疗联合多西他赛可进一步提高pCR率。因此,曲妥珠单抗和帕妥珠单抗双靶向联合化疗应是首选的治疗策略。
14.4.1 新辅助治疗方案
新辅助治疗方案可选择TCbH(P)、TH(P)、AC-TH(P)、TCH等方案。化疗方案主要为传统的含蒽环类药物方案和去蒽环类仅紫杉类药物方案,蒽环类药物由于心脏毒性一般不与曲妥珠单抗同时使用,近年来去蒽环类药物的呼声不绝于耳,但也有相当一部分专家认为蒽环类药物仍不可摒弃,尤其是对于淋巴结阳性的高危患者。
14.4.2 HER2阳性乳腺癌新辅助治疗后的辅助治疗
术前新辅助治疗用过曲妥珠单抗或者曲妥珠单抗和帕妥珠单抗双靶治疗的患者,术后辅助治疗推荐继续使用靶向治疗,治疗总时长为1年。HER2阳性乳腺癌患者如果术前新辅助治疗未用过曲妥珠单抗,术后有辅助治疗适应证者仍推荐曲妥珠单抗±帕妥珠单抗。新辅助治疗后达到pCR的患者,应继续完成1年的抗HER2治疗(曲妥珠单抗±帕妥珠单抗),未达pCR的患者,根据KATHERINE研究结果,可采用T-DM1行术后辅助强化治疗。恩美曲妥珠单抗剂量为3.6 mg/kg,每21 d为1个周期,共14个周期。若条件不允许,也可继续完成1年的抗HER2治疗(曲妥珠单抗±帕妥珠单抗),或根据ExteNET亚组结果,选择曲妥珠单抗联合酪氨酸激酶抑制剂如奈拉替尼。
现代乳腺癌诊断和分类,应该是在标准的传统病理组织学基础上,融入更好的免疫组织化学诊断和更新的分子病理学诊断。乳腺癌的科学合理综合治疗,有赖于病理科、影像科和临床有关学科的密切合作,应在国内外治疗指南和临床诊疗专家共识的基础上规范预后指标和预测指标的检测,力求合理治疗,提高患者的生活质量与生存率。
15 乳腺癌局部和区域淋巴结复发诊治指南
15.1 局部和区域复发的定义
局部复发是指早期乳腺癌患者乳房保留治疗后同侧乳腺内,或可手术乳腺癌患者乳房切除术后同侧胸壁再次出现肿瘤;区域复发是指患侧的淋巴引流区,包括腋窝、锁骨上/下及内乳淋巴结区域出现肿瘤。孤立性复发是指在发现局部-区域复发时,通过常规检查未发现合并其他部位的转移。
15.2 诊断
必须完整全面地检查以明确复发时有无合并远处转移。
细针穿刺虽然可以提供复发的依据,但仍需要获得复发灶的组织学诊断,并确定复发病变的生物学标志物(ER、PR和HER2)状态。
胸部CT等影像学检查,需要覆盖完整的胸壁和区域淋巴结。如果复发患者既往曾接受术后放疗,则诊断复发时的影像学检查需要明确复发病灶在放射野内还是放射野外,以及距离放射野边缘的距离。此外,还需要增加对有无放射性肺、心脏损伤的评估。如接受过术后放疗的患者出现臂丛神经症状或上肢水肿,且临床无明显淋巴结肿大,推荐行增强MRI或PET/CT扫描,有助于鉴别复发和放射性纤维化。18F-FDG PET/CT可与CT同时进行,有助于评估患者复发的完整范围,尤其是当胸部CT表现可疑或不能确定性质时,有助于评估有无远处转移,并有助于鉴别治疗后改变与复发。
15.3 治疗原则
无论乳房保留手术±放疗后复发还是乳房切除术后复发,均需要多学科评估和治疗,以最大程度地优化治疗原则,目的在于一方面有效地控制局部疾病,另一方面尽可能地减少或延迟再次复发或远处转移的发生。
15.3.1 保乳术后同侧乳房内复发
⑴ 单灶复发或可手术的复发患者,补救性乳房切除是最主要的局部治疗手段,可以获得60%~70%的5年局部控制率和约85%的总生存率。如果首次手术时未行腋窝淋巴结清扫,乳房切除术的同时可行Ⅰ~Ⅱ组腋窝淋巴结清扫。若以往曾行腋窝淋巴结清扫,经临床或影像学检查发现淋巴结侵犯证据时可行腋窝手术探查或补充清扫。再次保乳手术可作为乳房切除术的替代方法,既往接受放疗者,再次保乳术后可考虑加或不加部分乳腺照射,需视既往心肺等正常组织照射剂量,放疗与复发间隔,以及乳腺纤维化、心肺损伤情况等综合评判而定;未接受放疗者,应考虑保乳术后放疗,局部放疗范围需视复发时的临床-病理特征而定;临床上未扪及或影像学检查未见可疑腋窝淋巴结,且既往未接受腋窝清扫者,可考虑前哨淋巴结活检。
⑵ 若复发范围广泛或累及皮肤,甚至具有炎性乳腺癌表现者,则需先行全身治疗后再考虑局部手术和(或)放疗。
⑶ 补救性乳房切除术后一般不考虑胸壁放疗,但对同侧腋窝淋巴结有转移,而既往未行乳房和区域淋巴结放疗的患者,补充腋窝手术后需考虑患侧胸壁和锁骨上/下区±内乳区的放疗,既往仅行乳房放疗者,补充腋窝手术后需考虑锁骨上/下淋巴结的照射。
15.3.2 乳房切除术后复发
与保乳术后孤立乳房内复发患者相比,乳房切除术后胸壁和区域淋巴结复发的患者预后较差;同时首发胸壁复发患者,后续锁骨上淋巴结转移率较高。而首发区域淋巴结复发的患者,后续胸壁复发率也可高达30%。所以在既往没有接受过术后放疗的患者,在首次复发行放疗时,需包括易再次复发的高危区域。
15.3.3 胸壁复发
胸壁结节可切除者,推荐局部广泛切除。但是单纯手术切除的后续再次复发率可达60%~75%,放射治疗可以显著降低再次复发率,是局部区域性复发患者综合治疗的主要手段之一。首次复发患者局部小野照射会导致高达50%以上的再次复发率,且小野照射后再次复发中有2/3位于原照射野以外,所以在既往没有接受过术后放疗的患者中照射靶区需要覆盖患侧全胸壁,并需要对锁骨上/下±内乳淋巴引流区进行预防性照射。弥漫性复发患者需要先行全身性治疗,根据局部病变的退缩情况并排除远处转移后,再行胸壁和区域淋巴结的放疗。
对于以往曾行术后放疗的患者,再次照射的价值尚未证实,若复发病变不能手术或切除不完全,在充分考虑术后放疗与复发的间隔时间、放疗后正常组织改变的程度、局部-区域复发的风险,并且平衡了再照射的风险和益处之后,可针对复发病变局部再照射。
胸壁结节较大或不可切除如有全身治疗指征,经全身治疗后结节缩小预计有切除可能者,先全身治疗有助于增加局部治疗成功的可能性。
15.3.4 孤立的腋窝淋巴结复发
手术切除为主要的治疗手段,若以往未行腋窝淋巴结清扫,则需要补充清扫。而ALND后复发患者如可手术,则对复发灶行补充切除。在既往未行术后放疗的患者补充ALND后,需对患侧胸壁、内乳和锁骨上/下淋巴引流区行预防性照射。对于复发病变未能完全切除的患者,照射范围还需包括腋窝。
15.3.5 锁骨上/下淋巴结复发
如以往未行放疗,放疗靶区需包括患侧胸壁、内乳和锁骨上/下淋巴引流区,锁骨上复发者可考虑包括相邻部分颈部淋巴引流区;如既往有乳房和(或)胸壁照射史,可单独给予锁骨上/下和下颈部淋巴引流区的放疗,照射野需与原照射野衔接。对既往有锁骨上放疗史患者,可考虑行锁骨上ALND。
15.3.6 内乳淋巴结复发
如以往未行放疗,放疗范围除包括内乳区外,还需要包括患侧胸壁和锁骨上/下淋巴引流区。如以往曾行放疗,但放疗范围未包括内乳区,或虽然包括内乳区,但在仔细评估放疗后正常组织改变的程度,排除了胸壁纤维化、冠脉病变、心肌缺血和心功能异常,并且平衡了内乳区照射的风险和益处之后,可谨慎给予内乳区放疗。
15.3.7 放射治疗技术
与二维治疗相比,基于CT定位的三维治疗计划可以显著提高靶区覆盖程度,并合理评估正常组织的照射体积和剂量,推荐在复发患者中尽可能采用。全胸壁和区域淋巴结照射剂量达到50 Gy(共25次)或相应的生物等效剂量后,对复发灶需要加量至60 Gy,对未切除的复发灶照射剂量需要在60 Gy以上,但必须控制正常组织损伤。加热配合局部放疗可以在一定程度上改善局部控制率。胸壁照射时,需要添加与组织等效的填充物以保证皮肤剂量及皮下组织的剂量充分。
15.3.8 全身治疗策略
下列情况需要考虑全身治疗:局部-区域病变较大或不可切除,但经全身治疗后病变缓解有可能变为可以切除者;孤立的局部-区域复发在得到有效的局部治疗后,巩固化疗有可能改善PFS和OS,应考虑化疗,尤其是复发病灶激素受体阴性者,或对内分泌治疗不敏感或无效者;激素受体阳性患者内分泌治疗,具有可持续治疗和降低再次复发率的价值;复发灶广泛乃至放疗难以覆盖完整的靶区;同期放化疗可以提高局部控制率;HER2阳性患者可以联合靶向治疗。与其他复发转移患者的治疗原则一致,应密切跟踪治疗方案的疗效,并适时调整治疗方案。推荐局部-区域复发患者参加前瞻性临床试验。
16 乳腺癌骨转移的临床诊疗指南
16.1 概述
在晚期乳腺癌中,骨转移的发生率为65%~75%,而首发症状为骨转移者占27%~50%。骨痛、骨损伤、骨相关事件(skeletal-related event,SRE)及生活质量降低是乳腺癌骨转移常见的并发症。SRE包括骨痛加剧或出现新的骨痛、病理性骨折(椎体骨折、非椎体骨折)、椎体压缩或变形、脊髓压迫、骨放疗后症状(因骨痛或防治病理性骨折或脊髓压迫所行的放疗)及高钙血症。
16.2 骨转移的诊断方法
骨放射性核素显像(emission computed tomography,ECT)是骨转移的初筛诊断方法。具有灵敏度高、早期发现、全身显像不易漏诊的优点;但也存在特异度较低、不易区分成骨性还是溶骨性病变、不能显示骨破坏程度的缺点。骨ECT检查推荐用于乳腺癌出现骨疼痛、骨折、碱性磷酸酶升高、高钙血症等可疑骨转移的常规初筛诊断。乳腺癌分期高于T3N1M0患者进一步行常规分期检查。骨ECT检查也可选择性地用于乳腺癌患者的常规分期检查。
MRI、CT和X线检查是骨转移的影像学确诊检查方法。对于骨ECT扫描异常的患者,应该针对可疑骨转移灶部位进行MRI、CT(骨窗)及X线检查,以确认骨转移情况,并了解骨破坏的严重程度。PET/CT可以直接反映肿瘤细胞对葡萄糖的摄入,已有临床研究提示,18F-FDG PET/CT具有与骨ECT相似的灵敏度,更高的特异度,对乳腺癌骨转移治疗后病情的跟踪优于骨ECT;但是专家组认为目前PET/CT在骨转移诊断中的价值有待于进一步研究,临床并不作为常规推荐。
所以骨转移的临床诊断,ECT可以作为初筛检查,X线、CT和MRI可以明确有无骨转移,PET/CT的价值尚待进一步研究。临床上各种诊断方法应该合理应用,必要时需要通过骨活检取得病理学诊断。
16.3 乳腺癌骨转移的临床表现
乳腺癌骨转移多为多发性溶骨性病变,有些患者在溶骨性病变治疗后的修复可以在影像学中表现为过度钙化而被误诊为成骨性改变,对这部分患者应追溯其首诊时的X线摄片是否有溶骨性改变。
乳腺癌骨转移的特点:伴有疼痛的骨转移严重影响患者生活质量,但骨转移本身一般不直接对生命构成威胁;有效的治疗手段较多,不合并内脏转移的患者生存期相对较长。
16.4 骨转移的治疗
16.4.1 治疗目标
乳腺癌骨转移综合治疗的主要目标:①缓解疼痛,恢复功能,改善生活质量;② 预防和治疗SRE;③控制肿瘤进展,延长患者生存期。
16.4.2 治疗方案
乳腺癌骨转移,作为复发转移性乳腺癌已经是明显的全身性疾病,可以选择的治疗手段有:①化疗、内分泌治疗、分子靶向治疗等;② 双膦酸盐治疗;③手术治疗;④ 放射治疗;⑤ 镇痛和其他支持治疗。应根据患者具体病情,制订个体化的综合治疗方案(图3)。
图3 乳腺癌骨转移综合治疗
16.4.3 治疗原则和疗效判定
全身治疗为主,其中化疗、内分泌治疗、分子靶向治疗作为复发转移性乳腺癌的基本药物治疗,双膦酸盐类可以预防和治疗SRE。合理的局部治疗可以更好地控制骨转移症状,其中手术是治疗单发骨转移病灶的积极手段,放射治疗是有效的局部治疗手段。
复发转移性乳腺癌选择治疗方案,要考虑患者肿瘤组织的激素受体状况(ER/PR)、HER2情况、年龄、月经状态以及疾病进展是否缓慢。原则上疾病进展缓慢的激素反应性乳腺癌患者可以首选内分泌治疗,疾病进展迅速的复发转移患者应首选化疗,而HER2过表达的患者应考虑含抗HER2的治疗方案。骨病灶通常作为非靶病灶准确判断疗效一直存在着困难和争议,主要采用RECIST 1.1的标准;近年来,有学者提出骨假性进展(bone pseudoprogression)的概念,引起广泛关注,在内分泌±靶向治疗期间的出现的骨新病灶(骨扫描筛查、CT或MRI证实)并不一定意味着无效,骨新发病灶一律判定为疾病进展,可能引起过早停止治疗并对临床结局产生不利影响。
进展缓慢的复发转移性乳腺癌的特点:
⑴ 原发和(或)复发转移灶肿瘤组织ER阳性和(或)PR阳性。
⑵ 术后PFS较长的复发转移患者(如术后2年后出现复发转移)。
⑶ 仅有软组织和骨转移,或无明显症状的内脏转移(如非弥漫性的肺转移和肝转移,或肿瘤负荷不大且不危及生命的其他内脏转移)。
激素反应性乳腺癌的概念,是基于患者可能从内分泌治疗中获益的角度来界定哪些患者适合内分泌治疗,认为满足下列条件的患者有可能从内分泌治疗中获益:
⑴ 原发灶和(或)复发转移灶ER和(或)PR阳性。
⑵ 术后无病间期较长。
⑶ 既往内分泌治疗曾获益。
由于乳腺癌骨转移一般不直接构成生命威胁,且不合并内脏转移的患者生存期相对较长,因此宜尽量避免不必要的强烈化疗。而晚期乳腺癌患者,如治疗后疾病长期保持稳定则应视为临床获益,因为持续稳定6个月以上的患者生存期与临床缓解(CR+PR)的患者大致相同。鉴于内分泌治疗更适合长期用药,可以尽量延长治疗用药时间,延长疾病控制时间。
绝经后复发转移性乳腺癌,一线内分泌治疗的首选药物为氟维司群或第3代芳香化酶抑制剂,因为在他莫昔芬治疗失败的复发转移性乳腺癌的二线治疗中,第3代芳香化酶抑制剂(包括阿那曲唑、来曲唑、依西美坦)比甲地孕酮更有效。在复发转移性乳腺癌的一线内分泌治疗中,第3代芳香化酶抑制剂明显优于他莫昔芬。氟维司群500 mg在初治4期的一线内分泌治疗中明显优于第3代芳香化酶抑制剂,尤其是无内脏转移的患者。CDK4/6抑制剂(哌柏西利、瑞波西利、阿贝西利等3种CDK4/6抑制剂已在欧美等多个国家获批;哌柏西利已在中国上市)联合第3代芳香化酶抑制剂可以进一步提升疗效。
绝经前复发转移性乳腺癌激素受体阳性患者适合或需要用芳香化酶抑制剂进行内分泌治疗时,首选双侧卵巢切除手术,后续联合芳香化酶抑制剂。药物性卵巢功能抑制联合芳香化酶抑制剂也是可以考虑的方案,但尚缺乏临床证据。
乳腺癌骨转移患者,如ER和PR阴性、术后无病间隔期短、疾病进展迅速、合并内脏转移及对内分泌治疗无反应者应考虑化疗。具体化疗方案参考全身治疗指南(晚期/复发转移性乳腺癌化疗部分),但单纯骨转移患者一般不采用联合化疗。
16.4.4 放疗
放疗是乳腺癌骨转移患者姑息性治疗的有效方法。骨疼痛是骨转移的常见症状,也是影响患者生活质量及活动能力的主要原因。脊椎、股骨等负重部位骨转移并发病理性骨折的危险性约为30%,病理性骨折将显著影响患者的生存质量和生存时间。放疗用于乳腺癌骨转移治疗的主要作用是缓解骨疼痛、减少病理性骨折的危险。
放疗方法包括体外照射与放射性核素治疗2类。
体外照射是骨转移姑息治疗的常用有效方法。体外照射的主要适应证:有症状的骨转移灶,用于缓解疼痛及恢复功能;选择性用于负重部位骨转移的预防性放疗,如脊柱或股骨转移。骨转移放疗的体外照射常用剂量及分割方法有3种方案:300 cGy/次,共10次;400 cGy/次,共5次;800 cGy/次,单次照射。3种方案照射缓解骨疼痛的疗效及耐受性差异无统计学意义。单次放疗方案的治疗费用显著低于分次照射,但再放疗及病理性骨折发生率高于分次放疗。骨转移单次照射技术尤其适用于活动及搬动困难的晚期癌症患者。
放射性核素治疗对缓解全身广泛性骨转移疼痛有一定疗效,但是有些核素治疗后骨髓抑制发生率较高,而且恢复较缓慢,约需12周,可能会影响化疗的实施。因此,放射性核素治疗的临床应用应充分考虑选择合适的病例和恰当的时机。
放疗缓解骨痛的有效率为59%~88%。值得注意的是,放疗缓解骨痛的显效需要一定的时间,因此对于在放疗明显显效前的患者及放疗不能完全控制疼痛的患者,仍然需要根据患者的疼痛程度使用镇痛药以及必要的双膦酸盐治疗,可以采用负荷剂量。
16.4.5 手术治疗
骨转移外科治疗的目的是提高患者生活质量,骨外科技术的进步能够使癌症骨转移患者最大限度地解决对神经的压迫、减轻疼痛、恢复肢体功能,从而改善患者生活质量。应该对骨转移患者密切随访观察、早期发现骨转移灶,对具有潜在病理性骨折的长骨是否需要手术作出恰当的判断也是提高患者生活质量的重要保证。
外科手术治疗乳腺癌骨转移的方法包括骨损伤固定术、置换术和神经松解术。固定术治疗可考虑选择性用于病理性骨折或脊髓压迫,预期生存时间大于4周的乳腺癌骨转移患者。预防性固定术治疗可考虑选择性地用于股骨转移灶直径>2.5 cm,或股骨颈骨转移,或骨皮质破坏>50%,预期生存时间>4周的乳腺癌骨转移患者。
16.4.6 镇痛药治疗
镇痛药是缓解乳腺癌骨转移疼痛的主要方法。骨转移疼痛的镇痛药治疗应遵循WHO癌症三阶梯镇痛指导原则:首选口服及无创给药途径,按阶梯给药,按时给药,个体化给药,注意具体细节。止痛药物包括非甾体类抗炎镇痛药、阿片类镇痛药和辅助用药。
常用的非甾体抗炎药包括对乙酰氨基酚、布洛芬、双氯芬酸钠、吲哚美辛、萘普生、塞来昔布和氯诺昔康等。
常用的阿片类镇痛药包括吗啡缓释片、芬太尼透皮贴剂、羟考酮控释片、吗啡即释片、可待因和美沙酮等。哌替啶不宜用于癌痛治疗。
辅助用药包括三环类抗抑郁药、抗癫痫类药、神经弛缓剂和糖皮质激素等。
非甾体抗炎药是骨转移疼痛药物止痛治疗的基础用药,当止痛效果不佳或出现中重度疼痛时,推荐合用阿片类镇痛药。选择阿片缓释剂按时用药,有利于持续缓解骨疼痛。然而,骨转移疼痛患者在持续慢性疼痛的同时,大约63%的骨转移患者伴有突发性(爆发性)疼痛。对频繁发作的突发性疼痛的患者,可以通过增加镇痛药的按时用药剂量缓解疼痛。对少数患者,无法通过增加镇痛药剂量控制疼痛,甚至因无法耐受药物不良反应,而不能增加用药剂量。控制突发性疼痛的主要方法是备用速效或短效镇痛药。控制突发性疼痛的短效镇痛药单次用药剂量一般为日用剂量的5%~10%。对于难治的突发性疼痛患者,可考虑使用患者自控药泵法给药。发生神经病理性疼痛时,应根据病情选择辅助用药。例如出现灼痛、坠胀痛等表现时,可选择合用阿米替林、去甲替林或多虑平等三环类抗抑郁剂;出现电击样疼痛或枪击样疼痛等表现时,可选择合用加巴喷丁或卡马西平等药物。镇痛药可与双膦酸盐类药、放疗等方法多管齐下。
16.5 乳腺癌骨转移双膦酸盐临床应用专家共识
16.5.1 双膦酸盐类药物的共性和个性
16.5.1.1 作用原理
双膦酸盐是焦磷酸盐分子的稳定类似物。破骨细胞聚集于矿化骨基质后,通过酶水解作用导致骨重吸收,而双膦酸盐类药物可以抑制破骨细胞介导的骨重吸收作用。双膦酸盐可以抑制破骨细胞成熟,抑制成熟破骨细胞的功能,抑制破骨细胞在骨质吸收部位的聚集,抑制肿瘤细胞扩散、浸润和黏附于骨基质。
16.5.1.2 适应证
①高钙血症;② 骨痛;③治疗和预防SRE。SRE对乳腺癌骨转移患者的生活质量具有至关重要的影响,包括病理性骨折、脊髓压迫、为了缓解骨痛并防治病理性骨折或脊髓压迫,可通过放疗、骨骼手术、改变抗癌方案以减轻骨痛、恶性肿瘤所致高钙血症。目前在乳腺癌骨转移中使用双膦酸盐的主要目的在于降低SRE的发生率。
临床研究证实,双膦酸盐类药物可以有效地治疗乳腺癌的骨转移。基于英国国立临床规范研究所(National Institute for Clinical Excellence,NICE)的建议,这类药物已经和正在被广泛地用于治疗晚期乳腺癌的骨并发症。临床研究证明,双膦酸盐可以预防乳腺癌骨转移患者发生SRE。所以乳腺癌骨转移,如果预期生存时间大于或等于3个月,且血肌酐低于30 mg/L,在给予治疗病情所需的化疗药物和内分泌治疗的同时,应及时给予双膦酸盐治疗。
16.5.1.3 临床用药及使用方法
双膦酸盐化学结构中与中心碳原子连接的侧链不同,双膦酸盐类药物的临床活性和功效亦有所不同。
第1代双膦酸盐以氯膦酸二钠为代表,这些药物在30年前进入临床使用。用量和用法:氯膦酸二钠目前有静脉、口服2种制剂可供选择,双膦酸盐口服制剂方便在家用药,也方便与口服化疗药物及内分泌治疗药物联合使用。临床上也可以先采用静脉滴注氯膦酸二钠400 mg/d,连用3 d,而后口服氯膦酸二钠1 600 mg/d,共3~4周作为1个周期的用法。氯膦酸二钠主要经肾脏清除,因此,在氯膦酸二钠治疗过程中一定要维持足够的水分摄入。氯膦酸二钠胶囊应整粒吞服。任何情况下都不能将氯膦酸盐与含有钙或其他二价阳离子的食物(如牛奶等)或药物同服,因为它们会减少氯膦酸盐的吸收。
第2代是含氮的双膦酸盐,包括帕米膦酸二钠、阿仑膦酸钠,这些药物抑制骨吸收的体外活性要强于第1代药物。用量和用法:帕米膦酸盐静脉滴注,每次60~90 mg,输注时间不短于2 h,每3~4周用药1次。
第3代为具有杂环结构的含氮双膦酸盐唑来膦酸和不含环状结构含氮的伊班膦酸,作用强度和疗效比第2代进一步提高。用量和用法:唑来膦酸盐4 mg,静脉注射大于15 min,每3~4周注射1次。伊班膦酸盐6 mg,静脉注射大于15 min,每3~4周注射1次。
⑴ 伊班膦酸治疗转移性骨病:常规剂量为6 mg,静脉注射大于15 min,每3~4周注射1次。
⑵ 伊班膦酸负荷剂量:可快速缓解伴有严重疼痛的转移性骨痛患者,使用方法为6 mg/d,连续3 d静脉注射,以后每3~4周常规使用6 mg/次。
伊班膦酸目前在国外有静脉滴注、口服2种制剂可供选择,静脉滴注6 mg伊班膦酸和口服50 mg伊班膦酸疗效相当,而口服制剂可方便在家用药,也方便与口服化疗药物及内分泌治疗药物联合使用。
16.5.2 双膦酸盐的使用适应证和用药时机
具体使用情况见表8。单个随机临床研究提示,乳腺癌骨转移需接受双膦酸盐治疗者也可考虑地诺单抗注射治疗。
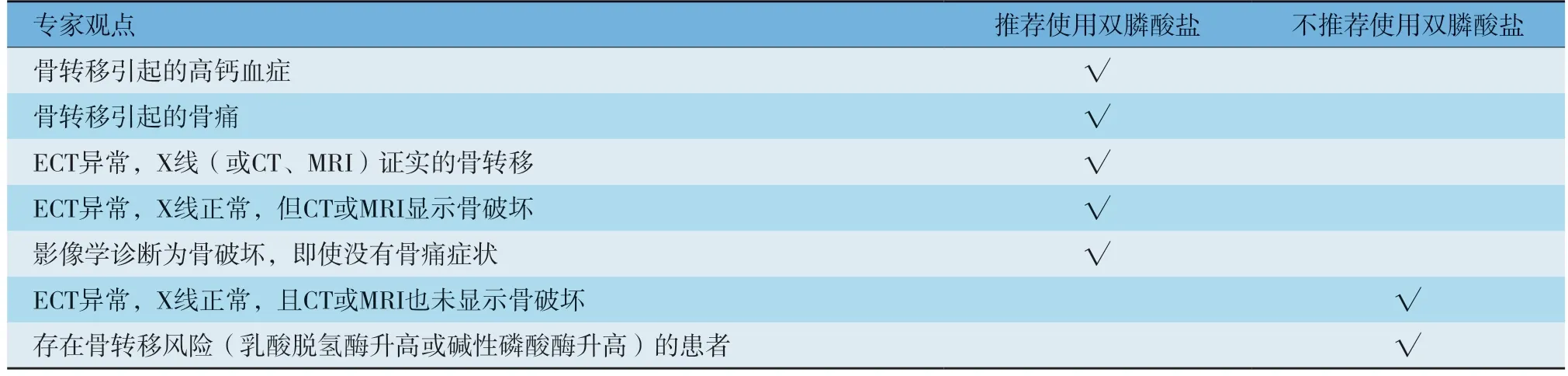
表8 双膦酸盐推荐使用情况
16.5.3 双膦酸盐的使用方法及注意事项
⑴ 在使用双膦酸盐类药物前,应该检测患者血清电解质水平,重点关注血肌酐、血清钙、血磷和镁等指标。
⑵ 临床研究表明,第1代氯膦酸盐、第2代帕米膦酸盐和第3代唑来膦酸和伊班膦酸盐都有治疗乳腺癌骨转移的作用,都可以用于治疗高钙血症、骨痛、预防和治疗SRE。已有临床研究结果显示,第3代双膦酸盐唑来膦酸和伊班膦酸有疗效更好、毒性更低和使用更方便的优点。
⑶ 选择药物治疗应考虑患者的一般状况和疾病的总体情况及同时接受的治疗。静脉内使用唑来膦酸和伊班膦酸具有输液时间更短的优势。
⑷ 双膦酸盐可以与放疗、化疗、内分泌治疗、止痛药联合使用。
⑸ 长期使用双膦酸盐联合治疗时应每日补钙和维生素D,剂量为钙1 200~1 500 mg/d及维生素D3 400~800 U。
⑹ 在轻、中度肾功能不全(肌酐清除率>30 mL/min)的患者中无需调整剂量,但严重肾功能不全(肌酐清除率≤30 mL/min)患者,应根据不同产品的说明书进行剂量调整或延长输注时间。
⑺ 鉴于有文献报道少数患者在长期使用双膦酸盐后有发生下颌骨坏死的风险,所以使用双膦酸盐前应进行口腔检查,注意每日口腔清洁,用药期间尽量避免包括拔牙等口腔手术。
16.5.4 用药时间及停药指征
16.5.4.1 用药时间
在乳腺癌骨转移全身系统性治疗基础上加用唑来膦酸、伊班膦酸、帕米膦酸二钠或地诺单抗每个月1次。对于病情稳定者,连用12次后可每3个月1次。
16.5.4.2 停药指征
⑴ 使用中监测到不良反应,且明确与双膦酸盐相关。
⑵ 治疗过程中出现肿瘤恶化,出现其他脏器转移并危及生命。
⑶ 临床医师认为有必要停药时。
⑷ 经过其他治疗后骨痛缓解非停药指征。
16.5.5 生化标志物
目前有部分生化指标可能帮助医师了解患者对双膦酸盐的治疗反应,但目前局限于科研领域,不建议临床使用。
16.5.6 临床资料和专家观点
16.5.6.1 双膦酸盐预防骨转移的作用
尽管已有研究提示,双膦酸盐类药物可能有预防骨转移的作用,并可能有潜在的预防内脏转移的作用,但双膦酸盐预防骨转移的临床研究仍在进行中。所以对于没有骨转移影像学证据的患者,以及出现骨外转移但没有骨转移证据的患者,目前均不推荐使用双膦酸盐。
16.5.6.2 双膦酸盐作为乳腺癌术后辅助治疗用药
体外研究显示,双膦酸盐类药物有抗肿瘤作用。多项临床研究及meta分析结果显示,乳腺癌术后标准放疗、化疗、内分泌治疗基础上,加用双膦酸盐治疗对于绝经后患者乳腺癌可显著降低复发转移、远处转移和骨转移风险,且显著降低乳腺癌相关死亡风险。目前ASCO指南推荐双膦酸盐可作为绝经后(包括绝经前使用卵巢功能抑制剂患者)乳腺癌术后辅助内分泌治疗期间的治疗用药。具体推荐用药用法为:唑来膦酸4 mg,静脉注射大于15 min,每6个月1次,持续3~5年;氯膦酸1 600 mg口服,每日1次,持续2~3年。
16.5.6.3 乳腺癌患者抗肿瘤治疗引起的骨丢失
抗肿瘤治疗引起的骨丢失(cancer treatment-induced bone loss,CTIBL)是应该引起重视的临床问题,可以发生在老年患者、化疗后、内分泌治疗尤其是卵巢功能抑制和芳香化酶抑制剂治疗后,根据ASCO骨健康指南,应该检测BMD,并根据结果考虑是否使用双膦酸盐类药物。绝经前妇女正在接受可能导致早绝经的治疗(化疗、卵巢去势)的患者都应该常规检查BMD。T-score低于-2.5开始使用双膦酸盐;T-score在-2.5~-1.0之间患者考虑使用双膦酸盐;而T-score高于-1.0的患者则不建议使用双膦酸盐。双膦酸盐治疗骨质疏松的用法和治疗骨转移的用法不一样,可以每3~6个月使用1次,并且要根据治疗后T-score的改变调整用药。而乳腺癌患者由于其年龄和治疗均有可能存在骨质疏松,医师应常规对这些女性的骨骼健康进行评估,目前不推荐将双膦酸盐类药物用于骨质疏松症的预防。
16.5.6.4 发生SRE后是否换药预防SRE再次发生的问题
发生某些特殊SRE(高钙血症、骨手术、放疗)后,在临床研究中会作为观察终点停止使用双膦酸盐,但临床实践中不应该停用,而应该继续用药。在某一类双膦酸盐使用过程发生首次骨转移加重的SRE后,可以考虑换用另一类双膦酸盐。也有专家认为换药是否获益有待更多的临床研究数据支持。
17 乳腺癌患者BRCA1/2基因检测与临床应用
基于当前对BRCA1/2在乳腺癌发病、预防、治疗及预后预测中作用认识的深化,检测技术的成熟以及新的靶向药物的应用,参考国外指南,结合我国部分肿瘤中心的数据和临床经验,形成本部分内容。
17.1 BRCA1/2基因突变与乳腺癌发病风险
BRCA基因突变分为两种类型,一种为胚系突变,是指来源于精子或卵母细胞的生殖细胞突变,致机体所有细胞都带有突变,可以遗传给后代;另一种为体细胞突变,是指发生于肿瘤细胞中的BRCA基因突变,为非遗传性突变。携带BRCA1/2基因突变的女性不仅乳腺癌发病风险增加,其他如卵巢癌、输卵管癌、胰腺癌、胃肠道肿瘤及黑色素瘤等发病风险也增加,男性罹患乳腺癌、前列腺癌风险增加。
17.2 BRCA1/2基因突变与乳腺癌患者的治疗决策
BRCA基因编码蛋白通过同源重组参与DNA双链损伤修复,BRCA1/2基因突变乳腺癌由于同源重组修复功能缺陷,可能对铂类药物或PARP抑制剂等致DNA损伤药物更为敏感。对于伴有BRCA1/2基因胚系突变或体细胞突变的晚期或复发转移性乳腺癌患者,制订化疗方案时可以优先考虑铂类药物,也可选择PARP抑制剂如奥拉帕尼作为化学治疗的替代药物。
17.3 对乳腺癌患者进行BRCA基因检测的建议
结合美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)、欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)等国外指南,以及我国现有的临床数据,提出推荐进行BRCA基因筛查的乳腺癌患者特征。
17.4 BRCA1/2基因突变检测流程、质控及报告内容和解读规范
17.4.1 检测前咨询
询问家族史信息,一级、二级及三级双方亲属是否有乳腺癌、卵巢癌、前列腺及胰腺癌病史;家族中是否有人已进行过BRCA1/2基因检测;评估被检者的患病风险;告知被检者关于乳腺癌遗传方式、外显率、遗传异质性及变异多样性的相关知识;告知被检者检测潜在的风险及可能的检测结果,并签署知情同意书。
17.4.2 突变检测及验证
对于家族中存在已知变异位点者,建议采用一代测序的方法检测。对于家族中未存在已知变异位点或家族中从未进行过BRCA基因检测者,建议采用二代测序结合大片段缺失检测方法检测BRCA1/2基因的全部外显子以及外显子和内含子连接区域±20 bp。
17.4.3 检测后咨询
向被检者详细解释检测结果以及针对检测结果应采取何种预防和治疗手段;向被检者推荐一些临床帮助,如参与药物临床试验及其他疾病互助系统;建议家族中其他高风险成员进行BRCA基因检测。
17.4.4BRCA1/2基因检测结果的解读
临床实验室应根据所检测的人群特征、综合临床分子诊断的实验数据和临床信息,为医师和患者描述此结果对疾病诊断的含义,为个体化用药提出建议。临床医师应根据检测结果和临床信息向患者解释检测结果。
对于阳性结果的判定解读是BRCA基因检测中最为重要的环节。BRCA基因突变解读需要依据各类信息(包括来自群体数据库、疾病数据库、文献和患者病史的信息)进行综合评判。在国外数据分析的基础之上,构建我国大样本BRCA基因突变数据库并进行规范化解读,可以指导与规范BRCA基因检测在我国的临床应用,改善相应患者的治疗策略,提高高危人群的筛查和预防水平。
18 乳腺癌多基因精准检测和精准治疗指南
肿瘤精准检测是指利用基因组学、表观遗传组学、转录组学、蛋白组学、代谢组学等组学检测技术,获取肿瘤相关的生物学信息,进一步分析组学检测结果对肿瘤筛查与诊疗的临床应用价值。其中,多基因突变检测指利用二代测序(next generation sequencing,NGS)技术,将多个基因对应的探针设计到同一张捕获芯片上以捕获目标肿瘤或者胚系DNA,并结合后续的测序分析检测肿瘤中的突变基因、突变类型与突变位点等相关信息。多基因突变检测应当由具备NGS与分析资质的机构提供精准的检测服务,并对乳腺癌发生、发展过程中的遗传易感性基因(BRCA1/2等)、高频突变基因、靶向用药相关基因和耐药相关基因等多类基因进行突变检测,检测结果应由专业人员结合患者具体情况进行合理解读。
多基因突变检测对于乳腺癌罹患风险预测、乳腺癌(尤其是三阴性乳腺癌)的分子分型和精准治疗方案选择具有重要参考意义。在临床实践中推荐对以下3类患者行多基因突变检测:①有肿瘤相关个人史或家族史,提示基因相关的肿瘤易感性;② 能够充分解释精准检测结果;③检测结果有助于临床筛查、诊疗的应用。当前针对乳腺癌的多基因突变检测主要应用于晚期多线治疗方案失败的患者中(推荐结合临床试验进行),辅助临床医师发现这部分乳腺癌患者的相关基因突变信息,并对肿瘤患者进行精准分型与治疗靶点的精确定位,进而选择可能有效的治疗策略与治疗药物。
包括多基因突变检测在内的精准检测在乳腺癌诊断与治疗中有广阔的应用前景,也将随着各类组学检测技术的发展和相关证据的累积,在临床实践中发挥更加重要的作用。
精准检测对于三阴性乳腺癌的精准治疗具有重要价值。三阴性乳腺癌是一群异质性肿瘤,可基于基因表达谱分成不同的分子亚型。目前认可度较高的分型系统包括Lehmann六分型、Burstein四分型和“复旦分型”,其中“复旦分型”系统具有多组学融合的特点和后续完整的临床验证过程,具有较高的临床转化价值。“复旦分型”系统将三阴性乳腺癌分为基底样免疫抑制型(BLIS)、免疫调节型(IM)、腔面雄激素受体型(LAR)和间充质样型(MES)。各亚型均存在特异性基因组和转录组改变,有对应的潜在治疗靶点。临床实践中可基于AR、FOXC1、CD8和DCLK1这4个亚型特异性标志物的免疫组织化学染色结果,按照如下的分型流程(图4),准确区分“复旦分型”的各个亚型,实现“复旦分型”从多组学大数据分析到临床应用的转化。
图4 三阴性乳腺癌“复旦分型”的免疫组织化学判定流程
在精准分型的基础上通过多基因突变检测,可鉴定“复旦分型”中各亚型特异的基因组变异,为临床医师开展精准治疗提供参考。目前推荐在晚期三阴性乳腺癌中开展“复旦分型”和多基因突变检测,针对亚型特异性靶点开展精准治疗,实现三阴性乳腺癌“分子分型基础上的精准治疗”,进而改善患者预后。如在IM亚型患者中使用抗PD-1单抗免疫治疗联合白蛋白结合型紫杉醇,在具有ERBB2激活突变的LAR亚型患者中使用吡咯替尼联合卡培他滨,均在多线治疗失败的三阴性乳腺癌患者中取得了显著疗效。
基于基因组和转录组建立的“复旦分型”系统仍在不断完善之中。表观遗传组学、转录组学、蛋白组学、代谢组学等多维度的组学检测和更精细的单细胞层面检测是优化“复旦分型”的新手段,将助力更精准的“复旦分型”系统和更多元化的精准治疗靶点,人工智能联合影像组学和病理组学分析将助力实现临床快捷简便的“复旦分型”。
19 乳腺肿瘤整合医学的其他问题
19.1 乳腺癌的中医治疗
乳腺癌属于中医“乳岩”范畴,是常见的危害生命健康的重要癌症之一,随着现代医学的发展和新型药物的不断出现,其治疗有效率与生存率显著提高。中医在乳腺癌的综合治疗中占有一定的地位,现已证实中医可以改善患者的症状,协同提高手术后恢复,减轻放疗、化疗、内分泌治疗、分子靶向治疗和分子免疫治疗的不良反应,并增加其疗效,调节患者的免疫功能和体质状况,防治肿瘤及肿瘤治疗相关的并发症,预防复发转移,提升生存质量,可能延长生存期,是乳腺癌治疗的重要辅助手段。
根据乳腺癌的发病机制和特点,结合转移辨证论治与“因人制宜”的方法,临床上主张“分期辨证”治疗,即采用围手术期、围化疗期、围放疗期和巩固(康复)期几个阶段,以“扶正”“祛邪”为治疗总则,涵盖乳腺癌治疗的全病程期。
关于乳腺癌中医治疗的适宜人群是有明确指南的,对于具备西医治疗条件的患者以西医治疗为主,中医治疗为辅的中西医结合治疗方式;对于不适合或者不愿意接受西医治疗的患者,可采用单纯的中医治疗方式,其中临床无肿瘤康复期和晚期肿瘤姑息安宁疗护期,中医治疗是有益的补充。
中医治疗乳腺癌的手段目前临床主要包括中药汤剂、中药颗粒剂、中成药、中药注射剂、外用制剂以及非药物治疗(如气功、针灸)等,其中,中药汤剂因为可以因人、因时、因地制宜地通过辨证施治针对乳腺癌的症状以及相关治疗后状态占主要地位。关于所谓的民间经方或验方,尚需谨慎对待。
中医对乳腺肿瘤讲究“治未病”的预防思想,即未病先防,既病防变。对于一些亚健康人群、高危人群(含乳腺肿瘤)中医在临床上也时常运用汤药和成药(如小金丸、西黄丸等)治疗,随着研究的深入,相关证据类别有望提高。
此外,在中医非药物治疗乳腺疾患中有一些理念和作法是为人称道的:一是中医历来注重乳腺癌患者的情志调养,改善患者的心理承受能力和身心状态,这对于乳腺癌患者的康复有临床积极意义。同时配合适当的功能锻炼(如太极拳、瑜伽、五禽戏等)有助于康复;还有就是饮食疗法,乳腺癌发病本身与饮食有一定的关联,合理的膳食调摄既是养生必需的,也是治疗的一部分,中医尚有药膳特色。
值得一提的是,在乳腺癌的治疗过程中我们既要相信中医的疗效,但也不可迷信其功效。
19.2 乳腺癌营养治疗指南
19.2.1 乳腺癌患者营养诊断
中国抗癌协会肿瘤营养专业委员会提出对患者营养状况需进行三级诊断:一级诊断,营养筛查;二级诊断,营养评估;三级诊断,综合评价(图5)。
图5 营养不良的三级诊断
19.2.1.1 营养筛查
欧洲临床营养和代谢学会(European Society for Clinical Nutrition and Metabolism,ESPEN)及中华医学会肠外肠内营养学分会(Chinese Society of Parenteral and Enteral Nutrition,CSPEN)推荐采用NRS 2002筛查乳腺癌患者营养风险,且应在入院24 h内完成。NRS 2002总分值≥3分提示患者存在营养风险。
19.2.1.2 营养评估
建议对所有营养筛查阳性患者使用患者主观整体评估(PG-SGA)方法进行营养评估,在入院后48 h内完成。根据PG-SGA积分将患者分为无营养不良(0~1分)、可疑或轻度营养不良(2~3分)、中度营养不良(4~8分)及重度营养不良(≥9分)这4类。
19.2.1.3 综合评价
综合评价从人体组成、身体活动能力、器官功能、心理状况、生活质量对营养不良的后果进行五层次分析,且应在患者入院后72 h内完成。
中国抗癌协会肿瘤营养与支持治疗专业委员会推荐的肿瘤患者营养疗法临床路径如下:肿瘤患者入院后应该常规进行营养筛查/评估,根据积分多少将患者分为无营养不良、可疑营养不良、中度营养不良及重度营养不良。无营养不良者,无需营养干预,直接进行抗肿瘤治疗;可疑营养不良者,在营养教育的同时,实施抗肿瘤治疗;中度营养不良者,在营养治疗的同时,实施抗肿瘤治疗;重度营养不良者,应先进行营养治疗1~2周,然后在继续营养治疗的同时,进行抗肿瘤治疗。无论有无营养不良,所有患者在完成1个疗程的抗肿瘤治疗后,应该重新进行营养筛查/评估(图6)。
图6 中国抗癌协会肿瘤营养与支持治疗专业委员会制定的肿瘤患者营养治疗临床路径
19.2.2 乳腺癌患者营养干预
19.2.2.1 原则
营养干预的实施方法应遵循五阶梯原则,首先选择营养教育,再选口服营养补充,次选肠内营养补充,最后选肠外营养补充。当下一阶梯不能满足目标需要量60%能量需求时,应该选择上一阶梯(图7)。
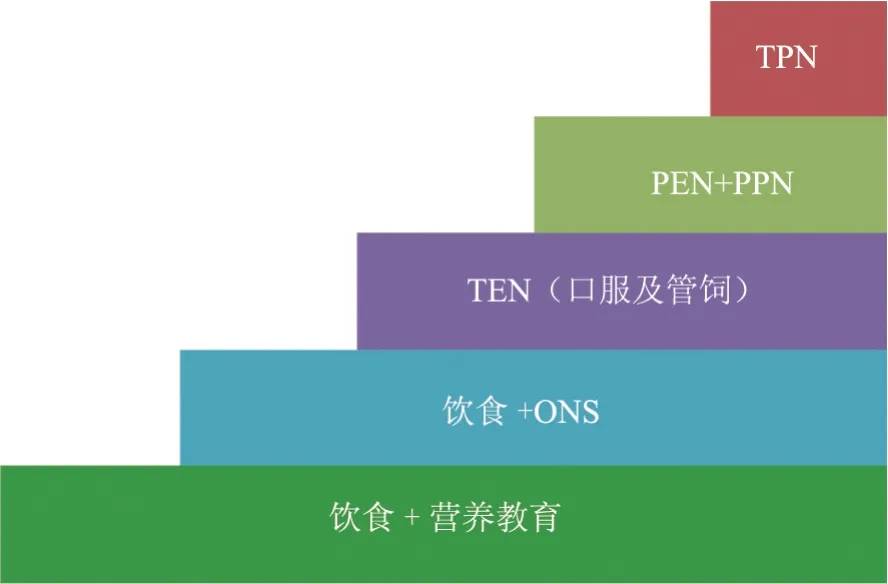
图7 肿瘤患者营养干预五阶梯
19.2.2.2 能量
乳腺癌患者能量供给为25~30 kcal/(kg·d),必要时可根据具体情况进行个体化动态调整。
19.2.2.3 三大营养素
非荷瘤状态下三大营养素的供能比例为:碳水化合物50%~55%、脂肪25%~30%、蛋白质15%;荷瘤患者,特别是伴有胰岛素抵抗的肿瘤患者应提高脂肪的供能比,可至50%。乳腺癌患者蛋白质摄入量为1.2~1.5 g/(kg·d),存在严重消耗的患者蛋白质摄入量可增至1.5~2.0 g/(kg·d)。饮食中可增加ω-3、ω-6不饱和脂肪酸摄入。
19.2.2.4 抗肿瘤治疗相关的营养治疗
⑴ 放疗:口服谷氨酰胺可降低放疗引起的皮肤不良反应。
⑵ 内分泌治疗:接受内分泌治疗的乳腺癌患者容易出现骨质流失,甚至发生骨折,建议接受内分泌治疗前进行骨折风险评估,改变生活方式及补充钙和维生素D。
19.2.3 乳腺癌患者营养治疗效果评估
考虑到营养干预的特殊性,将营养疗效评价指标分为3类。
19.2.3.1 近期指标(实验室参数)
血常规、电解质、肝肾功能、炎症参数(IL-1、IL-6、TNF、CRP)、营养套餐(白蛋白、前白蛋白、转铁蛋白、视黄醇结合蛋白、游离脂肪酸)等,每周检测1~2次。
19.2.3.2 中期指标
人体测量参数、人体成分分析、生存质量评估、体能评估、肿瘤病灶评估(双径法)。每4~12周评估1次。
19.2.3.3 远期指标
生存时间,每年评估1次。
19.2.4 膳食相关的营养治疗
⑴ 饮食中ω-3不饱和脂肪酸与ω-6不饱和脂肪酸相对摄入比增加能够降低乳腺癌发生风险。
⑵ 低脂奶制品或增加奶制品的摄入频率均有可能降低乳腺癌发生风险。
⑶ 含咖啡因的咖啡可降低绝经后女性乳腺癌的发病率。
⑷ 大豆食品可降低乳腺癌的死亡和复发风险。
⑸ 建议增加蔬菜、水果和全谷类食物、优质蛋白的摄入,限制酒精、红肉和加工肉制品的摄入。
19.2.5 体重管理相关的营养治疗
建议乳腺癌患者通过以下方式进行体重管理,以维持健康体重(BMI 18.5~23.9):
⑴ 每周定时(晨起排便后空腹)监测体重1次并记录。
⑵ 每周至少150 min的中等强度体力活动(每周5次,每次30 min)。
⑶ 每周至少2次力量性训练(大肌群抗阻运动)。
附 录
附录Ⅰ 推荐对乳腺癌患者进行BRCA基因检测的专家共识
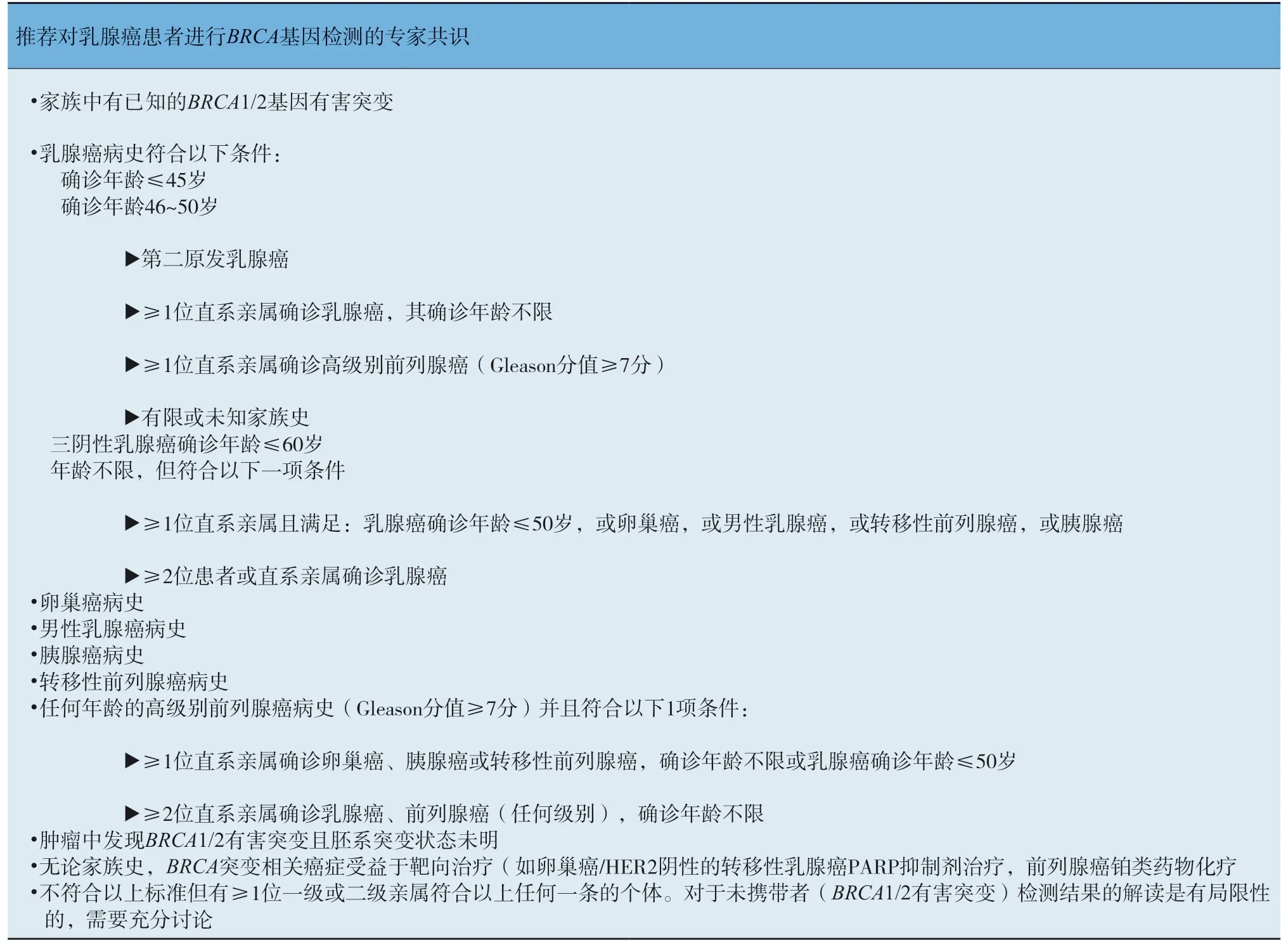
注:符合以上标准中1条或多条即应考虑进一步的风险评估、遗传咨询,以及基因检测和管理。仅有家族史个体应慎重解读基因检测结果,因其可能存在明显局限性
附录Ⅱ 乳腺X线诊断报告范本

XXXXXX医院乳腺X线检查报告书
附录Ⅲ 超声检查报告范本

XXXXXX医院乳腺超声检查报告书
附录Ⅳ 乳腺MRI诊断报告范本

XXXXXX医院乳腺MRI检查报告书
附录Ⅴ 乳腺病理学诊断
附录Ⅴ-A 乳腺癌新辅助治疗的病理诊断专家共识(2020版)
1.pCR(病理完全缓解)的定义:乳腺原发灶无浸润性癌且区域淋巴结无癌细胞。新辅助治疗后仅残留乳腺脉管内肿瘤或仅淋巴结内残余ITC均不能诊断pCR。
2.AJCC ypTNM分期:ypT以最大灶浸润性癌作为分期依据,如果纤维化间质内散在多个病灶,则以其中浸润性癌的最大连续病灶作为分期依据。ypN以淋巴结残余转移癌的最大连续病灶作为分期依据。
3.残余肿瘤负荷(residual cancer burden,RCB)评估:根据原发灶残余肿瘤范围,残余肿瘤的细胞密度,原位癌所占比例,阳性淋巴结个数和淋巴结转移癌最大径5项参数,参照网络计算器(www.mdanderson.org/breastcancer_RCB)获得RCB指数及对应的级别。
RCB 0:病理完全缓解(pCR)
RCBⅠ:少量肿瘤残余
RCBⅡ:中等量肿瘤残余
RCBⅢ:广泛肿瘤残余
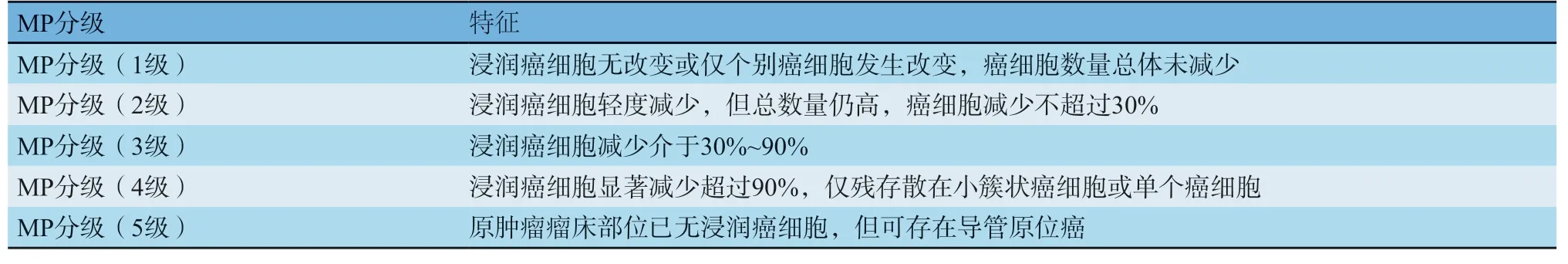
Miller&Payne评估系统(MP分级)
附录V-B 2019版世界卫生组织(WHO)乳腺癌组织学分型
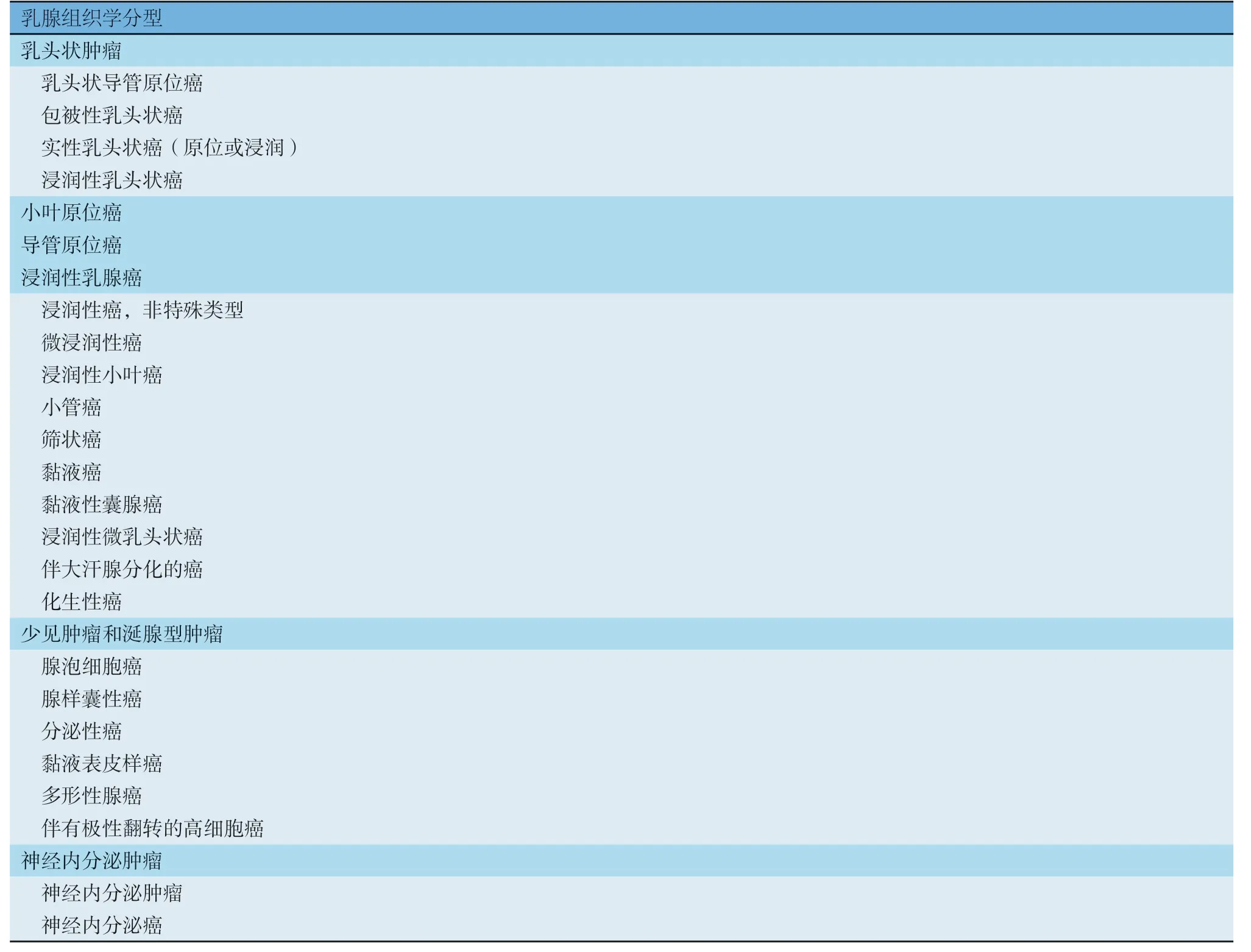
附录V-C 组织学分级
1 乳腺浸润性癌组织学分级
根据是否有腺管形成、细胞核多形性及核分裂象计数3项指标进行分级,建议采用Nottingham分级系统。
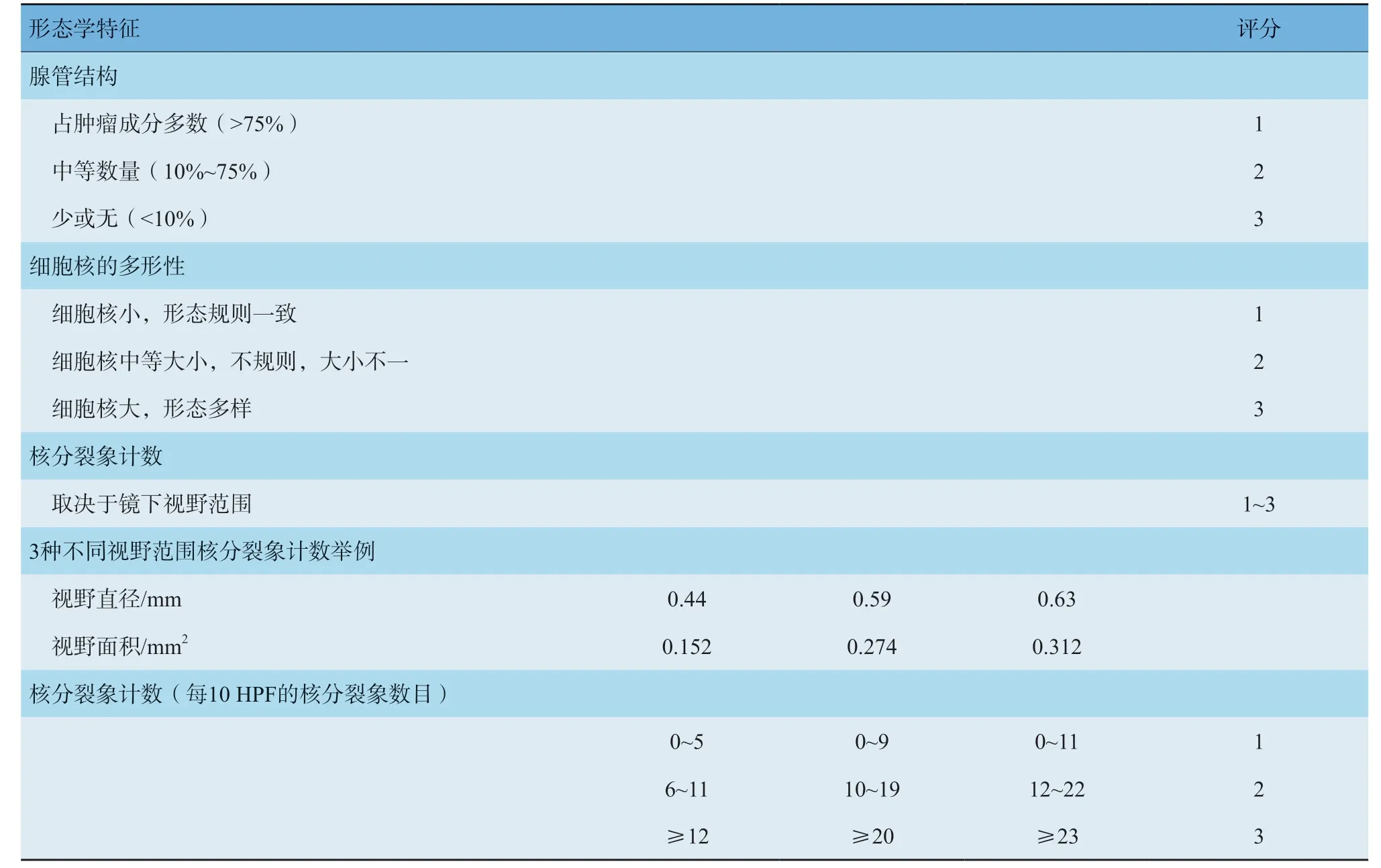
注:⑴ 对腺管结构、细胞核多形性及核分裂象计数3项指标分别进行评分:总分为3~5分,组织学分级为Ⅰ级;6~7分,组织学分级为Ⅱ级;8~9分,组织学分级为Ⅲ级。⑵ 视野直径=视野数/物镜的放大倍数
2 乳腺导管原位癌的分级
对于导管原位癌,病理报告中应该包括分级,并建议报告是否存在坏死、组织学结构、病变大小或范围、切缘状况。目前乳腺导管原位癌的分级主要是细胞核分级,诊断标准如下:
低核级导管原位癌:由小而一致的癌细胞组成,呈僵直搭桥状、微乳头状、筛状或实体状结构。细胞核大小一致,染色质均匀,为1.5~2.0倍红细胞大小,核仁不明显,核分裂象少见。
中核级导管原位癌:形态介于低级别和高级别导管原位癌之间,细胞的大小、形状、极性有中等程度差异。染色质粗细不等,可见核仁,核分裂象可见,可出现点状坏死或粉刺样坏死。
高核级导管原位癌:由高度不典型的细胞组成,形成微乳头状、筛状或实体状。细胞核多形性明显,>2.5倍红细胞大小。癌细胞缺乏极性排列,染色质粗块状,核仁明显,核分裂象多见。管腔内常出现伴有大量坏死碎屑的粉刺样坏死。但腔内坏死不是诊断高级别导管原位癌的必要条件,有时导管壁衬覆单层细胞,但细胞高度异型,也可以诊断为高级别导管原位癌。
附录V-D 乳腺癌雌激素受体免疫组织化学检测指南(2015版)
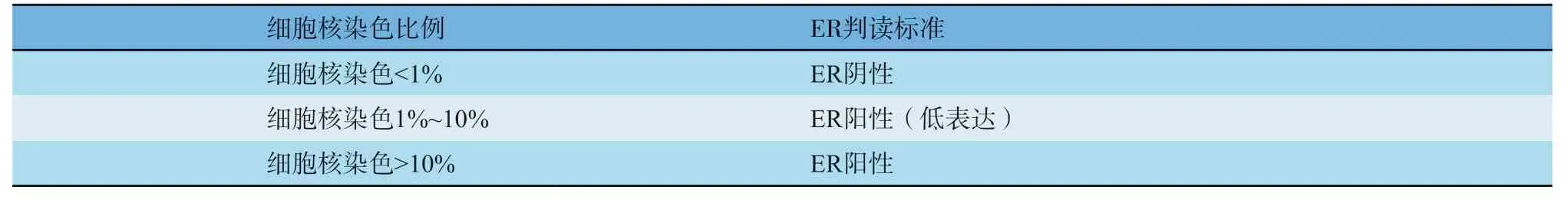
ER判读标准
附录V-E 乳腺癌HER2检测指南(2019版)
附录V-F

XXXXXX医院病理学诊断报告书
附录Ⅵ 乳腺癌常用的辅助/新辅助治疗方案*
1 HER2阴性乳腺癌辅助/新辅助治疗方案
TAC方案
多西他赛75 mg/m2iv第1天
多柔比星50 mg/m2iv第1天
环磷酰胺500 mg/m2iv第1天
21 d为1个周期,共6个周期
(所有周期均用G-CSF/PEG-rhG-CSF支持)
剂量密集AC/EC→P(每两周1次)
多柔比星60 mg/m2iv第1天
或表柔比星90~100 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
14 d为1个周期,共4个周期
序贯以
紫杉醇175 mg/m2iv 3 h 第1天——14 d为1个周期,共4个周期
(所有周期均用G-CSF/PEG-rhG-CSF支持)
剂量密集AC/EC→P(每周1次)
多柔比星60 mg/m2iv第1天
或表柔比星90~100 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
14 d为1个周期,共4个周期(用G-CSF/PEG-rhGCSF支持)
序贯以
紫杉醇80 mg/m2iv 1 h第1天——7 d 1次,共12次
AC/EC→P/T方案
多柔比星60 mg/m2iv第1天
或表柔比星90~100 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
21 d为1个周期,共4个周期
序贯以
紫杉醇80 mg/m2iv 1 h第1天——7 d 1次,共12次或多西他赛100 mg/m2iv第1天——21 d为1个周期,共4个周期
TC方案(用于辅助治疗)
多西他赛75 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
21 d为1个周期,共4~6个周期
AC方案
多柔比星60 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
21 d为1个周期,共4个周期
EC方案
表柔比星100 mg/m2iv第1天
环磷酰胺830 mg/m2iv第1天
21 d为1个周期,共4个周期
PCb方案
紫杉醇80 mg/m2,第1、8、15天
卡铂 AUC=6第1天,或AUC=2 第1、8、15天
21 d为1个周期,共4~6个周期
TCb方案
多西他赛75 mg/m2第1天
卡铂AUC=6 第1天
21 d为1个周期,共4~6个周期
辅助强化治疗方案
⑴ XT→XEC方案(用于三阴性乳腺癌)
多西他赛75 mg/m2iv第1天
卡培他滨1 000 mg/m2po bid第1~14天
21 d为1个周期,共4个周期
序贯以
表柔比星75 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
卡培他滨1 000 mg/m2po bid第1~14天
21 d为1个周期,共4个周期
⑵ 标准化疗结束后X强化(用于三阴性乳腺癌)
卡培他滨650 mg/m2po bid,连续口服1年
⑶ 新辅助未达pCR后X强化(用于三阴性乳腺癌和淋巴结残留阳性ER阳性/HER2阴性乳腺癌)
卡培他滨1 250 mg/m2po bid,第1~14天,共8个周期
⑷ 奥拉帕利强化(用于致病/疑似致病gBRCA突
变高危乳腺癌,尚未获得辅助治疗适应证)
奥拉帕利300 mg po bid,连续口服1年
ER阳性/HER2阴性患者的新辅助内分泌治疗:
绝经后患者通常使用AI进行新辅助内分泌治疗;绝经前患者除非进入临床研究或有化疗禁忌(可选OFS+AI/氟维司群),不应常规进行新辅助内分泌治疗。
2 HER2阳性乳腺癌辅助/新辅助治疗方案
AC/EC→PH
多柔比星60 mg/m2iv第1天
或表柔比星90~100 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
21 d为1个周期,共4个周期
序贯以
紫杉醇80 mg/m2iv 1 h第1天
曲妥珠单抗2 mg/kg(首次剂量4 mg/kg)第1天7 d 1次,共21次
而后曲妥珠单抗6 mg/kg,每3周1次,完成1年
每3个月监测心功能
剂量密集AC/EC→PH方案
多柔比星60 mg/m2iv第1天
或表柔比星90~100 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
14 d为1个周期,共4个周期
序贯以
紫杉醇175 mg/m2iv 3 h第1天,14 d为1个周期,共4个周期
(所有周期均用G-CSF/PEG-rhG-CSF支持)
同时采用曲妥珠单抗,首次剂量4 mg/kg,之后为2 mg/kg,每周1次,共1年
也可在紫杉醇结束后用曲妥珠单抗,首次剂量8 mg/kg,之后6 mg/kg,
每3周1次,完成1年
在基线、3、6和9个月时监测心功能
AC/EC→TH方案
多柔比星60 mg/m2iv第1天
或表柔比星90~100 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
21 d为1个周期,共4个周期
序贯以
多西他赛100 mg/m2iv 第1天
曲妥珠单抗2 mg/kg(首次剂量4 mg/kg)
第1、8、15天
21 d为1个周期,共4个周期
而后曲妥珠单抗6 mg/kg,每3周1次,完成1年
每3个月监测心功能
TCbH方案
多西他赛75 mg/m2iv第1天
卡铂AUC=6 iv第1天
曲妥珠单抗6 mg/kg(首次剂量8 mg/kg)第1天
21 d为1个周期,共6个周期
而后曲妥珠单抗6 mg/kg,每3周1次,完成1年每3个月监测心功能
AC/EC→THP方案
多柔比星60 mg/m2iv第1天
或表柔比星90~100 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
21 d为1个周期,共4个周期
序贯以
多西他赛75~100 mg/m2iv第1天
或紫杉醇80 mg/m2iv 1 h第1、8、15天
曲妥珠单抗6 mg/kg(首次剂量8 mg/kg)第1天
帕妥珠单抗 420 mg iv(首次剂量840 mg)第1天
21 d为1个周期,共4个周期
而后曲妥珠单抗6 mg/kg,帕妥珠单抗420 mg,
每3周1次,完成1年
每3个月监测心功能
剂量密集AC/EC→THP方案
多柔比星60 mg/m2iv第1天
或表柔比星90~100 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
14 d为1个周期,共4个周期(用G-CSF/PEG-rhGCSF支持)
序贯以
多西他赛75-100 mg/m2iv第1天
或紫杉醇80 mg/m2iv 1 h第1、8、15天
曲妥珠单抗6 mg/kg(首次剂量8 mg/kg)第1天
帕妥珠单抗 420 mg(首次剂量840 mg)iv第1天
21 d为1个周期,共4个周期
而后曲妥珠单抗6 mg/kg,帕妥珠单抗420 mg,
每3周1次,完成1年
每3个月监测心功能
TCbHP方案
多西他赛75 mg/m2iv第1天
卡铂AUC=6 iv第1天
曲妥珠单抗6 mg/kg(首次剂量8 mg/kg)第1天
帕妥珠单抗420 mg(首次剂量840 mg)iv第1天
21 d为1个周期,共6个周期
而后曲妥珠单抗6 mg/kg,帕妥珠单抗420 mg,
每3周1次,完成1年
每3个月监测心功能
wTH方案(用于辅助治疗)
紫杉醇80 mg/m2iv 1 h第1天
曲妥珠单抗2 mg/kg(首次剂量4 mg/kg)iv第1天
7d 1次,共12次
而后曲妥珠单抗6 mg/kg,每3周1次,完成1年
每3个月监测心功能
TC+H方案(用于辅助治疗)
多西他赛75 mg/m2iv第1天
环磷酰胺600 mg/m2iv第1天
曲妥珠单抗6 mg/kg(首次剂量8 mg/kg)第1天
21 d为1个周期,共4个周期
而后曲妥珠单抗6 mg/kg,每3周1次,完成1年
每3个月监测心功能
辅助强化治疗方案(用于高风险HER阳性乳腺癌特别是ER+患者)
在含曲妥珠单抗治疗完成后,奈拉替尼240 mg po qd,共1年
* 以上辅助治疗中,白蛋白结合型紫杉醇在出于医学上的必要性时(如减少过敏反应等)可尝试替代紫杉醇或多西他赛,但使用时周疗剂量不应超过125 mg/m²。
附录Ⅶ 复发或转移性乳腺癌常用的化疗和靶向治疗方案
1 HER2阴性乳腺癌常用的化疗和靶向治疗方案
⑴ 单药治疗
蒽环类药物
多柔比星60~75 mg/m2iv第1天
21 d为1个周期
或多柔比星20 mg/m2iv每周1次
表柔比星60~90 mg/m2iv第1天
21 d为1个周期
脂质体多柔比星50 mg/m2iv第1天
28 d为1个周期
紫杉类药物
紫杉醇175 mg/m2iv第1天
21 d为1个周期
或紫杉醇80 mg/m2iv每周1次
多西他赛60~100 mg/m2iv第1天
21 d为1个周期
白蛋白结合型紫杉醇100~150 mg/m2iv
第1、8、15天
28 d为1个周期
或白蛋白结合型紫杉醇260 mg/m2iv第1天
21 d为1个周期
抗代谢类药物
卡培他滨1 000~1 250 mg/m2po bid第1~14天
21 d为1个周期
吉西他滨800~1 200 mg/m2iv第1、8、15天
28 d为1个周期
其他微管类抑制剂
长春瑞滨25 mg/m2iv每周1次或50 mg po
第1、8、15天
艾立布林1.4 mg/m2iv第1、8天
21 d为1个周期
优替德隆30 mg/m2iv第1~5天21 d为1个周期
铂类药物(可用于三阴性乳腺癌或已知BRCA1/2突变乳腺癌)
顺铂75 mg/m2iv第1天或25 mg/m2iv第1~3天
21 d为1个周期
卡铂AUC=5~6 iv第1天
21~28 d为1个周期
PARP抑制剂(可用于已知BRCA1/2突变乳腺癌,国内尚未获批适应证)
奥拉帕利300 mg po bid
抗TROP2 ADC(可用于三阴性乳腺癌,国内尚未获批上市)
戈沙妥珠单抗(sacituzumab govitecan-hziy)
10 mg/kg iv第1、8天
21 d为1个周期
⑵ 联合治疗
XT方案
多西他赛75 mg/m2iv第1天
或白蛋白结合型紫杉醇100~150 mg/m2iv第1天
每周1次
卡培他滨1 000 mg/m2po bid第1~14天
21 d为1个周期
GT方案
紫杉醇175 mg/m2iv第1天
吉西他滨1 000~1 250 mg/m2iv第1、8天
21 d为1个周期
NX方案
长春瑞滨25 mg/m2iv第1、8天或 40 mg po
第1、8、15天
卡培他滨1 000 mg/m2po bid第1~14天
21 d为1个周期
GP方案(可用于三阴性乳腺癌)
吉西他滨1 000~1 250mg/m2iv第1、8天
顺铂75 mg/m2iv第1天或25 mg/m2iv第1~3天
21 d为1个周期
GC方案(可用于三阴性乳腺癌)
吉西他滨1 000 mg/m2iv第1、8天
卡铂AUC=2 iv第1、8天
21 d为1个周期
AP方案(可用于三阴性乳腺癌)
白蛋白结合型紫杉醇125 mg/m2iv第1、8天
顺铂75 mg/m2iv第1天或 25 mg/m2iv第1~3天
21 d为1个周期
NP方案(可用于三阴性乳腺癌)
长春瑞滨25 mg/m2iv第1、8天
顺铂75 mg/m2iv第1天或 25 mg/m2iv第1~3天
或卡铂AUC=2 iv第1、8天
21 d为1个周期
PC方案
紫杉醇175 mg/m2iv 第1天
或白蛋白结合型紫杉醇125 mg/m2iv第1、8天
卡铂AUC=5~6第1天,或AUC=2 iv第1、8天
21 d为1个周期
紫杉醇+贝伐珠单抗(贝伐珠单抗国内尚未获批适应证)
紫杉醇90 mg/m2iv第1、8、15天
贝伐珠单抗10 mg/kg第1、15天
28 d为1个周期
含PD-1/PD-L1抗体免疫治疗方案(可用于三阴性乳腺癌,国内尚未获批适应证)
①阿替利珠单抗+白蛋白结合型紫杉醇
(当PD-L1 SP142阳性,即IC≥1%时)
阿替利珠单抗840 mg iv第1、15天
白蛋白结合型紫杉醇100 mg/m2iv第1、8、15天
28 d为1个周期
② 帕博利珠单抗+化疗(当PD-L122C3CPS≥10时)
帕博利珠单抗200 mg iv第1天,21 d为1个周期
白蛋白结合型紫杉醇100 mg/m2iv
第1、8、15天,28 d为1个周期
或紫杉醇90 mg/m2iv第1、8、15天,28 d为1个周期
或吉西他滨1 000 mg/m2iv第1天 +卡铂AUC=2 iv
第1、8天,21 d为1个周期
2 HER2阳性乳腺癌常用的化疗和靶向治疗方案
THP方案
多西他赛75 mg/m2iv第1天
或白蛋白结合型紫杉醇100~150 mg/m2iv第1天 每周1次
或紫杉醇80 mg/m2iv第1天每周1次
曲妥珠单抗首次剂量8 mg/kg,之后为6 mg/kg iv
第1天
帕妥珠单抗首次剂量840 mg,之后为420 mg iv第1天
21 d为1个周期
TXH方案
多西他赛75 mg/m2iv第1天
卡培他滨1 000 mg/m2po bid第1~14天
曲妥珠单抗首次剂量8 mg/kg,之后为6 mg/kg iv
第1天
21 d为1个周期
TH方案
白蛋白结合型紫杉醇100~150 mg/m2iv第1天
曲妥珠单抗首次剂量4 mg/kg,之后为2 mg/kg iv
第1天
7 d为1个周期
或
多西他赛75 mg/m2iv第1天
曲妥珠单抗首次剂量8 mg/kg,之后为6 mg/kg iv
第1天
21 d为1个周期
NH方案
长春瑞滨30 mg/m2iv第1、8天
曲妥珠单抗首次剂量4 mg/kg,之后为2 mg/kg iv
第1天
21d为1个周期
或
长春瑞滨25 mg/m2iv第1、8、15天
曲妥珠单抗或伊尼妥单抗首次剂量4 mg/kg,之
后为2 mg/kg iv第1天
28 d为1个周期
XH方案
卡培他滨1 000~1 250 mg/m2po bid第1~14天
曲妥珠单抗首次剂量8 mg/kg,之后为6 mg/kg iv
第1天
21 d为1个周期
PCbH
紫杉醇175 mg/m2iv第1天
或白蛋白结合型紫杉醇125 mg/m2iv第1、8天
卡铂AUC=5~6 第1天,或AUC=2 iv第1、8天
曲妥珠单抗首次剂量8 mg/kg,之后为6 mg/kg iv
第1天
21 d为1个周期
吡咯替尼+卡培他滨方案
吡咯替尼400 mg po qd
卡培他滨1 000 mg/m2po bid第1~14天
21 d为1个周期
奈拉替尼+卡培他滨方案
奈拉替尼240 mg po qd第1~21天
卡培他滨750 mg/m2po bid第1~14天
21 d为1个周期
拉帕替尼+卡培他滨
拉帕替尼1 250 mg po qd
卡培他滨1 000 mg/m2po bid 第1~14天
21 d为1个周期
拉帕替尼+曲妥珠单抗
拉帕替尼1 000 mg po qd
曲妥珠单抗首次剂量8 mg/kg,之后为6 mg/kg iv
第1天
21 d为1个周期
T-DM1单药
3.6mg/kg iv第1天
21 d为1个周期
DS8201(国内尚未获批上市)
5.4 mg/kg iv第1天
21 d为1个周期
附录Ⅷ 绝经的定义
绝经一般是指月经永久性终止,提示卵巢合成的雌激素持续性减少。满足以下任意一条者,都可认为达到绝经状态:
⑴ 双侧卵巢切除术后。
⑵ 年龄≥60岁。
⑶ 年龄<60岁,自然停经≥12个月,在近1年未接受化疗、他莫昔芬、托瑞米芬或卵巢去势的情况下,FSH和雌二醇水平在绝经后范围内。
⑷ 年龄<60岁正在服用他莫昔芬或托瑞米芬的患者,FSH和雌二醇水平在绝经后范围内。
注:正在接受LHRH拮抗剂/激动剂的患者月经状况无法判断。化疗前未绝经者即使化疗后停经也不能判断其为绝经后状态,化疗或内分泌或药物去势治疗后停经的患者需反复测定FSH和雌二醇水平,确认其为绝经后状态时方能使用芳香化酶抑制剂。
附录Ⅸ VNPI
VNPI


