台州地区老年女性人乳头状瘤病毒感染的流行病学特征分析
徐馨宇 韦晓宁 孙 博,3 王少为,※
宫颈癌在全球女性癌症的发病率和死亡率中均排名第四,患病人数占所有女性癌症病例的6.6%,致死人数为女性癌症死亡总人数的7.5%[1]。尽管健康卫生条件有了很大改善,但我国宫颈癌的发病率和死亡率仍呈逐年上升趋势[2]。据估计,我国每年有98,900例新发宫颈癌病例,约占全球新发病例总数的20%,且每年发生近30,500例宫颈癌死亡病例[3]。持续性人乳头瘤病毒(human papillomavirus,HPV)感染,尤其是高危型HPV感染,是癌前病变和宫颈癌的主要原因[4]。值得注意的是,HPV的感染率及亚型分布在不同的地区和年龄组均呈现出不同的特点,因此,有必要了解我国各地区和各年龄组HPV的感染率及亚型分布特征,以更有效地开展宫颈癌前病变和宫颈癌筛查以及HPV疫苗接种工作。本研究对37967例台州地区女性的HPV分型结果进行分析,以了解当地HPV感染流行病学特征,为老年女性宫颈癌的筛查和防治提供理论指导。
1.资料与方法
1.1 研究对象 在2012年12月至2016年2月期间,共有42707名15~90岁的女性在台州ENZE医疗中心(台州医院、台州妇产医院、台州中心医院、路桥医院和卫生管理部门中心)接受了HPV检测。本研究一共纳入了37967例女性,平均年龄(41.61±10.02)岁,年龄范围15~90岁,其中有27899例来自门诊,有10068例来自体检。选取60岁及以上女性1566例作为老年组,平均年龄(65.05±5.23)岁,年龄范围60~90岁;以同期36401例60岁以下女性作为对照组,平均年龄(40.61±8.89)岁,年龄范围15~59岁。纳入标准如下:①初次接受宫颈筛查(第一轮筛查);②居住在台州地区;③目前未怀孕且没有子宫全切或宫颈切除史的妇女。排除标准如下:①进行第二轮或以上筛查(n=4178);②不在台州地区居住(n=129);③正在接受宫颈物理治疗或有癌症病史(n=411)。所有受试者均自愿进行HPV筛查,两组的一般资料比较差异无统计学意义,具有可比性。
1.2 研究方法
1.2.1 标本采集:根据公认的操作规程,妇科医生用细胞刷收集宫颈细胞标本,然后将其放置在标本运输介质中,并保存在4℃下。随后,所有标本均在24小时内被运送到台州医院医学研究中心进行HPV分型检测。
1.2.2 检测方法:采用GP5+/bioGP6+-PCR/MPG分析法对收集的标本进行HPV分型检测,该方法已获得中国FDA批准[认证号(2014):3400847]。该测定方法包括使用生物素化扩增子的GP5+/bioGP6+-PCR和基于Luminex悬浮阵列技术的多重人乳头瘤病毒基因分型(multiplex human papillomavirus genotyping,MPG)法。该方法可同时对27种HPV亚型进行分型检测,包括14种高危型(HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58、HPV59、HPV66和HPV68)和14种低危型(HPV6、HPV11、HPV26、HPV40、HPV42、HPV43、HPV44、HPV53、HPV55、HPV61、HPV73、HPV81、HPV82、HPV83)。
1.3 统计学方法 将受试者分为14个年龄组(15~19岁、20~24岁、25~29岁、30~34岁、35~39岁、40~44岁、45~49岁、50~54岁、55~59岁、60~64岁、65~69岁、70~74岁、75~79岁、80岁及以上)。采用SPSS 25.0软件进行统计学分析,计量资料用(均数±标准差)表示,采用t检验;计数资料用百分率表示,采用χ2检验,P<0.05为差异有统计学意义。
2.结果
2.1 两组HPV感染率及各型感染情况 对照组HPV阳性8268例,HPV总阳性率为22.71%(8268/36401),其中高危阳性率为17.05%(6205/36401),低危阳性率为8.19%(2982/36401)。老年组HPV阳性401例,HPV总阳性率为25.61%(8268/1566),其中高危阳性率为20.18%(316/1566),低危阳性率为9.90%(155/1566)。对照组HPV阳性结果中28种亚型均有分布,而老年组仅覆盖了其中的27种亚型,不包含HPV73。对照组中HPV感染率前3位依次为HPV52、HPV16和HPV58,其检出率分别为4.47%、2.70%和2.56%。老年组中,HPV感染率前3位也均为高危型,其中最常见的是HPV52(5.04%),其次是HPV58(4.21%)和HPV16(3.00%)。HPV18的感染率在两组中都较低(2.04%和1.48%)。HPV31、HPV35和HPV45为两组中最不常见的高危型HPV型别。对于低危型HPV感染率,对照组中最常见的三种亚型为HPV53(2.49%)、HPV61(2.17%)和HPV43(1.34%),老年组中为HPV53(1.75%)、HPV61(1.59%)和HPV81(0.93%)。HPV6和HPV11的感染率在两组中均排名靠后。HPV55、HPV83、HPV26和HPV73是两组中感染率最低的低危型HPV型别。见表1。
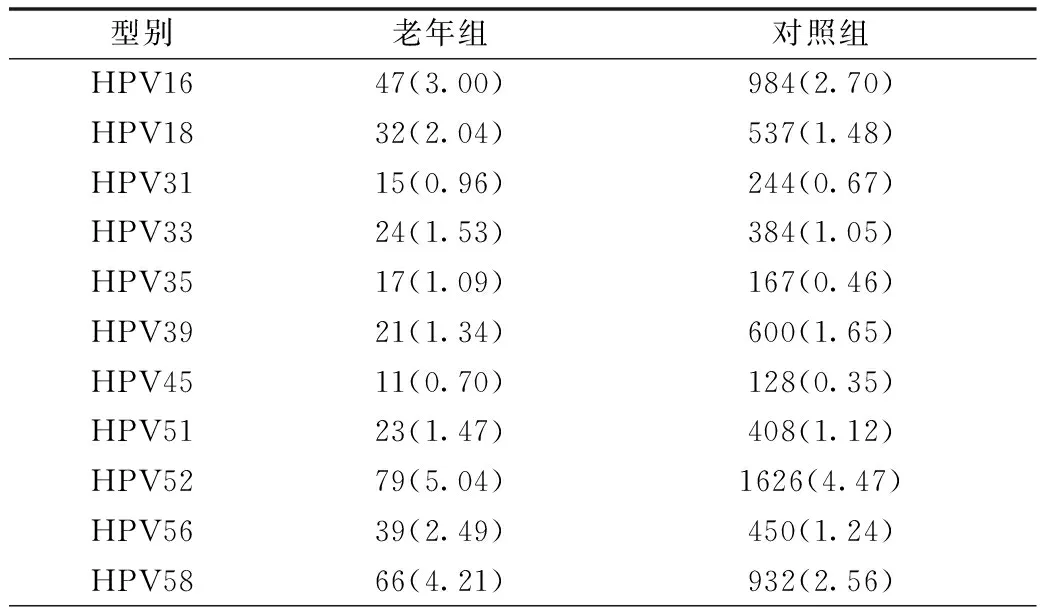
表1 两组各型HPV感染情况 单位:例(%)
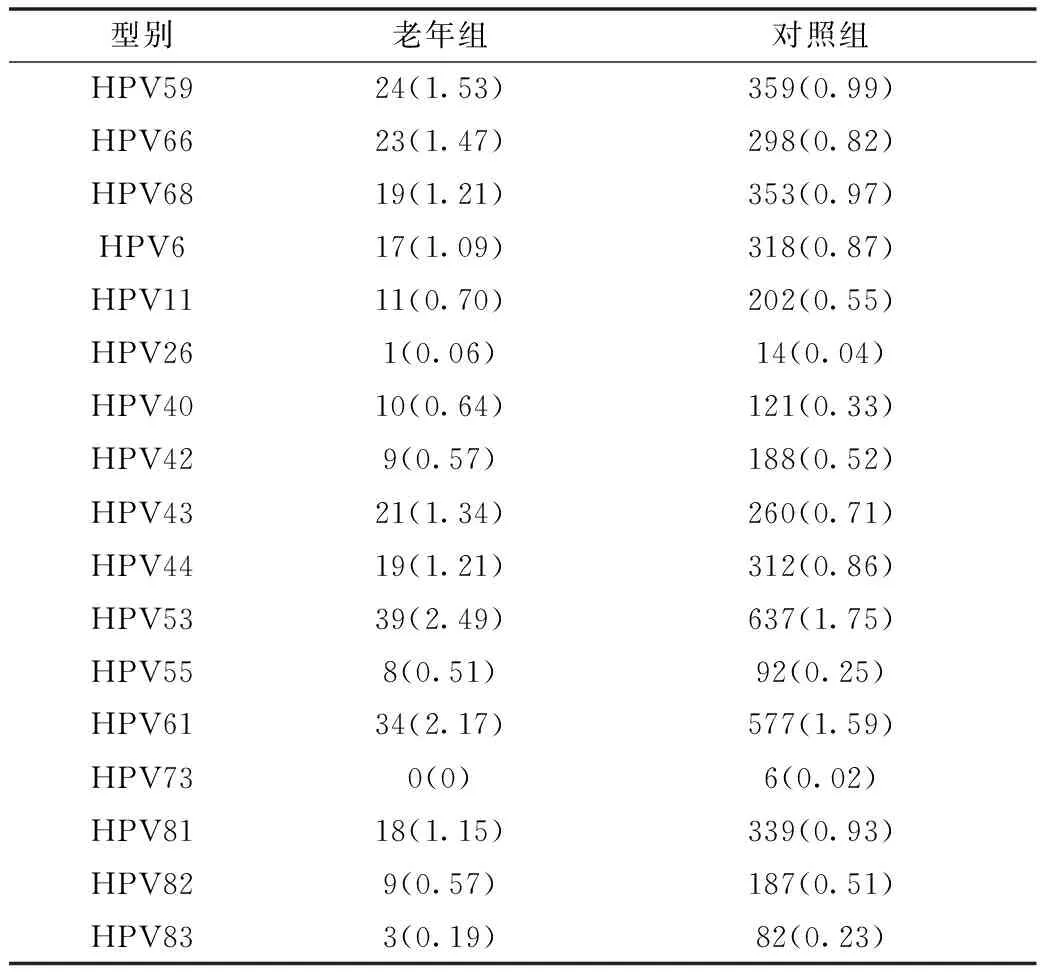
续表1
2.2 两组HPV高低危型感染组成情况 老年组HPV阳性结果中44.39%为单个HPV高危型感染,17.21%为单个HPV低危型感染,38.40%为HPV混合型感染,其中15.96%为高危混合型,3.99%为低危混合型,18.45%为高低混合型,混合型感染最多的包含7种HPV亚型。对照组HPV阳性结果中52.76%为单个HPV高危型感染,22.58%为单个HPV低危型感染,24.66%为HPV混合型感染,其中10.12%为高危混合型,2.36%为低危混合型,12.18%为高低混合型,混合型感染最多的包含9种HPV亚型。老年女性单个HPV高危型感染率和单个低危型感染率均低于年轻女性,而老年女性HPV高危混合型感染率、低危混合型感染率及高低危混合型感染率均高于年轻女性(P<0.05)。见表2。
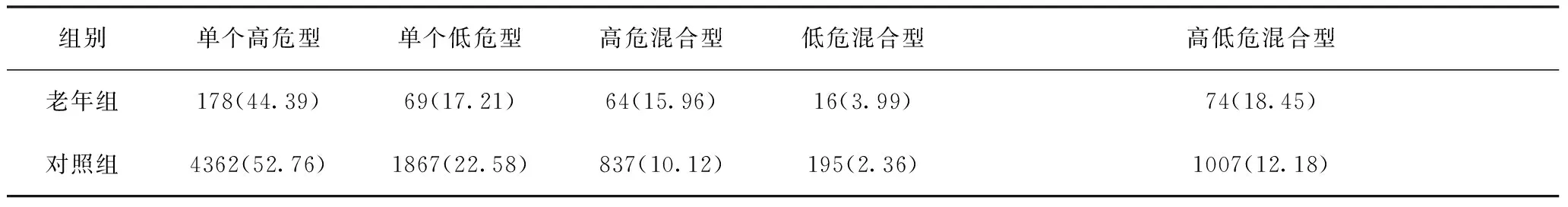
表2 两组HPV高低危型感染情况 单位:例(%)
以HPV16为主的混合型感染在对照组中占比为0.97%,在老年组中占比为1.21%。以HPV52为主的混合型感染在对照组中占比为1.60%,在老年组中占比为2.60%。以HPV58为主的混合型感染在对照组中占比为0.98%,在老年组中占比为2.36%。见表3。
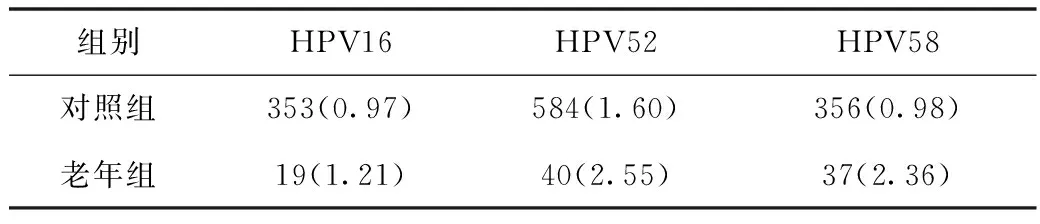
表3 三种最常见高危型HPV感染情况 单位:例(%)
2.3 老年组HPV型别感染情况 HPV的总感染率在各个年龄段的分布呈双峰曲线,在15~19岁年龄组感染率达到最高(47.10%),而后逐渐下降,感染率维持在20%左右,自40~44岁年龄组逐渐上升,于55~59岁年龄组达到最高(28.96%),其中在75~79岁年龄组出现明显下降(20.69%),于80岁及以上年龄组降至最低(5.00%)。此外,在高危型HPV感染率中,也发现了类似的年龄特异性流行病学特征,其中第一次高峰出现在20岁以下的年轻女性中(36.23%),第二次高峰出现在55~59岁年龄组(23.15%)。见图1。
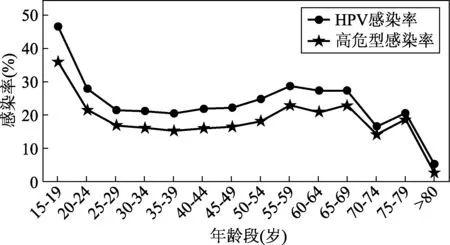
图1 该地区各年龄段女性HPV和高危型HPV感染率
60~64岁HPV检出覆盖27种型别,65~69岁检出26种,70~74岁检出18种,75~79岁检出11种,80岁及以上检出2种。各年龄段HPV阳性率分别为27.53%、27.54%、16.56%、20.69%和5.00%。高危型HPV阳性率分别为20.81%、23.08%、14.01%、18.97%和2.50%。除80岁及以上年龄段,60~64岁及65~69岁HPV感染率最高均为HPV52型,70~74岁及75~79岁HPV感染率最高均为HPV16型。各型HPV感染率最高的主要集中在60~64岁及65~69岁。HPV18阳性率高峰出现在60~64岁,为2.42%。HPV16的阳性率高峰出现在75~79岁,为5.17%。其次,以HPV16为主的高危混合型阳性率高峰也出现在该年龄段,为8.33%。见表4。
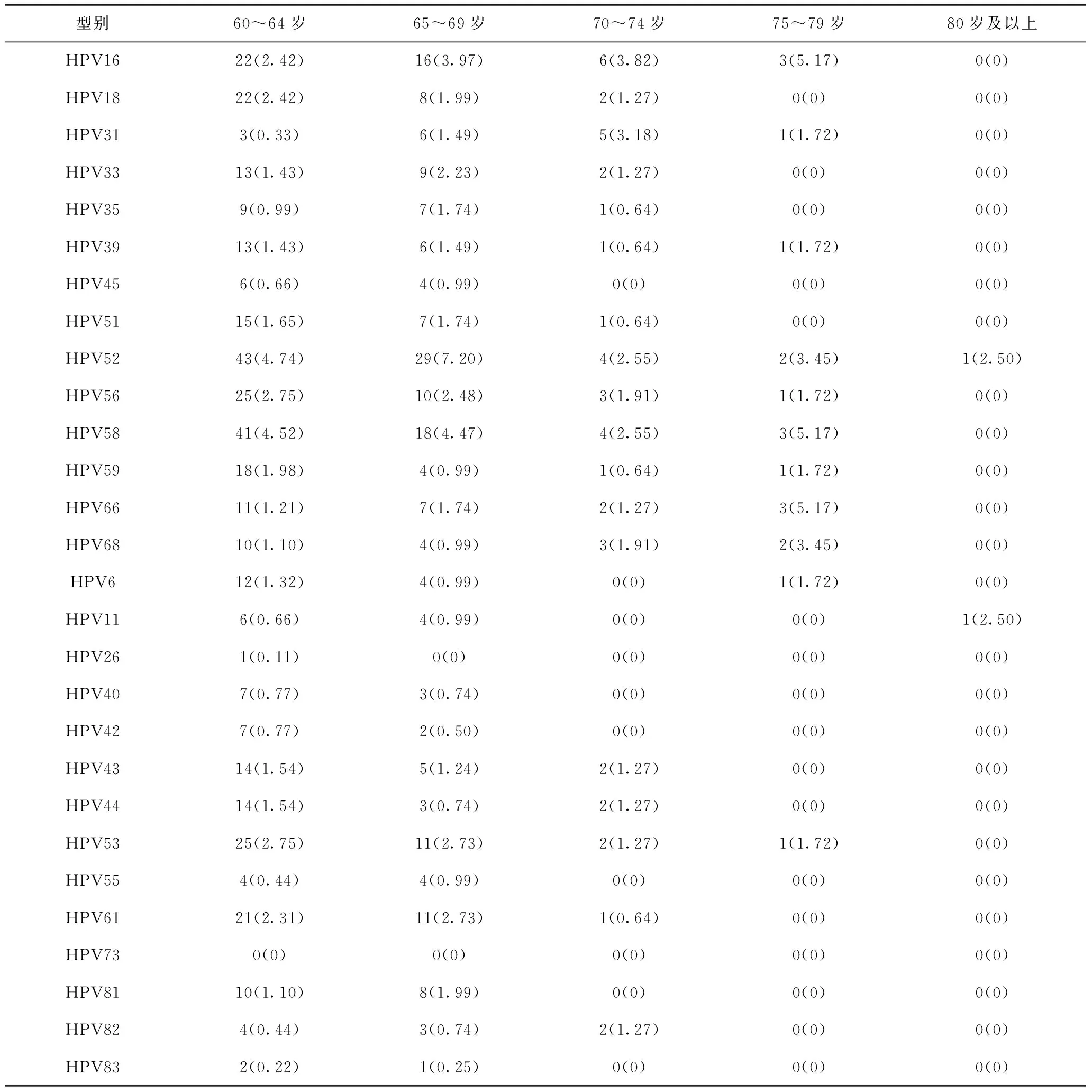
表4 老年组HPV各型别感染情况 单位:例(%)
3.讨论
3.1 两组HPV感染率及各型感染情况 本研究中,HPV在对照组和老年组中的患病率和亚型分布特征各不相同。老年女性的HPV总感染率、高危型HPV感染率和低危型HPV感染率均略高于年轻女性。两组均以HPV16、HPV52及HPV58这三种高危型HPV感染最为常见,与中国其他地区人群的调查结果一致[5]。HPV16的感染率因国家、地区以及年龄而异,但始终排名靠前。HPV16在58.70%的浸润性宫颈癌中被发现,是与致癌作用密切相关的重要亚型。与HPV16相比,HPV52和HPV58与浸润性宫颈癌的相关性要低得多[6]。最近的一项研究表明,HPV53是包括宫颈癌在内的宫颈相关疾病中最常见的基因型之一[7]。本研究中,HPV53感染率在老年组和对照组均排名第四(2.49%和1.75%)。这些发现提示,HPV53可能是导致中国女性患宫颈癌的另一主要危险因素。然而,目前市面上的HPV疫苗并未包含HPV53,因此有必要研发针对中国女性的下一代HPV疫苗。
3.2 两组HPV高低危型感染组成情况 目前,混合型感染是否会增加患宫颈癌的风险仍存在不同的看法。一项研究表明,混合型感染是一种普遍现象,并不会增加患宫颈癌的风险。Salazar等人[8]提出,与感染单个HPV亚型相比,感染多个HPV亚型的女性患宫颈癌的风险更低,这表明混合型感染可能因为竞争而诱发了更有效的交叉保护作用,混合型感染会增加感染HPV的持续时间以及患宫颈癌和宫颈癌前病变的风险。此次研究老年组HPV阳性受试者中有38.40%为混合型感染,远高于对照组(24.66%),其中15.96%为高危混合型,3.99%为低危混合型,18.45%为高低混合型,提示超过1/3的老年女性患者患宫颈癌的风险显著增加。另一项研究指出,HPV16与其他HPV亚型混合感染会增加患宫颈癌的风险[9]。本研究中,HPV52是老年组混合型感染者中最常见的HPV亚型,其次是HPV58和HPV16,其中1.21%的患者是以HPV16为主的混合型感染。因此,探索混合型感染的潜在竞争和协同致癌作用,对于制定基于HPV型别的宫颈癌筛查计划和基于疫苗的HPV预防策略来说具有重大意义。
3.3 老年组HPV型别感染情况 本研究和现有研究中的年龄特异性流行病学特征反映了HPV感染的自然病程[5,10]。由于频繁的性生活以及不敏感的免疫系统,20岁以下的年轻女性极易感染HPV[11]。其次,60岁以上的老年女性也易感染HPV,与卵巢功能、雌激素水平以及免疫功能的下降密切相关。同时,老年女性暴露于危险因素的时间更长,导致其发生持续性感染的机会大大增加。由此可见,年龄是HPV感染的重要因素,老年女性是当地宫颈癌防治的重点人群。提高老年女性的自我保健意识,加强宫颈癌筛查工作的开展,对于宫颈癌前病变和宫颈癌的防治具有重要意义。
本研究发现,HPV16、HPV52和HPV58均是各年龄组的主要感染亚型。然而,三种高危型HPV亚型的感染率排名在组内各不相同,这可能与激素波动相关的生理和免疫紊乱有关。在老年组中,HPV52阳性率的高峰出现在60~64岁,而HPV16和HPV58阳性率的高峰出现在75~79岁。其次,80岁以下各年龄组老年女性HPV感染率以及高危型感染率均明显高于80岁及以上年龄组的老年女性。因此,在老年女性中进行宫颈癌筛查是有必要的,终止筛查年龄可考虑适当延长至80岁。
本研究分析了台州地区37967例女性HPV感染的流行率和亚型分布特征。老年女性的HPV总感染率、高危型HPV感染率和低危型HPV感染率均高于年轻女性。老年女性由于更易发生混合型感染和持续性感染,这大大增加了其异常细胞增殖和宫颈癌变的风险。随着我国人口老龄化问题日趋严重,结合以上台州地区HPV感染的流行病学特征,应重点关注当地老年女性宫颈癌前病变和宫颈癌变的筛查和防治情况,因此,可以考虑将终止筛查年龄适当延长至80岁。研究发现该地区老年组和对照组中最常见的4种HPV亚型均为HPV16、HPV52、HPV53和HPV58,与中国其他地区人群的调查结果不尽相同,因此有必要研发针对台州地区女性的HPV疫苗。
备注:本文数据来源于《Prevalence characteristics of cervical human papillomavirus(HPV)genotypes in the Taizhou area,China:a cross-sectional study of 37967 women from the general population》,下载于the Dryad data(the doi:10.5061/dryad.c7h3c.)

