非淀粉多糖对肠道菌群的调节作用及其对代谢疾病影响的研究概述
李珊,孙万成,罗毅皓
(青海大学农牧学院,青海 西宁 810016)
近年来,代谢综合征(metabolic syndrome,MetS)在全球范围内广泛流行,如何控制MetS已经变成了一个全球性的热点问题。代谢综合征是一种复杂的代谢紊乱的病理状态,主要由蛋白质、脂肪、碳水化合物和其它物质的不平衡引起,由于肥胖人群和胰岛素抵抗的增加,这种不平衡越来越普遍[1]。采用药物治疗代谢紊乱是很有必要的,但目前还没有被批准的药物可以长期、可靠地改善所有的代谢危险因素[2]。
人类肠道中的微生物数量是人体细胞的10倍,这些庞大的微生物组成了一个复杂生态群落,该生态群落健康状况可直接影响宿主生理的许多方面,包括食物摄入、维生素的产生和疾病的发病机制等[3]。大量研究表明,肠道微生物与宿主健康有关,有益微生物的活动可以增强肠道上皮保障功能、减少炎症反应、调节免疫反应。Samuel等[4]将带有拟杆菌的小鼠的肠道菌群移植到正常饲养的小鼠体内,在减少食物摄入量的情况下,14 d后发现,小鼠体脂含量和胰岛素抵抗都有所增加,进而引起了肥胖和其它代谢紊乱疾病的发生。而日常膳食直接影响肠道微生物生态健康,例如,David等[5]研究发现改变饮食可以在24 h内引起肠道微生物菌群的变化。
非淀粉多糖与抗性淀粉和木质素一起构成了膳食纤维,膳食纤维具有多种生物学活性,能够抵御一系列疾病,如癌症、2型糖尿病、高血脂、心血管疾病和肥胖症等。非淀粉多糖(non-starch polysaccharides,NSPs)作为膳食纤维中的组成部分,在纤维的功能性调控中扮演着重要的角色。非淀粉多糖联合机体内源性碳水化合物(宿主来源及微生物来源多糖),通过肠道微生物的代谢作用,在机体中参与多种代谢机制[6]。人类基因组中不能编码足够的碳水化合物消化酶(carbohydrateactive enzymes,CAZymes),导致 NSPs到达肠道无法被机体内源消化酶彻底降解,而是通过选择性地刺激肠道内的微生物有益菌的增殖或活性来发挥相应功能。例如,肠道微生物菌群将NSPs降解成短链脂肪酸(short chain fatty acids,SCFA),该消化过程为肠道微生物供能的同时,其产物SCFA又反过来调节微生物生态和机体肠道环境健康,从而实现代谢调控作用[7]。因此,良好的NSPs摄入可调节机体生理活动,缓解肥胖、MetS等。基于此,本文介绍了常见非淀粉多糖的种类和主要功能,从“NSPs与肠道微生物”角度阐述了NSPs与肠道健康的关系,论述了NSPs对代谢相关疾病之间的重要性,以期在全面认识NSPs的同时,关注膳食纤维,关注肠道健康,科学饮食,预防代谢疾病发生。
1 非淀粉多糖
膳食纤维中的NSPs是由若干个单糖通过糖苷键连接而成的多聚体。包括纤维素、半纤维素、果胶、树胶、β-葡聚糖、果聚糖以及半乳糖等低聚糖。主要存在于燕麦、蔬菜、水果、大麦和豆类等,与碳水化合物和脂质的代谢有关,且可以抵抗非反刍动物的内源消化酶的水解,无法被人体消化酶分解,可以完整地通过小肠被结肠和盲肠的共生微生物发酵[8]。此外,海洋多糖,如岩藻聚糖和藻酸盐也是NSPs的重要组成部分,对人类肠道健康具有多种影响[9]。
NSPs通常分为水溶性和不溶性两类,植物通常包含可溶性和不溶性非淀粉多糖[10]。不溶性非淀粉多糖主要由纤维素和半纤维素组成。纤维素是植物细胞壁的主要结构成分,由1 000个~15 000个D-吡喃葡萄糖组成,并通过β-1,4-糖苷键连接[11]。相比之下,另一种细胞壁多糖半纤维素是由较短的支链组成,含有异源单糖,如葡萄糖、木糖和甘露糖[12]。果胶是来源于植物细胞壁的杂糖,主要由α-1-4链连接的D-半乳糖醛酸组成,通常是水溶性的,并能形成凝胶[13]。植物来源的树胶有高度分支的结构和几个单糖残基以及糖醛酸。它们主要由瓜尔胶和阿拉伯胶组成。瓜尔胶,其主链由β-1,4甘露糖为结构单元连接而成,侧链则由单个的α-D-半乳糖组成,并以β-1,6和主链相接[14]。阿拉伯胶由1-3连接的β-D-半乳糖醛基组成,D-半乳糖、L-阿拉伯糖、L-鼠糖和D-葡萄糖醛酸作为侧链[15]。β-葡聚糖通常从燕麦、大麦、细菌、藻类和真菌中提取。大麦和燕麦的成分由β-1,3和β-1,4连接的β-葡聚糖组成,真菌的主链通常由β-1,3和β-1,6连接的β-葡聚糖组成,而细菌和藻类由葡萄糖单体的β-1,3糖苷键连接[16]。果聚糖主要由末端葡萄糖分子的果糖链组成,包括短链低聚果糖(fructooligosaccharide,FOS)和长链菊糖。低聚果糖存在于洋葱、菊苣、大蒜和芦笋等植物中。菊糖由D-果糖的线性链和β-2-1连接的D-葡萄糖组成[17]。半乳糖低聚糖(galactooligosaccharides,GOS)存在于牛奶和大豆等植物中,由若干个β-1,6和β-1,4半乳糖链组成[18]。非淀粉多糖的分类见图1[10]。
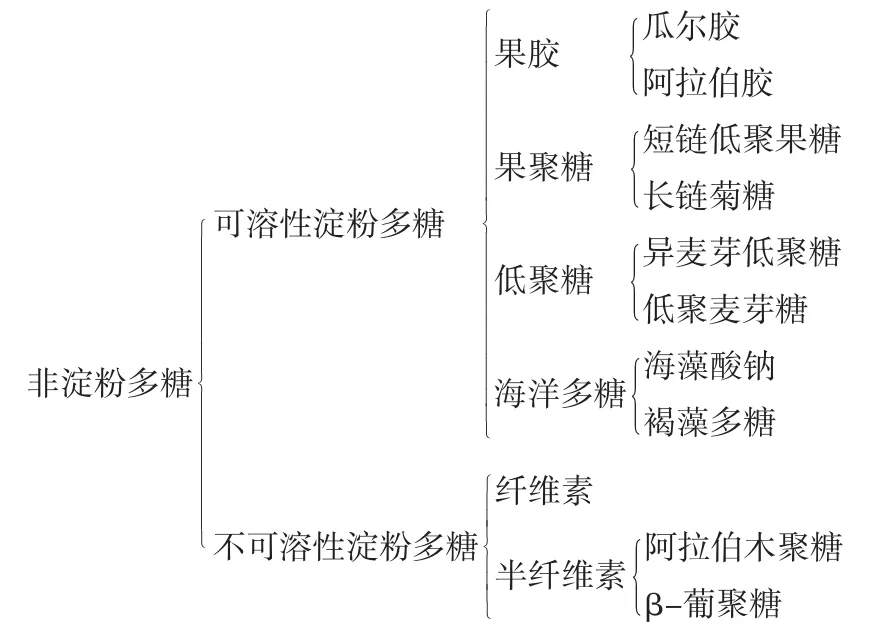
图1 非淀粉多糖的分类Fig.1 Categorization of non-starch polysaccharides
2 肠道菌群与代谢性疾病
2.1 肠道菌群与肥胖
肥胖症和糖尿病已经成为目前最受关注的代谢疾病。众所周知,肥胖是能量摄入多于消耗的结果,肠道菌群在影响能量稳态方面发挥着重要作用。肠道微生物通过影响从饮食中获取的卡路里效率,将这些获取的能量进行作用和储存,从而影响能量平衡[19]。Samuel等[20]将无菌小鼠多形拟杆菌(bacteroides thetaiotaomicron)与产甲烷菌(Methanobrevibacter smithii)共同定植,提高了从饮食中提取能量的效率,导致宿主肥胖显著增加。与无菌对照组相比,用完整粪便菌群或人类供体培养菌群定植的无菌小鼠表现出显著的脂肪型与体重比。然而,两种小鼠的肥胖程度没有显著差异。肠道微生物菌群可以将碳水化合物降解,发酵的产物SCFA是G蛋白偶联受体(G protein-coupledreceptor41,GPR41)的配体。Samuel等[4]发现 GPR41是一种在肠道上皮细胞中表达GPR41,推测肠道共生菌群可能通过GPR41信号通路调节宿主肥胖。此外,Turnbaugh等[21]发现从肥胖小鼠的盲肠获得的肥胖菌群在无菌小鼠体内定植,与从瘦人供体获得菌群的小鼠相比,其体脂含量更高。Ley等[22]分析了遗传肥胖ob/ob小鼠、瘦肉ob/+小鼠和野生型小鼠及其ob/+母鼠的肠道菌群中的细菌16S rRNA基因序列,均进食相同的多糖。结果表明,无论血缘关系如何,与瘦肉小鼠相比,ob/ob小鼠拟杆菌门(bacteroidetes)的丰度降低了50%,厚壁菌门(firmicutes)的丰度增加了50%。在肥胖和瘦人的粪便中也观察到了类似的结果。这些变化表明,有意调节肠道微生物菌群可能有助于调节肥胖个体的能量平衡。进一步的研究表明,肥胖者的肠道微生物菌群从特定饮食中提取和储存能量方面比瘦人更有效[21]。Payne等[23]将目光聚焦于肥胖儿童身上,利用宏基因组测序技术观察到肥胖儿童肠道巨单胞菌属(Megamonas)数量增加,普雷沃菌属(Prevotella)丰度较高。然而颤螺旋菌属(Oscil lospiraceae)的数量减少,提示肥胖儿童肠道菌群异常,其与血清胆固醇水平呈负相关。此外,还检测到肥胖儿童粪便中人疱疹病毒4型(human herpesvirus-4)的数量是正常儿童的19倍,进一步证实肥胖儿童肠道菌群的代谢活性高于瘦人。
2.2 肠道菌群与糖尿病
肠道微生物菌群失调、肠黏膜屏障渗漏和肠道免疫反应的改变及相互作用是导致1型糖尿病(type 1 diabetes mellitus,T1DM)等疾病的重要因素。据报道,2型糖尿病(type 2 diabetes mellitus,T2DM)患者体内产生短链脂肪酸(SCFA)的细菌数量减少[24]。膳食纤维不能被消化液消化,只能通过转基因发酵产生短链脂肪酸,SCFA能够促进胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的分泌。GLP-1通过阻碍肝脏中的糖异生作用来阻止胰高血糖素的分泌,从而提高胰岛素敏感性[25]。Brugman等[26]采用荧光原位杂交技术,用抗生素治疗处理1-型糖尿病大鼠模型(bio-breeding diabetes-prone,BB-DP),分析其对糖尿病发病率和脑炎水平的影响,分析最终患糖尿病的老鼠和未患糖尿病的老鼠之间细菌组成的差异。结果表明,未患糖尿病的大鼠的拟杆菌数量较低,通过抗生素对肠道菌群的调节降低了糖尿病的发病率,延缓了糖尿病的发作。宏基因组研究表明,肠道菌群的三磷酸腺苷合酶(adenosine triphosphate synthase,ATP synthase)和宿主的体质指数(body mass index,BMI)支持肥胖菌群具有更高的能量收集能力[21]。生化分析表明,去除发酵产生的氢气调节了日粮能量提取效率。与利用多糖的细菌相比,以氨基酸为靶点的细菌通过促进乙酸盐的生产和保持较高的烟酰胺腺嘌呤二核苷酸[NAD(+)/NADH]比率来提高发酵效率[27]。与健康成人相比,肥胖和糖尿病患者肠道微生物菌群的整体多样性较低。几种主要菌群的比例在糖尿病患者和对照组之间有显著差异。如拟杆菌门、拟杆菌科、卟啉单胞菌科和拟杆菌属在糖尿病患者中的丰度较低,而毛螺菌科和罗斯氏属的比例高于对照组[28]。
2.3 肠道菌群与其它代谢疾病
除肥胖与糖尿病以外,与健康受试者相比,在高血压、心血管疾病和非酒精脂肪肝等其它疾病中也观察到肠道微生物组成的异常变化。例如,Han等[29]发现肠道微生物菌群引起的肠道内毒素血症会加重肝损伤。Wu等[30]使用条形码454焦磷酸测序技术,慢性乙型肝炎病毒(chronic hepatitis B virus infection,CHB)感染患者的肠道微生物组成与微生物多样性降低有关。具体来说,CHB患者与健康个体相比,拟杆菌门的丰度显著增加,而厚壁菌门则减少。在属水平上,CHB患者普氏菌丰度显著增加,屏障保护菌双歧杆菌和罗斯氏菌减少。肠易激综合征(irritable bowel syndrome,IBS)是一种功能性胃肠疾病,与异常的肠道微生物菌群有关,在健康和IBS受试者之间存在明显差异。大多数IBS患者的特征是厚壁菌相关类群增加,拟杆菌相关类群减少[31]。Henao-Mejia等[32]发现,核苷酸结合寡聚结构域蛋白(nucleotide binding oligomerization domain,NOD)样受体家族3NLRP3和NLRP6炎症相关的肠道微生物菌群改变,加剧了非酒精性脂肪肝小鼠模型的脂肪变性和炎症。最近,也有研究发现在实验性自身免疫性脑脊髓炎动物模型中,肠道微生物菌群与多发性硬化症的加重有关。
3 非淀粉多糖与肠道菌群相互作用及代谢性疾病
3.1 非淀粉多糖对肠道菌群的调节作用
NSPs是肠道微生物的重要能量来源,许多研究已经证实了NSPs对肠道健康的影响。共生微生物可以代谢多种复杂的碳水化合物,并通过产生多种代谢物如SCFA来改变肠道环境,影响肠道环境和宿主的健康。因此,摄入充足的膳食纤维对维持肠道细菌种类的多样性和调节微生物菌群环境至关重要。
NSPs可以促进宿主健康的细菌的生长,益生元的概念也由此而来。益生元的常见来源包括β-葡聚糖、果胶、菊糖和一些不可消化的低聚糖,如低聚果糖(fructooligosaccharide,FOS)和半乳糖寡糖(galactooligosaccharides,GOS)。研究表明,摄入 GOS 和 FOS 可增加双歧杆菌、乳杆菌和拟杆菌种群的丰度,从而增加SCFA的产生和刺激钙吸收,改善宿主的健康,缓解炎症性肠病(inflammatory bowel disease,IBD)[33]。膳食纤维素作为一种不可溶的NSPs物质,通过添加膳食纤维素不仅可以改变结肠黏膜微生物菌群的组成,而且提高微生物的多样性[34]。Leitch等[35]的体外培养试验表明,以富含阿拉伯木聚糖的麦麸乙醇提取物作为底物,可以增加属于梭菌属XIVa细菌的相对丰度。此外,Chen等[36]研究发现,葡甘露聚糖(konjacmannan)可以选择性地促进有益肠道菌群(如双歧杆菌和乳酸菌)的生长。杨立杰等[37]在日粮中添加10%小麦麸,可显著提高断奶仔猪回肠乳酸杆菌和结肠中双歧杆菌的数量。此外,在一项评估膳食菊糖型果聚糖(linearinulin-typefructan,ITF)益生元活性的临床研究中,发现ITF能抑制阴沟拟杆菌、肠拟杆菌和丙酸杆菌的增殖,并显著富集双歧杆菌和粪肠球菌。此外,ITF还能对肠道屏障发挥保护作用,并显著降低血清脂多糖(lipopolysaccharide,LPS)水平。Conlon等[38]认为益生元发挥作用机制是NSPs通过微生物发酵降低菌落内的酸碱度,从而抑制一些可能具有致病性的生物的生长。在此基础上,Falony等[39]讨论益生元发挥作用可能并不限于对微生物菌群,而是通过交叉影响的方式进行干预。这就意味着能够利用多糖的生物可以维持微生物菌群落的其它成员。
3.2 非淀粉多糖对代谢疾病的影响
膳食多酚(包括NSPs)可根据它们的存在和吸收水分的能力,为肠道提供水分,通过增加消化量来促进肠道健康。膳食多酚通过降低结肠压力、稀释毒素和增加排便频率来促进肠道健康。目前研究发现,膳食纤维除了具有通便和促进粪便膨胀的作用,还可以消除黏附在肠道内的毒素和致癌物,被认为是免疫系统的有效调节剂。因此,NSPs在促进益生菌生长的同时,影响代谢产物并发挥益生作用。
NAGY-SZAKAL等[34]通过研究短暂膳食纤维素补充剂对儿童时期小鼠结肠炎易感性的影响,发现纤维素的补充刺激结肠黏膜微生物组发生了实质性变化。一些细菌类群的相对丰度降低(如红蝽菌科Coriobacteriaceae),而其它类群的相对丰度增加(如消化链球菌科 Peptostreptococcaceae和梭菌科 Clostridiaceae)。结果表明,通过改善肠道炎症,纤维素补充剂具有短暂的抗大肠杆菌作用。Sarma等[40]研究发现,补充阿拉伯木聚糖可以改善回肠和结肠健康,以及缓解代谢内毒素血症。此外,Azuma等[41]发现在小鼠肠炎模型(inflammatory bowel disease,IBD)中,来自海藻的纤维素纳米纤维通过下调NF-κB表现出对结肠炎症反应具有抑制作用。同时发现另一种半纤维素-葡萄糖甘露聚糖也对IBD模型有促进肠道健康的作用,如改善肠道运动、腹泻、腹痛和气胀。果胶也可以改善炎症,降低肠道疾病的发病。Yue等[42]研究发现,果胶可以显著减轻结肠炎的症状,通过下调TNF-α、IL-1β和IL-6等促炎细胞因子在大鼠中的表达,减轻结肠炎的严重程度和黏膜损伤程度。在评估果胶对腹泻型肠易激综合征患者的疗效时,从柑橘中获得的果胶酸钙的给药可以显著减少小鼠肠道溃疡,有效缓解症状,且无副作用[43]。关于低聚糖对于肠道健康的研究,Capitán-Cañadas等[44]发现补充FOS可以通过减少炎症细胞因子的分泌和上调紧密连接蛋白的水平来改善结肠炎。长链菊粉除了降低COX-2和NF-κB细胞,还可下调IL-1β、IL-10和巨噬细胞炎症因子的表达,从而抑制结肠癌[45]。
4 结论
近年来,随着试验方法的发展,如宏基因组工具、无菌小鼠和转基因动物模型等,研究者对NSPs与肠道健康的重要性的认识在过去几十年里急剧扩大。本文综述了NSPs对肠道健康的影响以及通过调节具有益生元效应的肠道微生物对肠道健康的影响。考虑到近年来多糖在处理肠道功能紊乱方面的巨大潜力,阐明NSPs在物理化学和生理特性的复杂作用中影响肠道健康的机制是很重要的。然而,目前有些NSPs对肠道菌群的作用和机制尚不清楚,为了人类肠道健康,对NSPs与代谢疾病之间的深入研究将是必要的。

