黄药叶总黄酮提取工艺优化及其抗氧化活性研究
桂利利,吴正坤,余惠凡,李飞
(1.湖北医药学院药学院武当特色中药研究湖北省重点实验室,湖北 十堰 442000;2.湖北医药学院生物医药研究院,湖北 十堰 442000)
黄药(Premna cavaleriei Levl.)是马鞭草科豆腐柴属植物[1],湖北省十堰市武当山地区野生黄药分布广、品质优,当地居民有用黄药叶制作“神仙豆腐”的传统,但多以农家自制为主,缺乏系统化和标准化开发。目前尚无黄药的相关研究报道,而相对报道较多的为黄药同属植物。研究表明,该属植物的叶中含有黄酮、果胶、挥发油、氨基酸、维生素、多糖和矿物质等多种营养成分[2-3],其中黄酮类化合物具有抗氧化、抗菌、抗病毒、防治心脑血管疾病及降血脂等功效,应用范围广[4-6]。因此,深入研究黄药叶黄酮成分、提取工艺等可为当地黄药叶质量标准制定与产品开发提供理论依据。
本文以总黄酮得率为检测指标,乙醇为提取溶剂,选用L9(34)正交试验,优化黄药叶总黄酮超声波辅助提取工艺,并通过测定羟自由基清除率、DPPH自由基清除率、超氧阴离子自由基清除率和铁离子还原能力考察其体外抗氧化活性。本研究弥补了黄药研究的空白,为明确其有效成分奠定基础,并为黄药药食同源相关产品开发利用提供理论支撑。
1 材料与方法
1.1 材料与仪器
黄药叶原料:2019年9月采于十堰市张湾区黄龙镇青石村,经湖北医药学院附属十堰市人民医院中药学专家张晓燕副教授鉴定为马鞭草科豆腐柴属植物黄药(Premna cavaleriei Levl.)的叶;芦丁标准品:上海源叶生物科技有限公司;无水乙醇、氢氧化钠、邻苯三酚、水杨酸、氯化铁、亚硝酸钠、硝酸铝、L-抗坏血酸(分析纯):国药集团化学试剂有限公司;30%过氧化氢(优级纯):德国Merck公司;盐酸(分析纯):上海安谱实验科技股份有限公司;DPPH、三羟甲基氨基甲烷(分析纯):北京索莱宝科技有限公司;2,4,6-三吡啶基三嗪(2,4,6-tripyridyl-triazine,TPTZ)(分析纯):阿拉丁试剂有限公司;试验用水均为超纯水。
TU-1901型紫外可见分光光度计:北京普析通用仪器有限责任公司;KQ-250DE型超声波清洗仪:昆山市超声仪器有限公司;MBF-20A型高速中药粉碎机:温岭市迈邦机械设备有限公司;CPA225D型电子天平、PB-10型酸度计:德国Sartorius公司;RE-52AA型旋转蒸发仪:上海亚荣生化仪器厂;SH2-D(Ⅲ)型循环水式真空泵:河南省予华仪器有限公司;GZX-9240MBE型电热鼓风干燥箱:上海博迅实业有限公司医疗设备厂。
1.2 试验方法
1.2.1 黄药叶样品制备
新鲜黄药叶,采摘当天用纯水洗净,50℃烘干,粉碎过60目筛,得黄药叶粉末,密封备用。
1.2.2 超声波辅助提取法提取黄药叶总黄酮
1.2.2.1 单因素试验
精密称取1.2.1项下样品2.000 g,确定料液比1∶20(g/mL),60%乙醇溶液,浸泡时间 30 min,提取温度55℃,超声功率125 W,提取时间30 min,提取次数1次为固定因子,分别考察提取温度(25、35、45、55、65、75 ℃)、料液比[1∶7.5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40(g/mL)]、乙醇体积分数(30%、40%、50%、60%、70%、80%、90%)、浸泡时间(0、10、20、30、40、50,60 min)、超声功率(100、125、150、175、200、225、250 W)、提取时间(0、10、20、30、40、50、60 min) 和提取次数(1、2、3、4、5次)对超声波辅助提取黄药叶总黄酮得率的影响。
1.2.2.2 正交试验
在单因素试验结果基础上,选择对总黄酮得率影响较大的4个因素,进行四因素三水平正交试验,因素与水平见表1。

表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test
1.2.3 样品提取液中总黄酮含量及得率测定
1.2.3.1 对照品溶液的配制
精密称取芦丁对照品20.0 mg,加无水乙醇定容至50 mL,备用。
1.2.3.2 标准曲线的绘制
采用亚硝酸钠-硝酸铝-氢氧化钠光度法测定样品总黄酮含量[7]。精密吸取对照品溶液 0、0.5、1.0、1.5、2.0、2.5、3.0、4.0、5.0 mL,分别置于 25 mL 容量瓶中,加无水乙醇至6.0 mL,再分别加入5%亚硝酸钠溶液1 mL,摇匀,放置6 min;加入10%硝酸铝溶液1 mL,摇匀,放置6 min;加入1 mol/L氢氧化钠溶液10 mL,摇匀,最后加入30%乙醇至刻度,放置15 min。510 nm波长处测定吸光度值,以吸光度值(A)为纵坐标、芦丁质量浓度(mg/mL)为横坐标绘制标准曲线Y=0.013 76X-0.001 04,R2=0.999 9,结果表明芦丁对照品在0~0.08 mg/mL范围内线性关系良好。
1.2.3.3 样品提取液中总黄酮含量及得率测定
依据1.2.2项下方法提取样品,离心取上清,并用60%乙醇溶液定容至100 mL,精密吸取1.0mL至25mL容量瓶,待测,以等体积无水乙醇为对照,按1.2.3.2项下试验步骤进行总黄酮含量测定。由公式(1)计算总黄酮得率。

式中:c为根据标准曲线方程计算出样品中总黄酮含量,mg/mL;N为稀释倍数;V为样品提取液总体积,mL;m 为样品质量,g。
1.2.4 黄药叶总黄酮提取物抗氧化性能测定
1.2.4.1 羟自由基清除率测定
参考李亚军等[8]和Liang等[9]的方法略作改动。在最优工艺条件下提取黄药叶总黄酮,并用提取溶剂(即80%乙醇溶液)将提取液稀释成浓度为50、100、200、300、400 μg/mL的黄药叶总黄酮溶液,取样品液1.0 mL于具塞刻度试管中,再加9 mmol/L FeSO41 mL,反应15 min后加9 mmol/L水杨酸-乙醇溶液1 mL,最后加 8.8 mmol/L H2O21 mL,37℃反应 30 min,测510 nm处吸光度值,记A1;用蒸馏水代替H2O2测定样品的本底吸光度值,记A2;以蒸馏水代替样品,记A0;用提取溶剂溶解阳性对照物L-抗坏血酸,并配制为上述浓度梯度的溶液,同法测定其羟自由基清除率。由公式(2)计算清除率。

1.2.4.2 DPPH自由基清除率测定
参考 Yeo等[10]和 GB/T 39100—2020《多肽抗氧化性测定DPPH和ABTS法》[11]的方法略有改动。同1.2.4.1 方法,稀释提取液得到浓度为 2、4、6、8、10、20、40 μg/mL的黄药叶总黄酮溶液,取样品液2.0 mL于具塞刻度试管中,再依次加2 mL的DPPH试剂(0.2 mmol/L),暗反应30 min,离心后取上清液作为试验组,于517 nm处测吸光度值,记A1;用2.0 mL甲醇代替2.0 mL DPPH,测定样品的本底吸光度值,记A2;用蒸馏水代替样品作空白对照,记A0;用提取溶剂溶解阳性对照物L-抗坏血酸,并配制为上述浓度梯度的溶液,同法测定其DPPH自由基清除率。由公式(3)计算清除率。

1.2.4.3 超氧阴离子自由基清除率测定
参考Tao等[12]的方法略有改动。同1.2.4.1方法,稀释提取液得到浓度为 10、20、30、40、50 μg/mL 的黄药叶总黄酮溶液,取样品液1.0 mL于具塞刻度试管中,再分别加 50 mmol/L Tris-HCl缓冲液(pH 8.2)3 mL,37℃水浴20 min,立即加37℃预热的7 mmol/L邻苯三酚1 mL,迅速摇匀倒入比色皿,325 nm处每30 s测吸光度值,连测4 min,计算每分钟变化值,记A1;蒸馏水代替样品,增加值记A0;用提取溶剂溶解阳性对照物L-抗坏血酸,并配制为上述浓度梯度的溶液,同法测定其超氧阴离子自由基清除率。由公式(4)计算清除率。

1.2.4.4 铁离子还原能力测定
参考王国庆等[13]的方法略有改动。配制TPTZ工作液:将 0.3 mol/L 醋酸缓冲液(pH 3.6)、10 mmol/L TPTZ溶液(溶于40 mmol/L盐酸)、20 mmol/L氯化铁溶液以10∶1∶1 体积比混合,现配现用。
同1.2.4.1方法,稀释提取液得到浓度为25、50、100、200、300、400 μg/mL 的黄药叶总黄酮溶液。试验组加入200 μL同浓度样品和1.8 mL TPTZ工作液,空白组加入200 μL蒸馏水与1.8 mL TPTZ工作液,对照组加入200 μL不同浓度样品和1.8 mL蒸馏水。避光静置10 min,593 nm处测吸光度,空白组吸光度值为A0,试验组吸光度值为A1,对照组吸光度值为A2。用提取溶剂溶解阳性对照物L-抗坏血酸,并配制为上述浓度梯度的溶液,同法测定其铁离子还原能力。吸光度越大表示还原能力越强。由公式(5)计算铁离子还原能力。

1.3 数据处理
所有试验均设3个平行,试验数据以平均值±标准差表示,采用SPSS 19.0统计软件进行单因素方差分析、GraphPad Prism 8.0进行绘图。
2 结果与分析
2.1 超声波辅助提取法单因素试验
2.1.1 提取温度单因素试验结果
提取温度对黄药叶总黄酮得率的影响见图1。

图1 提取温度对黄药叶总黄酮得率的影响Fig.1 Extraction temperature on the yield of total flavonoids in Premna cavaleriei Levl.leaves
由图1可知,提取温度在25℃~55℃时,总黄酮得率呈先下降后升高趋势,在55℃时,达到峰值4.08%,继续升温至65℃以上时,总黄酮得率有所降低。温度升高可加剧分子热运动,降低溶剂黏度,总黄酮在溶剂中溶解速度加快,得率上升[14-15];但温度过高可能会加快溶剂挥发和总黄酮氧化分解,导致得率下降[16]。因此,55℃为最佳提取温度。
2.1.2 料液比单因素试验结果
料液比对黄药叶总黄酮得率的影响见图2。

图2 料液比对黄药叶总黄酮得率的影响Fig.2 Effect of solid/liquid ratio on the yield of total flavonoids in Premna cavaleriei Levl.leaves
由图 2 可知,料液比在 1∶7.5(g/mL)~1∶30(g/mL)时,随着溶剂体积的增大,总黄酮得率呈递增趋势,料液比为1∶30(g/mL)时总黄酮得率达到最大值3.99%后趋于平衡。原因可能是随着溶剂量的加大,样品与溶剂的接触面积也逐渐增大,在料液比1∶30(g/mL)时溶剂充分包裹样品,再继续增加溶剂量,对总黄酮得率将无促进作用[17]。此外,随溶剂量增大,细胞内非黄酮类杂质溶出量增加,阻碍了总黄酮溶出,导致得率下降[18]。为获取最佳料液比,选取 1∶25、1∶30、1∶35(g/mL)作为正交试验设计中料液比的3个水平。
2.1.3 乙醇体积分数单因素试验结果
乙醇体积分数对黄药叶总黄酮得率的影响见图3。

图3 乙醇体积分数对黄药叶总黄酮得率的影响Fig.3 Effect of ethanol concentration on the yield of total flavonoids in Premna cavaleriei Levl.leaves
由图3可知,当乙醇体积分数为60%时,黄药叶总黄酮得率最高,为3.47%,但随着乙醇体积分数继续增大,总黄酮得率呈下降趋势。可能因60%乙醇溶液极性与黄药叶中黄酮类化合物的极性较为相近,依据相似相溶原理,得率较高,但当乙醇体积分数高于60%时,提取溶剂与黄酮类化合物之间极性差异增大,导致总黄酮得率呈下降趋势[19]。另外,随着乙醇体积分数的增大,更多的蛋白质、糖类和脂溶性杂质溶出,导致总黄酮得率有所下降[20-21]。因此,选择50%、60%和70%作为正交试验设计乙醇体积分数的3个水平。
2.1.4 浸泡时间单因素试验结果
浸泡时间对黄药叶总黄酮得率的影响见图4。
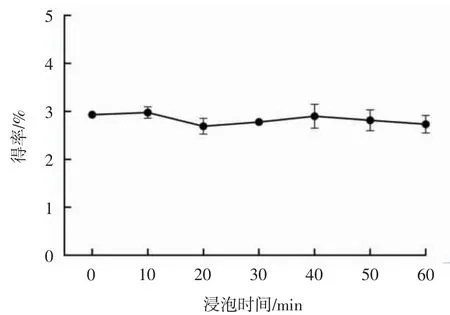
图4 浸泡时间对黄药叶总黄酮得率的影响Fig.4 Effect of soaking time the yield of total flavonoids in Premna cavaleriei Levl.leaves
由图4可知,当浸泡时间为10 min时,黄药叶总黄酮得率最高,为2.98%。浸泡时间增加至20 min时,总黄酮得率有所下降,随着浸泡时间的进一步延长,总黄酮得率基本稳定。可能是因为初始阶段提取溶剂迅速包裹样品,提取液中黄酮类化合物含量提高[22],但随着浸泡时间的增加,样品在提取液中逐渐沉降[23],导致提取液中有效成分减少。因此,浸泡时间10 min为最佳。
2.1.5 超声功率单因素试验结果
超声功率对黄药叶总黄酮得率的影响见图5。

图5 超声功率对黄药叶总黄酮得率的影响Fig.5 Effect of ultrasonic power on the yield of total flavonoids in Premna cavaleriei Levl.leaves
由图5可知,黄药叶总黄酮得率随着超声功率的增加先升高后趋于平稳,当超声功率150 W时,黄药叶总黄酮得率最高,为3.82%。随着超声功率增强,加大了超声波的“机械效应”和“空化效应”,可有效减小粉末与溶剂之间的阻滞层,提高样品的破碎度,增加了总黄酮得率[24-25];当超声功率达到一定值时,超声波产生的“机械效应”和“空化效应”已达最佳,所以在150 W~250 W范围,黄药叶总黄酮得率基本保持恒定。因此,适宜超声功率为150 W。
2.1.6 提取时间单因素试验结果
提取时间对黄药叶总黄酮得率的影响见图6。

图6 提取时间对黄药叶总黄酮得率的影响Fig.6 Effect of extraction time on the yield of total flavonoids in Premna cavaleriei Levl.leaves
由图6可知,提取时间为30 min时,黄药叶总黄酮得率达到峰值3.58%,当提取时间继续延长,总黄酮得率呈下降趋势。可能由于提取时间在0~30 min时,样品破碎程度迅速增加,黄酮类化合物不断溶出,提取液中总黄酮得率在30 min时达到最大值,但随着提取时间延长,部分总黄酮被氧化或分解,导致目标产物得率降低[26]。因此,选择提取时间为20、30、40 min进行正交试验。
2.1.7 提取次数单因素试验结果
提取次数对黄药叶总黄酮得率的影响见图7。

图7 提取次数对黄药叶总黄酮得率的影响Fig.7 Effect of extraction times on the yield of total flavonoids in Premna cavaleriei Levl.leaves
由图7可知,随着提取次数增加,黄药叶总黄酮得率先快速升高后缓慢升高。提取1次~3次时,总黄酮得率由2.82%快速增至4.19%,提取3次与提取1次相比,总黄酮得率增加48.58%。随着提取次数进一步增加,提取5次时总黄酮得率为4.74%,与提取3次相比,总黄酮得率增加13.13%。可能因每次更换溶剂进行提取时,不断形成高渗透压环境,使得样品中黄酮类化合物逐次被提取,而样品中黄酮类化合物含量有限,随着提取次数进一步增加,黄酮类化合物已基本溶出,总黄酮得率增加缓慢;同时随着提取次数增加,促进了杂质的溶出,影响了总黄酮的提取[27]。因此,选择提取次数2、3、4次进行正交试验。
2.2 正交试验设计优化超声波辅助提取法提取工艺
2.2.1 正交试验设计与结果分析
在单因素试验结果基础上,选择料液比(A)、提取时间(B)、提取次数(C)、乙醇体积分数(D)4个因素,进行四因素三水平正交试验。其它参数固定为浸泡时间10 min,超声功率150 W,提取温度55℃,正交试验结果与分析见表2。

表2 正交试验结果与分析Table 2 Experimental results and analyses for optimization of total flavonoids
由表2可知,4个因素极差顺序为D>B>A>C,即乙醇体积分数对黄药叶总黄酮得率影响最大,其次是提取时间、料液比,最后是提取次数。通过比较k值可知,4个因素的最佳水平为A2B3C2D3,即料液比1∶30(g/mL),提取时间 40 min,提取次数 3次,乙醇体积分数70%,由于该条件不在正交试验的9次试验中,因此需进一步试验验证。
2.2.2 方差分析及最优工艺试验验证
方差分析见表3。

表3 正交试验结果方差分析Table 3 Analysis of variance of orthogonal experiment results for optimization of total flavonoid extraction
由表3可知,上述4个因素对黄药叶总黄酮得率的影响大小顺序是乙醇体积分数>提取时间>料液比>提取次数,与极差分析结果一致。同时,由P值可知4个因素均对黄药叶总黄酮得率有显著影响。
为进一步验证最优工艺可靠性,进行3组平行试验验证,得率为分别为6.30%、6.25%和6.00%,均值为6.18%,相对标准偏差为0.13%,验证试验总黄酮得率均高于正交表中得率,证实该正交试验结果可靠,故确定黄药叶总黄酮的最优提取条件为乙醇体积分数70%,提取次数 3 次,提取时间 40 min,料液比 1∶30(g/mL)。
2.3 黄药叶总黄酮提取物抗氧化能力测定
黄药叶总黄酮提取物和L-抗坏血酸抗氧化活性试验线性拟合结果见表4和表5。

表4 黄药叶总黄酮提取物抗氧化活性试验线性拟合结果Table 4 The linearity correlation results of antioxidant activity of total flavonoids from Premna cavaleriei Levl.leaves

表5 L-抗坏血酸抗氧化活性试验线性拟合结果Table 5 The linearity correlation results of antioxidant activity of L-ascorbic acid
2.3.1 羟自由基清除率测定
黄药叶总黄酮提取物和L-抗坏血酸对羟自由基的清除作用见图8。

图8 黄药叶总黄酮提取物和L-抗坏血酸对羟自由基的清除作用Fig.8 Hlydroxyl radicals scavenging effects of total flavonoids from Premna cavaleriei Levl.leaves and L-ascorbic acid
由图 8 可知,在 50 μg/mL~500 μg/mL 范围内黄药叶总黄酮提取物清除羟自由基的能力弱于同浓度的L-抗坏血酸,两者对羟自由基的清除作用均随浓度的增加而增大,在500 μg/mL时黄药叶总黄酮提取物对羟自由基的清除率为(51.87±1.18)%,低于L-抗坏血酸的(79.43±2.65)%。另外,由表4和表5可知,L-抗坏血酸的IC50为323.50 μg/mL,而黄药叶总黄酮提取物的IC50为484.12 μg/mL,是L-抗坏血酸的1.50倍。以上结果表明黄药叶总黄酮提取物对羟自由基具有较强的清除能力,且与浓度具有量效关系。
2.3.2 DPPH自由基清除率测定
黄药叶总黄酮提取物和L-抗坏血酸对DPPH自由基的清除作用见图9。

图9 黄药叶总黄酮提取物和L-抗坏血酸对DPPH自由基的清除作用Fig.9 DPPH radical scavenging effects of total flavonoids from Premna cavaleriei Levl.leaves and L-ascorbic acid
由图9可知,黄药叶总黄酮提取物清除DPPH自由基的能力弱于同浓度的L-抗坏血酸,两者对DPPH自由基的清除率随浓度的增加而增大,到达一定浓度后增长趋于平缓。L-抗坏血酸及黄药叶总黄酮提取物分别在 0.5 μg/mL ~ 8 μg/mL、0.5 μg/mL ~ 40 μg/mL 范围时对DPPH自由基的清除率与其浓度相关性较好。由回归方程得L-抗坏血酸的IC50为4.06 μg/mL,而黄药叶总黄酮提取物的IC50为18.27 μg/mL,是L-抗坏血酸的4.50倍。在试验浓度范围内,当黄药叶总黄酮提取物浓度为40 μg/mL时,清除率最大为(89.99±0.11)%,仅与L-抗坏血酸相差5.95%。因此,黄药叶总黄酮提取物对DPPH自由基清除能力虽不及L-抗坏血酸,但也具有一定程度的清除作用。
2.3.3 超氧阴离子自由基清除率测定
黄药叶总黄酮提取物和L-抗坏血酸对超氧阴离子自由基的清除作用见图10。

图10 黄药叶总黄酮提取物和L-抗坏血酸对超氧阴离子自由基的清除作用Fig.10 Scavenging ability against superoxide anion radicals of total flavonoids from Premna cavaleriei Levl.leaves and L-ascorbic acid
由图10可知,当浓度小于10 μg/mL时,黄药叶总黄酮提取物对超氧阴离子自由基的清除效果较L-抗坏血酸略强;当浓度大于10 μg/mL时,随着浓度的增大,L-抗坏血酸对超氧阴离子自由基清除能力略优于黄药叶总黄酮提取物清除能力,当浓度为50 μg/mL时,黄药叶总黄酮提取物对超氧阴离子自由基清除率为(51.68±0.23)%,而L-抗坏血酸则为(99.30±0.22)%,两者清除率差值达最大值。黄药叶总黄酮提取物对超氧阴离子自由基的IC50为46.88 μg/mL,为L-抗坏血酸IC50的2.51倍,表明黄药叶总黄酮提取物对超氧阴离子自由基的清除能力虽弱于L-抗坏血酸,但仍具有较强的超氧阴离子自由基的清除能力。
2.3.4 铁离子还原能力
黄药叶总黄酮提取物和L-抗坏血酸的铁离子还原能力见图11。

图11 黄药叶总黄酮提取物和L-抗坏血酸的铁离子还原能力Fig.11 Ferric reducing ability of total flavonoids from Premna cavaleriei Levl.leaves and L-ascorbic acid
铁离子还原能力以吸光度值衡量,吸光度值越大,还原能力越强。由图11可知,黄药叶总黄酮提取物在5 μg/mL~300 μg/mL范围内,随着浓度升高吸光度值不断增大;在300 μg/mL~400 μg/mL时吸光度值趋于平稳且与L-抗坏血酸吸光度曲线重合,表明黄药叶总黄酮提取物具有较强的铁离子还原能力。
3 结论
本文采用超声波辅助提取法提取武当山地区野生黄药叶总黄酮,通过单因素试验和正交试验优化提取工艺,获取最佳工艺条件为乙醇体积分数70%,提取次数 3 次,提取时间 40 min,料液比 1∶30(g/mL),此工艺条件下,得率为6.18%,即提取量为61.8 mg/g。与传统醇提法相比,本研究所得最佳提取工艺条件可缩短提取时间,避免长时间提取对活性成分的影响,提高黄药叶总黄酮的提取量和效率。此外体外抗氧化活性研究表明,黄药叶总黄酮提取物对羟自由基、DPPH自由基和超氧阴离子自由基均具有清除作用,且具较强的铁离子还原能力;同时在一定浓度范围内,抗氧化能力与浓度呈正相关。黄药叶总黄酮提取物对羟自由基、DPPH自由基和超氧阴离子自由基的IC50为484.12、18.27、46.88 μg/mL,分别为 L-抗坏血酸的1.50、4.50、2.51倍;此外,其铁离子还原能力略低于L-抗坏血酸。本文首次对武当山野生黄药叶总黄酮提取工艺及体外抗氧化活性进行研究,可为当地野生黄药叶明确营养成分及活性物质奠定研究基础,以及为黄药药食同源相关产品开发提供了理论支撑。

