海洋生物活性肽的功能、制备技术与作用机制研究进展
杨贵兰, 秦 松, 李文军, 李 亚
海洋生物活性肽的功能、制备技术与作用机制研究进展
杨贵兰1, 2, 3, 秦 松1, 3, 李文军1, 3, 李 亚4
(1.中国科学院 烟台海岸带研究所, 山东 烟台 264003; 2.滨州医学院 药学院, 山东 烟台 264005; 3.中国科学院 海洋大科学研究中心, 山东 青岛 266071; 4.烟台嘉惠海洋生物科技有限公司, 山东 烟台 264003)
许多海洋生物活性肽具有降血压、抗炎、抗氧化、抗血栓等多种生物活性, 在功能食品及医药领域有着广阔的应用前景。本文主要综述了海洋生物活性肽的制备方法、功能活性及其作用机制, 为进一步开发和利用海洋生物活性肽提供参考。
海洋生物活性肽; 制备方法; 功能活性; 作用机制
海洋表面积约占地球总表面积的71%, 海洋中种类繁多的动物、植物以及微生物形成了一个丰富的生物资源库。与陆地环境相比, 海洋环境具有诸如高盐、低温、高压及少光等特点。为了适应特殊的环境, 海洋生物形成了许多具有的特定功能的生物活性肽。比如, 海洋藻类为了防止氧化损伤, 可产生抗氧化肽实现自我保护[1]; 海洋鱼类生物肽可能会产生一些由特殊氨基酸组成的环状肽, 该肽具有特殊的功能活性包括细胞毒性、抗肿瘤[2]。
生物活性肽是2~50个氨基酸残基以不同组合和排列方式构成的从二肽到复杂的线性、环形结构的不同肽类的总称[1]。这些生物活性多肽大多是从鱼类, 海绵, 海鞘, 海藻和软体动物中提取得到的, 据报道具抗炎、抗氧化性、抗血栓等多种药理作用[3]。本综述概述了海洋生物活性多肽的制备方法与功能活性, 并介绍活性化合物的作用机制等, 为进一步开发海洋生物活性多肽在功能性食品和药品中的潜在应用提供了理论基础。
1 海洋生物活性肽的制备方法
海洋生物活性肽的制备主要有3种途径, 一是通过对海洋生物蛋白质进行酶解获得具有各种功能活性的生物肽; 二是通过特定的化学法, 使海洋生物蛋白质中的肽键断裂得到的活性肽类; 三是通过人工合成法等方法获得具有一定分子质量的多肽类化合物。海洋生物活性肽的获得途径如图1所示。
1.1 酶解法
蛋白酶解法是制备生物活性肽最常用的方法。酶解法具有生产成本低、生产条件温和、水解进程易于控制且产品安全性较高等特点。酶解法中蛋白酶的选择是关键, 不同的蛋白酶酶切后将得到不同的片段。胃蛋白酶, 胰蛋白酶, 碱性蛋白酶, 菠萝蛋白酶和风味蛋白酶是几种常用的蛋白酶, 同时这些酶的复合使用可生产更多高效、稳定的生物活性肽。但酶解的最优条件需要通过多个单因素实验来确定, 如底物浓度、用于酶解的最佳酶及添加量、酶解时间等。不同的蛋白酶的酶切位点不同, 使用不同的酶水解相同的蛋白质底物时将会获得活性不同的多肽片段。
已从海洋生物如紫菜、牡蛎、鲈鱼、腈鱼等中提取得到具有不同功能的活性肽(表1)。黄湛媛等[6]采用中性蛋白酶对竹节虾头副产物进行酶解, 最优酶解条件下, 获得的酶解产物DPPH清除率达69.50%。Wu等[9]从海洋微藻胰蛋白酶酶解液中分离得到氨基酸序列为TMGLDLK的ACE抑制肽, 其IC50值为36.1 μmol/L。
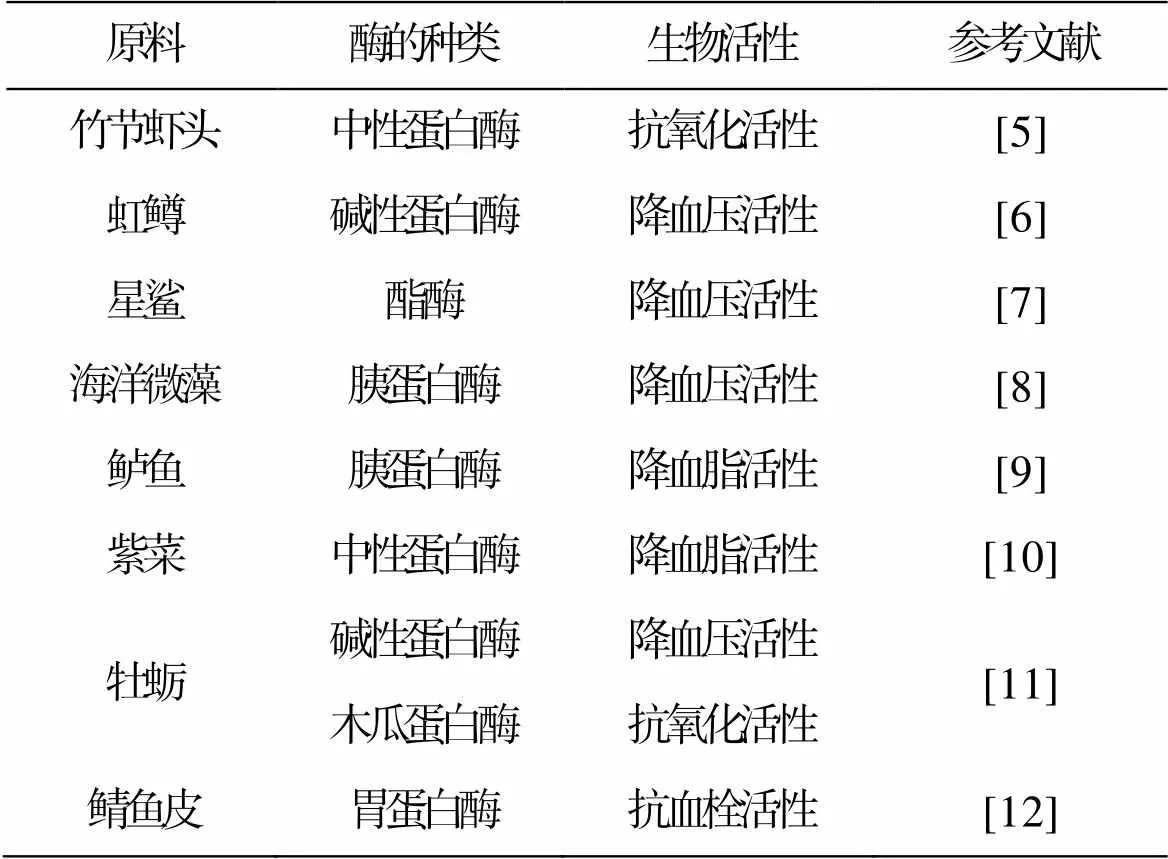
表1 胃肠道消化酶酶解法制备海洋生物活性肽
在酶解法制备活性肽过程中, 超声波辅助可显著缩短多肽的提取时间、提高有效成分的提取率、避免高温提取对多肽的影响[13-18]。超声波加快酶解反应速率的原理主要是空化效应, 即超声波在体介质中可形成微泡, 借助其破裂时能量的释放, 进而提高酶解反应的速度, 最终获得更加丰富的目标肽段, 同时提高多肽的生物活性[19-22]。
康永峰等[23]利用超声波-微波协同对鲑鱼胶原蛋白进行了酶解, 制备得到一种抗氧化肽, 还研究了超声波和微波单一作用及共同作用对鲑鱼肽超氧阴离子自由基清除能力的影响, 发现抗氧化能力均得到一定程度的提高。张玥等[24]采用超声辅助乙酸提取法, 从紫贻贝加工下脚料中得到一种抗菌肽, 并对其提取工艺进行了优化, 研究发现: 与传统乙酸提取法相比, 超声辅助乙酸法提取的抗菌肽抑菌效果更好, 抑菌圈可达(7.52±0.08) mm。
1.2 微生物发酵法
微生物发酵法是利用微生物自身的胞外蛋白酶将蛋白质降解的过程, 是产生生物活性肽和食品级水解蛋白质的一种有效方法。与酶解法相比, 微生物发酵法产物纯化较困难, 有一些产酶菌株可能对机体产生毒害作用等[13]。但该方法成本较低, 产量较高, 同时还能对鱼皮进行脱腥脱臭处理。
刘芳等[14]采用微生物发酵法从鳕鱼中提取得到抗氧化胶原多肽, 发酵菌株为JF0Y3+啤酒酵母+ H-2, 并达到除臭除腥的效果。彭健等[15]采用复合酶解与微生物发酵法协同制备得到了一种刺参低聚肽, 提升了刺参肽功能制品附加值及刺参副产物利用率, 并有效彻底除腥。林俊宏等[16]采用微生物发酵法, 将嗜酸乳杆菌和枯草芽孢杆菌混合与鱼粉共同发酵, 提取得到具有强抗氧化能力的鱼粉肽类化合物。
1.3 化学水解法
化学水解法是一种利用适当浓度的酸或碱溶液对蛋白质进行处理, 使蛋白质中的肽键断裂, 获得小分子生物活性肽的方法[2]。对于一些与脂质结合能力较强且具有很多非极性侧链的多肽需采用不同比例的酸或碱同步提取。然而, 该技术存在许多限制因素, 如在多肽提取工艺过程中难以控制氨基酸的改变[17]。因此, 近年来单独使用该方法在海洋生物活性肽的提取中应用较少。
李祺福[18]采用20 mmol/L的HCl对牡蛎匀浆液进行提取, 并利用分子筛层析获得一种低分子活性肽, 且该活性肽可显著抑制人肺腺癌A549细胞的增殖, 细胞生长抑制率高达49.8%。王传幸等[19]以黑鱼鱼鳞为原料, 采用碱提法提取胶原蛋白, 又在此基础上, 利用酶解法制备得到小分子胶原蛋白肽, 研究发现: 体外羟自由基清除能力最高可达65.76%。
1.4 固相合成法
固相合成法是一个从C端向N端重复添加氨基酸的过程, 可合成包含10~100个残基的多肽序列[20]。使用该方法合成多肽的前提是已知目标肽段中氨基酸的序列。
Deng等[21]采用HPLC-MS技术从龙须菜水解物中筛选出了两种ACE抑制肽, 并采用固相合成法进行合成, 研究发现合成的两种多肽在给药2~4 h内,高血压大鼠的收缩压和舒张压分别降低了34和28 mmHg。丁靖[22]采用固相合成法合成了胡蜂蜂毒肽-M, 经HPLC分析其纯度可达97%, 多肽最终收率达56%, 说明固相合成法合成的多肽纯度较高, 操作较方便, 多肽得率也较高。但经研究发现合成多肽的成本较高、活性不稳定, 只能合成已知氨基酸种类和肽链排列顺序的肽[23]。
2 海洋生物活性肽的功能活性
2.1 降血压
近年来, 天然海产品已被作为化学合成药物的替代品被研究, 目前已经从藻类和海洋蛋白质, 如海虾[24]、鲑鱼[25]中分离得到一些新的具有ACE抑制活性的化合物。肾素-血管紧张素系统(RAS)在人体血压调节过程中具有重要作用, 血管紧张素转化酶(ACE)是RAS中重要的水解酶, 抑制ACE的活性, 可以减少血管紧张素II的生成、降低ACE对缓激肽的水解, 从而抑制RAS系统, 达到降低血压的目的[26]。
胃蛋白酶、糜蛋白酶、碱性蛋白酶和胰蛋白酶等常被用于蛋白水解以获得ACE抑制肽。不同的蛋白酶, 酶切位点不同, 制备得到的降压肽的IC50值也不同(表2), 这可能是由于肽的结构不同导致其活性大小不同[27]。例如: 胰蛋白酶可特异性裂解羧基侧具有Lys和Arg残基的蛋白质, α-胰凝乳蛋白酶倾向于在芳香族或大型疏水侧链的羧基侧裂解肽键, 释放带有His、Ala、Val、Leu、Tyr、Phe、Trp和Pro C末端氨基酸的肽[27]。另外, 肽链N端和C端氨基酸残基的类型对ACE抑制活性影响很大。Saadi等[28]发现肽段N端氨基酸为Gly、Asn、Met、Arg和Tyr, C端氨基酸为Leu、Pro、Asp和Phe时, ACE抑制活性较好。该作者还指出抑制ACE肽的序列可以根据其分子量进行分类, 其中前导序列是分子质量最低的序列, 其次是中等分子质量的序列, 最后是分子质量最高的序列。因此, 含有两个和三个氨基酸的肽序列常是ACE抑制活性最强的序列[29]。当抑制剂C-末端的三肽序列为疏水性氨基酸(包括Phe、Trp、Tyr、Val、Leu和Ile)时, ACE抑制活性较好[27, 30]。此外, C末端残基为带有正电荷氨基酸(Lys和Arg)或者倒数第二个氨基酸是脂肪族氨基酸(如: Val、Ile、Ala等), 碱性和芳香族氨基酸(例如Tyr、Phe等)时, 该抑制肽的ACE抑制活性更好[31-32]。

表2 具有ACE抑制活性的海洋来源蛋白质水解物的制备条件与氨基酸序列
2.2 促钙吸收
促钙吸收肽在pH值呈中性至微碱性的动物小肠下端, 能与钙离子结合, 阻止钙离子与磷酸根产生沉淀, 使小肠内可溶性的钙浓度增加, 从而促进钙离子的吸收和利用[41]。目前已从鳕鱼、姑鱼、虾等海洋生物中提取得到多种促钙吸收肽(表3)。促钙吸收肽中有许多官能团, 如磷酸基、氨基、羧基、半胱氨酸的巯基、组氨酸的咪唑基、羰基及亚氨基等, 可与钙结合形成可溶性肽钙复合物, 进而可以提高其钙离子螯合能力[42]。促钙吸收肽中的氨基酸残基侧链中含有Asp、Ser、His、Cys和Gln等氨基酸时, 可能会通过静电相互作用或氢键配位与肽形成复合物。因此含有以上氨基酸的肽钙结合物活性较高[43]。

表3 已鉴定出的海洋来源促钙吸收肽的制备条件与氨基酸序列
2.3 抗血栓
血小板的活化和聚集是血栓形成的主要原因, 目前使用的抗血小板药物, 如阿司匹林, 可能会增加出血风险、胃肠毒性、血小板反应性等[50]。所以, 寻求来源更广泛更安全可靠的抗血小板活性物质, 对预防或延缓血栓性疾病具有重大意义。
Pierschbacher等发现RGDS序列是纤维蛋白原结合细胞的活性位点, 可抑制血小板的凝集、纤连蛋白与活化血小板的结合, 最终抑制血栓形成[51]。从天然物质中分离的抗血小板肽也相继出现[52]。Khiari等采从腈鱼皮胃蛋白酶酶解液中分离得到一种序列为FGN的三肽, 该肽作用浓度为60 μg/mL时, 血小板的聚集抑制活性与阿司匹林相似。Cian等[53]从紫菜碱性和风味蛋白酶酶解液中分离纯化得到一种分子量约为287 Da的抗血栓肽, 其抗血小板聚集活性可达44%±1.6%。Qiao等[54]对贻贝内收肌、足、内脏等8个不同部位的组织进行酶解, 研究发现从内收肌胰蛋白酶酶解液中分离得到氨基酸序列为“VQQELEDAEERADSAEGSLQK”的抗血小板肽对凝血酶的亲和力较强, IC50值可达1.49 g/L。
2.4 降血脂
高血脂症是指血液内脂质含量超过正常范围, 即TG, TC, LDL-C过高及HDL-C过低, 由此诱发的一系列人体脂质代谢紊乱疾病。应用于临床的有效降血脂药物包括贝特类、他汀类等, 价格昂贵, 长期服用还可能会诱发胃肠道不适、全身性肌肉疼痛和无力等其他不良反应[55]。
研究表明, 沙丁鱼、大西洋鲑、扇贝、牡蛎等海洋动物中含有降血脂功能的活性肽, 它们富含ω-3脂肪酸和甾醇, 与部分陆地生物来源的降血脂活性物质相比, 降血脂效果更为显著, 一些活性肽的降血脂效果与合成降血脂药相当[56]。江锟等[57]利用胰蛋白酶对海洋鲈鱼酶解5 h时, 此时水解度可达12.5%, 制备得到降血脂活性肽与降血脂药物考来烯胺相当。朱晓连等[58]以卵形鲳鲹鱼肉为原料, 发现其作用浓度为100 g/L的酶解液与甘氨胆酸钠体外结合率为21.73%, 相当于同浓度降血脂药物考来烯胺散的48.3%, 这也表明卵形鲳鲹酶解蛋白肽可辅助降血脂。
虽然一些海洋活性多肽在体外已被证明具有良好的降血脂活性, 但其在血脂调节方面的作用机制尚不清楚。为此, Ben等[59]通过动物实验证明多肽含量为5%的沙丁鱼酶解物可降低高血脂大鼠血脂水平, 其中, 血清中胆固醇和甘油三酯含量分别降低了31%和46%。
为进一步确保海洋来源的降血脂肽的安全性和有效性, Zhu等[60]为探讨海洋鱼水解液中的胶原蛋白肽对Ⅱ型糖尿病的治疗作用, 招募了100名Ⅱ型糖尿病患者和和50名健康对照, 研究发现连续口服3个月海洋鱼胶原蛋白肽后, 糖尿病患者血清中TG、TC、LDL、游离脂肪酸的水平显著降低, HDL-C水平升高, 说明海洋鱼胶原蛋白肽可改善患者的高血脂症状。通过结合胆酸盐从而降低肠道对胆固醇吸收是已知食品辅助降血脂的主要机制之一。
2.5 抗炎
炎症是人体应对不同病原体、有毒化合物和受损细胞时, 免疫系统对组织损伤的自然生理反应, 这些触发因素可以引发不同器官的急性或慢性炎症反应, 引起组织损伤或一些免疫介导的疾病[61]。炎症的发生与多种因子相关, 包括介导前列腺素、白三烯、组胺、缓激肽、血小板活化因子和白细胞介素-1等化学物质的释放[62], 抗炎活性肽可以通过减少促炎细胞因子释放, 抑制或干预TNF-α诱导的炎症途径、NF-κB和MAPK信号通路达到预防和治疗炎症的目的(图2)。
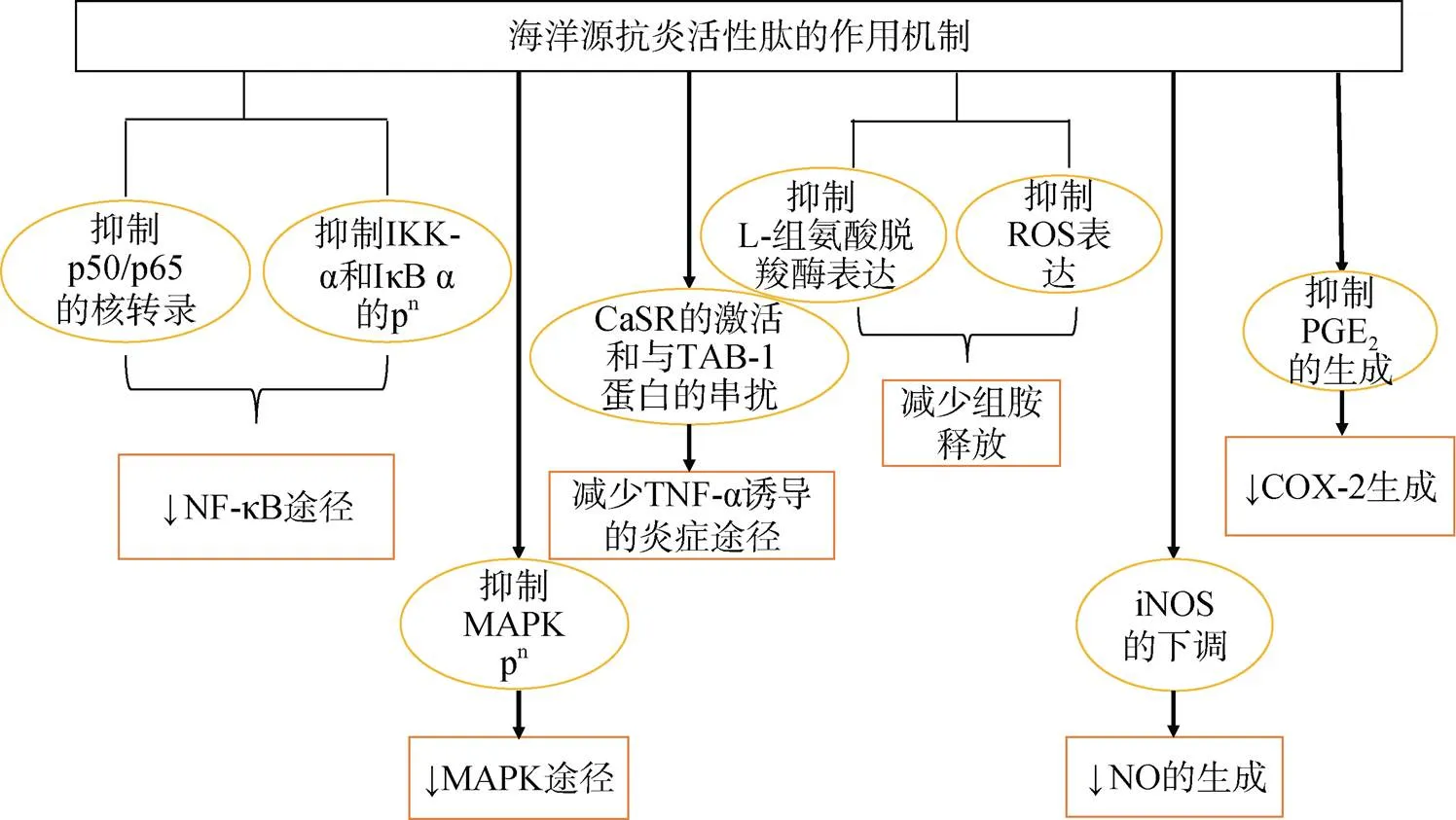
图2 海洋源抗炎活性肽的作用机制[63]
Cheng等[64]从金枪鱼汤汁碱性蛋白酶酶解液中分离得到两种抗炎肽, 其氨基酸序列分别为PRRMMNGGR和MGPAMMRTMPG, 分子质量分别为1 543.8、1 211.5 Da, 研究发现在48 h, 肽浓度为500 μg/mL时, 仍可显著抑制炎症因子TNF-α、IFN-γ和IL-2的表达。Qian等[65]将牡蛎组织胃蛋白酶、胰蛋白酶和Maxipro PSP酶解液依次经大孔树脂DA201-C柱洗脱得到四种多肽组分, 研究发现肽浓度为0.6 g/L时, 20%乙醇洗脱的胃蛋白酶酶解液和40%乙醇洗脱的胰蛋白酶酶解液分离组分可显著抑制TNF-α的分泌, 40%乙醇洗脱Maxipro PSP酶解液分离组分对IL-1β和IL-6因子的抑制作用最强。
2.6 抗氧化
当人体机体内自由基过量堆积, 这些氧自由基会与蛋白质、核酸、脂质等生物大分子发生反应, 生成大量的氧化物或过氧化物, 可能会打破人体的代谢平衡, 并引起动脉粥样硬化、癌症、关节炎、糖尿病等一些慢性疾病的发生[66-67]。海洋抗氧化肽可以通过清除体内自由基、抑制脂质过氧化、金属离子螯合等作用, 发挥抗氧化活性[4, 68]。
Zhao等[69]从腈鱼肌肉酶解液中分离得到4种抗氧化肽PELDW、WPDHW、FGYDWW和YLHFW, 四个肽段的DPPH自由基清除率的EC50值分别为1.53、0.70、0.53和0.97 g/L、羟基自由基清除率的EC50值分别为1.12、0.38、0.26和0.67 g/L以及超氧阴离子自由基清除率的EC50值分别为0.85、0.49、0.34和1.37 g/L。Wong等[70]对蓝斑刺鳐碱性蛋白酶水解液进一步纯化得到WAFAPA和MYPGLA两个肽段。结果表明WAFAPA的抗氧化活性高于阳性对照谷胱甘肽和MYPGLA, 其EC50值分别为12.6、13.7和19.8 µmol/L。Zheng等[71]利用Ginger蛋白酶对鱼皮进行酶解, 进一步分离得到氨基酸序列为Gly-Pro-Ala的抗氧化肽。研究发现Gly-Pro-Ala以剂量依赖的方式激活了ARE介导的抗氧化酶基因的表达, 进而抑制了H2O2诱导的细胞内ROS的产生。
3 展望
海洋来源的生物活性肽具有营养、安全的优点, 在保健食品及生化药物开发方面具有重要意义。目前国内外关于水产来源生物活性肽的研究与应用上也有了一定的成果, 但在构效关系和作用机制方面的深入研究还欠缺, 难以阐释清楚其作用靶点和代谢途径, 限制了其在食品医药领域的应用。未来, 随着分子对接技术、电镜与大分子相互作用解析技术、基于靶蛋白-靶蛋白激活剂之间竞争性抑制的功效作用机制解析等技术的突破, 将有望深入研究海洋功能多肽的结构特征与活性功效, 这对提高我国水产精深加工与高值化利用水平, 充分利用我国丰富的海洋蛋白资源, 具有十分重要的意义。
[1] NAGALINGAM G, PAYNE R J, BRITTON W J, et al.Synthesis of norfijimycin A with activity against mycobacterium tuberculosis[J].Australian Journal of Chemistry: A Journal for the Publication of Original Research in All Branches of Chemistry, 2017, 70(2): 229-232.
[2] 汪少芸, 杨倩, 蔡茜茜, 等.食源性功能肽的研究进展[J].食品与机械, 2020, 36(6): 1-10.
WANG Shaoyun, YANG Qian, CAI Xixi, et al.Research progress in food-derived functional peptides[J].Food & Machinery, 2020, 36(6): 1-10.
[3] CHEUNG R C, NG T B, WONG J H.Marine peptides: bioactivities and applications[J].Mar Drugs, 2015, 13(7): 4006-4043.
[4] LORENZO J M, MUNEKATA P E S, GÓMEZ B, et al.Bioactive peptides as natural antioxidants in food products–A review[J].Trends in Food Science & Technology, 2018, 79: 136-147.
[5] 黄湛媛, 李丽, 熊宇飞, 等.超声辅助竹节虾头酶解及抗氧化肽分离研究[J].核农学报, 2017, 31(8): 1556-1566.
HUANG Zhanyuan, LI Li, XIONG Yufei, et al.Study on ultrasound-assisted enzymatic hydrolysis of penaeus japonicas head and separation of the antioxidant peptides[J].Journal of Nuclear Agricultural Sciences, 2017, 31(8): 1556-1566.
[6] KETNAWA S, SUWAL S, HUANG J, et al.Selective separation and characterisation of dual ACE and DPP- IV inhibitory peptides from rainbow trout (Oncorhynchus mykiss) protein hydrolysates[J].International journal of food science and technology, 2019, 54(4SI): 1062-1073.
[7] ABDELHEDI O, NASRI R, JRIDI M, et al.In silico analysis and antihypertensive effect of ACE-inhibitory peptides from smooth-hound viscera protein hydrolysate: Enzyme-peptide interaction study using molecular docking simulation[J].Process Biochemistry, 2017, 58: 145-159.
[8] WU H, XU N, SUN X, et al.Hydrolysis and purification of ACE inhibitory peptides from the marine microalga Isochrysis galbana[J].Journal of Applied Phycology, 2015, 27(1): 351-361.
[9] 江锟, 徐志宏, 魏振承, 等.鲈鱼活性肽的制备工艺及其体外降血脂活性研究[J].广东农业科学, 2013, 40(9): 99-102.
JIANG Kun, XU Zhihong, WEI Zhencheng, et al.Preparation of active peptides from marine bass and their hypolipidemic activity in vitro[J].Guangdong Agricultural Sciences, 2013, 40(9): 99-102.
[10] 王茵, 苏永昌, 吴靖娜, 等.紫菜多肽降血脂及抗氧化作用的研究[J].食品工业科技, 2013, 34(16): 334-337.
WANG Yin, SU Yongchang, WU Jingna, et al.Study on the hypolipidemic effects and antioxidative activity of porphyra peptide[J].Science and Technology of Food Industry, 2013, 34(16): 334-337.
[11] ASHA K K, KUMARI K R R, KUMAR K A, et al.Sequence determination of an antioxidant peptide obtained by enzymatic hydrolysis of oyster crassostrea madrasensis (preston)[J].International Journal of Peptide Research and Therapeutics, 2016, 22(3): 421-433.
[12] KHIARI Z, RICO D, MARTIN-DIANA A B, et al.Structure elucidation of ACE-inhibitory and antithrombotic peptides isolated from mackerel skin gelatine hydrolysates[J].J Sci Food Agric, 2014, 94(8): 1663-1671.
[13] 陈文雅, 谭云.生物活性肽制备及其在粮油中的开发[J].粮油食品科技, 2017, 25(6): 40-45.
CHEN Wenya, TAN Yun.Preparation of biological active peptides and its development in grain and oil[J].Science and Technology of Cereals, Oils and Foods, 2017, 25(6): 40-45.
[14] 刘芳.混合菌种发酵法制备鳕鱼皮小分子胶原多肽及体外抗氧化性能研究[D].烟台: 烟台大学, 2014.
LIU Fang.Preparation of collagen peptides from cod skin fermentation by multi-microbes and its antioxidant properties in vitro[D].Yantai: Yantai University, 2014.
[15] 彭健, 方素云, 胡晓珂, 等.一种刺参低聚肽及其制备方法和应用: CN110973342B[P].2018.
PENG Jian, FANG Suyun, HU Xiaoke, et al.The invention relates to an oligopeptide of sea cucumber and a preparation method thereof and its application.CN110973342B[P].2018.
[16] 林俊宏, 朱辉, 林琨杰, 等.混合菌固态发酵制备发酵鱼粉的研究[J].饲料工业, 2017, 38(10): 35-40.
LIN Junhong, ZHU Hui, LIN Kunjie, et al.Solid-state fermentation of fish meal with mixed culture of microorganisms[J].Feed Industry, 2017, 38(10): 35-40.
[17] VIJAYKRISHNARAJ M, PRABHASANKAR P.Marine protein hydrolysates: their present and future perspectives in food chemistry - a review[J].RSC Advances, 2015, 5(44): 34864-34877.
[18] 李祺福.牡蛎低分子活性肽及其制备方法和在制备抗癌药物中的应用: CN1478792A[P].
LI Qifu.Oyster low molecular active peptide and its preparation method and application in the preparation of anticancer drugs: CN1478792A[P].
[19] 王传幸, 李国英.小分子鱼鳞胶原蛋白肽的制备及其抗氧化性测定[J].食品科技, 2019, 44(4): 141-145.
WANG Chuanxing, LI Guoying.Preparation and antioxidant activities measurement of scales collagen peptide with low molecular weight[J].Food Science and Technology, 2019, 44(4): 141-145.
[20] 阮晓慧, 韩军岐, 张润光, 等.食源性生物活性肽制备工艺、功能特性及应用研究进展[J].食品与发酵工业, 2016, 42(6): 248-253.RUAN Xiaohui, HAN Junqi, ZHANG Runguang, et al.Progress in the preparation, functional properties and applications of food-derived bioactive peptides[J].Food and Fermentation Industries, 2016, 42(6): 248-253.
[21] DENG Z, LIU Y, WANG J, et al.Antihypertensive effects of two novel angiotensin I-Converting Enzyme (ACE) inhibitory peptides from gracilariopsis lemaneiformis (Rhodophyta) in spontaneously hypertensive rats (SHRs)[J].Marine Drugs, 2018, 16(9): 299.
[22] 丁靖.胡蜂毒肽-M和麦角环肽的合成研究[D].成都: 西南交通大学, 2019.
DING Jing.Study on the synthesis of mastoparan-M and ergopeptide[D].Chengdu: Southwest Jiaotong University, 2019.
[23] 余楠楠, 陈琛.生物活性肽功能及制备技术研究进展[J].中国酿造, 2018, 37(9): 17-21.
YU Nannan, CHEN Chen.Research progress of bioactive peptide function and preparation technology[J].China Brewing, 2018, 37(9): 17-21.
[24] WANG Y K, HE H L, CHEN X L, et al.Production of novel angiotensin I-converting enzyme inhibitory peptides by fermentation of marine shrimp Acetes chinensis with Lactobacillus fermentum SM 605[J].Appl Microbiol Biotechnol, 2008, 79(5): 785-791.
[25] ONO S, HOSOKAWA M, MIYASHITA K, et al.Inhibition properties of dipeptides from salmon muscle hydrolysate on angiotensin I-converting enzyme[J].International Journal of Food Science & Technology, 2006, 41(4): 383-386.
[26] ABDELHEDI O, NASRI M.Basic and recent advances in marine antihypertensive peptides: Production, structure-activity relationship and bioavailability[J].Trends in Food Science & Technology, 2019, 88: 543-557.
[27] ABDELHEDI O, NASRI M.Basic and recent advances in marine antihypertensive peptides: Production, structure-activity relationship and bioavailability[J].Trends in Food Science & Technology, 2019, 88: 543-557.
[28] SAADI S, SAARI N, ANWAR F, et al.Recent advances in food biopeptides: Production, biological functionalities and therapeutic applications[J].Biotechnology Advances, 2015, 33(1): 80-116.
[29] SIRTORI C R, GALLI C, ANDERSON J W, et al.Nutritional and nutraceutical approaches to dyslipidemia and atherosclerosis prevention: Focus on dietary proteins[J].Atherosclerosis, 2009, 203(1): 8-17.
[30] HAYES M, MORA L, HUSSEY K, et al.Boarfish protein recovery using the pH-shift process and generation of protein hydrolysates with ACE-I and antihypertensive bioactivities in spontaneously hypertensive rats[J].Innovative Food Science & Emerging Technologies, 2016, 37: 253-260.
[31] SUN L, WU S, ZHOU L, et al.Separation and characterization of angiotensin I converting enzyme (ACE) inhibitory peptides from saurida elongata proteins hydrolysate by IMAC-Ni(2)[J].Mar Drugs, 2017, 15(2): 29.
[32] SABEENA F K, ANDERSEN L L, OTTE J, et al.Antioxidant activity of cod (Gadus morhua) protein hydrolysates: Fractionation and characterisation of peptide fractions[J].Food Chem, 2016, 204: 409-419.
[33] FAHMI A, MORIMURA S, GUO H C, et al.Production of angiotensin I converting enzyme inhibitory peptides from sea bream scales[J].Process Biochemistry, 2004, 39(10): 1195-1200.
[34] LAN X, LIAO D, WU S, et al.Rapid purification and characterization of angiotensin converting enzyme inhibitory peptides from lizard fish protein hydrolysates with magnetic affinity separation[J].Food Chemistry, 2015, 182: 136-142.
[35] WU S, FENG X, LAN X, et al.Purification and identification of Angiotensin-I Converting Enzyme (ACE) inhibitory peptide from lizard fish (Saurida elongata) hydrolysate[J].Journal of Functional Foods, 2015, 13: 295-299.
[36] BYUN H, KIM S.Purification and characterization of angiotensin I converting enzyme (ACE) inhibitory peptides from Alaska pollack (Theragra chalcogramma) skin[J].Process Biochemistry, 2001, 36(12): 1155-1162.
[37] NGO D, VO T, RYU B, et al.Angiotensin- I- converting enzyme (ACE) inhibitory peptides from Pacific cod skin gelatin using ultrafiltration membranes[J].Process Biochemistry, 2016, 51(10): 1622-1628.
[38] ZHAO Y, LI B, DONG S, et al.A novel ACE inhibitory peptide isolated from Acaudina molpadioidea hydrolysate[J].Peptides, 2009, 30(6): 1028-1033.
[39] JE J, KIM H, LEE H, et al.Low-molecular weight peptides isolated from seahorse () improve vasodilation via inhibition of angiotensin- converting enzyme in vivo and in vitro[J].Process Biochemistry, 2020, 95: 30-35.
[40] ZHENG Y, ZHANG Y, SAN S.Efficacy of a novel ACE-Inhibitory peptide from sargassum maclurei in hypertension and reduction of intracellular endothelin- 1[J].Nutrients, 2020, 12(3): 653.
[41] 胡晓, 李来好, 杨贤庆, 等.一种罗非鱼钙离子结合肽的制备方法与应用: CN112210579A[P].
HU Xiao, LI Laihao, YANG Xianqing, et al.Preparation method and application of tilapia calcium ion binding peptide: CN112210579A[P].
[42] SUN N, WU H, DU M, et al.Food protein-derived calcium chelating peptides: A review[J].Trends in Food Science & Technology, 2016, 58: 140-148.
[43] WALTERS M, ESFANDI R, TSOPMO A.Potential of food hydrolyzed proteins and peptides to chelate iron or calcium and enhance their absorption[J].Foods, 2018, 7(10): 172.
[44] CHEN Q, GUO L, DU F, et al.The chelating peptide (GPAGPHGPPG) derived from Alaska pollock skin enhances calcium, zinc and iron transport in Caco‐2 cells[J].International Journal of Food Science & Technology, 2017, 52(5): 1283-1290.
[45] GUO L, HARNEDY P A, O’KEEFFE M B, et al.Fractionation and identification of Alaska pollock skin collagen-derived mineral chelating peptides[J].Food Chemistry, 2015, 173(Apr.15): 536-542.
[46] HUANG G, REN L, JIANG J.Purification of a histidine-containing peptide with calcium binding activity from shrimp processing byproducts hydrolysate[J].European Food Research and Technology, 2011, 232(2): 281-287.
[47] ZHANG K, LI J, HOU H, et al.Purification and characterization of a novel calcium-biding decapeptide from Pacific cod () bone: Molecular properties and calcium chelating modes[J].Journal of Functional Foods, 2019, 52: 670-679.
[48] CAI X, LIN J, WANG S.Novel Peptide with specific calcium-binding capacity from schizochytrium sp.protein hydrolysates and calcium bioavailability in Caco-2 Cells[J].Marine Drugs, 2017, 15(1): 3.
[49] JUNG W, KIM S.Calcium-binding peptide derived from pepsinolytic hydrolysates of hoki (Johnius belengerii) frame[J].European Food Research and Technology, 2007, 224(6): 763-767.
[50] INDUMATHI P, MEHTA A.A novel anticoagulant peptide from the Nori hydrolysate[J].Journal of Functional Foods, 2016, 20: 606-617.
[51] PIERSCHBACHER M D, RUOSLAHTI E.Cell attachment activity of fibronectin can be duplicated by small synthetic fragments of the molecule[J].Nature, 1984, 309(5963): 30-33.
[52] 夏梦媛, 王俐, 王跃虎.胡椒属植物抗血小板和抗血栓活性研究进展[J].天然产物研究与开发, 2016, 28(10): 1676-1685.
XIA Mengyuan, WANG Li, WANG Yuehu.Antiplatelet and antithrombotic activities of piper plants[J].Natural Product Research and Development, 2016, 28(10): 1676- 1685.
[53] CIAN R E, GARZÓN A G, ANCONA D B, et al.Hydrolyzates from Pyropia columbina seaweed have antiplatelet aggregation, antioxidant and ACE I inhibitory peptides which maintain bioactivity after simulated gastrointestinal digestion[J].LWT - Food Science and Technology, 2015, 64(2): 881-888.
[54] QIAO M, TU M, CHEN H, et al.Identification and In silico prediction of anticoagulant peptides from the enzymatic hydrolysates of mytilus edulis proteins[J].International journal of molecular sciences, 2018, 19(7): 2100.
[55] 闵文剑, 齐炼文, 杨鹏.新型降血脂药物的研究进展[J].中国新药杂志, 2019, 28(19): 2367-2374.
MIN Wenjian, QI Lianwen, YANG Peng.Advances in studies on novel hypolipidemic drugs[J].Chinese Journal of New Drugs, 2019, 28(19): 2367-2374.
[56] 赵慧, 肖正, 陈紫红, 等.海洋生物活性物质降血脂作用研究进展[J].农产品加工, 2017, 1: 92-96.
ZHAO Hui, XIAO Zheng, CHEN Zihong, et al.Research Progress on the hypolipidemic effect of marine bioactive substances[J].Farm Products Processing, 2017, 1: 92-96.
[57] 江锟, 徐志宏, 魏振承, 等.鲈鱼活性肽的制备工艺及其体外降血脂活性研究[J].广东农业科学, 2013, 40(9): 99-102.
JIANG Kun, XU Zhihong, WEI Zhencheng, et al.Preparation of active peptides from marine bassand their hypolipidemic activity in vitro[J].Guangdong Agricultural Sciences, 2013, 40(9): 99-102.
[58] 朱晓连, 陈华, 蔡冰娜, 等.具有结合胆酸盐作用卵形鲳鲹蛋白酶解物的制备和分子量分布研究[J].南方水产科学, 2017, 13(2): 101-108.
ZHU Xiaolian, CHEN Hua, CAI Bingna, et al.Production of bile acid salts binding hydrolysate fromand its molecular weight distribution[J].South China Fisheries Science, 2017, 13(2): 101-108.
[59] BEN KHALED H, GHLISSI Z, CHTOUROU Y, et al.Effect of protein hydrolysates from sardinelle (Sardinella aurita) on the oxidative status and blood lipid profile of cholesterol-fed rats[J].Food Research International, 2012, 45(1): 60-68.
[60] ZHU C, LI G, PENG H, et al.Treatment with marine collagen peptides modulates glucose and lipid metabolism in Chinese patients with type 2 diabetes mellitus[J].Applied Physiology, Nutrition, and Metabolism, 2010, 35(6): 797-804.
[61] TABARZAD M, ATABAKI V, HOSSEINABADI T.Anti-inflammatory Activity of Bioactive Compounds from Microalgae and Cyanobacteria by Focusing on the Mechanisms of Action[J].Molecular Biology Reports, 2020, 47(8): 6193-6205.
[62] VANE J, BOTTING R.Inflammation and the mechanism of action of anti-inflammatory drugs[J].The FASEB Journal, 1987, 1(2): 89-96.
[63] GUHA S, MAJUMDER K.Structural-features of food- derived bioactive peptides with anti-inflammatory activity: A brief review[J].Journal of Food Biochemistry, 2019, 43(1): e12531.
[64] CHENG M, WANG H, HSU K, et al.Anti-inflammatory peptides from enzymatic hydrolysates of tuna cooking juice[J].Food and Agricultural Immunology, 2015, 26(6): 770-781.
[65] QIAN B, ZHAO X, YANG Y, et al.Antioxidant and anti‐inflammatory peptide fraction from oyster soft tissue by enzymatic hydrolysis[J].Food science & nutrition, 2020, 8(7): 3947-3956.
[66] SUDHAKAR S, NAZEER R A.Structural characterization of an Indian squid antioxidant peptide and its protective effect against cellular reactive oxygen species[J].Journal of Functional Foods, 2015, 14: 502- 512.
[67] UMAYAPARVATHI S, MEENAKSHI S, VIMALRAJ V, et al.Isolation and structural elucidation of antioxidant peptides from oyster (Saccostrea cucullata) protein hydrolysate[J].Protein Pept Lett, 2014, 21(10): 1073- 1083.
[68] 冯建慧, 曹爱玲, 蔡路昀, 等.鱼类副产物中抗氧化肽及活性机理研究进展[J].食品工业科技, 2016, 37(15): 365-369, 374.
FENG Jianhui, CAO Ailing, CAI Luyun, et al.Research progress of antioxidant peptides from fish byproduct and its active mechanism[J].Science and Technology of Food Industry, 2016, 37(15): 365-369, 374.
[69] ZHAO G X, YANG X R, WANG Y M, et al.Antioxidant peptides from the protein hydrolysate of spanish mackerel () muscle by in vitro gastrointestinal digestion and their in vitro activities[J].Marine Drugs, 2019, 17(9): 531.
[70] WONG F, XIAO J, ONG M G, et al.Identification and characterization of antioxidant peptides from hydrolysate of blue-spotted stingray and their stability against thermal, pH and simulated gastrointestinal digestion treatments[J].Food Chemistry, 2019, 271: 614-622.
[71] ZHENG L, YU H, WEI H, et al.Antioxidative peptides of hydrolysate prepared from fish skin gelatin using ginger protease activate antioxidant response element- mediated gene transcription in IPEC-J2 cells[J].Journal of Functional Foods, 2018, 51: 104-112.
Function, preparation technology, and mechanism of marine biological active peptides
YANG Gui-lan1, 2, 3, QIN Song1, 3, LI Wen-jun1, 3, LI Ya4
(1.Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China; 2.School of Pharmacy, Binzhou Medical University, Yantai 264005, China; 3.Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China; 4.Yantai Jiahui Marine Biological Technology Co., Ltd, Yantai 264003, China)
marine bioactive peptides; preparation methods; functional activity; mechanism
Many marine bioactive peptides have application prospects in the fields of functional food and medicine due to their various biological activities, such as antihypertensive, anti-inflammatory, antioxidation, and antiplatelet activities.This review highlights the overview on preparation methods, functional activity, and mechanism of marine biotic active peptide, and provides some references for their further development and utilization.
Sep.23, 2020
[National Key Research and Development Program of China, No.2018YFD0901102; Marine Economy Innovation Development Demonstration Project, No.YHCX-SW-L-201705; Major Science and Technology Innovation Project of Shandong Province (China), No.2019JZZY011103]
Q51
A
1000-3096(2021)10-0123-10
10.11759/hykx20200923003
2020-09-23;
2021-04-27
国家重点研究发展计划(2018YFD0901102); “十三五”海洋经济创新发展示范项目烟台市创新型海洋医用材料产业孵化聚集创新与示范资助项目(YHCX-SW-Y-201701); 天然海洋胶原基可降解、可诱导、可修复系列生物医用材料的研究与开发(2019JZZY011103)
杨贵兰(1995—), 女, 山东滕州人, 硕士研究生, 研究方向: 海洋生物活性肽的开发与分析, 电话: 17861176003, E-mail: yangguilan0212@163.com; 李文军, 通信作者, 副研究员, 研究方向: 海岸带功能蛋白分子结构、功能及应用, 电话: 15605350917, E-mail: wjli@yic.ac.cn; 李亚, 通信作者, 研究方向: 海洋生物活性肽产品的开发与研究, E-mail: biotechly@163.com
(本文编辑: 康亦兼)

