柠檬酸和枯草芽胞杆菌协同强化万寿菊提取土壤中铀
马 静,庞彩燕,丁志超,谭国炽,石 涛,孙 静,李广悦
(南华大学 资源环境与安全工程学院, 湖南 衡阳 421001)
0 引 言
铀的植物提取是将土壤中的铀离子吸收、转移并贮存于植物体内,并通过收获和处理植物,实现土壤的修复和资源的回收。植物提取技术具有保持土壤肥力[1]、增加土壤微生物多样性[2]、安全、高效等优点,在提取土壤中铀的方面具有良好的应用前景。
利用植物从土壤中高效提取铀,取决于土壤中铀的生物可利用态、植物对铀的富集性能以及植物生物量。添加螯合剂可以增加土壤中铀的生物可利用态。其中天然低分子有机酸可生物降解,对土壤破坏较小,可与铀形成配合物,从而被植物富集,是理想的天然螯合剂[3]。添加柠檬酸到含铀土壤后,芥菜叶片中的铀积累可以达到2 225 mg/kg[4]。而内生细菌能够直接影响植物生长素及与植物生长代谢功能相关的微生物活性,从而促进植物生长,增加植物的生物量[5]。研究表明,添加枯草芽胞杆菌(Bacillussubtilis)不仅促进植物生长,增加病原体抗性[6],还可以强化植物提取土壤中的重金属[7]。
利用高生物量的菊科景观植物从土壤中提取铀,具有美化环境和净化土壤的双重优势。研究表明,万寿菊具有富集镉的能力,在10 mg/kg、100 mg/kg的镉(Cd)土壤中,富集含量分别达到6.79±0.08 μg/(plant·d)、27.45±0.16 μg/(plant·d)[8]。在含铜[9]、铅[10]等土壤中,万寿菊也表现出良好的吸收和积累效果。但目前在铀的提取中仍未报道。
为了研究菊科景观植物对土壤中铀的提取效果,本文以芙蓉菊和万寿菊为供试植物,研究了其提取土壤中铀的效果,以及柠檬酸和枯草芽胞杆菌对两种植物的协同强化作用,以期为菊科植物提取土壤中铀提供借鉴。
1 材料和方法
1.1 实验材料
1.1.1 供试土壤
供试土壤按铀矿石∶土壤=1∶4的体积比混合(铀矿石取自江西某矿山,土壤取自南华大学园内土)。采用圆锥四分法进行取样,根据GB/T13070—1991标准测定铀品位。表1为含铀土壤的理化性质。

表1 含铀土壤的理化性质Table 1 Physiocochemical properties of uranium-containing soil
1.1.2 供试植物
供试植物为万寿菊、芙蓉菊,其幼苗购自河南商丘某花店。
1.1.3 供试菌种
供试菌种为枯草芽胞杆菌(Bacillussubtilis,CICC 10155),购自中国工业微生物菌种保藏管理中心。
1.1.4 培养基
1)液体培养基:5.0 g/L蛋白胨,3.0 g/L牛肉浸取物,5.0 g/L NaCl,5 mg/L MnSO4·H2O,调节pH值为7.0。
2)斜面培养基:5.0 g/L蛋白胨,3.0 g/L牛肉浸取物,5.0 g/L NaCl,15.0 g/L琼脂,5 mg/L MnSO4·H2O,调节pH值为7.0。
1.1.5 柠檬酸
柠檬酸购于湖南省衡阳市化学试剂厂。
1.2 实验方法
1.2.1 菌悬液的制备
在超净工作台上,挑取一环斜面培养基上的B.subtilis于20 mL液体培养基中,置于30 ℃恒温培养。静置培养3 d后,加入液体培养基调整菌悬液浓度为1×109cfu/mL,作为备用菌悬液。
1.2.2 柠檬酸及B.subtilis的添加方式
1)添加柠檬酸到土壤中:将1.5 mol/L的柠檬酸均匀的添加到距离土壤表面20 cm的土壤层中;
2)添加B.subtilis到土壤中:将培养好的B.subtilis均匀的倾倒于植物根部周围距离土壤表面20 cm的土壤层中;
3)注射B.subtilis到植物根部:利用注射器将培养好的B.subtilis注入到植物根部。
1.2.3 实验处理与分组
芙蓉菊和万寿菊幼苗种植于4 kg的供试土壤中,置于湿度约为60%、温度为25~30 ℃的温室大棚中培养。每种植物设1个对照组(CK1、CK2)和3个处理组。3个处理组分别为:单独添加柠檬酸组(H1、D1)、同时添加柠檬酸与B.subtilis到土壤组(H2、D2)、添加柠檬酸到土壤并注射B.subtilis到植物根部组(H3、D3)。每个处理组含4株植物,共32株植物,实验处理与分组详见表2。在植物生长过程中,采用补光灯补充光照以确保植物受光均匀;按需浇水以确保植物土壤保持湿润;每隔7 d喷洒一次营养液以确保植物生长所需的养分充足。
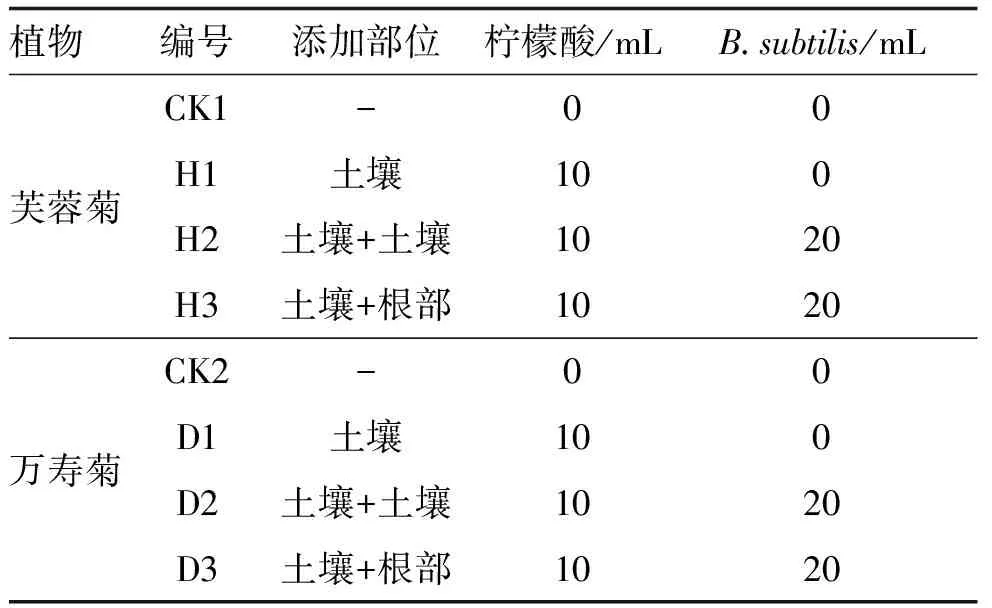
表2 实验分组与处理Table 2 Experimental grouping and treatment methods
1.2.4 植物样品处理
植物生长75 d后,分别收割地上部分和地下部分,首先利用自来水冲洗掉表面的灰尘、土壤等杂质,然后浸泡于20 mmol/L的乙二胺四乙酸二钠中20 min,再用超纯水冲洗4~5遍。
1.3 分析方法
1.3.1 植物生物量测定
将洗净的植物用吸水纸吸干表面水分,用电子天平称得其鲜重;然后将植物置于105 ℃的烘箱中杀青0.5 h,调节温度至85 ℃烘干至恒重,冷却后用电子天平称得其干重;准确称量烘干后的植物于200 mL坩埚中,放入马弗炉,在550 ℃下灰化6 h,冷却至室温后研磨,称其灰重[11-13]。
1.3.2 植物样品铀浓度测定
灰化后的植物样品采用王水∶高氯酸=2∶1(体积比)的消解液进行消解。加热3%~5%的稀硝酸至60 ℃以上,将消解后的样品用热的稀硝酸冲洗过滤,于25 mL容量瓶中定容,然后将待测液置于4 ℃冰箱中保藏待测。根据GB/T11220.1—1989的标准测定铀浓度。
1.3.3 植物叶片中酶含量的测定
1)过氧化物酶(peroxidase,POD)试剂盒购于南京建成生物工程研究所,以测定植物叶片中POD活性;
2)超氧化物歧化酶(superoxide dismutase,SOD)活性试剂盒购于生工生物工程(上海)股份有限公司,以测定植物叶片中SOD活性。
1.3.4 植物叶片中丙二醛(MDA)含量的测定
采用硫代巴比妥酸法[14]测定植物叶片中丙二醛(malondialdehyde,MDA)含量。
1.4 实验数据分析方法
采用SPSS 24软件进行数据的单因素(Analysis of Variance,ANOVA)ANOVA检验和方差分析(P<0.05),Origin 2018软件进行绘图。
2 结果与讨论
2.1 不同处理方式对植物生物量的影响
不同处理方式对芙蓉菊和万寿菊生物量的影响分别见表3和表4。

表3 不同处理方式下芙蓉菊的生物量Table 3 Biomass of Crossostephium chinense (L.) Makino under different treatments
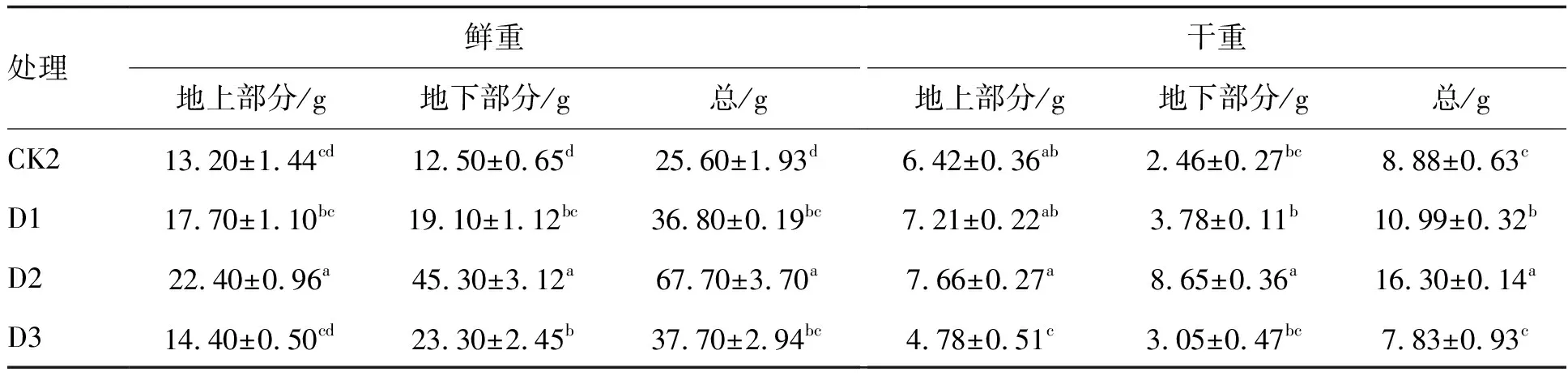
表4 不同处理方式下万寿菊的生物量Table 4 Biomass of Tagetes erecta L. under different treatments
对于芙蓉菊,与对照组CK1相比,H1组的总鲜重和总干重均显著增大。H2组的总鲜重与总干重也比CK1组显著增大(P<0.05),但其总干重与H1组基本一致,说明添加柠檬酸并加入B.subtilis到土壤中对芙蓉菊的生长没有显著的作用。H3组总干重比CK1组没有显著性增加,且显著低于H1和H2组,说明注射B.subtilis到芙蓉菊根部,反而对芙蓉菊生长产生了不利的影响。
对于万寿菊,与对照组CK2相比,D1组的总鲜重和总干重均显著增大(P<0.05)。D2组的总鲜重与总干重比CK2组和D1组均显著增大,D2组的总鲜重比CK2组和D1组分别增大了164.45%和83.97%,D2组的总干重比CK2组和D1组分别增大了83.56%和48.32%(P<0.05),说明添加柠檬酸并加入B.subtilis到土壤中对芙蓉菊的生长具有协同作用。D3组的总干重比CK2组略有降低,且显著低于D1组和D2组,说明添加柠檬酸并注射B.subtilis到万寿菊根部,不但没有协同作用,且抑制了万寿菊的生长。
在铀的胁迫环境下,柠檬酸能够与铀离子螯合,降低毒性,从而促进植物的生长,提高生物量[15]。U.Najeeb[16]等报道,柠檬酸添加到含锰的土壤中使红豆的地上干重和地下干重分别增加了5.09%和17.22%。B.subtilis是根际促生细菌,可促进植物生长。在含铀水中添加B.subtilis后的凤眼莲的根系与茎叶的干重分别增加了34.80%和22.00%[17]。本研究表明,添加柠檬酸并注射B.subtilis到土壤中时,两者对万寿菊的生长具有协同作用,但对芙蓉菊协同作用不明显,这可能是由于不同植物对B.subtilis的适应性不同造成的。此外,添加柠檬酸并注射B.subtilis到植物根部时,两者不但没有协同作用,反而不利于芙蓉菊和万寿菊生长,这可能是由于施加于根部造成植物体内菌液浓度过高所致。
2.2 植物叶片中的生理指标
2.2.1 丙二醛(MDA)含量
不同处理方式下芙蓉菊和万寿菊MDA含量的影响如图1所示。
植物在逆境胁迫下会产生大量的自由基,导致膜脂过氧化产生MDA。因此,MDA代表了膜脂的过氧化程度,也间接反应了自由基的含量[18]。图1为不同处理方式对植物叶片MDA含量的影响。在三种处理方式下,芙蓉菊和万寿菊叶片中的MDA含量均比对照组显著降低,说明单独添加柠檬酸、或者同时添加柠檬酸和B.Subtilis都降低了铀对两种植物的胁迫,这与其生物量都提高的结果相一致。对于芙蓉菊,添加柠檬酸并加入B.subtilis到土壤的H2组,MDA含量显著性降低,达到了(0.96±0.07) μmol/L,说明两者具有协同作用;而对于万寿菊,结果却相反,这可能是因为D2组的铀含量升高导致胁迫加大,因而其MDA含量高于其他处理组[19]。

图1 不同处理方式下的MDA含量Fig.1 Effect on MDA contents of plants leaves under different treatments 注:不同字母,表示的是组间具有显著性差异(P<0.05)
2.2.2 超氧化物歧化酶(SOD)活性
不同处理方式下芙蓉菊和万寿菊SOD活性的影响如图2所示。
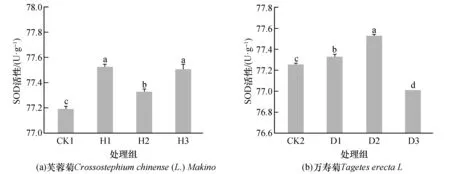
图2 不同处理方式对植物SOD活性的影响Fig.2 Effect on SOD activity of plants leaves under different treatments 注:不同字母,表示的是组间具有显著性差异(P<0.05)
SOD可清除植物体内的自由基和过氧化物,其反应了植物在环境胁迫下的抗氧化能力[20]。图2为不同处理方式对植物SOD活性的影响。在三种处理方式下,芙蓉菊的SOD活性均比对照组显著提高,其中H1组和H3组的增加幅度基本一致,H2组的增加幅度最小。对于万寿菊,D1组和D2组的SOD活性比对照组显著增加,但D3组却显著下降。每种处理方式下,植物叶片的SOD活性结果与MDA含量结果相一致,呈正相关,这说明铀胁迫产生的自由基诱导了抗氧化酶活性。
2.2.3 过氧化物酶(POD)活性
不同处理方式下芙蓉菊和万寿菊POD活性的影响如图3所示。
POD是植物抗氧化系统中一种重要的酶,其活性与植物抗逆境呈正相关[21]。图3为不同处理方式对植物POD活性的影响。结果表明,三种不同处理方式下,芙蓉菊的POD活性均略有提高,其中H2组的POD活性最大,但三者无显著性差异。万寿菊在三种处理方式下,D1组和D3组的POD活性均高于对照组,而D2组略有降低。杨瑞丽等[22]研究结果表明柠檬酸能够提高黑麦草中POD活性,肖亚静等[23]研究结果表明B.Subtilis菌株21使玉米的POD活性升高。本研究表明,单独添加柠檬酸可增加芙蓉菊和万寿菊的POD活性,提高两种植物抗铀的胁迫。添加柠檬酸并注射B.subtilis到植物根部时,也可增加两种植物的POD活性。而添加柠檬酸并加入B.Subtilis到土壤时,两种植物呈现相反的结果,这可能由于D2组的植物体内铀含量明显高于其他组而导致其抗胁迫有所减低。

图3 不同处理方式对植物POD活性的影响Fig.3 Effect on POD activity of plants leaves under different treatments 注:不同字母,表示的是组间具有显著性差异(P<0.05)
2.3 不同处理方式对植物提取铀的影响
不同处理方式下芙蓉菊和万寿菊富集铀的结果分别见表5和表6。
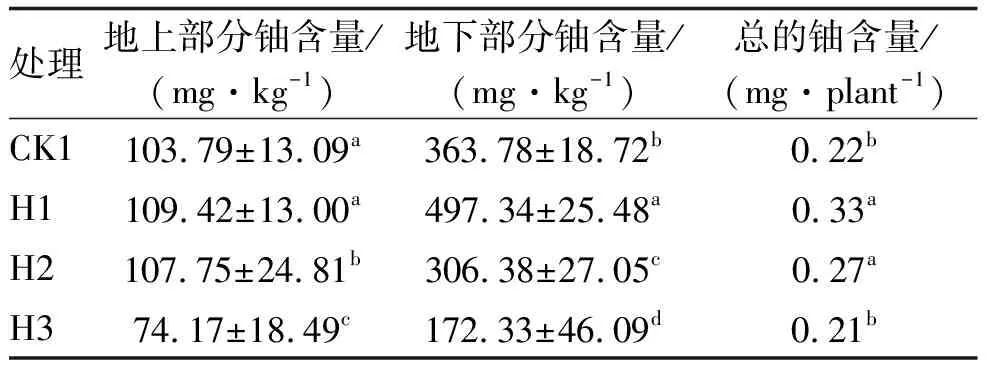
表5 不同处理方式下芙蓉菊富集铀含量Table 5 Enrichment of uranium by Crossostephium chinense (L.) Makino under different treatments

表6 不同处理方式下万寿菊富集铀含量
对于芙蓉菊,与对照组CK1相比,H1组的铀富集总量略有增加,但其地上和地下部分铀含量增加不明显,其铀富集总量的增加是由于生物量的增加导致的。H2组的地上部分和铀富集总量比CK1组也略有增加,但与H1组无显著性差异,且其地下部分铀含量比CK1组和H1组均显著下降,分别为107.75±24.81 mg/kg和0.27 mg/plant,说明添加柠檬酸并加入B.subtilis到土壤中,对强化芙蓉菊富集铀没有协同作用。H3组的铀富集总量与CK1组基本一致,低于H1组和H2组,这是由于将B.subtilis注射到芙蓉菊根部无法显著性促进芙蓉菊生长所致。
对于万寿菊,与对照组CK2相比,D1组的铀富集总量显著增加,且其地上部分铀含量明显增大,说明柠檬酸提高了铀的转运能力。D2组的铀富集总量比CK2组和D1组均明显增加,分别提高了207.41%和76.60%,但其地上部分较D1组显著下降,其对铀的富集协同作用是由于植物生物量增加引起的。D3组与D1组的铀富集总量基本一致,但显著低于D2组,说明将B.subtilis添加到万寿菊根部时,不能促进植物对铀的富集。
E.Sevostianova等[24]研究了肥料和柠檬酸处理后的不同植物富集铀的效果,结果表明,柠檬酸促进了地肤、向日葵、和甜玉米对铀的吸收,使得地上部分分别增加138.46%、204.17%和26.09%,提高了铀的转运能力。W.Liu等[25]表明B.subtilis促进了土壤中的镉含量,且能够与纳米羟基磷灰石协同强化油菜提取含镉土壤中的镉。本研究表明,同时添加柠檬酸和B.subtilis到土壤中,对万寿菊提取土壤中的铀具有显著的协同强化作用,但对于芙蓉菊无协同强化作用,这可能与植物种类对B.subtilis的适应性有关。
3 结 论
1)同时添加柠檬酸和B.subtilis到土壤中,两者可协同促进万寿菊的生长,生物量提高了83.56%,但对芙蓉菊效果不明显;添加柠檬酸并注射B.subtilis到植物根部时,反而对芙蓉菊和万寿菊的生长产生了不利的影响。
2)同时添加柠檬酸和B.subtilis到土壤中,两者对万寿菊富集铀具有协同作用,铀富集总量提高了207.41%,但对芙蓉菊协同效果不明显;添加柠檬酸并注射B.subtilis到植物根部时,对芙蓉菊和万寿菊富集铀均无协同作用。
3)柠檬酸和B.Subtilis可增加芙蓉菊和万寿菊的抗氧化性,提高其对铀的耐受性,使其MDA含量显著降低。铀胁迫产生的自由基诱导了植物的抗氧化酶活性,植物的SOD活性与MDA含量呈正相关。在铀含量较低时,柠檬酸和B.Subtilis可使两种植物的POD活性增高,但高浓度的铀胁迫下POD活性下降。

