盐酸可乐定人工抗原及其鼠源多抗的制备
王 耀,曹金博,曹夕丹,李铁梅,邢云瑞,孟继秋,,庞杏豪,,孙亚宁,陈秀金,李兆周,胡骁飞
(1.河南科技大学 食品与生物工程学院,河南洛阳 471003;2.河南省农业科学院 动物免疫学重点实验室,郑州 450002;3.西北农林科技大学 动物医学院,陕西杨凌 712100;4.中国检验检疫科学研究院,北京 100176)
盐酸可乐定(Clonidine hydrochloride,CLO)属于α2肾上腺受体激动剂,化学名为[2-(2,6-二氯苯基)亚氨基]咪唑啉,其结构式如图1-A所示,临床上主要用于治疗高血压、偏头痛、绝经期潮热、痛经等病症,将其与中枢神经抑制药合用,可产生协同抑制作用,与降压药合用可加强降压作用[1-3]。CLO为咪唑啉的衍生物,可刺激垂体分泌生长激素,将其添加在禽畜饲料或者饮水中可在很大程度上促进禽畜生长,并改善营养代谢途径,重新分配脂肪肌肉比例,从而起到提高瘦肉率的作用[4-5],被视为一种新型的瘦肉精类药物。有研究表明,CLO具有极大的毒副作用,人食用含CLO残留的动物源性食品后,食品中残留的CLO将在体内大量蓄积,严重危害人身健康,其导致的中毒症状主要包括口干、嗜睡、头痛、恶心、呕吐、便秘、心悸、精神抑郁等[6-7]。因此,原农业部1519号公告中严令禁止在养殖过程中添加CLO。但出于经济利益驱使,目前仍有一些在家畜养殖中违法使用CLO的现象。因此,建立CLO残留的简便、快速、准确、灵敏和高通量的检测方法尤为重要,对保障动物源性食品安全具有重要的现实意义。
目前关于CLO残留的检测方法主要包括高效液相色谱法(High performance liquid chromatography,HPLC)[8]、气相色谱法(Gas Chromatography,GC)[9]、高效液相色谱—串联质谱法(High performance liquid chromatography tandem mass spectrometry,UPLC-MS)[10]等,此类检测方法虽然检测精确度较高,假阳性和假阴性率较低,但需要的仪器较为昂贵,需要专业培训的操作人员和一定的图谱分析能力,同时样品的前处理过程较为复杂,不利于运输中易受损样品和现场高通量样品的快速筛查[11]。近年来,基于抗原抗体特异性结合的免疫分析检测技术发展迅速,在农兽药残留、病原检测等领域广泛应用。其中经典的酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)不仅操作简单、快速,而且具有较高的灵敏度和准确度,可克服色谱检测技术的部分应用局限[12-14]。基于免疫层析技术和胶体金示踪技术发展起来的胶体金免疫层析试纸(Colloidal gold immunochromatographic strip,ICS),可对样品实现5~10 min肉眼可见的快速检测,特别适合基层对样品的高通量快速筛查[15-17]。CLO分子质量较小,无免疫原性,需通过与蛋白载体偶联形成半抗原—载体复合物才能刺激机体产生相应的免疫应答反应,但CLO分子结构上无可用于偶联载体的活泼基团,无法与载体蛋白偶联。ACLO为CLO的衍生物(图1-B),基于结构类似物的交叉反应性原理,可以选择ACLO为半抗原,利用其分子结构苯环上活泼的氨基基团,采用重氮化法合成CLO人工抗原。本研究以ACLO为半抗原,利用其苯环4位上的氨基,采用重氮化法将氨基重氮化与蛋白载体偶联,合成免疫原性良好的CLO人工抗原,免疫BALB/c小鼠后,获得免疫学特性较好的CLO鼠源多抗,为制备高亲和力CLO单克隆抗体以及建立其免疫学检测方法奠定良好的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂 ACLO(纯度≥98%),购自中国食品药品鉴定研究所;CLO、苯乙醇胺A(Phenylethanolamine A,PA)、巴氯芬(Baclofen,BA)、沙丁胺醇(Salbutamol,SAL)、莱克多巴胺(Ractopamine,RAC)、弗氏完全佐剂(Freund’s Adjuvant Complete,FCA)、弗氏不完全佐剂(Freund's Adjuvant Incomplete,FIA)、牛血清白蛋白(Bovine serum albumin,BSA)、鸡卵清蛋白(Ovalbumin,OVA),均为Sigma公司产品;HRP标记的羊抗鼠IgG(Peroxidase-conjugated AffiniPure Goat Anti-Mouse IgG,GaMIgG-HRP)为Jackson ImmunoResearch公司产品;其他试剂均为市售分析级试剂。
1.1.2 溶液 包被液(pH 9.6的0.05 mol/L NaHCO3/Na2CO3缓冲液,CBS);稀释液(pH 7.4的0.01 mol/L磷酸盐缓冲液,PBS);洗涤液[V(PBS)∶V(Tween20)=2×103∶1,PBST];封闭液[V(PBST)∶V(脱脂奶粉)=20∶1];显色液(TMB);终止液(2 mol/L的H2SO4溶液)均由河南省农业科学院动物免疫学重点实验室配制。
1.1.3 仪器 BSA224S型电子天平,德国Sartorius公司;Multiskan FC型酶标仪和UV-5100H型紫外—可见分光光度计,美国Thermo Fisher Scientific公司;Vortex2型振荡器和 T8.10高速均质乳化机,艾卡仪器设备有限公司;SZCL-2型控温磁力搅拌器,巩义市予华仪器有限责任公司;HPX-9052MBE型恒温培养箱,上海博迅实业有限公司;ChemiDocTMXRS+型凝胶成像仪,美国Bio-Rad公司。
1.1.4 试验动物 6周龄SPF级BALB/c小鼠,购自河南省实验动物中心。
1.2 方 法
1.2.1 人工抗原合成 采用重氮化法[18]合成CLO人工抗原,其中免疫原(CLO-BSA)的合成路线图如图2所示。称取3 mg ACLO溶于0.5 mL 0.1 mol/mL的稀盐酸溶液中,向该溶液中逐滴搅拌滴加0.2 mol/mL的NaNO2溶液至用淀粉碘化钾试纸检测变蓝时为止,并用适量100 mg/mL的氨基磺酸溶液终止反应(反应全程0~4 ℃避光)。然后称取2.5 mg BSA溶于1 mL CBS缓冲液中(蛋白液),将上述反应液逐滴搅拌滴加在该蛋白液中,室温避光搅拌反应4 h。最后将反应液转移至洁净透析袋中,4 ℃条件下用PBS搅拌透析3 d。透析结束后,离心去除沉淀得免疫原(CLO-BSA),-20℃保存,备用。包被原(CLO-OVA)制备方法同上。
1.2.2 人工抗原鉴定 紫外扫描鉴定:用PBS缓冲液配置BSA标准品溶液和CLO标准品溶液,使其浓度分别与人工抗原浓度一致。然后利用全波长紫外—可见分光光度计分别对各溶液进行扫描,根据紫外光谱中人工抗原特征吸收峰相比载体蛋白和BSA标准品的变化判断人工抗原偶联效果。
SDS-PAGE鉴定:参照文献[19]配制电泳所需浓缩胶和分离胶,选择的浓缩胶和分离胶体积分数分别为5%和12%,电泳的电压分别为60 V和90 V,上样量为10 μL(含人工抗原5 μg)。考马斯亮蓝染液染色3~4 h,脱色液脱色6 h,用凝胶成像仪拍照,根据蛋白条带位置差异判断偶联效果。
1.2.3 多抗的制备与鉴定 用合成的免疫原(CLO-BSA)免疫4只SPF级6周的龄雌性BALB/c小鼠,采用背部皮下多点注射方式进行免疫。首免为基础免疫,用灭菌PBS稀释CLO-BSA后与FCA等体积混合,用乳化器充分乳化后以每只200 μL(含免疫原30 μg)的剂量免疫小鼠,首免21 d后进行3次加强免疫,每次间隔21 d,其中免疫佐剂使用FIA代替FCA。在第4 次免疫10 d后断尾采血,用PBS稀释100倍,离心去除沉淀后,以包被原(CLO-OVA)包被ELISA板鉴定其免疫学特性。
多抗效价测定:采用间接ELISA方法(i-ELISA)[20]测定多抗效价,具体操作为:首先将包被原CLO-OVA用CBS包被缓冲液稀释后每孔100 μL包被于96孔ELISA板中,在4 ℃条件下包被过夜,然后用PBST洗涤液洗板并甩干液体,最后每孔加入250 μL封闭液在37 ℃条件下封闭1 h,洗板甩干后于4 ℃保存,备用。检测时,取包被好的ELISA板,每孔加入100 μL倍比稀释的多抗,以小鼠阴性血清为阴性对照,PBS为空白对照,在37 ℃条件下孵育15 min;洗板甩干后加入用封闭液稀释1 000倍的HRP标记的羊抗鼠IgG,37 ℃条件下孵育30 min;洗板后每孔加入100 μL显色液(TMB),室温避光显色10 min,最后加100 μL终止液终止反应,用酶标仪读取OD450nm。阳性判定标准为:待测孔OD450nm大于0.2,并大于空白孔OD450nm的2.1倍。以阳性孔最小OD450nm所对应的多抗稀释倍数作为效价。
多抗敏感性鉴定:采用间接竞争ELISA方法(ic-ELISA)[21]鉴定多抗敏感性,具体操作为:取包被好的ELISA板,首先每孔加入100 μL不同浓度梯度的CLO标准品溶液,然后加入一定倍数稀释的多抗(效价测定时OD450nm为1.2左右),在37 ℃条件下孵育15 min。其他操作步骤与多抗效价测定操作相同。以抑制率(B/B0)为纵坐标(其中B为阳性孔的OD450nm,B0为CLO浓度为零时的OD450nm),以CLO浓度的对数值为横坐标,绘制标准抑制曲线,最后根据抑制曲线获得的线性回归方程计算半数抑制质量浓度(Half inhibitory concentration,IC50),并以此来评定多抗的敏感性。
多抗特异性鉴定:选择PA、BA、SAL、RAC等瘦肉精类药物作为竞争物,采用ic-ELISA法测定各竞争物对多抗的IC50。以CLO的IC50与各竞争物的IC50的百分比作为交叉反应率(Cross reactivity,CR%),CR越低,则说明多抗的特异性越强[22]。
1.3 数据处理
对所得的数据利用Excel进行处理并绘图,对分子结构式及合成路线图用ChemDraw Pro 18.0进行绘制。
2 结果与分析
2.1 人工抗原鉴定
2.1.1 紫外扫描鉴定结果 采用重氮化法合成CLO人工抗原,用紫外扫描法鉴定其偶联效果,结果如图3所示。从紫外扫描图谱中可以看出,BSA和OVA在280 nm处左右有明显的特征吸收峰,CLO在225 nm和270 nm处出现特征吸收峰,而合成的人工抗原(CLO-BSA和CLO-OVA)的特征吸收峰相比载体蛋白和CLO均发生明显偏移,特征吸收峰偏移是由于靶标与载体蛋白偶联改变了原有的化学基团并形成了新的基团所致,进而初步证明人工抗原偶联成功。
2.1.2 SDS-PAGE鉴定 采用SDS-PAGE对人工抗原的偶联效果进行进一步鉴定,结果如图4、图5所示。从图中可看出,CLO-BSA电泳条带迁移的位移小于BSA,具拖尾现象,说明其分子质量大于BSA,证明ACLO成功偶联到BSA上;CLO-OVA的电泳条带迁移的位移小于OVA,同样证明ACLO成功偶联到载体蛋白(OVA)上。
2.2 多抗制备及鉴定
2.2.1 多抗效价测定 利用i-ELISA方法测定多抗效价,结果如表1所示。利用免疫抗原免疫的4只小鼠所获得的多抗效价均达到1∶25 600以上,其中4号小鼠多抗效价更高,免疫效果更好。效价测定结果表明,免疫原成功刺激小鼠机体免疫应答,产生相应抗体。

表1 效价测定结果
2.2.2 敏感性鉴定 利用ic-ELISA方法鉴定多抗的敏感性,结果如表2所示。免疫的4只小鼠所获得的多抗均能够特异性识别并结合CLO,CLO对4只小鼠多抗的IC50分别为81.360、7.026、47.474和34.086 ng/mL,其中2号小鼠多抗敏感性最好,其抑制曲线线性回归方程为y=-0.146 8x+0.624 3,R2=0.991(图6),x表示log10CLO质量浓度,y表示抑制率。因此,可选择2号小鼠脾细胞作为细胞融合对象,后期可通过细胞融合及单克隆抗体筛选技术制备单克隆抗体。

表2 间接竞争ELISA鉴定结果
2.2.3 特异性鉴定 选择敏感性最好的2号小鼠多抗,以其他瘦肉精类药物(PA、BA、SAL、RAC)作为竞争物,利用ic-ELISA方法鉴定多抗特异性。特异性鉴定结果如表3所示,多抗与PA、BA、SAL、RAC均不存在交叉反应,具有较高的特异性,在实际样品检测中可有效排除其他瘦肉精类药物的干扰。
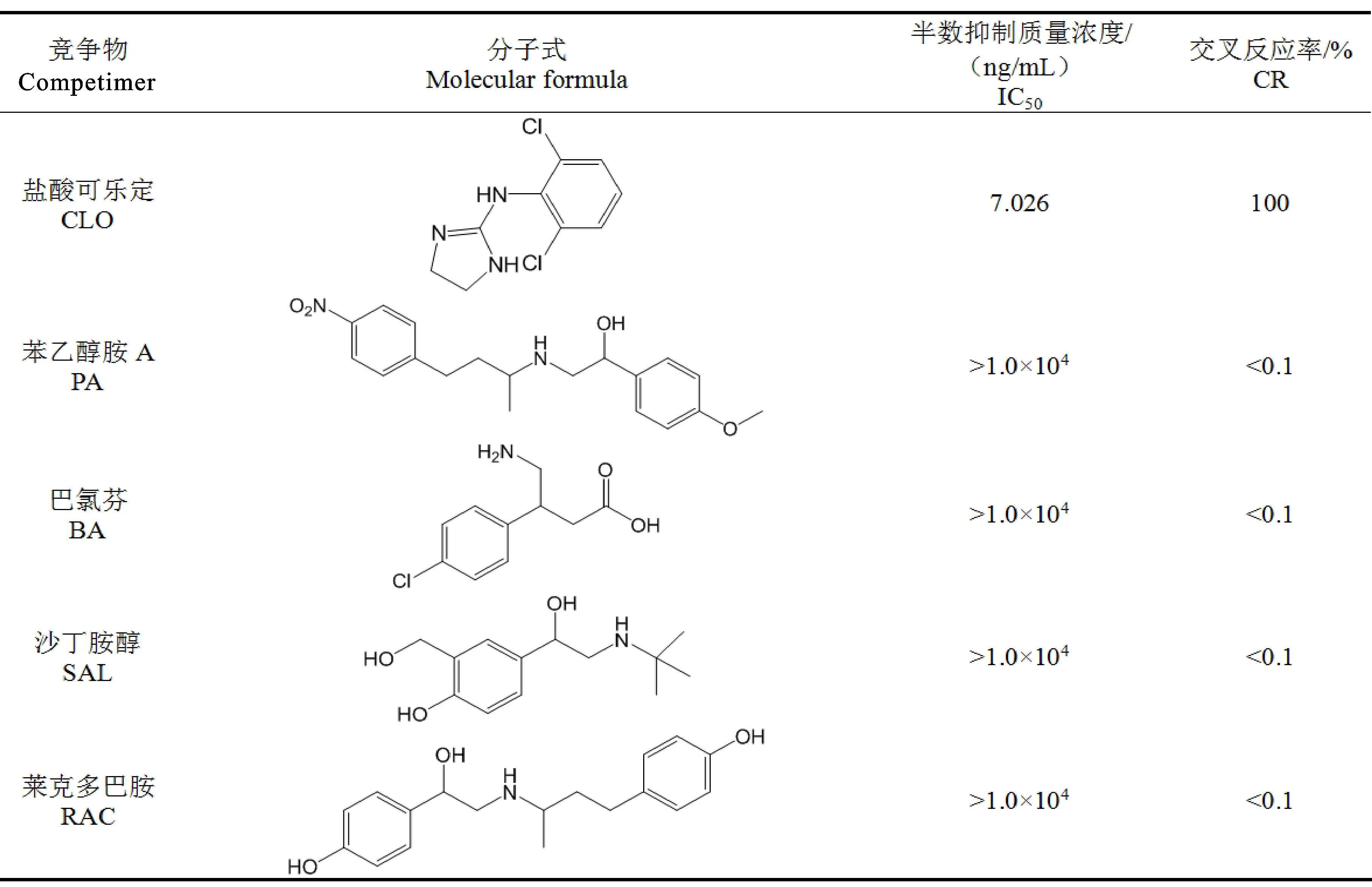
表3 多抗与竞争物的交叉反应
3 讨 论
3.1 人工抗原合成
CLO分子质量较小,属于小分子半抗原,无法直接刺激机体产生免疫应答反应,需要连接到大分子载体上才能获得免疫原性。通常选择溶解性好,且含有大量活泼基团(羧基和氨基)的BSA和OVA作为载体蛋白,而且BSA和OVA同源性较差,选择BSA作为免疫原载体,而OVA作为包被原载体,可有效排除载体蛋白本身对鉴定多抗敏感性和特异性的影响。在选择人工抗原合成方法时,若靶标分子含有羧基、氨基、羰基、羟基、巯基和芳香胺等基团,则可采用碳二亚胺法、戊二醛法、混合酸酐法、重氮化法等方法进行偶联。若半抗原分子结构中无活泼基团,则可先通过分子改造引入活泼基团,或基于结构类似物的交叉反应性原理,选择靶标分子结构类似物为半抗原进行偶联。CLO分子结构上无可用于连接的活泼基团,李丹妮等[2]以CLO的衍生物ACLO为半抗原,利用琥珀酸酐法对苯环4位氨基基团进行改造,引入羧基基团,进而利用碳二亚胺法合成CLO人工抗原。笔者曾采用过此方法,但对半抗原改造时条件不易控制,合成的人工抗原未达到预期的免疫效果。本研究同样从苯环4位的氨基基团出发,采用重氮化法,将氨基基团重氮化后直接偶联到载体蛋白上,通过免疫BALB/c小鼠,获得了针对CLO敏感性高和特异性强的多抗,证明此方法合成的CLO人工抗原具有较好的免疫原性。
3.2 人工抗原质量鉴定
鉴定人工抗原偶联效果,通常采用物理和化学方法,如紫外扫描、SDS-PAGE、红外扫描、质谱鉴定等。红外扫描和质谱鉴定可准确分析分子基团的变化,但操作较为繁琐,仪器较为昂贵。紫外扫描和SDS-PAGE鉴定方法虽然操作简单,但准确度不如红外扫描和质谱鉴定。物理和化学鉴定方法仅能初步鉴定人工抗原的偶联效果,笔者在采用琥珀酸酐法和碳二亚胺法合成CLO人工抗原时,采用紫外扫描和SDS-PAGE均鉴定CLO偶联到载体蛋白上,但免疫小鼠后获得的多抗血清虽然效价很高,但并不能特异性的识别CLO,原因可能如下:CLO半抗原在人工抗原偶联过程中,决定其免疫原性的抗原决定簇的结构发生了改变,也就意味着免疫小鼠后产生的抗体不一定完全是针对CLO的,或者是抗原决定簇并未充分地暴露,从而导致多抗血清表现出较强的非特异性。因此,在人工抗原偶联方法选择时,应尽量避免改变CLO的抗原决定簇结构,尽量使其充分暴露,并通过免疫动物,鉴定多抗是否能特异性识并结合CLO来最终验证人工抗原的偶联 效果。
4 结 论
本研究采用重氮化法成功合成免疫原性良好的CLO人工抗原,免疫BALB/c小鼠后获得效价高达1∶25 600以上的鼠源多抗血清,获得的多抗血清能特异性识别CLO,具备较高的敏感性(IC50=7.026 ng/mL),同时与其他瘦肉精类药物无交叉反应,特异性良好,为CLO高亲和力单克隆抗体的制备以及ELISA和ICS检测方法的建立奠定良好的基础。

