表观弥散系数对混合型肝癌(≤5 cm)微血管侵犯的预测价值
陆秀良, 倪小艳, 周琳夕, 周长武, 杨 春, 曾蒙苏
1. 复旦大学附属中山医院放射科,上海 200032 2. 上海市影像医学研究所,上海 200032
混合型肝癌(combined hepatocellular-cholan-giocarcinoma, cHCC-CCA)是一种比较少见的原发性肝恶性肿瘤的亚型,占原发性肝癌(primary liver carcinoma, PLC)的2%~5%[1-2]。有研究[3-4]表明,cHCC-CCA的生物学行为和预后介于肝细胞癌(hepatocellular carcinoma, HCC)和肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)之间。由于cHCC-CCA的发病率相对较低,且样本量存在差异,因此各项研究与预后相关的危险因素并不一致。研究[5]发现,cHCC-CCA合并微血管侵犯(microvascular invasion, MVI)是肿瘤切除术后早期复发的关键影响因素。
目前,多种磁共振成像(magnetic resonance imaging, MRI)技术被用于提高cHCC-CCA合并MVI的术前预测。研究[5]结果显示,瘤内脂肪沉积及不规则动脉瘤周强化是cHCC-CCA发生MVI的独立相关因素,但是其预测MVI的灵敏度较低,仅为12.5%。
弥散加权成像(diffusion-weighted imaging,DWI)通过显示水分子的弥散运动,来评价细胞膜的完整性和通透性及其微血管的灌注异常[6],其定量指标——表观弥散系数(apparent diffusion coefficient, ADC)被广泛应用于肿瘤性病变的分级、预测和预后之中。本研究将使用这一定量指标术前预测cHCC-CCA患者是否存在MVI,为cHCC-CCA患者的预后提供必要的定量评价指标。
1 资料与方法
1.1 研究对象 回顾性收集2016年1月至2019年6月复旦大学附属中山医院收治的术后病理确诊为cHCC-CCA的患者67例,术前检查均无肝外转移。纳入标准:(1)未接受治疗的原发性肝脏肿瘤;(2)肝切除术前30 d内行MRI检查,MRI扫描符合诊断标准;(3)单发肿块,无肝内转移或多发病灶;(4)1 cm≤病灶最大直径≤5 cm。排除标准:(1)MRI图像伪影较重,不能达到诊断标准;(2)肝内多发病灶;(3)病灶最大直径<1 cm或>5 cm。本研究经复旦大学附属中山医院伦理委员会批准(B2021-325R),所有患者均知情并签署知情同意书。
1.2 MRI数据采集 所有患者均采用24通道1.5 Telsa磁共振扫描(uMR 560; United Imaging Healthcare)。常规肝脏平面扫描包括横向T2加权屏气脂肪抑制快速自旋回波序列,T1加权屏气同反相位梯度回波序列,以及横向单脉冲自旋回波自由呼吸DWI序列(b值选用0、50和500 s/mm2)。静脉给药钆-二乙基三胺五乙酸(gadolinium-diethylenetriamine pentaacetic acid, Gd-DTPA;Magnevist; Bayer HealthCare)。Gd-DTPA的剂量为0.1 mmol/kg,速率为2 mL/s,随后使用高压注射器(Spectris; Medrad)20 mL生理盐水冲洗。当对比剂到达升主动脉时,通过监测自动触发动脉相采集。随后,在注药后70~90 s(门静脉期)和160~180 s(延迟期)进行动态T1加权MRI扫描。各采集序列的详细参数见表1。

表1 腹部磁共振成像参数
1.3 图像分析 图像分析由2位腹部放射科医师(10年及18年工作经验)在PACS(picture archiving and communication system)上完成。他们被告知患者为混合型肝癌患者,并且被告知病灶的具体位置(couinaud classification八段法),但是未被告知是否存在MVI。分别评价肿瘤大小(cm)、肿瘤的形态和边界、肿瘤的信号强度(T1WI、T2WI、DWI)、病灶内是否存在脂肪、肿瘤包膜、动脉期的周边强化和动态增强强化方式。1位放射科医师(10年工作经验)手动勾画感兴趣区(region of interest,ROI)。ADC图的感兴趣区包括整个肿瘤病灶。沿着肿瘤的边缘一层一层手动勾画肿瘤的ROI,计算出肿瘤的平均ADC值。
肿瘤大小:增强后的静脉期或延迟期横断位上肿瘤最大径。肿瘤的形态和边界:(1)圆形或椭圆形,边界光整;(2)分叶状或不规则,边界不光整。肿瘤的信号强度(相对于肝实质)分为低信号、等信号和高信号。病灶内是否存在脂肪:T1WI同反相位上评价。肿瘤包膜:增强后的延迟期横断位上评价,包绕肿瘤的薄的线状增强结构,分为有包膜(完全或部分包绕肿瘤)和无包膜。动脉期的周边强化:动脉期可见瘤旁异常强化区,于延迟期呈等信号(相对于肝实质)。动态增强强化方式分为“快进快出”的典型强化方式和非典型强化方式,动脉期呈低信号或者静脉期、延迟期呈等高信号。
1.4 观察指标 收集人口特征(年龄和性别)、病因学(乙型或丙型肝炎病毒感染)和肿瘤生物标志物,包括甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)。
1.5 MVI病理评价及分组 使用原始组织标本,由2位病理科医师(9年及11年工作经验)在未被告知影像学表现的情况下进行重新独立读片。意见不一致时,由另一位高年资病理科医师(20年工作经验)会诊,最终达到一致诊断。存在MVI的诊断标准:根据2015年中华病理学会《原发性肝癌规范化病理诊断指南(2015版)》[7]中的标准,MVI定义为显微镜下内皮细胞衬覆的血管腔内见到癌细胞巢团(癌细胞数量大于50个)。根据病理特征将67例患者分为MVI阳性组(n=26)和MVI阴性组(n=41)。

2 结 果
2.1 一般资料分析 组织病理学结果显示,67个cHCC-CCA病灶中有26个病灶存在MVI,即MVI阳性,另外41个病灶不存在MVI,即MVI阴性。本研究中cHCC-CCA患者MVI的发生率为38.81%(26/67)。结果(表2)显示:MVI阳性组与阴性组患者的一般资料差异无统计学意义。
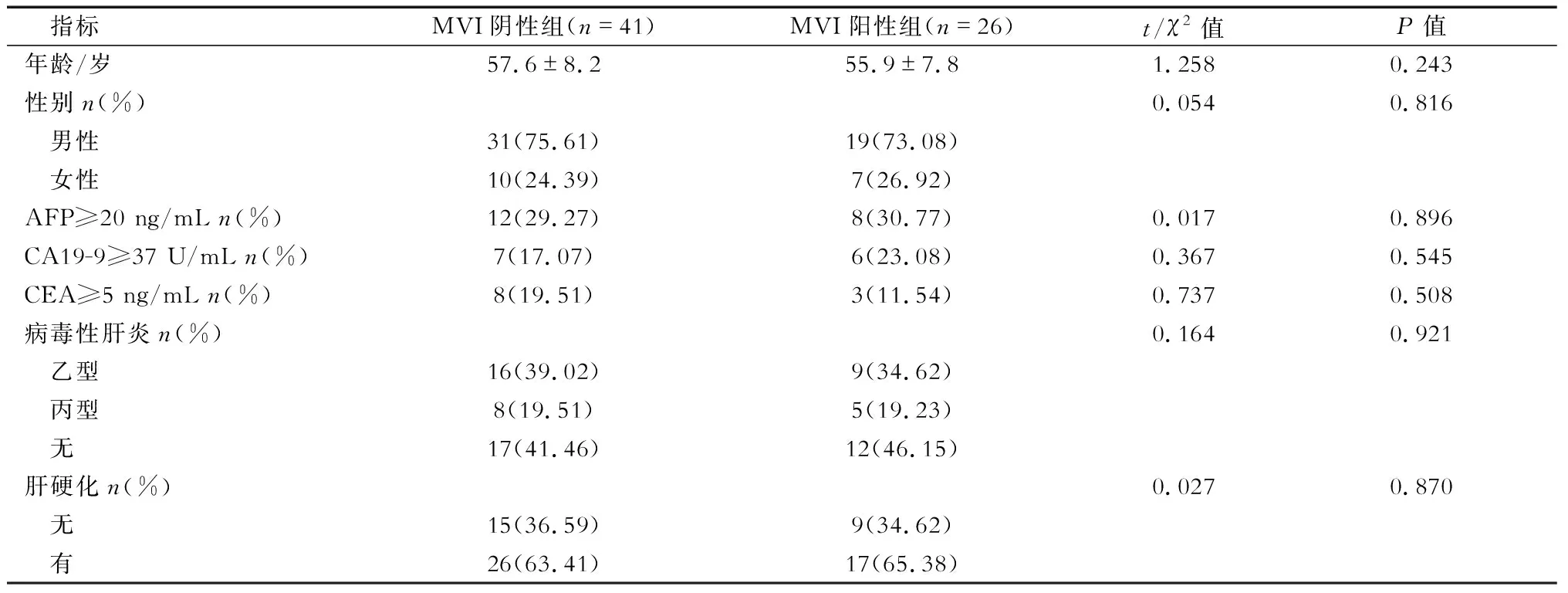
表2 2组混合型肝癌患者的一般资料分析
2.2 影像学表现 MVI阳性组和阴性组典型病例的磁共振成像图片见图1和图2。结果(表3)显示:2组患者的磁共振成像征象为瘤周强化及ADC值差异有统计学意义(P=0.001、0.009),其他磁共振成像参数均无统计学意义。
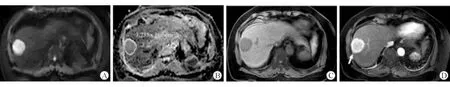
图1 混合型肝癌伴MVI阳性典型病例的磁共振图像
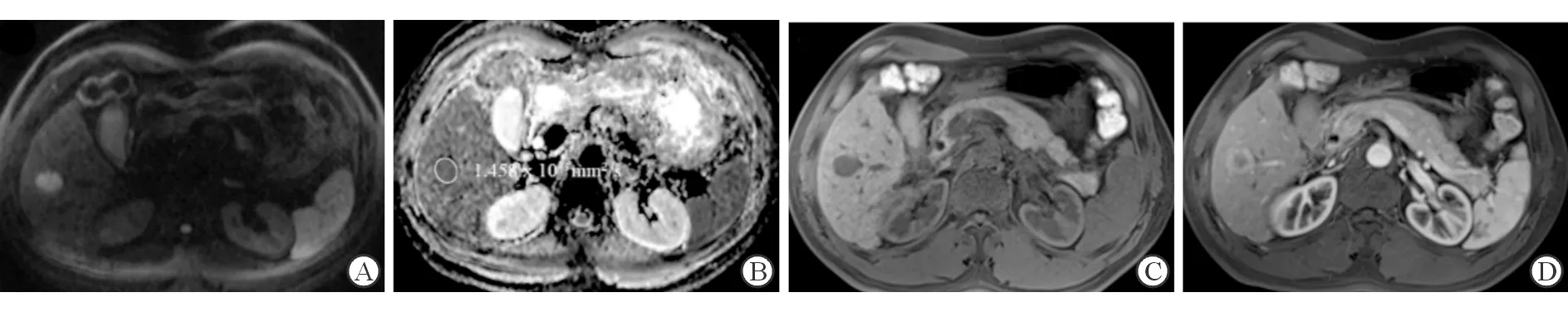
图2 混合型肝癌不伴MVI典型病例的磁共振图像
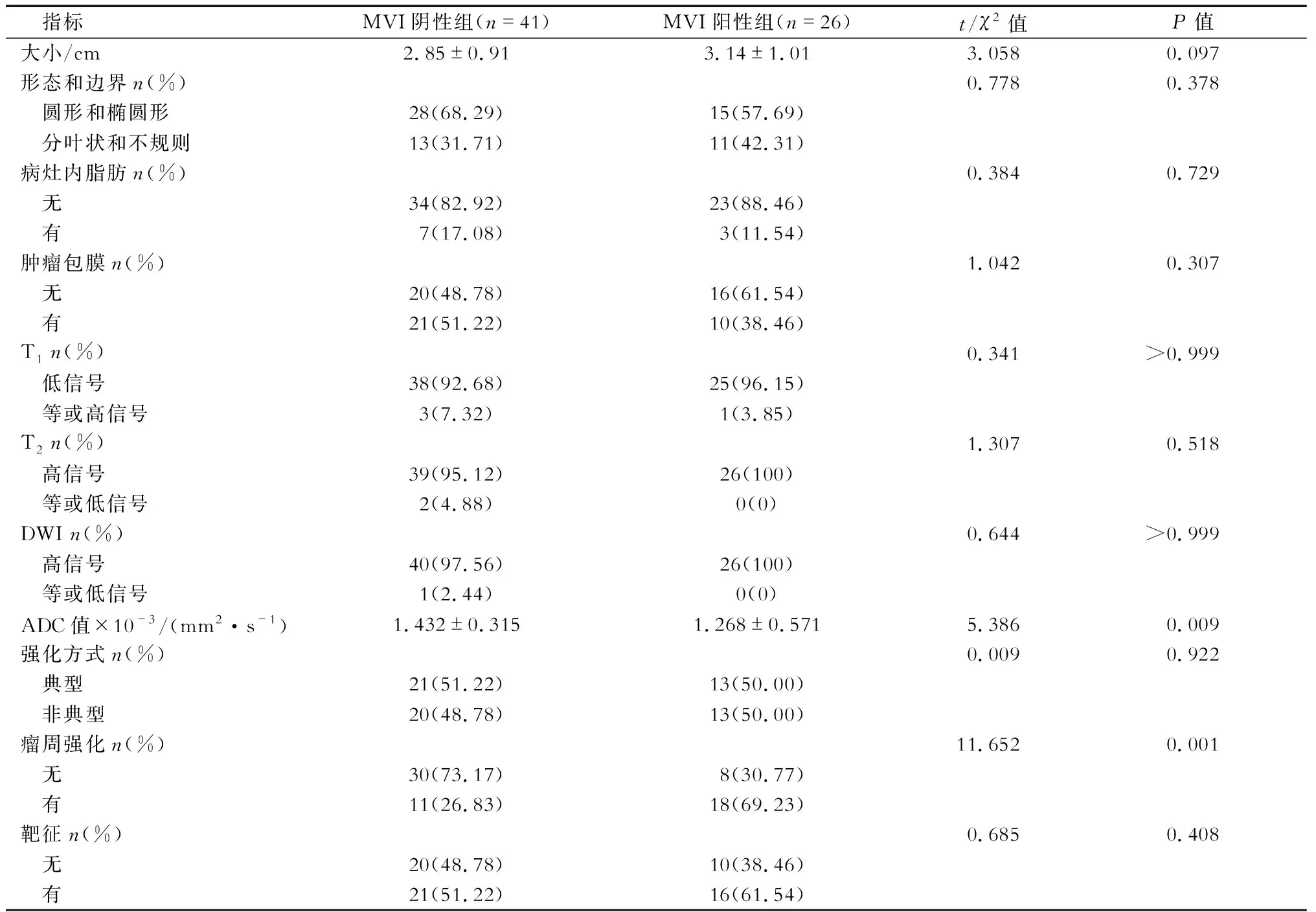
表3 2组混合型肝癌患者的磁共振成像结果
患者,女性,61岁,手术病理证实为混合型肝癌伴MVI阳性。该病灶位于肝右后叶边缘处,直径约5 cm,信号均匀,DWI序列(A)为高信号,ADC序列(B)为低信号,ADC值为1.235×10-3mm2/s,T1W平扫(C)为低信号。增强动脉期(D)为明显均匀强化,箭头所指为瘤周强化。
患者,女性,61岁,手术病理证实为混合型肝癌不伴MVI。该病灶位于肝右后叶,直径约2 cm,信号均匀,DWI序列(A)为高信号,ADC序列(B)为低信号,ADC值为1.458×10-3mm2/s,T1W平扫(C)为低信号。增强动脉期(D)为“靶征”。
2.3 混合型肝癌MVI的危险因素分析 结果(表4)显示,ADC值是cHCC-CCA患者MVI的独立危险因素(P=0.025),其比值比(odds ratio,OR)为5.421。

表4 混合型肝癌MVI的多元回归分析
2.4 ADC值预测cHCC-CCA患者MVI的ROC曲线 结果(图3)显示:ADC值预测cHCC-CCA患者MVI的AUC为0.685(95%CI 0.539~0.756),灵敏度为75.5%(95%CI 47.8%~92.6%),特异度为63.4%(95%CI 45.6%~78.2%)。当ADC截断值为1.378×10-3mm2/s时,约登指数为0.4。
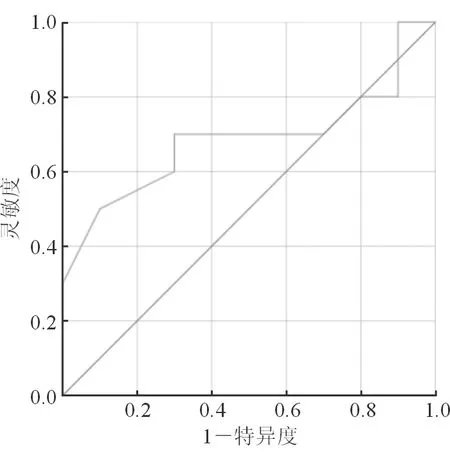
图3 ADC值预测混合型肝癌(≤5 cm)MVI的ROC曲线
3 讨 论
Wang等[5]研究中,113例cHCC-CCA患者均在首次MRI检查后30 d内行R0肝切除术(无肿瘤残留),术后cHCC-CCA中MVI阳性患者的中位无复发生存率(recurrence-free surviva, RFS)为10.8(1~25)个月,而MVI阴性患者的中位RFS为25.4(1~40)个月,2组的早期复发率(<2年)分别为83.9%(47/56)和49.1%(28/57)。MVI阳性和MVI阴性患者的RFS差异有统计学意义(P=0.013)。这说明MVI是术前预测cHCC-CCA预后的重要指标,但MVI的术前影像学预测仍是个难题。Wang等[5]的结果显示,较高的血清AFP水平(P=0.040)、瘤内脂肪沉积(P=0.002)和不规则动脉瘤周强化(P=0.001)是cHCC-CCA合并MVI的独立相关因素。当3个因素同时表现时,诊断MVI的特异度较高,为98.2%(56/57),但灵敏度仍较低,为12.5%(7/56)。
弥散是一个物理上的概念,代表这水分子在热驱动下的自由运动[6]。弥散加权成像通过显示水分子的弥散运动,可用来评价细胞膜的完整性和通透性及其微血管的灌注异常。弥散加权成像可以提高肿瘤性病变的检出率,并可提供额外的信息用于区分肿瘤的分级[9-10]。因此,ADC值能够反映cHCC-CCA的一些组织学上的特性。本研究结果亦显示,ADC值是cHCC-CCA MVI的独立危险因素,其AUC为0.685。当ADC截断值为1.378×10-3mm2/s时,约登指数为0.4。
本研究结果中,动脉期不规则瘤周强化仅是预测cHCC-CCA发生MVI的重要MRI特征,而不是独立危险因素。这种MRI征象血流动力学改变的机制可解释为肿瘤周围微门静脉分支的肿瘤血栓形成,门静脉血流减少或消失,导致肝动脉代偿性高灌注[11]。这与Wang等[5]的研究结果不一致,分析其原因可能是,本研究仅纳入≤5 cm的cHCC-CCA,导致动脉期不规则瘤周强化这一征象的发生率降低。肿瘤的大小是发生MVI的危险因素,尤其是直径>5 cm的肿瘤更容易发生MVI,且患者生存率明显下降[12]。
靶征包括DWI序列的“靶征”、动脉期周边强化、周边廓清及中央延迟强化等[13]。最新研究[14]表明,靶征是cHCC-CCA预后差的一个预测因素。但是,本研究中靶征并不能预测cHCC-CCA发生MVI,这可能是因为靶征反映了病灶周边细胞密集,而中央为纤维基质或缺血;另外,cHCC-CCA是一种兼具肝细胞和胆管细胞的异质性混合物,其生物学行为并不等同于肝内胆管细胞癌[15]。
综上所述,本研究结果显示,ADC值是预测cHCC-CCA患者存在MVI的独立危险因素,并且对MVI有一定预测价值。
利益冲突:所有作者声明不存在利益冲突。

