蓝狐母系起源及谱系重建
聂子涵 武晓宇 孙 锴 樊 攀 魏 来 刘志平* 李 波,3,4*
(1.东北林业大学野生动物与自然保护地学院,哈尔滨,150040;2.哈尔滨华隆蓝狐育种有限公司,哈尔滨,150129;3.国家林业和草原局野生动植物检测中心,哈尔滨,150040;4.国家林业和草原局野生动物保护与利用工程技术研究中心,哈尔滨,150040)
蓝狐是圈养北极狐(Vulpexlagopus)的主要品种,我国自1956年从芬兰引种进行人工饲养,2005年饲养量已达1 000万只[1],2011年狐皮产量已占世界总产量的38%[2]。但由于缺乏有效的管理措施,种兽后代逐年退化,因而无法摆脱重复引种的局面。据统计,1996—2006年,我国从芬兰引进的种公狐超6万只,占我国种狐数量的5%[3]。不断地引进种源只能满足一时之需,通过科学有效的遗传管理来保持我国蓝狐的优良性状才是根本的解决办法。目前,圈养种群的遗传管理普遍基于谱系,同时利用遗传标记进行亲权鉴定来检验谱系信息。宗文丽[4]利用9个微卫星位点对北极狐进行亲权鉴定,结果显示,微卫星累积排除率可达99.99%。白玉妍[5]利用微卫星标记对蓝狐进行单亲亲权鉴定,找出了4个谱系丢失子代的母本,同时发现谱系记录中2只子代的记录错误。刘丽等[6]利用微卫星分子标记,根据后代遗传质量的预测判定最佳的配对方案,为圈养北极狐遗传管理提供参考。此外,Sacks等[7]利用微卫星和线粒体D-Loop两种分子标记成功鉴别了圈养和野生北极狐种群。Dalén等[8]利用线粒体高变区部分序列分析北极狐种群的遗传关系,确定了种群间的基因交流。本研究选用犬科试剂盒(Canine ISAG STR Parentage Kit)对蓝狐样本进行扩增,通过复合扩增可以在短时间内获得多个基因座的分型结果,具有高检测效率、低成本、低耗材等优势;利用线粒体D-Loop序列分析追溯蓝狐种群的母系起源,同时利用试剂盒中的微卫星位点鉴别蓝狐个体亲缘关系,为蓝狐种群的管理和繁育提供依据。
1 材料与方法
1.1 材料
选取哈尔滨华隆蓝狐育种有限公司2016、2017年从芬兰中南部引进的原种芬兰蓝狐繁育后代122只,其中涉及亲权鉴定的53只(表1),其余为随机选取。利用非损伤法采集带有毛囊的毛样本为试验材料,样本涵盖原种蓝狐繁殖的第1代、第2代和第3代。亲子鉴定部分样本见表1。所选母狐采用2种人工授精模式:“A-B-A”模式(即第1次、第3次输精选用同一只种公狐精液,第2次选用另一只)和“A-B/A-B-C”模式(第2和第3次均选用不同种公狐精液进行输精)。
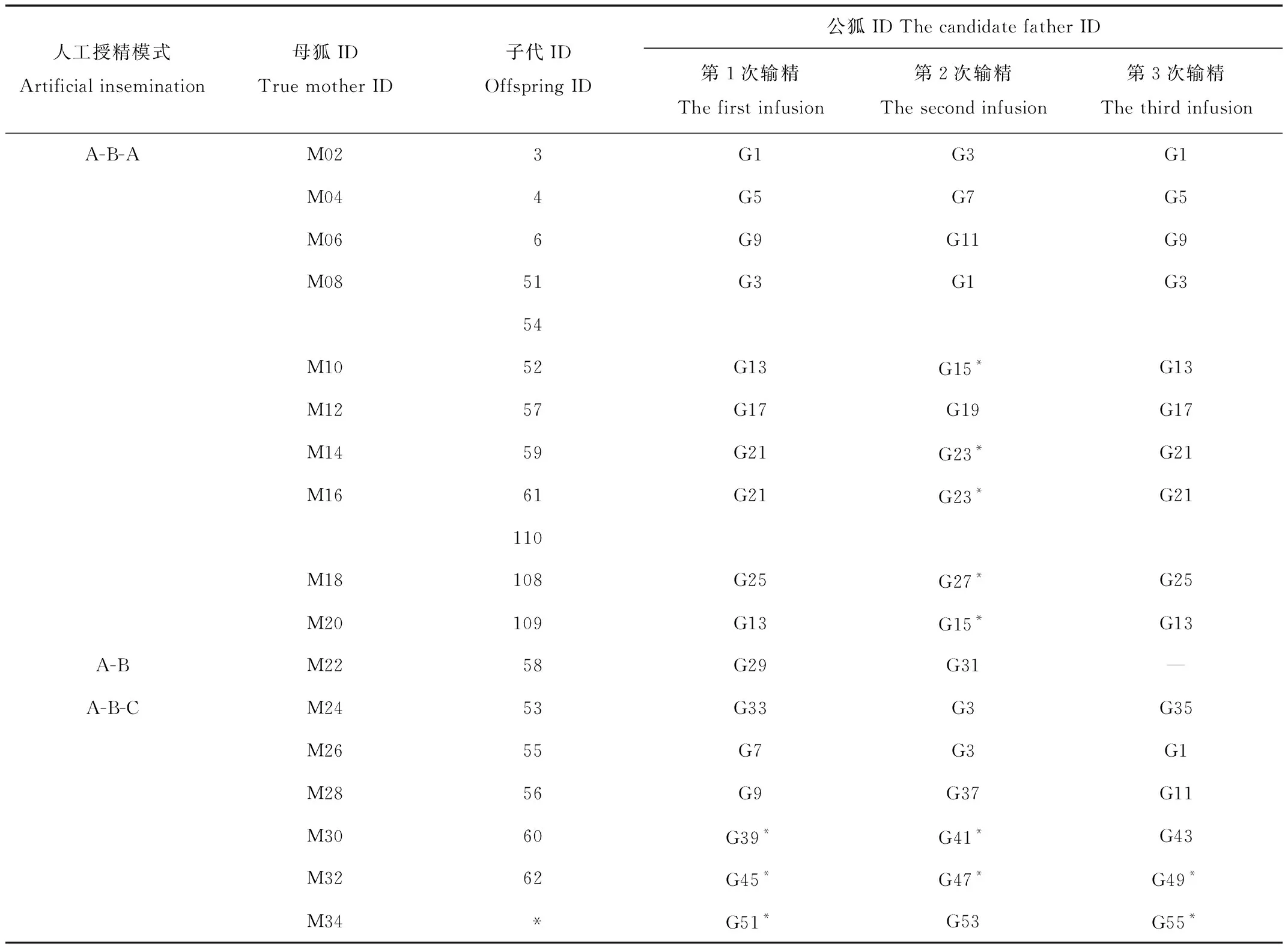
表1 蓝狐亲权鉴定部分样本Tab.1 Parentage identification of some blue fox samples
1.2 方法
1.2.1 基因组DNA的提取
利用基因组提取试剂盒(上海百赛生物工程技术有限公司)对样本基因组DNA进行提取,所有操作均按照说明书要求进行。提取的DNA原液于-20℃保存。
1.2.2 PCR扩增与测序
使用引物VVProf/VVCRR2[9]扩增线粒体D-Loop部分序列。PCR扩增体系为50.0 μL,包括2×EasyTaqSuperMix(Transgen,北京)25.0 μL,正反向引物各0.5 μL(10 μmol/L),ddH2O 19.0 μL,DNA模板5.0 μL。扩增采用DNA扩增仪PE-9700型和2400型(PE,美国),反应程序为:94℃预变性5 min;94℃变性45 s,55℃退火30 s,72℃延伸70 s,40个循环;72℃延伸10 min。PCR扩增产物用质量分数1.5%的琼脂糖凝胶电泳分离(220 V,25 min)。后将PCR产物送至哈尔滨擎科生物有限公司,采用原引物进行双向测序。
利用Canine ISAG STR Parentage Kit犬科试剂盒扩增具有亲缘关系的53个蓝狐样本,PCR扩增程序为:98℃预变性3 min;98℃变性15 s,60℃退火75 s,72℃延伸30 s,30个循环;72℃再延伸5 min,4℃终止反应。PCR扩增体系为10.0 μL,包括DNA模板(15 ng/μL)1.0 μL,Canine STR Master Mix 4.5 μL,Canine 22 STR Primer Panel 4.5 μL。后将PCR产物用ABI3100 Genetic Anslyzer检测分型(上海生工生物工程股份有限公司)。
1.2.3 数据分析
从GenBank下载产于西伯利亚(AF365961—AF365966)和瑞典(AF365967—AF365968)北极狐的10个mtDNA D-Loop单倍型序列,以及北极狐(KP200876.1)、赤狐(Vulpesvulpes,AF098155)和貉(Nyctereutesprocyonoides,MG256392.1)全基因序列。在系统发育分析中采用貉作为外群。本研究所用的全部序列信息详见表2。
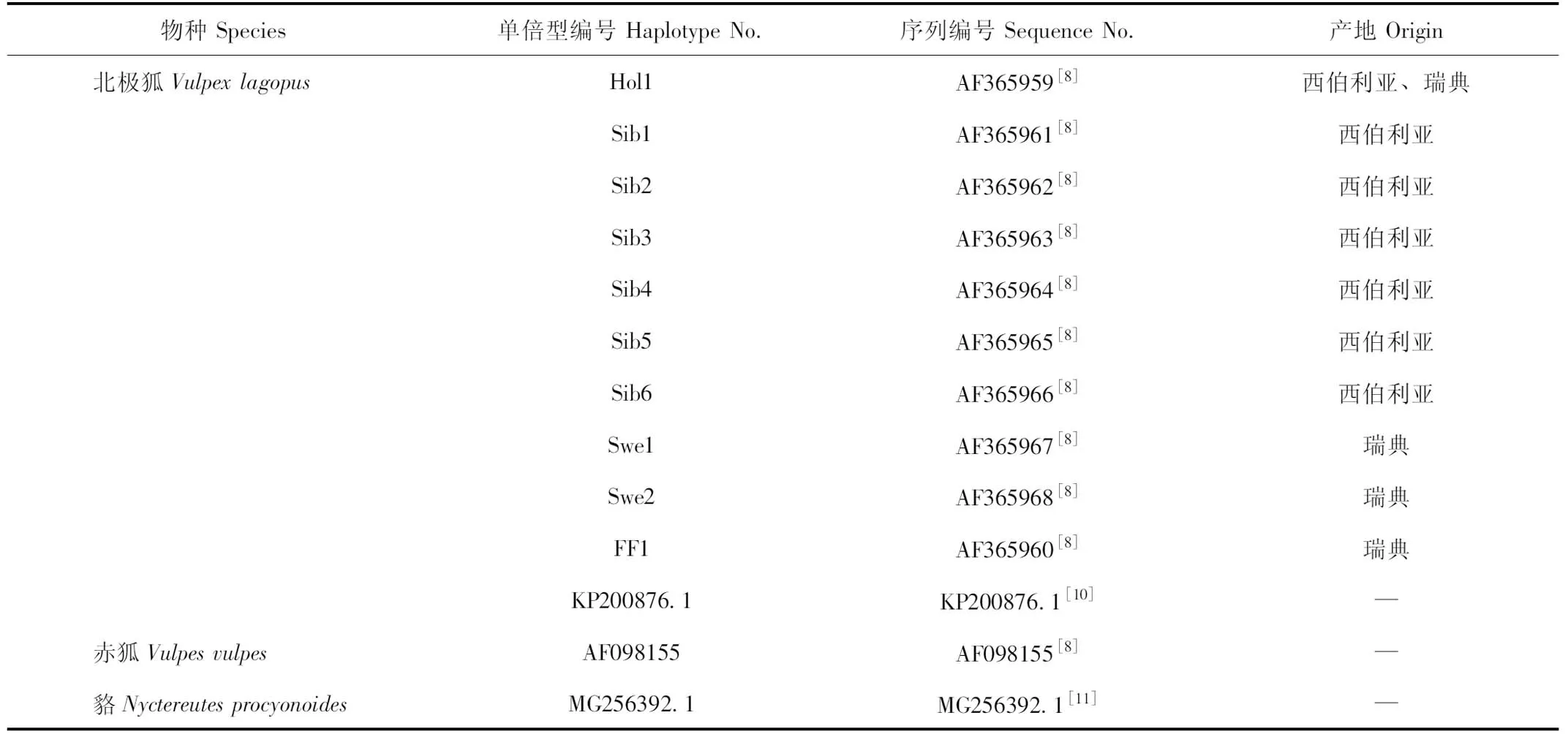
表2 蓝狐系统发育分析采用的物种序列信息Tab.2 Species sequence information used in phylogenetic analysis of blue fox
将试验所得序列用DNAstar软件包中的SeqMan程序进行拼接,根据峰图对序列内部位点进行人工校对。利用Clustal X软件对序列进行比对。利用MEGA 5.2软件计算碱基组成[12]。利用DnaSP 6软件确定单倍型并计算单倍型多样性(Hd)、核苷酸多样性(Pi)及平均核苷酸差异(K)等[13]。
选用最大似然法(ML)和贝叶斯推论法(BBI)进行系统发育分析。在MEGA 5.2软件中计算核苷酸最佳替代模型,并根据贝叶斯信息准则(BIC)选择最佳模型Hasegawa-Kishino-Yano+G(HKY+G)[14]。利用IQ-TREE构建ML树[15];使用MrBayes.2.1构建贝叶斯树[16]。
微卫星数据利用Cervus软件计算每个位点的基因频率(P)及多态信息含量(PIC)。为保证微卫星标记提供的遗传信息可靠,在筛选时,将等位基因数≥4,多态信息含量≥0.5作为选择标准[17-18]。筛选出可用的微卫星位点后,统计各位点的等位基因数(Na)、观察杂合度(Ho)、期望杂合度(He)、排除概率(EP)等信息。微卫星位点存在着突变,因此为确保其准确性,在进行亲权鉴定时要使用多个遗传标记系统,根据公式求得累计非父排除概率(CPE)。
式中:n为遗传标记数,EPi为第i系统的非父排除概率。
根据微卫星位点等位基因的片段大小,参照配种记录,利用Cervus软件对父子关系不清的后代进行分析,以确定这些后代的生物学父亲。
2 结果与分析
2.1 母系世系
122份样本共测得116条线粒体D-Loop区序列,其中8份测序结果出现杂峰或信号弱的问题而被舍弃。序列分析仅定义了1个单倍型。基于线粒体D-Loop区序列单倍型构建最大似然树及贝叶斯树,2种树的拓扑结构大致相同。线粒体D-Loop区的系统发育树(图1)表明,瑞典单倍型Swe1、Swe2彼此分离,未被归在同一世系中,说明世系的划分与种群所在地点间无必然联系,也表明瑞典种群与西伯利亚种群之间存在紧密联系。样本单倍型hap_1与西伯利亚Sib2及瑞典圈养种群FF1单倍型聚集在同一分支中,说明圈养建群者部分个体可能来源于西伯利亚野生种群。
2.2 微卫星位点筛选和应用
利用犬科试剂盒和Cervus软件计算筛选适应于蓝狐种群的微卫星位点,结果表明,4个位点无扩增产物;1个位点片段分布范围内有多个强度接近的信号峰,难以准确分型;3个位点的等位基因数小于4;另有3个位点的多态信息含量在0.5以下。舍弃以上位点后共筛选出11个位点用于后续分析。经分型的53份样本中,3份由于峰图效果不好被舍弃,其余50只蓝狐个体各微卫星位点特征见表3,位点多态性参数见表4。
由表3得知,各位点的等位基因数为4—9个,11个位点共有等位基因67个,平均等位基因数为6.09个。各位点基因频率有差异,部分位点的等位基因频率偏低,例如:位点AHTk211中的B片段、REN54P11中的C片段和INU030中的D片段的频率仅为0.010 0;位点FH2054中的A、C、D片段和REN162C04中的A、C片段的频率也仅为0.010 2。
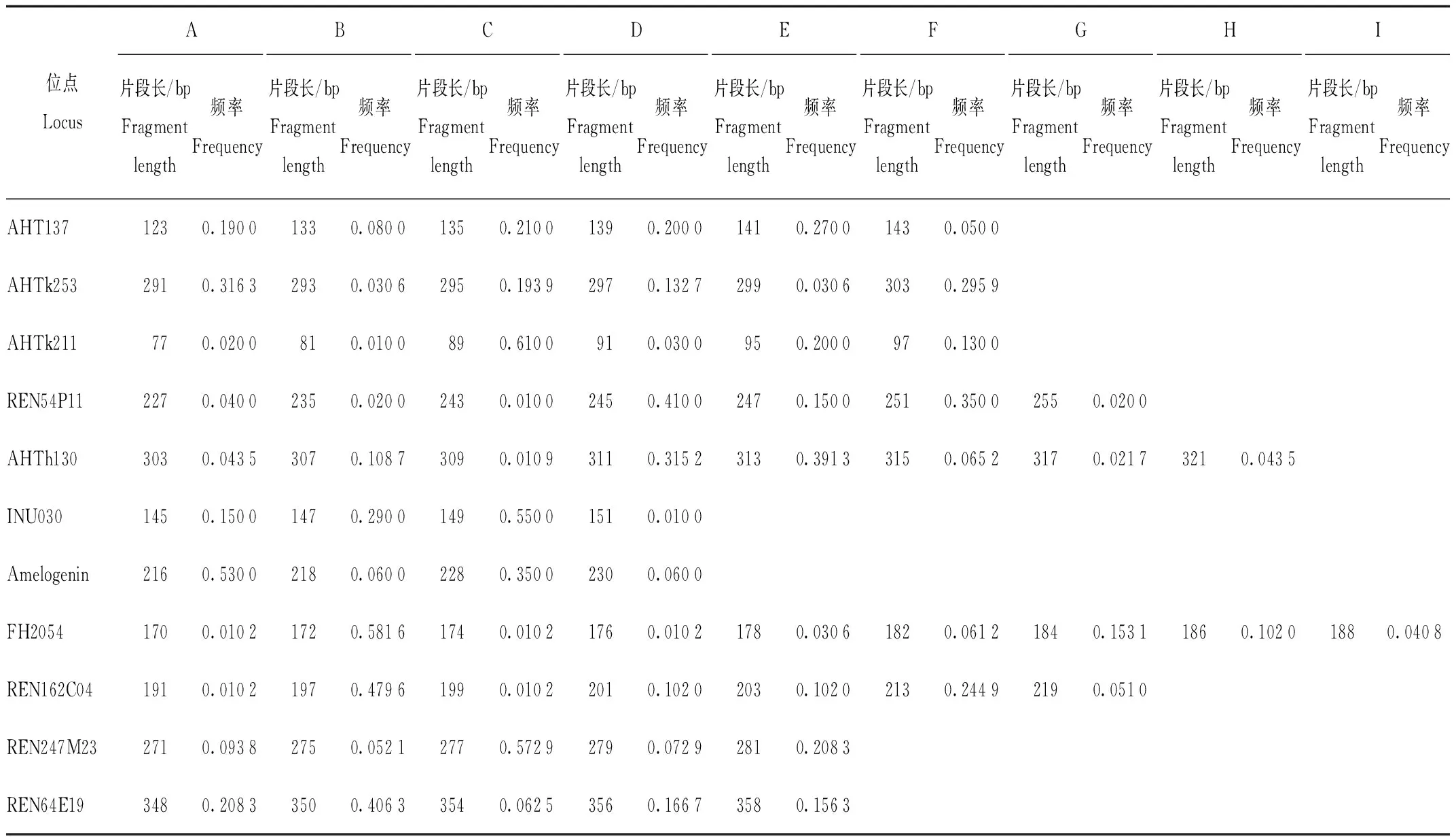
表3 蓝狐各位点等位基因及等位基因频率Tab.3 The allele and the allele frequency of each locus in blue fox
由表4可知,该群体有高的多态性,表现为有较高的杂合度。样本群体在不同的微卫星位点期望杂合度范围是0.575 4—0.806 1,平均0.676 9;观察杂合度的变动范围为0.200 0—0.880 0,平均0.649 2;期望杂合度和观察杂合度的最大差值为0.396 8,最小差值为0.007 0。将各标记的观察值与期望值的差值同观察值作比得到一个比值,该比值最大为1.984 0,最小为0.010 6,除INU030位点比值大于0.5外,其余10个位点比值均小于0.5,占位点总数的90.91%。观察值与期望值的差异较小,能进一步说明微卫星位点选取的合理性。此外,多态信息含量0.514 7—0.767 4,平均0.623 9。多态信息含量越大,意味着在一个群体中,该位点上的杂合子比例就越大,提供的遗传信息就越多。在母子关系不清的情况下,单个微卫星标记排除概率为0.579 3—0.823 3,累计排除概率为0.999 999;在母子关系确定的条件下,单个微卫星标记排除概率为0.401 1—0.682 8,累计排除概率为0.999 912。
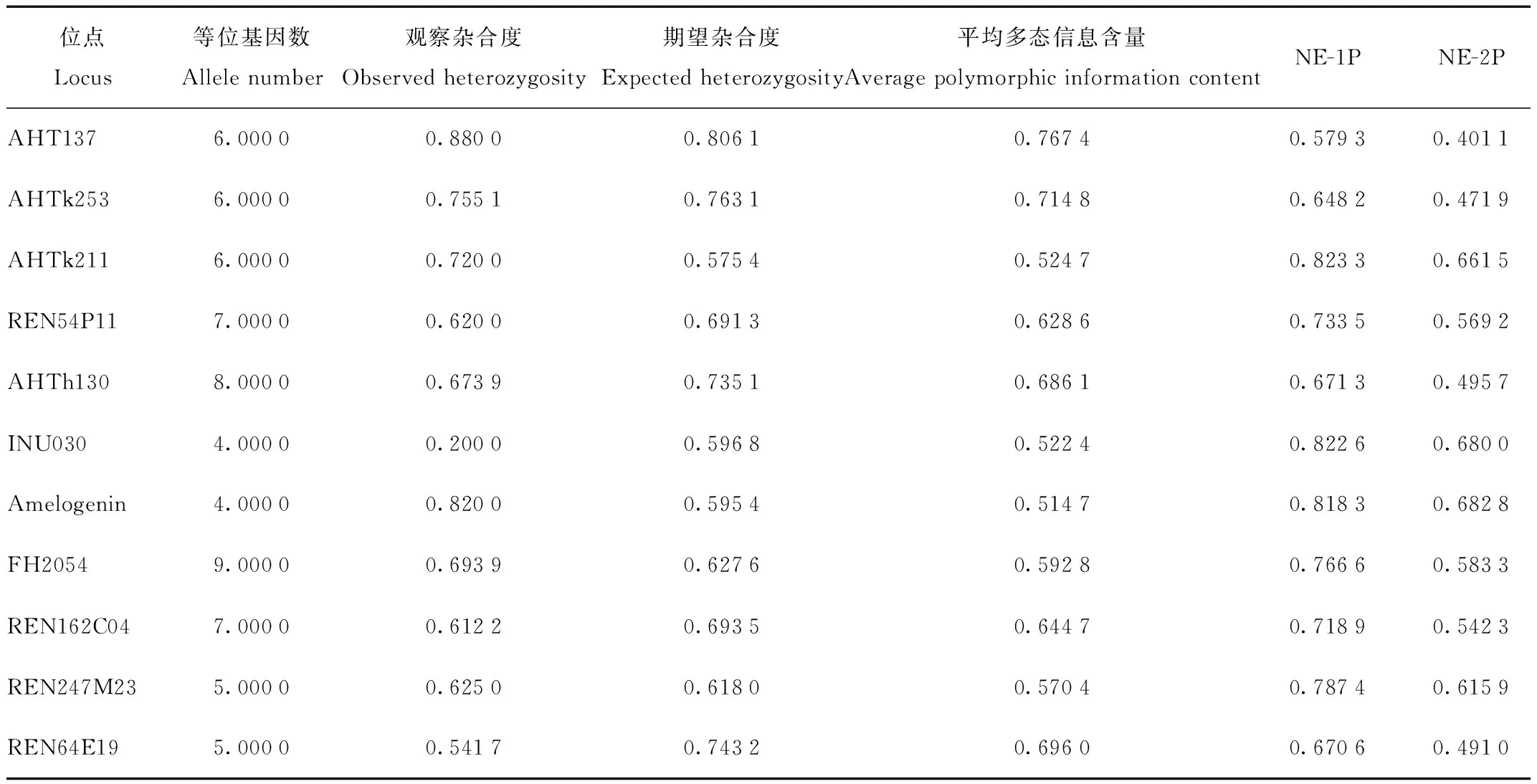
表4 蓝狐微卫星位点的多态性参数Tab.4 Polymorphic parameters of microsatellite locus in blue fox
基于配种记录和个体微卫星分型结果,进行父子关系不清的父权排除,结果见表5。个体53、60、109、110由于候选父亲样本不全,未成功找到真实父亲,其余11只仔狐成功找到生物学父亲。配种母狐中,9只采用“A-B-A”方式进行配种,从其后代选取的11只仔狐中,4只为“A”种公狐的后代,5只为“B”种公狐的后代;通过排除法可知109和110的真父为“B”种公狐。因此,真父为B种公狐的子代为7只,占子代数目的64%。采用“A-B/A-B-C”方式配种的母狐子代,由于数量较少,未做统计。通过子代61和110可知,在同一窝中,存在多重父权的现象。
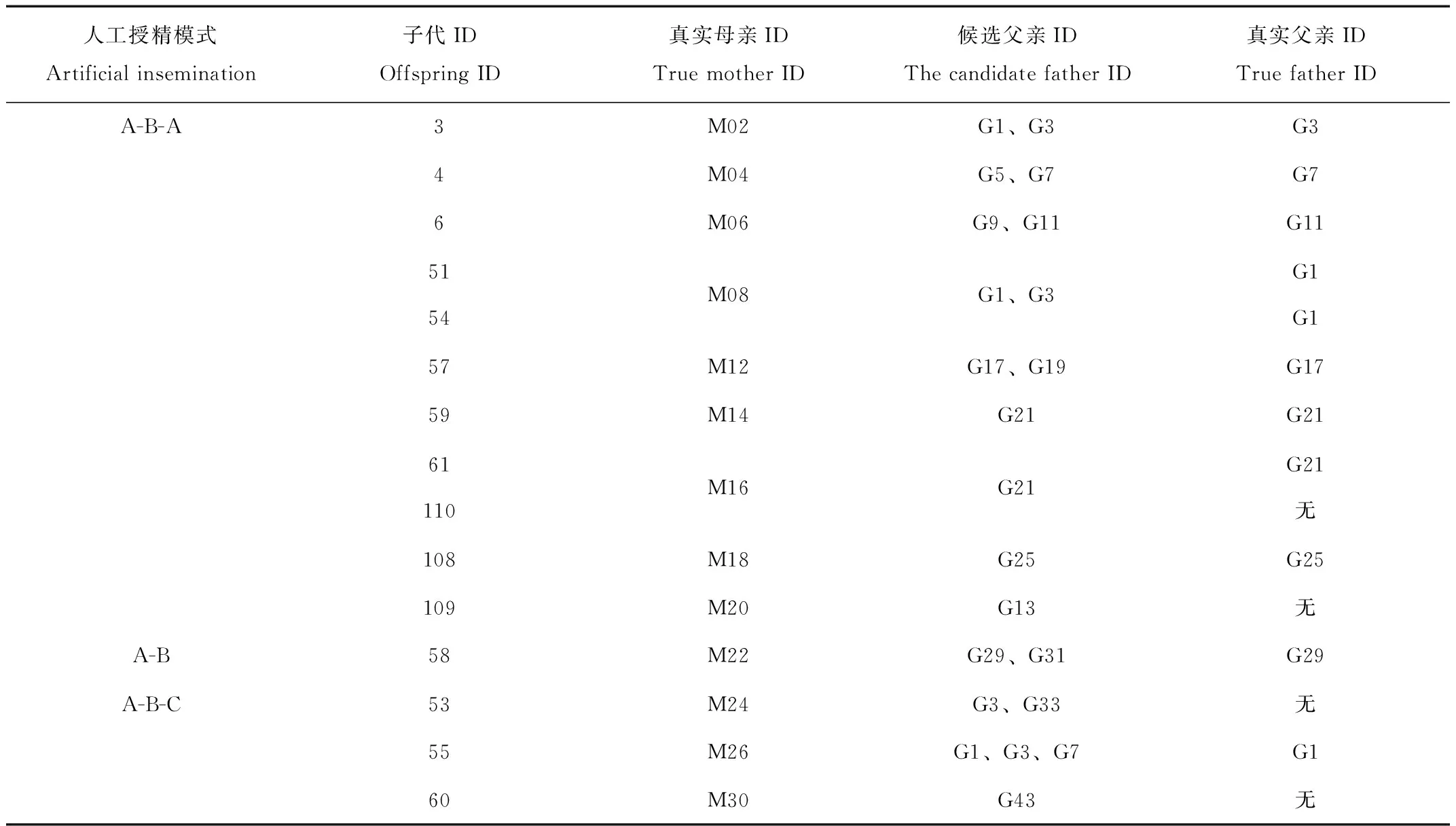
表5 蓝狐亲权鉴定的结果Tab.5 Results of paternity test of blue fox
3 讨论
系统发育分析显示,样本种群与瑞典圈养种群及西伯利亚野生种群有紧密联系。本研究所选蓝狐皆由从芬兰中南部城市引进的原种芬兰蓝狐繁育而成,在20世纪五六十年代,芬兰因养殖需求曾从挪威购买狐种兽[19],因为当时芬诺斯堪底亚(Fennoscandia)地区养狐业特别兴旺发达[20]。此前的研究[8]确定了芬诺斯堪底亚种群与西伯利亚种群间的关联,2个种群在科拉半岛可能存在一个基因交流接触带。由此推断,样本种群与瑞典圈养种群起源于西伯利亚野生种群。
本研究通过等位基因数和多态信息含量2项标准共筛选出11个可用位点,多态信息含量均大于0.5,等位基因数为4—9个。部分等位基因的频率较低,从群体遗传学的角度来看,这些低频的等位基因在群体中可能没有起到作用,如果进一步近亲交配,会导致这些基因逐渐消失;伴随着基因的减少,群体生存能力可能会下降[4]。经计算,11个微卫星位点的累计排除概率为99.99%,达到郑秀芬[21]衡量用于亲权鉴定的分子标记的标准。由亲权鉴定结果可知,“A-B-A”授精模式下,母狐经2次输精后成功受孕的概率为64%。这是因为在发情测试仪数字化的直观显示下,蓝狐交配或人工授精时间在阴道电阻达到最大值后24—48 h内达到最佳点[19]。在实践中,母蓝狐的输精时间可以相应拖迟0.5—1.0 d以达到更好的效果。母狐的受孕率受种狐的选育、精液的品质、人工授精的时机和技术、精子的体外保存等多重因素影响[22]。依据亲权鉴定结果、母狐平均妊娠期(52 d)、结合母狐产仔日期及输精时间等因素来推断其余4只母狐受孕时间,初步得到此种模式下母狐经1次、3次输精成功受孕的概率相等,均为18%。同时,研究发现在同一窝仔狐中存在多重父权的现象。在多胎动物中,如果雌性在一个发情周期中排出多枚卵子,并与多个雄性轮替交配,就可能产生多重父权[23-26]。但蓝狐为季节性单次发情动物,在人工授精过程中,对发情母狐每天仅采用1只公狐的精液进行输精,不存在混合输精的情况。有关母狐的排卵时间的持续性目前尚无准确的说法,但刘志平[22]曾分别使用蓝狐、银狐(Vulpesvulpesfulva)精液在不同日期为同只母蓝狐进行输精,其后代在同一窝仔中既出现了杂种蓝霜狐,又出现了纯种蓝狐。宗文丽[4]对北极狐进行父权排除后也发现,在同一窝中,存在一母多父的现象。同时布隆斯泰特等[19]提出,在经2次输精后受孕的雌狐产下的一窝仔狐中,仔狐的父本可能不同,不应该按照惯例把第2次提供精液的公狐当作仔狐的唯一父本。此种情况虽为个别现象,但在育种过程中,应尽量避免人为因素产生的影响。
综上,蓝狐种群仅存在一个单倍型,血统单一。结合已知亲缘关系资料对不明确的亲权关系进行亲权鉴定,可以建立准确的谱系,有助于开展科学的选种选育、降低近交的概率,进而保持种群的优良性状。
——从虐童事例切入

