超声辅助碱性蛋白酶提取鸡爪胶原蛋白肽理化性质及功能特性
周婷 吴瑀婕 卢方云 杨彪 马晶晶 杨静 邹烨 王道营 徐为民

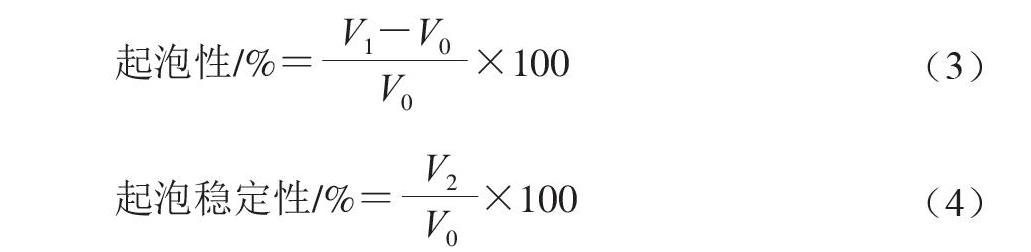
摘 要:以超聲波辅助碱性蛋白酶提取所得鸡爪胶原蛋白肽作为实验材料,首先研究鸡爪胶原蛋白肽的理化特性(外观色泽、等电点、分子质量分布、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、氨基酸组成及水解度),进一步对其起泡性和起泡稳定性、乳化性和乳化稳定性等功能特性进行研究。结果表明:鸡爪胶原蛋白肽的分子质量分布范围小于α2-链,小分子质量肽段比例较高;氨基酸种类丰富,甘氨酸和脯氨酸在总氨基酸含量中占比最高;优化提取的鸡爪胶原蛋白肽水解度约28.65%,起泡性和起泡稳定性高达133.33%和126.67%,且具有较好的乳化性和乳化稳定性。
关键词:鸡爪;胶原蛋白肽;理化性质;功能特性
Physicochemical and Functional Properties of Collagen Peptides Derived from Ultrasonic-Assisted
Alkaline Protease Hydrolysis of Chicken Claws
ZHOU Ting1,2, WU Yujie1,2, LU Fangyun1, YANG Biao1, MA Jingjing1, YANG Jing1,2, ZOU Ye1,*, WANG Daoying1,2,*, XU Weimin1
(1. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Science, Nanjing 210014, China;
2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: The physicochemical properties (color appearance, isoelectric point, molecular mass, SDS polyacrylamide gel electrophoresis pattern, amino acid composition and hydrolysis degree) of collagen peptides produced by ultrasonic-assisted alkaline protease hydrolysis of chicken claws were determined as well as the functional characteristics such as foaming ability, foam stability, emulsification ability and emulsion stability. The results showed that the molecular mass distribution of the collagen peptides was below the α2-chain, small peptides being the major ones. The collagen peptides contained a wide variety of amino acids, with glycine and proline being the predominant ones. The hydrolysis degree of the collagen peptides prepared under the optimized conditions, having good foaming ability (133.33%) and foam stability (126.67%), having good emulsification capacity and emulsion stability, was about 28.65%.
Keywords: chicken claw; collagen peptides; physicochemical properties; functional characteristics
DOI:10.7506/rlyj1001-8123-20210422-108
中图分类号:TS251.94 文献标志码:A 文章编号:1001-8123(2021)10-0008-05
引文格式:
周婷, 吴瑀婕, 卢方云, 等. 超声辅助碱性蛋白酶提取鸡爪胶原蛋白肽理化性质及功能特性[J]. 肉类研究, 2021, 35(10): 8-12. DOI:10.7506/rlyj1001-8123-20210422-108. http://www.rlyj.net.cn
ZHOU Ting, WU Yujie, LU Fangyun, et al. Physicochemical and functional properties of collagen peptides derived from ultrasonic-assisted alkaline protease hydrolysis of chicken claws[J]. Meat Research, 2021, 35(10): 8-12. DOI:10.7506/rlyj1001-8123-20210422-108. http://www.rlyj.net.cn
胶原蛋白肽是由胶原蛋白(简称胶原)衍生的物质,主要来源包括自然界中存在、经过蛋白质水解和人为合成。胶原蛋白肽具有较强的消化吸收性,所以有利于人体小肠的消化与吸收[1-2]。GB 31645—2018《食品安全国家标准 胶原蛋白肽》规定富含胶原的新鲜动物组织在水解到一定程度后,即分子质量低于10 kDa时,称为胶原肽[3]。胶原蛋白肽具有许多异于胶原的特性:易透皮、抗氧化、抑菌、无凝胶属性和降血压,而与其他蛋白多肽的主要区别在于其脯氨酸和羟脯氨酸的含量明显居高[4-5]。
在肉鸡工业生产车间会产生大量富含胶原的副产物,如鸡爪、鸡皮、鸡骨等。一些西方国家将少部分鸡爪作为宠物饲料,但绝大部分被弃用[6-8]。目前,仅亚洲一些国家将鸡爪及其副产物制作成鸡爪类制品,因此开发一种能有效提升鸡爪经济附加值的方法迫在眉睫。利用鸡爪作为酶提胶原蛋白肽的原材料,不仅可极大程度地利用其中的胶原物质,而且能减少资源浪费和环境污染,也可将其应用于化妆品和食品添加剂行业,以提升鸡爪的附加值和资源利用效率。因此,从资源丰富且价格相对低廉的鸡爪中提取胶原蛋白肽并研究其性质十分必要。
1 材料与方法
1.1 材料与试剂
单冻鸡爪购于山东荣华食品集团有限公司,经蒸馏水清洗、低温通风晾干后,分装,于-20 ℃下保存备用;金龙鱼大豆油购于江苏省南京市玄武区钟灵街苏果超市。
氢氧化钠(分析纯) 国药集团化学试剂有限公司;冰醋酸、甲醛(分析纯) 西陇化工股份有限公司。
1.2 仪器与设备
FiveEasy Plus pH计 梅特勒-托利多仪器(上海)有限公司;CR-400色彩色差计 日本Konica Minolta公司;BJ1514018L-8900氨基酸分析仪 日本日立公司;1260高效液相色谱仪 美国Agilent公司;Mini-Pro TEAN Tetra Cell 美国Bio-Rad公司;T-25数显匀浆机 德国ZKA公司;Gen5全波长酶标仪 美国伯腾仪器有限公司;SCIENTZ-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 鸡爪胶原蛋白肽制备工艺
工艺流程:鸡爪(剔骨)→脱脂、除杂蛋白→水洗→超声波辅助酶解→灭酶→离心→胶原蛋白肽提取液→冻干成粉末
操作要点:鸡爪剔骨处理制备无骨鸡爪,使用NaOH和Na2CO3溶液进行脱脂,再在0.1 mol/L NaOH溶液
(液料比10∶1,V/m)中浸泡6 h,每3 h更换一次NaOH溶液,以去除杂蛋白。采用碱性蛋白酶,参考预实验中通过单因素试验和响应面优化试验得到的最佳参数(料液比1∶25、超声功率250 W、酶提时间4 h)提取鸡爪胶原蛋白肽,最后于100 ℃下灭酶10 min,取出冷却,在10 000 r/min离心10 min后得鸡爪胶原蛋白肽液,真空冷冻干燥制成鸡爪胶原蛋白肽粉末。
1.3.2 鸡爪胶原蛋白肽外观颜色表征
通过肉眼观察鸡爪胶原蛋白肽的外观色泽,然后用色差计测定鸡爪胶原蛋白肽亮度值(L*)、红度值(a*)、黄度值(b*),并根据L*、a*、b*计算色差(ΔE)。L*越大,亮度越亮;a*表示样品颜色的红绿偏向,若正值越大则说明偏移红色方向;b*反映样品色泽的黄蓝偏向,若正值越大则偏移黄色方向。
1.3.3 鸡爪胶原蛋白肽等电点的测定
根据程海明等[9]的方法,将2 g鸡爪胶原蛋白肽粉末复溶于8 mL 0.5 mol/L醋酸溶液中,搅拌至溶液澄清,然后用6 mol/L NaOH溶液滴定到胶原蛋白肽溶液出現沉淀,且此时沉淀不会溶解,用精密pH计测定溶液pH值,即为鸡爪胶原蛋白肽等电点,重复测定3 次,结果取平均值。
1.3.4 氨基酸组分测定
参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》[10],利用氨基酸自动分析仪测定鸡爪胶原蛋白肽中氨基酸的组成和含量。
1.3.5 分子质量组成分布测定
采用尺寸排阻色谱测定、峰面积归一法计算样品分子质量分布情况[11]。色谱检测条件:TSKgel G2000 SWXL_012EA01051F尺寸排阻色谱柱(粒径5 μm、孔径125 A、排阻限5 000~150 000 Da),流动相pH 6.7、100 mmol/L磷酸盐缓冲液,柱温为室温,流速0.7 mL/min,检测波长280 nm,上样质量浓度1.0 mg/mL。
1.3.6 十二烷基硫酸钠-聚丙烯胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)测定
参考肖枫等[12]的方法,略作修改。取200 μL 2 mg/mL鸡爪胶原蛋白肽溶液与50 μL含体积分数5% β-巯基乙醇的样品缓冲液(250 mmol/L Tris-HCl、10% SDS、50%甘油、0.5%溴酚蓝)混合,以不含β-巯基乙醇的样品缓冲液作为空白对照)。将样品溶液先于95 ℃水浴加热5 min后,再于12 000×g离心5 min。使用垂直板电泳装置,采用12%分离胶、4%浓缩胶,电极缓冲液为Tris-Gly缓冲液(含0.1% SDS),上样量约为5 μL,恒定电压120 V下电泳90 min。电泳结束后,加入考马斯亮蓝染色液,染色约2 h,然后用去离子水冲洗多次,脱色液脱色处理,对蛋白质条带拍照观察。
1.3.7 水解度测定
采用双指示甲醛滴定法[13]测定水解度,并略作修改。用蒸馏水配制质量浓度2 mg/mL的鸡爪胶原蛋白肽冻干粉溶液,用pH计测定溶液pH值为8.20,然后加入约20 mL甲醛(用NaOH调节pH值至8.2),最后用
0.1 mol/L NaOH溶液滴定至pH 9.0,记录此时消耗NaOH溶液体积(V1,mL),以蒸馏水代替样品溶液作为空白组,记录空白组所消耗NaOH溶液体积(V0,mL)。采用凯式定氮法[14]测定鸡爪胶原蛋白肽冻干粉中蛋白含量,分别按式(1)~(2)计算鸡爪胶原蛋白肽冻干粉中氨基态氮含量和鸡爪胶原蛋白水解度。
(1)
(2)
式中:0.1为NaOH溶液标准溶液浓度/(mol/L);14.008为1 mL 0.1 mol/L NaOH标准溶液相当于氮的质量/mg。
1.3.8 起泡性和起泡稳定性测定
取一定量鸡爪胶原蛋白肽粉末,用蒸馏水复溶,溶液质量浓度分别为1、2、3 g/100 mL,取30 mL
(V0,mL)不同质量浓度鸡爪胶原蛋白肽溶液置于50 mL烧杯中,在12 000 r/min下高速分散2 min,使鸡爪胶原蛋白肽溶液均匀起泡,立即测定均质后总体积(V1,mL),静置40 min再次测定体积(V2,mL)[15]。分别按式(3)~(4)计算鸡爪胶原蛋白肽溶液起泡性和起泡稳定性。
(3)
(4)
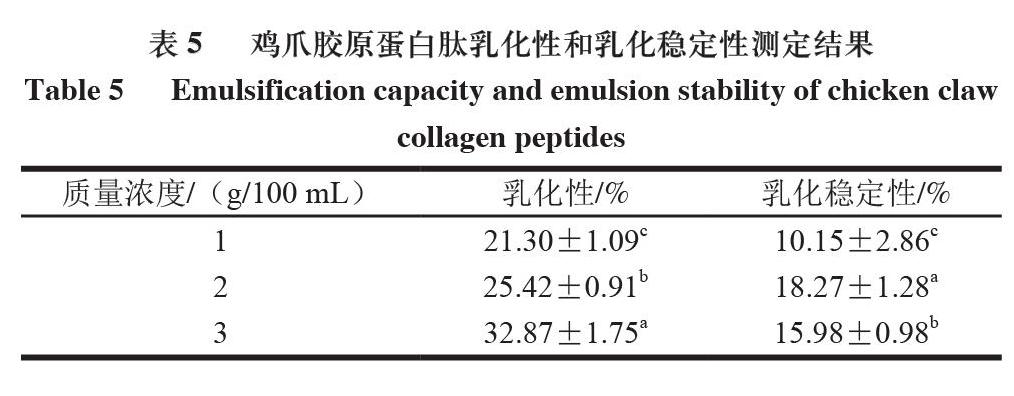
1.3.9 乳化性和乳化稳定性测定
将鸡爪胶原蛋白肽冻干粉末复溶于60 ℃蒸馏水中,质量浓度分别为1、2、3 g/100 mL,取不同质量浓度胶原蛋白肽溶液约3 mL,加入1 mL大豆油,使用均质机(12 000 r/min)将体系混合均匀,分别于均质后0 min和10 min时取容器底部乳液,用提前配制的质量分数0.1% SDS溶液将鸡爪胶原蛋白肽质量浓度分别为1、2、3 g/100 mL乳液分别稀释200、400、600 倍,最后用酶标仪在500 nm波长处测定稀释后乳液的吸光度[16]。乳化性和乳化稳定性分别按式(5)~(6)计算。
(5)
(6)
式中:A0为0 min时鸡爪胶原蛋白肽乳液吸光度;A10为10 min时鸡爪胶原蛋白肽乳化液吸光度;L为比色皿光程(0.01 m);n为溶液稀释倍数;ρ为蛋白质量浓度/(g/100 mL);φ为油相体积分数(25%);Δt为10 min。
1.4 数据处理
运用Excel软件进行实验数据处理,每组实验均重复3 次,结果取平均值。用SPSS 18.0软件采用单因素方差分析、Tukey test法进行统计分析,P<0.05表示两组数据差异显著。使用Origin软件作图。
2 结果与分析
2.1 鸡爪胶原蛋白肽粉末外观颜色表征和等电点
鸡爪胶原蛋白肽粉末均一、细致,未出现明显结块现象,颜色偏向黄色,且无杂质,有少许腥味。由表1可知,所测L*、a*、b*与肉眼观察到的外观颜色特征一致。
等电点是两性电解质特有的物理参数[17],当溶液中正、负离子数量相等时,此时的氢离子浓度为该物质的等电点。在等电点处,蛋白分子受到的静电作用力最弱,而蛋白分子之间相互作用增强,蛋白分子处于稳定状态。蛋白的等电点与其氨基酸组成及结构特性
有关[18]。经测定,鸡爪胶原蛋白肽的等电点平均值为4.73,等电点较低的酸性氨基酸天冬氨酸、谷氨酸含量在鸡爪胶原蛋白肽中含量相对较高,这与氨基酸含量测定结果相一致。
2.2 鸡爪胶原蛋白肽氨基酸组分分析
由表2可知,鸡爪胶原蛋白肽中氨基酸种类较为丰富,甘氨酸、脯氨酸、精氨酸、谷氨酸、丙氨酸含量相对较多。其中甘氨酸含量最高,在总氨基酸含量中占比为17.284%,其次是脯氨酸,在总氨基酸含量中占比为16.565%;含量最少的是胱氨酸和酪氨酸,在总氨基酸含量中占比分别为0.194%和0.733%。疏水性氨基酸在总氨基酸含量中占比26.356%,必需氨基酸在总氨基酸含量中占比为15.556%。孔惠等[19]提取鲑鱼皮明胶并制备胶原蛋白肽,发现在大多数普通蛋白质中脯氨酸含量相对较少,但胶原蛋白及其水解物中脯氨酸含量较高。本实验中鸡爪胶原蛋白肽中脯氨酸含量为16.565%,这与南学敏[20]
对羊骨胶原蛋白肽的研究结果一致,表明所制备鸡爪胶原蛋白肽符合标准胶原蛋白肽的氨基酸组成特征。
2.3 鸡爪胶原蛋白肽的分子质量组成分布
由表3可知,71%的鸡爪胶原蛋白肽分子质量在1.35~17 kDa范围内,27%的胶原蛋白肽分子
质量小于1.35 kDa。研究表明,胶原蛋白肽中小分子质量组分相对含量较多,则其溶解度较好;反之,若胶原蛋白肽分子中大分子质量组分含量较高,则其溶解性较差。综上可知,小分子质量胶原蛋白肽更易被人体吸收,其体内消化转换率更高[21]。
2.4 鸡爪胶原蛋白肽的SDS-PAGE分析结果
泳道1~2. 5 mg/mL鸡膝软骨胶原蛋白肽;泳道3. Marker;泳道4~5. 2.5 mg/mL鸡爪胶原蛋白肽。
由图1可知,质量浓度5 mg/mL鸡爪胶原蛋白肽有3 条清晰且染色较深的条带,分别为α1-链、α2-链和β-链;而质量浓度2.5 mg/mL鸡爪胶原蛋白肽的条带模糊,可能是由于鸡爪胶原蛋白肽溶液的质量浓度直接影响上样量,当质量浓度低时,部分蛋白组分不能被有效电泳分离。凝胶底部有些条带聚集,颜色沉积,可能是由于一些蛋白组分密切联结,导致条带堆积而无法分开。总的来说,鸡爪胶原蛋白肽的电泳条带基本集中分布在α2-链下方,说明胶原蛋白三螺旋结构被破坏,大部分已被酶解为小分子肽。
2.5 鸡爪胶原蛋白的水解度
由图2可知,随酶解时间的延长,鸡爪胶原蛋白肽水解度总体呈上升趋势。在碱性蛋白酶作用下,酶解3 h内水解度增加速率较大,至4 h后逐渐趋于稳定。酶解0~3 h内,胶原分子中含有大量肽键,此时微量的酶解产物对强烈的酶促反应抑制作用微弱,酶-底物络合物开始形成[22],导致水解度不断上升;酶解4 h后,随着反应进行形成大量小分子物质,水解度渐趋于稳定狀态。鸡爪胶原蛋白在酶提时间4 h时水解度最高,约为28.65%。
2.6 雞爪胶原蛋白肽起泡性和起泡稳定性
注:同列小写字母不同,表示差异显著(P<0.05)。表5同。
起泡性及起泡稳定性受到蛋白种类、溶液pH值、溶液质量浓度、环境温度等因素的综合影响[23]。由表4可知,鸡爪胶原蛋白肽的起泡性和起泡稳定性均随质量浓度的增加呈显著升高的趋势(P<0.05)。这是由于随着鸡爪胶原蛋白肽质量浓度的增加,其分子间疏水区域面积增大,黏性增大,使得胶原蛋白肽分子经历迅速搅拌作用后富集于气-液界面,形成密集的多层膜结构,此时胶原蛋白肽的起泡性和起泡稳定性相应得到增强[24]。蛋白质类产品的起泡性与泡沫稳定性在食品工业中应用广泛,其可用作发泡剂替代蛋类,改善烘焙食品的食用品质,使产品质地更加疏松、软糯且可口。
2.7 鸡爪胶原蛋白肽乳化性和乳化稳定性
乳化性用于衡量水油结合形成乳化液的能力,乳化稳定性则反映油水混合乳状液维持稳定的能力[25],二者受物质颗粒大小、加工方式、加工温度和蛋白质质量浓度等因素综合影响[26]。由表5可知,鸡爪胶原蛋白肽的乳化性随质量浓度的增加而逐渐增加,但乳化稳定性呈先增加后降低的趋势,这可能是由于胶原蛋白肽质量浓度增加的同时,蛋白质分子数量也随之增加,形成界面膜的强度和厚度均减弱。鸡爪胶原蛋白肽的乳化性和乳化稳定性显著低于未水解大分子酪蛋白(乳化性76.6%和乳化稳定性90.27%),这说明得到的鸡爪胶原蛋白肽分子质量小,不利于其在油-水界面扩散且吸附能力弱。由于胶原蛋白肽具有乳化性与乳化稳定性可将其用于甜品制作行业。研究发现在面包中添加0.8%胶原蛋白多肽后,面包的体积膨胀和食用品质得到提升,且面包老化时间从3 d提高到5 d,即延长了面包产品的货架期[27]。
3 结 论
首先对超声辅助碱性蛋白酶提取的鸡爪胶原蛋白肽的外观色泽、等电点、分子质量分布、氨基酸组成、SDS-PAGE电泳图及水解度进行系统研究,然后对其起泡性、起泡稳定性和乳化性、乳化稳定性进行测定。鸡爪胶原蛋白肽粉末呈均一、细致状态,颜色偏黄,有少许腥味;平均等电点为4.73,氨基酸组成种类丰富。SDS-PAGE图谱显示,鸡爪胶原蛋白肽电泳条带基本集中在α2-链以下,表明胶原蛋白三螺旋结构遭到严重破坏,大部分已被酶解为小分子肽。优化提取条件下鸡爪胶原蛋白的水解度达到28.65%,鸡爪胶原蛋白肽起泡性和起泡稳定性均较好,具备一定的乳化性和乳化稳定性,但较酪蛋白小得多,可能由于其分子质量相对较小。
通过对鸡爪胶原蛋白肽的理化性质及功能特性综合评估,认为鸡爪胶原蛋白肽理化性能优质,且具备良好的功能特性。但目前国内胶原蛋白肽研究和国外仍有很大差距,产品开发略显单一,胶原蛋白肽特有的理化性质和功能活性特点还存在许多待开发的用途,还应继续深入探究。
参考文献:
[1] BERNARDINI R D, HARNEDY P, BOLTON D, et al. Antioxidant and antimicrobial peptidic hydrolysates from muscle protein sources and by-products[J]. Food Chemistry, 2010, 124(4): 1296-1307. DOI:10.1016/j.foodchem.2010.07.004.
[2] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. DOI:10.1016/0003-2697(76)90527-3.
[3] 李敏雄, 郭斌, 刘飞, 等. 罗非鱼皮胶原蛋白肽制备的工艺优化[J]. 现代食品科技, 2018, 34(7): 205-212. DOI:10.13982/j.mfst.1673-9078.2018.7.030.
[4] 周雪松. 胶原蛋白肽产业现状及发展趋势[J]. 食品与发酵工业, 2013, 39(6): 115-119.
[5] WOITKOWIAK D, FRYDRYCHOWSKI A F, HADZIK J, et al. Identification of small peptides of acidic collagen extracts from silver carp skin and their therapeutic relevance[J]. Advances in Clinical & Experimental Medicine, 2016, 25(02):227-235. DOI:10.17219/acem/36361.
[6] MALISON A, ARPANTUD P, KEERATIPIBUL S. Chicken foot broth byproduct: a new source for highly effective peptide-calcium chelate[J]. Food Chemistry, 2021, 345(6):13-19. DOI:10.1016/j.foodchem.2020.128713.
[7] MOKREJ P, MR?ZEK P, G?L R, et al. Biotechnological preparation of gelatines from chicken feet[J]. Polymers, 2019, 11(6): 24-29. DOI:10.3390/polym11061060.
[8] DE ALMEIDA P F, DE ARA?JO M G O, CURVELO-SANTANA J C. Collagen extraction from chicken feet for jelly production[J]. Acta Scientiarum Technology, 2012, 34(3): 345-351. DOI:10.4025/actascitechnol.v34i3.10602.
[9] 程海明, 王磊, 王睿, 等. Zeta电位法测定胶原及其降解物的等电点[J]. 皮革科学与工程, 2006(6): 40-43. DOI:10.3969/j.issn.1004-7964.2006.06.008.
[10] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中氨基酸的测定: GB 5009.124—2016[S]. 北京:中国标准出版社, 2016.
[11] 林霖. 乌骨鸡多肽产品质量指标及其黑色素提取和含量测定研究[D]. 南昌: 南昌大学, 2007. DOI:10.7666/d.y1238288.
[12] 肖枫, 朱文学, 康怀彬, 等. 正交试验优化黄河鲤鱼鳞酶促溶性胶原蛋白提取工艺[J]. 食品科学, 2015, 36(12): 60-64. DOI:10.7506/spkx1002-6630-201512011.
[13] 黃焕, 王欣, 刘宝林. 鱼鳞胶原蛋白水解度两种测定方法的比较[J]. 食品工业科技, 2010, 31(3):354-356. DOI:10.13386/j.issn1002-0306.2010.03.090.
[14] 王淡兮, 孙秀兰. 蛋白质定量检测方法的探讨[J]. 粮食与食品工业, 2009, 16(4): 49-51; 62. DOI:10.3969/j.issn.1672-5026.2009.04.015.
[15] 祝婧, 刘磊, 张名位, 等. 不同分子质量海鲈鱼胶原蛋白肽组分的功能特性比较[J]. 现代食品科技, 2014, 30(12): 113-118. DOI:10.13982/j.mfst.1673-9078.2014.12.019.
[16] 李静, 冉旭. 大鲵皮胶原蛋白肽理化性质和功能特性研究[J]. 食品工业, 2016, 37(1): 217-222.
[17] XING C, QING Y, QIU K W, et al. Water-soluble myofibrillar protein-pectin complex for enhanced physical stability near the isoelectric point: fabrication, rheology and thermal property[J]. International Journal of Biological Macromolecules, 2020, 142(6): 31-38. DOI:10.1016/j.ijbiomac.2019.10.003.
[18] WANG Y D, GAO B H, CHEN S Y, et al. In vitro corrosion of pure Mg in phosphate buffer solution-influences of isoelectric point and molecular structure of amino acids[J]. Materials Science & Engineering C. Materials for Biological Applications, 2019, 105(3): 24-28. DOI:10.1016/j.msec.2019.110042.
[19] 孔惠, 邢晓平, 曹玉华, 等. 鲑鱼皮明胶的提取及胶原蛋白肽的制备[J]. 食品与生物技术学报, 2018, 37(10): 1042-1047. DOI:10.3969/j.issn.1673-1689.2018.10.006.
[20] 南学敏. 羊骨胶原蛋白肽抗氧化活性及氨基酸组成分析[D]. 呼和浩特: 内蒙古农业大学, 2019. DOI:10.27229/d.cnki.gnmnu.2019.000439.
[21] 张鸽. 河鲀鱼皮胶原蛋白肽提取及其化妆品功效研究[D]. 厦门: 集美大学, 2018. DOI:10.27720/d.cnki.gjmdx.2018.000031.
[22] WANG S N, JIANG L Z, LI Y, et al. Optimization on aqueous enzymatic extraction conditions of pine seed protein by response surface method[J]. Procedia Engineering, 2011(15):4956-4966. DOI:10.1016/j.proeng.2011.08.922.
[23] WOUTERS A G,FIERENS E,ROMBOUTS I,et al. Exploring the relationship between structural and air-water interfacial properties of wheat (Triticum aestivum L.) gluten hydrolysates in a food system relevant pH range[J]. Journal of Agricultural and Food Chemistry, 2017, 65(6): 1263-1271. DOI:10.1021/acs.jafc.6b05062.
[24] 李玉珍, 肖怀秋. 蛋白酶酶解液溶解度对起泡性和乳化性的影响研究[J]. 粮油食品科技, 2009, 17(6): 21-22. DOI:10.3969/j.issn.1007-7561.2009.06.009.
[25] KINSELLA J E. Functional properties of soy proteins[J]. Journal of the American Oil Chemists Society, 1979, 56(3): 242-258. DOI:10.1007/BF02671468.
[26] 樊雪静. 大豆分离蛋白-寡糖复合体系乳化性及乳化稳定性研究[D]. 哈尔滨: 东北农业大学, 2018.
[27] 翁凌, 郑焱戈, 冯雨晨, 等. 胶原小肽和海藻糖对面包抗老化效果的研究[J]. 中国食品添加剂, 2018(12): 163-171.
收稿日期:2021-04-22
基金项目:国家现代农业(肉鸡)产业技术体系建设专项(CARS-41);国家自然科学基金青年科学基金项目(31901612);
江苏省农业自主创新项目(CX(19)2018);江苏省自然科学基金项目(BK20180300)
第一作者简介:周婷(1997—)(ORCID: 0000-0002-8927-7326),女,硕士研究生,研究方向为畜禽副产品的高值化开发与综合利用。E-mail: 1579642322@qq.com
*通信作者简介:邹烨(1986—)(ORCID: 0000-0002-2320-786X),女,副研究员,博士,研究方向为畜禽副产品的高值化开发与综合利用。E-mail: zouye@jaas.ac.cn
王道营(1979—)(ORCID: 0000-0003-1776-5854),男,研究员,博士,研究方向为肉品加工与质量控制。E-mail: wdy0373@aliyun.com

