猕猴桃花粉活力测定方法研究
张 鸿,李秀丽,戢小梅,陈 镇,乐有章,翟敬华,赵志远,陈志伟
(武汉市农业科学院林业果树研究所,武汉 430075)
猕猴桃(Actinidia chinensis)是猕猴桃科猕猴桃属的多年生藤本植物,原产于湖北省宜昌市夷陵区雾渡河镇。猕猴桃枝繁叶茂,花美且香,是作为庭院公园观赏植物的上佳选择,猕猴桃的果实素有“水果之王”之称,果实含有丰富的猕猴桃碱、单宁、糖类以及大量的氨基酸和维生素等营养物质[1],此外猕猴桃还能治疗坏血病,提高人体免疫力。猕猴桃种植收益高,已经成为中国多个地区的扶贫产业。传统果树授粉采用的方式是昆虫授粉,猕猴桃是半蜜源性植物,当花期相同时蜜蜂会优先选择其他的蜜源植物,另外,当花期不遇、花期气候条件差、昆虫数量较少时往往很难达到优质高产的目的,因此,生产中常需要利用人工授粉来提升果园的产量[2]。人工授粉则需要考虑花粉采集的时间、处理方法和贮藏条件等因素对花粉活力的影响。果树花粉的生活力能直接影响授粉、受精和坐果,最终决定产量和品质,因此,在人工授粉之前对花粉活力进行检测尤为重要。目前,对于猕猴桃花粉采集时间、花药分离时间、干燥方法、贮藏条件、测定方法等方面均有研究[3-6],但是在猕猴桃花粉制作、不同方法和浓度配比方面的报道比较较少。本研究从花粉制作、检测方法、浓度配比这3 个方面对猕猴桃花粉活力进行分析,以期对提高猕猴桃的结实率和坐果率、促进猕猴桃产业健康发展奠定基础。
1 材料与方法
1.1 试验材料
供试试验材料取自武汉市农业科学院林业果树研究所基地,位于武汉市黄陂区武湖街道。收集开花前1 d 的中华猕猴桃雄花于广口瓶中,在室内摘掉花瓣,用剪刀剪下花药,室温条件下(25~28 ℃)平铺于纸上(1 d),使其自然阴干。花药裂开后,过细筛筛出花粉并装于青霉素瓶中,放于4 ℃冰箱保存。
1.2 花粉制作
本试验用于测定活力的花粉有两种,一种是过细筛之后的纯花粉,另一种是花粉壳粉碎过筛后将纯花粉和花粉壳按照1∶8 的比例混合[7],现配现用。不同制作方式下的花粉活力用离体萌发法进行测定。
1.3 活力测定
1.3.1 TTC 法 称取0.5 g TTC(2,3,5-三苯基氯化四氮唑),用少量95%乙醇将其溶解,然后加去离子水定容至100 mL,避光保存。在2 mL 离心管中加入2~3 滴TTC 溶液,用棉棒蘸取少量花粉于离心管中混匀,放入35 ℃恒温箱中,15 min 后取1 滴溶液至有凹槽的载玻片中,盖上盖玻片在低倍显微镜下观察,每个视野选择100 粒花粉记录花粉状态,重复3 次。若花粉被染成红色,则生活力强,无色的为生活力弱的花粉。
1.3.2 I2-IK 法 I2-IK 溶液依据IK 浓度的不同分为5 个水平,各浓度梯度配比见表1。分别称取不同质量的IK 和I2,溶解后定容至100 mL,避光保存。在2 mL 离心管中加入2~3 滴I2-IK 溶液,用棉棒蘸取少量花粉于离心管中混匀,室温下孵育30 min 后取1滴溶液置于有凹槽的载玻片中,盖上盖玻片,在低倍显微镜下观察,每个视野选择100 粒花粉记录花粉状态,重复3 次。若花粉被染成蓝紫色,则生活力强,黄褐色的为生活力弱的花粉。

表1 IK 的浓度梯度 (单位:g)
1.3.3 离体萌发法 对离体萌发法蔗糖浓度、硼酸浓度和氯化钙浓度进行了探索,蔗糖浓度为0、5%、10%和20%,硼酸浓度为0、0.05、0.10 和0.20 mg/mL,氯化钙浓度为0、0.05、0.10 和0.20 mg/mL,共计3 个处理4 个水平,为了使试验设计达到最优,采用“3414”试验处理,组合情况见表2。

表2 “3414”试验各处理组合
按照表2 称取蔗糖、硼酸和氯化钙溶于水中,加入0.5%琼脂,pH 调整为6.5,加热待琼脂溶解后在培养皿中倒入薄薄的一层。待培养基凝固后用棉签蘸取少量花粉洒落在培养基上,盖上培养皿盖,在25 ℃恒温箱中黑暗处理4 h 后,在低倍显微镜下观察花粉萌发情况,当花粉管长度大于花粉粒直径时认为花粉具有生活力。每个视野选择100 粒花粉记录花粉状态,重复3 次。
2 结果与分析
2.1 不同制作方法对猕猴桃花粉活力的影响
用离体萌发法对花粉活力进行检测,不同制作方法对猕猴桃花粉活力的影响见表3。在不同培养基中,纯花粉萌发率最高为44.6%,混合花粉萌发率最高为77.9%。在大多数培养基中,混合花粉的萌发率比纯花粉普遍高20~30 个百分点,最高可达37.7 个百分点(处理6)。

表3 不同制作方法对猕猴桃花粉萌发率的影响(单位:%)
2.2 TTC 染色法测定的花粉活力
TTC 与活细胞内的琥珀酸脱氢酶产生红色反映,从而判断细胞的活力。经TTC 染色后的猕猴桃花粉几乎呈现无色的状态(图1A),此方法测定的猕猴桃花粉活力几乎为0,因此,此方法不能如实反映猕猴桃花粉活力的真实情况。
2.3 I2-IK 染色法测定的花粉活力
活细胞经I2-IK 染色会变成蓝色,经I2-IK 染色的猕猴桃花粉呈现黄褐色(图1B),无论染液浓度的高低,染色效果均无变化,此方法测定的猕猴桃花粉活力和TTC 一样几乎为0。因此,I2-IK 染色法同样不能如实反映猕猴桃花粉的活力。
2.4 离体萌发法测定的花粉活力
离体萌发法测定的猕猴桃花粉活力结果见表4,在暗培养2 h 时有部分花粉管萌发,培养4 h 时萌发基本趋于稳定(图1C)。由表4 可见,处理6 测定的猕猴桃花粉活力最高,为77.9%,其次为处理7 的69.7%。对混合花粉的萌发结果进行单因素分析和多重比较,除处理7 以外,处理6 的花粉管萌发率与其他处理具有极显著差异。处理6和处理7的不同在于硼酸浓度不同,处理6 的硼酸浓度为0.1 mg/mL,而处理7的硼酸浓度为0.2 mg/mL。从节省费用、提高测定效果方面考虑,离体萌发法测定猕猴桃花粉活力最佳配比为10%蔗糖+0.1 mg/mL 硼酸+0.1 mg/mL氯化钙。

表4 离体萌发法各处理猕猴桃花粉萌发率
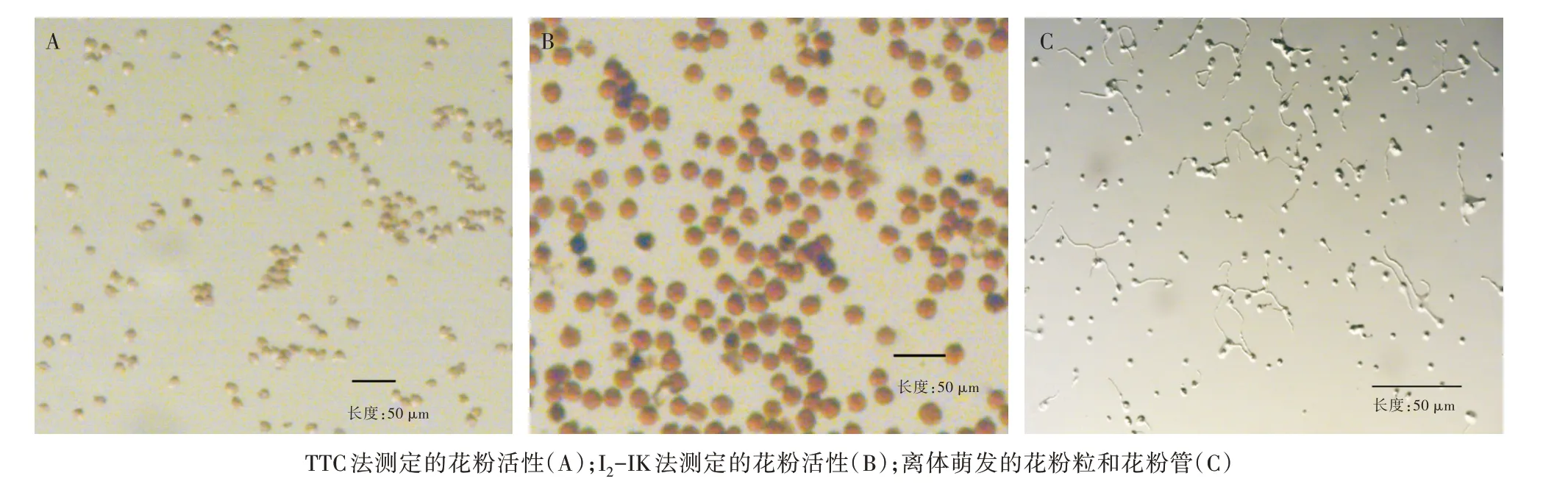
图1 不同方法测定猕猴桃花粉活性
3 小结与讨论
生产上在进行人工授粉时常用花粉辅料与花粉混合授粉,好处在于提高辨识度,减少花粉用量[8],同时可以为花粉提供一个稳定的pH 环境保护花粉活性。目前,对花粉辅料相关的研究较少,本研究分别测定了添加辅料与否的花粉活力,结果表明,添加辅料后有助于花粉管的萌发,因此,花粉辅料可能为花粉萌发提供营养,花粉辅料对花粉的作用还需要通过研究来判断。
花粉活力测定方法较多,TTC 法、I2-IK 法和离体萌发法较为常见。对于野生毛花猕猴桃而言,I2-IK 能有效检测花粉的活力[9]。通过TTC 法测定的大蕾期花粉活力可达82.3%[3]。本研究结果表明,TTC法和I2-IK 法不适用于本研究供试材料活力的检测,可能原因是猕猴桃花粉内琥珀酸脱氢酶和淀粉的含量较低,不能被染成相应的颜色。离体萌发法测定的花粉活力为77.9%,因此,离体萌发法更能反映花粉的活性。
“3414”试验设计吸收了回归最优设计处理少、效率高的特点[10],本试验将“3414”试验设计应用于猕猴桃花粉活力的测定,大大减少了试验处理的组合数,效率高、处理少。当蔗糖浓度为10%、硼酸浓度为0.1 mg/mL、氯化钙浓度为0.1 mg/mL 时,花粉管萌发率最高。在相关研究中,利用离体萌发法测定猕猴桃花粉活力,采用的配方是10%蔗糖和100 mg/L硼酸,这可能与品种、花粉采集时间等不同有关。人工创造的萌发环境和柱头上的萌发环境存在一定的差异,因此,本研究的结果只能反映花粉活性的大小,最理想的萌发条件还需要进行深入的研究。

