补阳还五汤对间歇低氧大鼠心肌miRNA-214/CaMKⅡ信号通路的影响
★ 楼莹 伍娟 王小婷 吴润华 蔡巧燕 陈沁(.福建中医药大学临床技能教学中心 福州 50;.福建中医药大学中西医结合研究院 福州 50;.福建中医药大学中西医结合学院 福州 50)
心血管损害是睡眠呼吸暂停综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)常 见 严重危害健康的并发症;夜间反复的低氧复氧造成氧化应激和炎症反应增多,交感神经兴奋性增高,是OSAHS心血管损害的重要因素[1];OSAHS患者患冠心病、心力衰竭和心律失常等疾病的风险高于正常人。OSAHS早期心肌损伤在医学上被认为是可逆性病变,有效的阻断、减轻或逆转心肌损伤的进程,可在很大程度上改善OSAHS心脏病的预后,甚至可以预防失代偿心功能衰竭的发生。因此,开展防治OSAHS心肌损伤的研究对OSAHS心脏病临床治疗具有重要意义。
补阳还五汤(Buyang Huanwu decoction)出自清代医家王清任所著《医林改错》,是治疗中风的经典方,临床上广泛应用于心血管疾病的治疗[2-3],疗效确切,并将之列为益气活血化瘀的代表方。体内外研究表明补阳还五汤具有抗氧化、抗炎、抗兴奋性氨基酸毒性的作用[4]。课题组前期研究亦表明益气活血化瘀可改善OSAHS患者氧化应激[5],但其具体机制尚不清楚。本研究通过建立间歇低氧大鼠模型,观察补阳还五汤对模型大鼠miRNA-214/CaMKⅡ氧化应激信号通路相关因子mRNA和蛋白表达的影响,探讨中药对其心肌氧化应激的影响及机制。
1 材料
1.1 动物 本课题经福建医科大学动物实验管理委员会批准,所有试验均遵照相关动物保护和使用指南的规定实施。选取SPF级健康雄性SD大鼠,体重(200±20)g,购于上海斯莱克实验动物责任有限公司(生产许可证:SCXK〈沪〉2017-0005),饲养于福建医科大学SPF级实验动物中心(生产许可证:SYXK〈闽〉2016-002)。
1.2 药材 取中药黄芪30 g、当归9 g、川芎12 g、赤芍12 g、地龙12 g、桃仁3 g、红花6 g,饮片置煎煮容器内,加相当于药材量5~7倍的冷水浸泡1~2 h,煮沸30 min,过滤。药渣加3~5倍量水继续煎煮,煮沸20 min,过滤。合并两次滤液,于水浴上浓缩成每毫升相当于原生药材0.5 g的药液,冷却后装入灭菌药瓶,置4 ℃冰箱保存备用。
1.3 试剂 Tunel 检测试剂盒(Roche公司,货号W11684817910);SOD检测试剂盒(南京建成生物公司,货号A001-1);MDA检测试剂盒(南京建成生物公司,货号A003-1);miRNA-214、CaMKⅡ引物设计(Servicebio公司);miRNA-214颈环法逆转录试剂盒(thermo公司,货号GK1622);qPCR 试剂盒(Roche公司);Anti-CaMKⅡ(ABCA公司,货号ab22609);HRP标记山羊抗小鼠(武汉谷歌生物科技公司,GB23301);GAPDH(武汉谷歌生物科技,GB13002-m-1)。
1.4 仪器 ABI 7500Fast实时荧光定量PCR系统;APC 300电泳仪(美国Bio-Rad公司);Mini-PROTEAN Tetra小型垂直电泳槽(美国Bio-Rad公司);DU-650 蛋白核酸分析仪(美国Beckman公司)。
2 方法
2.1 动物分组、模型制备及给药 随机分为常氧组、间歇低氧组、补阳还五汤组,每组8只,间歇低氧组与补阳还五汤组每天9∶00~17∶00置于低氧舱中进行间歇性低氧处理制备模型,常氧组在每天同一时间给予常氧,为期8周。低氧舱采用KY-2F型控氧仪进行氧浓度的调控,通过向低氧舱中循环充入氮气和氧气,达到并维持预定的氧气浓度,其中最低氧浓度为5.1 %,最高氧浓度为21.0 %。每一循环周期分为4个阶段,即氧浓度下降期(50 s)、低氧维持期(20 s),氧浓度上升期(30 s)、常氧维持期(20 s),共计120 s,用以模拟呼吸暂停低通气指数为30次/h的中度OSAHS。暴露开始第一天的同时开始灌胃给药:中药组于每天低氧前、后半小时给予方药灌胃,按方剂饮片合剂量19.2 mL/(kg·d)灌胃。常氧组和间歇低氧组采用等量生理盐水灌胃,造模期间饮食饮水不限。
2.2 取材 8周后所有大鼠均空腹8 h,3 %戊巴比妥钠腹腔注射麻醉,腹主动脉采血后处死,开胸将大鼠心脏完整取出,分离血清,-20 ℃保存;取心室的心肌片段,切片后使其浸泡于4 %多聚甲醛(以pH 7.4的PBS配制)中固定,用于形态学观察。再取数块心室肌组织放入液氮中迅速冷冻后转移至-80 ℃超低温冰箱用于后续实验。
2.3 观察指标
2.3.1 心脏超声心动图检测 异氟烷麻醉小鼠,称重,胸部备皮后置于温垫上,固定四肢并连接电极。麻醉后将小鼠心率控制在400~500次/min进行超声心动图检测。应用VISUALSONICS小动物超声仪,宽频探头,频率30 MHz,聚焦深度1.3 cm,采集小鼠心脏的M型超声心动图像,测量评价心脏结构和功能的各项参数。
2.3.2 血清检测 应用化学比色法检测大鼠血清SOD、MDA,麻醉后腹主动脉采血,静置2 h后用离心机离心10 min(3 000 r /min)取上清,按试剂盒说明书检测SOD、MDA。
2.3.3 心脏组织病理学观察 取心室组织多聚甲醛固定,梯度酒精脱水,二甲苯透明,制备石蜡切片,用HE染色,光镜下观察心肌组织病理改变。
2.3.4 心肌细胞凋亡检测 取大鼠左室心肌组织约120 mg,冰冻切片,用TUNEL法检测心肌细胞凋亡,首先用PBS洗涤玻片,放在37℃湿盒中孵育40 min,用PBS冲洗5次,在其上滴入60荧光底物溶液,室温孵育40 min,用PBS冲洗 5次,DAPI复染细胞核,树脂封片。用IPP 6.2图像分析软件计数和荧光显微镜拍照。
2.3.5 荧光定量PCR检测组织中miRNA-214及CaMKⅡ表达变化 按RNA抽提试剂盒说明书进行,提取总RNA,miRNA-214通过茎环法逆转录试剂盒说明书进行逆转录,按miRNA 荧光定量PCR试剂盒进行cDNA扩增,以U6为内参。CaMKⅡ按普通mRNA逆转录试剂盒进行操作,按荧光定量PCR试剂盒进行cDNA扩增,以β-actin 为内参。PCR引物序列如表1。实验重复3次,数据通过Ct 比较法进行分析,定量(2-△△ct)。

表1 qPCR 引物序列表
2.3.6 Western blot检测 CaMKⅡ蛋白表达变化,依照各试剂盒说明书要求,提取大鼠心肌组织的总蛋白,将等量的蛋白(30 mg),在10 %的SDSPAGE中以80 V恒压电泳35 min,120 V恒压电泳90 min,切取目的条带。100 V低温条件下转膜。在脱脂奶粉封闭液中常温封闭1 h。用一抗孵育过夜,将膜取出,在TBST中充分洗涤。洗膜后,加入HRP标记的相应二抗,常温孵育1 h。将膜取出,在TBST中洗涤后,使用ECL试剂曝光,用Bio-Rad成像仪拍照,ImageJ 软件进行灰度值分析,GAPDH作为内参。
2.3.7 统计学方法 采用SPSS 17.0软件进行统计分析,计量资料以均数±标准差(±s)表示,若方差齐,多组比较采用单因素方差分析,两组比较采用t检验,若方差不齐,则采用非参数检验。计数资料采用χ2检验。以P<0.05为差异有统计学意义。
3 结果
3.1 补阳还五汤对心脏多普勒超声的影响 超声检测发现与常氧组相比,间歇低氧组大鼠左心室舒张末期内径(left ventricular end-diastolic dimension,LVIDd)、左心室收缩末期内径(left ventricular endsystolic dimension,LVIDs)数值增加,射血分数(EF)、心肌缩短分数(FS)数值下降,差异均具有统计学意义(P<0.05),见图1和表2,说明心脏结构发生改变,心脏扩张并出现心脏收缩功能下降。补阳还五汤组与间歇低氧组大鼠对比,LVIDs和LVIDd数值下降,EF、FS数值增加,差异均具有统计学意义(P<0.05),见图1和表2,说明中药组具有抑制心脏结构改变,保护心功能的作用。
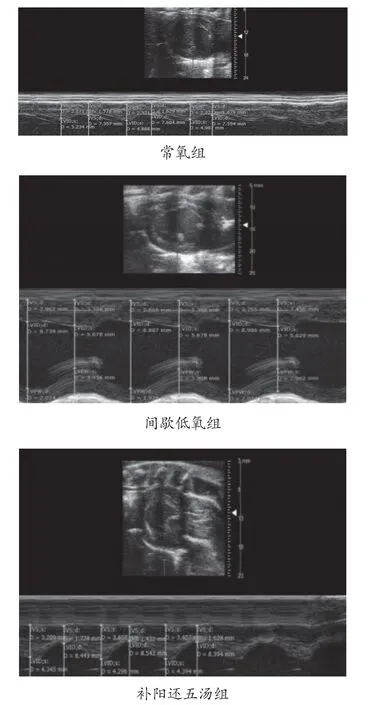
图1 补阳还五汤对心脏超声的影响
表2 补阳还五汤对心脏超声的影响(±s,n=8)
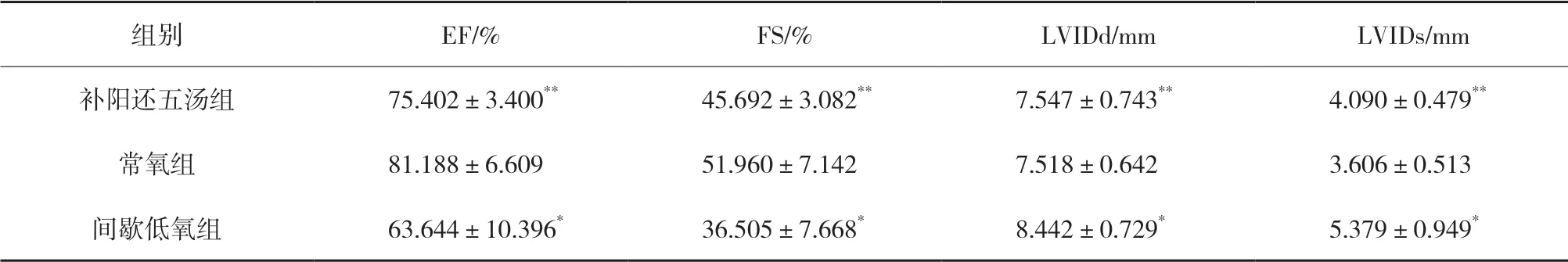
表2 补阳还五汤对心脏超声的影响(±s,n=8)
注:与常氧组比较,*P<0.05;与间歇低氧组比较,**P<0.05。
组别 EF/% FS/% LVIDd/mm LVIDs/mm补阳还五汤组 75.402±3.400** 45.692±3.082** 7.547±0.743** 4.090±0.479**常氧组 81.188±6.609 51.960±7.142 7.518±0.642 3.606±0.513间歇低氧组 63.644±10.396* 36.505±7.668* 8.442±0.729* 5.379±0.949*
3.2 补阳还五汤对病理组织学的影响 光镜下心肌组织病理学改变:(1)常氧组:心肌细胞排列整齐,形态正常,间质中无炎细胞浸润;(2)间歇低氧组:心肌细胞肿胀,细胞界限不清,炎症细胞浸润;(3)补阳还五汤组:心肌细胞形态正常,伴有少量炎细胞浸润。见图2。

图2 补阳还五汤对心肌病理组织学的影响(HE染色 40×)
3.3 补阳还五汤对心肌细胞凋亡的影响 在荧光镜下间歇低氧组的大鼠心肌TUNEL绿色荧光标记的凋亡细胞数量明显多于常氧组,补阳还五汤组凋亡细胞数量明显少于间歇低氧组。见图3。
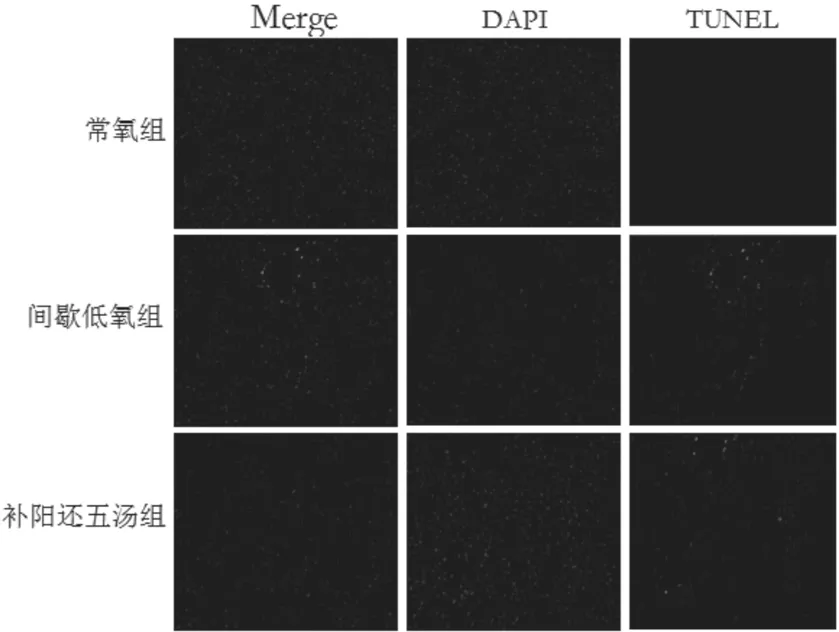
图3 补阳还五汤对心肌细胞凋亡的影响
3.4 补阳还五汤对血清SOD及MDA的影响 与常氧组比较,间歇低氧组血清SOD表达下降,而MDA表达升高,差异均具有统计学意义。与间歇低氧组比较,补阳还五汤组血清抗氧化应激作用的SOD显著增高,而促进氧化损伤的MDA明显下降(P<0.05),见表3。证实补阳还五汤可调控间歇低氧诱导的全身氧化应激效应。
表3 补阳还五汤对SOD和 MDA的影响(±s,n=8)

表3 补阳还五汤对SOD和 MDA的影响(±s,n=8)
注:与常氧组比较,*P<0.05;与间歇低氧组比较,**P<0.05。
组别 SOD/kU·L-1 MDA/mol·L-1补阳还五汤组 557.486±23.028** 5.745±0.309**常氧组 566.680±15.676 5.798± 0.321间歇低氧组 425.745±11.185* 8 .629±0.489*
3.5 补阳还五汤对miRNA-214及CaMKⅡmRNA相对表达量的影响 间歇低氧组miRNA-214相对表达量显著低于常氧组(P<0.05),CaMKⅡmRNA相对表达量显著高于常氧组(P<0.05),与间歇低氧组比较,补阳还五汤组miRNA-214相对表达量显著升高(P<0.05),CaMKⅡ显著降低(P<0.05),见表4。结果表明补阳还五汤对miRNA-214及CaMKⅡ表达有显著调控作用。3.6 补阳还五汤对CaMKⅡ蛋白表达量的影响 与常氧组比较,间歇低氧组CaMKⅡ蛋白表达明显升高(P<0.05),与间歇低氧组比较,补阳还五汤组CaMKⅡ蛋白表达明显降低(P<0.05)。见图4和表5。
表4 补阳还五汤对miRNA-214 和CaMKⅡmRNA表达的影响(±s,n=8)

表4 补阳还五汤对miRNA-214 和CaMKⅡmRNA表达的影响(±s,n=8)
注:与常氧组比较,*P<0.05;与间歇低氧组比较,**P<0.05。
组别 miRNA-214 CaMKⅡ补阳还五汤组 1.506±0.100** 45.692±3.082**常氧组 1.175±0.109 51.960±7.142间歇低氧组 1.864±0.260* 36.505±7.668*
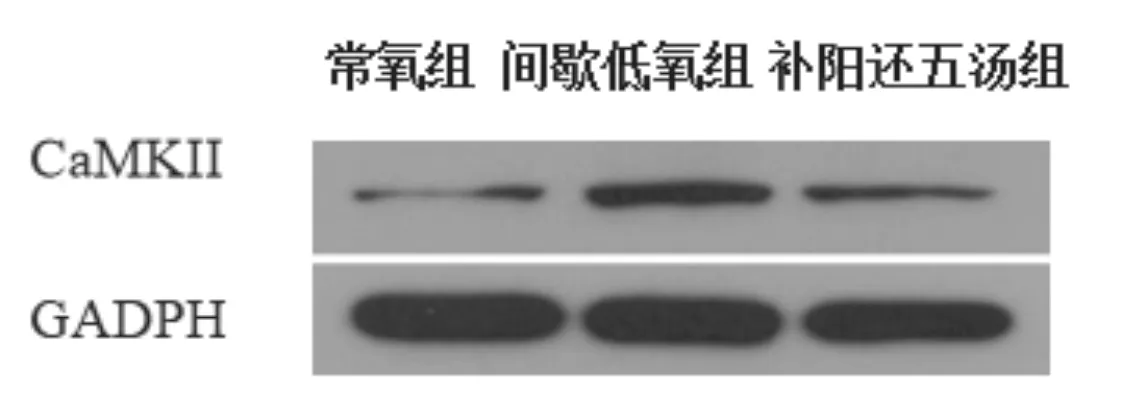
图4 补阳还五汤对CaMKⅡ蛋白相对表达量灰度值的影响
表5 补阳还五汤对CaMKⅡ蛋白相对表达量的影响( ±s,n=8)

表5 补阳还五汤对CaMKⅡ蛋白相对表达量的影响( ±s,n=8)
注:与常氧组比较,*P<0.05;与间歇低氧组比较,**P<0.05。
组别 CaMKⅡ补阳还五汤组 0.346±0.084**常氧组 0.125±0.044间歇低氧组 0.484±0.054*
4 讨论
OSAHS患者特征性间歇低氧诱导机体发生氧化应激反应,是OSAHS靶器官损伤的重要机制[6]。OSAHS患者由于反复发生上气道阻塞,而反复发生缺氧和再氧合,产生了过多的活性氧(reactive oxygen species,ROS),破坏了氧化和抗氧化系统的平衡,导致氧化应激的发生[7],可造成类似心脏缺血-再灌注造成心肌损伤的各种表现。研究表明,在间歇低氧氧化应激损伤过程中往往伴随着心肌细胞活性氧的过度累积,线粒体功能障碍,从而引发心肌细胞凋亡、坏死等变化,因此如何减少间歇低氧引起的心肌氧化应激是预防心肌细胞的凋亡、心肌重构的重要途径。
miRNA是一种长约21~23个核苷酸的RNA分子,在真核生物中广泛存在。研究表明miRNAS可调节多种基因的表达,进而影响细胞的分化、凋亡等生理过程[8]。已发现多种miRNA与心脏的缺血/缺氧损伤有关,如心肌缺血/缺氧损伤存在miR-1、miR-29和miR-320的 表 达 增 高[9-11],miR-21和miR-24的表达降低[12-13]。这些miRNA分子与心肌细胞的纤维化、心肌重构及心肌细胞的凋亡等密切相关[14],miRNA-214既为心脏特异性miRNA,也是缺氧诱导型 miRNA[15-17],研究表明miRNA-214可通过多条信号通路提高心肌细胞抗氧化应激能力[17],并通过抑制钠/钙交换通道1(NCX1)降低氧化应激状态下细胞内钙负荷[18]。而miRNA-214发挥作用需通过调控相应基因表达,通过Target Scan数据库预测CaMKⅡ为miRNA-214靶基因,miRNA-214通过3p'-GACGAC-5p'与CaMKⅡmRNA 5p'-CUGCUGA-3p'相互配对,体外细胞实验证实miRNA-214 靶向抑制CaMKⅡ[19]。CaMKⅡ是一种受钙调蛋白调控的多功能蛋白激酶[20],研究发现CaMKⅡ已成为许多心脏疾病的关键酶[21]。CaMKⅡ作为Ca2+/CaM调节蛋白家族中的一个主要成员,被认为是氧化应激致心肌重构的关键信号之一,此效应可能由于活化的CaMKⅡ可诱导钙离子泄漏通过多途径促进ROS表达增加进一步加重氧化损伤。当ROS过度生成并积累时,会导致SOD消耗性降低,同时组织细胞脂膜发生过氧化损伤,生成大量MDA,促进细胞进一步损害。MDA可通过不同途径造成组织损伤,并能够反映机体受ROS氧化损伤的程度。因而抗氧化治疗手段通过阻断CaMKⅡ与ROS之间联通的桥梁,或许能保护机体免于心肌氧化应激损伤发生。
本实验结果显示,与模型组比较,补阳还五汤组可改善大鼠心脏收缩功能,HE染色显示可改善大鼠心肌病理损害,此外,补阳还五汤显著增加miRNA-214 的表达,从而抑制CaMKⅡ 的表达,使SOD升高,MDA减少,从而改善心肌氧化应激。在细胞氧化损伤过程中,往往伴随着细胞凋亡增加,故本实验进一步采用 TUNEL 法检测细胞凋亡状态,结果显示间歇低氧可诱导细胞凋亡,TUNEL 阳性细胞数增加,而补阳还五汤可明显减少心肌细胞凋亡的发生。
综上所述,补阳还五汤可改善间歇低氧大鼠心肌氧化应激,抑制心肌细胞凋亡,其作用机制可能是通过激活miRNA-214/CaMKⅡ信号通路,miRNA-214可能抑制CaMKⅡmRNA表达,发挥改善心肌细胞内氧化应激作用。

