水系锂离子电池正极材料的研究现状及进展①
魏郑柏荷,张靖佳,2,*,王振波,刘孝伟,王红霞
(1.哈尔滨师范大学化学化工学院,光化学生物材料与储能材料黑龙江省重点实验室,黑龙江 哈尔滨 150025;2.哈尔滨工业大学化工与化学学院,黑龙江 哈尔滨 150001;3.超威电源集团有限公司研究院,浙江 长兴 313100)
1 引言
近年来电池工业作为与交通、医学、科技等领域都密切相关的新能源领域之一,得到了很好的发展。技术的飞速发展使我们对电池的性能提出了更高的要求,生产者希望其成本低、性能高、无污染,使用者希望其体积小、重量轻、寿命长。这为科研人员提出了更高的要求以及更加明确的研究方向[1]。现在已有的镍氢电池虽然使用时间长,但是材料昂贵,单位体积内放出的能量低;铅酸电池虽然价格低廉,但是单位质量内放出的能量少且对环境有污染[2]。相较于其他电池,锂离子电池在单位质量下有更高的电容量,且放电电压更大。
锂离子电池是应用广泛的储能器件之一。现在商业化的锂离子电池大多都采用有机体系做电解液,但是有机溶剂不仅具有毒性和易燃性,成本也很高,导电性能也较差[3-6]。科研人员发现,水系锂离子电池具有廉价、安全、高速率等一系列优势,在许多领域中都具有潜在的应用前景[7-9],但水系锂离子电池在循环性能上还存在一定的问题,正极材料的选择与改性对于其电池性能的提高起着至关重要的作用[10]。近年来,科研人员就水系锂离子电池正极材料进行了一系列研究,取得了突破性的进展。本文主要总结了近年来用于水系锂离子电池的正极材料,并对改进和制备方法进行了汇总,对正极材料未来的发展趋势进行了展望。
2 水系锂离子电池
水系锂离子电池,是以水作为溶剂的溶液为电解液的二次电池。近年来,科研人员不断尝试在水系锂离子电池中使用新的材料。水系锂离子电池也是依靠Li+在两极之间来回移动进行工作:充电时,Li+从正极脱嵌,经过电解质嵌入负极;放电时,Li+又从处于富锂状态的负极以相同的路径返回正极(如图1所示)。
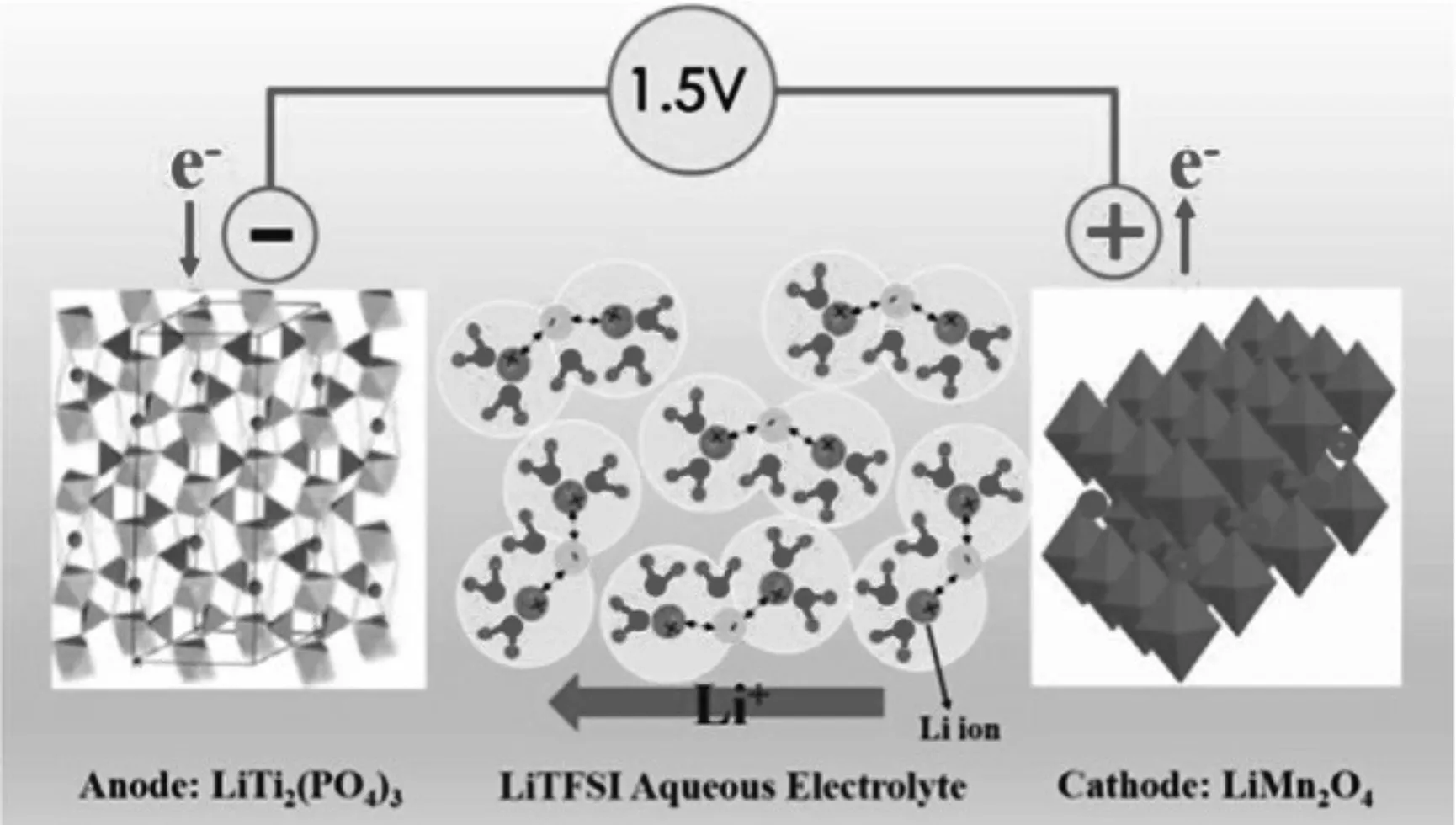
图1 水系锂离子电池工作原理图[11]
从热力学角度来说,水的电化学稳定窗口为1.23 V,考虑到动力学因素的影响,电化学窗口可能会扩大[12]。Mahesh等人[13]通过高温自生压力法合成了LiNi0.8Co0.2O2正极材料。他们分别在水电解质和非水电解质中研究了Li+的电化学阻抗谱。研究表明,在水电解质和非水电解质中,Li+在LiNi0.8Co0.2O2电极中的嵌入/脱嵌机理基本相同。它的电化学表达式为:
正极反应:
LiNi0.8Co0.2O2→Li1-xNi0.8Co0.2O2+xLi++xe-(x<1,0.65 V)
负极反应:
Li1-xNi0.8Co0.2O2+xLi++xe-→LiNi0.8Co0.2O2(x<1,0.63 V)
3 水系锂离子电池的正极材料
材料需要结构稳定,且具备良好的Li+嵌入/脱嵌通道。在选择材料的过程中科研人员不仅要考虑其结构和尺寸大小,也要考虑电池的工作电压以及pH值对材料的影响,下图中虚线分别为析氧和析氢的电位值,虚线之间为水的稳定范围,超出该范围的电极材料就会使水水解,从而影响电池性能。
在正极材料方面,LiCoO2、LiMn2O4、LiFePO4等插层化合物以及NCM等三元正极材料得到了广泛的研究。科研人员也进行了大量的改性工作,不断尝试用包覆、掺杂等方法来提高正极材料的循环性能。
3.1 氧化物电极材料
3.1.1 层状LiCoO2
LiCoO2具有放电电压高、易合成、稳定性高等优点,由于离子电导率较高,LiCoO2材料在水系电解质溶液中的电流响应和氧化还原行为的可逆性都优于有机电解质溶液,早在1995年就作为正极材料应用于锂离子电池中。
Aziz等人[15]在不同的搅拌时间下合成了LiCoO2样品。被搅拌30 h的六边形LiCoO2产生了最高的峰强度和最小的粒径。研究表明,其粒径在0.32~0.47 μm,且LiCoO2显示了115.49 mAh·g-1的高初始比容量(如图2所示);Liu等人[16]以金属镉为负极,纳米LiCoO2为正极,在0.5 M Li2SO4和10 mM Cd(Ac)2中性水溶液中组成了电池。研究表明,该电池具有72 Wh·kg-1的能量密度,其电化学性能可与镍镉电池媲美,且环保性能更佳;随着便携式电子设备供电需求的不断增长,现如今迫切需要低成本、高安全性的柔性、可穿戴式储能设备。Man等人[17]在碳纳米管纤维上分别合成了无粘结剂的LiCoO2多边形片状正极材料(LCO@CNTF)和橄榄球状的NaTi2(PO4)3负极材料(NTP@CNTF),并在饱和Li2SO4溶液中组装了准固态纤维状柔性水系可充锂离子电池(FARLIB)。研究表明,LCO@CNTF电极在饱和Li2SO4溶液中具有出色的容量和非凡的速率性能。同时,由于LCO@CNTF和NTP@CNTF的协同作用,FARLIB的容量为45.24 mAh·cm-3,能量密度为67.86 mWh·cm-3,优于大多数报道FARLIB。该电池还具有良好的灵活性,在弯曲3 000次后能保留94.74%的容量,为可穿戴储能设备的设计提供了新的前景。

图2 LiCoO2在不同倍率下的充放电曲线[15]
由于钴金属的价格较为昂贵,且对环境污染大,近年来LiCoO2的使用率正在逐渐降低。通过在LiCoO2材料中掺杂其他无污染元素可以降低其对环境带来的危害。
3.1.2 尖晶石型LiMn2O4
尖晶石型LiMn2O4具有原材料资源丰富、成本低、安全性高、无污染、易制备、比容量高、表面积大、电荷转移阻力小等优点,且其骨架结构有利于Li+的嵌入/脱嵌,是如今的研究热点。
Mehdi和Abdolmajid[18]合成了结晶良好、尺寸很小的LiMn2O4纳米粒子,并对其进行了表征。研究表明,其最小的粒径约为50 nm,平均粒径约为125 nm,其中无酸水溶液电解质可防止Mn2+的溶解;Zhu等人[19]研制了高柔性LiMn2O4/CNT正极材料。无粘结剂的LiMn2O4/CNT电极具有良好的力学性能、高电导率和有效的电荷传输,能获得更高的速率性能和更高的循环稳定性,可应用于超薄、轻便的电子设备;Abdollahifar等人[20]利用纳米ZnMn2O4在Li2SO4水溶液电解质中进行原位电化学阳离子交换,成功地制备了一种具有超长循环性能的纳米正方结构的LiMn2O4电极。其伪电容特性使该电极能够大电流环境中运行而不影响循环寿命,并且在低电流负载下有高的电荷存储容量。另外,Abdollahifar等人还制作了一个表格,总结了近几年水系电池中LiMn2O4材料的性能;Wen等人[11]合成了LiMn2O4材料并在不同浓度的电解液中测试其循环性能。研究表明,在15 M的LiTFSI溶液中该电极有最好的循环性能。在1 C速率下,其初始放电容量为111 mAh·g-1,1 400次循环后容量保持率高达88%(如图3所示)。

图3 LiMn2O4在不同浓度的LiTFSI溶液中速率为1 C时的循环寿命[11]
由于Jahn-Teller效应,LiMn2O4的立方结构会退化为不均匀的四边形,其表面的Mn2+也会溶解于电解液,导致电池容量衰退。而其电极表面发生锂化形成其他不需要的锰锂化合物也是造成电极容量衰减的重要原因。用Al、Ni、Cr、Co、Na等其他元素替代锰[21],可以降低其容量衰减,采用电极材料包覆的方法对其进行改进,也可以使电池性能有很大的提升。
3.1.3 其他氧化物
近年来,科研人员将镍锰酸锂材料和镍钴锰酸锂材料[22]作为水系锂离子电池的正极材料进行了研究。Wang等人[23]研究了将LiNi0.5Mn1.5O4和Mo6S8作为正负极在WIS(Water-in-salt)水系电解液中的电化学行为。研究表明,LiNi0.5Mn1.5O4在经过50次0.5 C低速率循环和400次5 C高速率循环后结构没有发生变化,优化电极材料比例后,其初始比容量最高可达140 Wh·kg-1(如图4所示);Li等人[24]分别合成了微棒、微球、纳米块三种NCM (LiNi1/3Co1/3Mn1/3O2) 样品。三种样品中,NCM纳米块表现出最佳的电化学性能。即使在50 C的高电流密度下,其放电容量也仍为50.1 mAh·g-1,显示出纳米块作为水系锂离子电池正极的巨大潜力。

图4 (a)采用LiNi0.5Mn1.5O4和Mo6S8作为正负极的全水锂离子电池在0.5 C恒流条件下的典型电压分布图;(b)循环前后LiNi0.5Mn1.5O4电极的XRD谱图[23]
虽然镍锰酸锂材料和镍钴锰酸锂材料在结构和性能上显示了更强的稳定性,与LiCoO2材料相比成本也更低,但是在使用过程中仍有不可逆的能量衰减,导致电池循环性能变差。
3.2 磷酸盐电极材料
橄榄石型磷酸盐系正极材料(LiMPO4,其中M=Fe,Mn,Co,Ni)因为具有廉价易得、环境友好等优点,被认为是很有应用潜力和研究潜力的正极材料,近年来引起了科研人员的兴趣。
Lee等人[25]对LiFePO4表面官能团的数量随pH值的变化情况进行了定量分析,研究了LiFePO4电极在水介质中的表面化学变化。研究发现,LiFePO4中Li+的溶解增加了酸性表面基团的数量,Fe2+的溶解减少了碱性表面基团的数量,这些变化使粒子的粘度增加,从而降低了材料的电化学性能;Hou等人[26]制备了三维大孔LiFePO4材料将其作为正极,金属锂作为负极,在0.5 M Li2SO4溶液中建立了水系锂离子电池体系。研究表明,该体系稳定输出电压为3.32 V;Minakshi等人[27]为研究一种新型水系可充电池正极材料,制备了LiNiPO4材料并对其进行了表征。研究表明,在氧化过程中Li+的脱嵌行为形成了无定形的NiPO4和少量的镍(II)氢氧化物(β-NiOOH),而在还原过程中Li+并没有完全嵌入,其工作效率仍需进一步提高。但是LiNiPO4材料具有的高电位使其在实现高能量密度方面具有很大的潜力;Zhao等人[28]合成了LiMn0.6Fe0.4PO4正极材料,组成了(LiMn0.6Fe0.4PO4/C)//LiV3O8水系锂离子电池,研究了其在不同水溶液电解质中的化学性能。研究表明,其在pH为7的饱和LiNO3溶液中的电化学性能最佳。
由于磷酸系电极材料本身的性能不佳,导致Li+的扩散系数较低,倍率性能较差,且高OH-和高的溶解氧含量会加速LiFePO4材料循环性能的衰退。通过对磷酸系材料进行包覆可以提高Li+的扩散速率,提高电池性能。
3.3 其他电极材料
除上述电极材料外,还有一些研究较少的电极材料,例如:Li2MnSiO4。Ndipingwi等人[29]采用水热法合成了Pmn21相的Li2MnSiO4纳米粒子作为水系锂离子电池的正极。研究表明,Li2MnSiO4纳米粒子平均直径在14~25 nm之间;由于钒基化物在氧化还原流电池中有较好的电化学可逆性,Shao等人[30]还组装了以LiVOPO4为正极、VO2为负极、20 M LiTFSI水溶液为电解液的全钒水系锂离子电池。该电池显示了出色的循环稳定性,在超过1 000次循环后仍有84%的容量保留,可应用于能量存储设备(如图5所示);其次还有六氰基金属类材料,例如:普鲁士蓝,它因为具有更大的离子通道而被大量应用于钠离子电池中[31]。
图5 LiVOPO4-VO2全电池
水系锂离子电池的正极材料中,LiCoO2和LiMn2O4和LiFePO4在循环性能方面都还需要进一步改进;另外,还有一些结构中不含Li+的正极材料,例如:MnO2、FePO4、六氰基金属[32]和SnCl2等[33],它们虽然具有出色的电化学性能,但需要先在负极嵌入锂才能使用。
4 水系锂离子电池正极材料的改进
4.1 正极材料存在的问题
使用水作为溶剂可以降低电池电极的制造成本和对环境的负面影响,但是这对正极材料的溶解和集电体的腐蚀提出了新的挑战[34]。由于水溶液中H+的半径小,所以也能像Li+一样嵌入到电极材料当中,通过调解溶液的pH来控制质子的嵌入电位,改变电极材料的微观结构,可以使问题得到解决。Dominko等人[35]以柠檬酸盐为原料,制备了多孔LiFePO4/C颗粒。颗粒中由于柠檬酸阴离子的热分解而产生了孔隙,研究表明,颗粒内部形成的交错的孔隙对电化学行为有很大的影响;Manjunatha等人[36]用高温自生压力法制备了LiMnPO4正极材料。研究表明,在较低浓度的电解质中LiMnPO4会发生质子嵌入,而在较高浓度的电解质或饱和溶液中,Li+的嵌入/脱嵌反应成为主要反应,但质子的嵌入/脱嵌作用仍不可忽视。
在选择电极材料时,比表面积也是一个重要的因素。虽然LiMn2O4正极材料对环境友好且成本较低,但与钴和镍基正极材料相比,其循环寿命更低。正极材料的溶解导致电池在较高的温度条件下,特别是在50 ℃以上的环境循环时,电池容量会严重降低;Zhou等人[37]合成了未包覆碳以及包覆碳的三维花状LiFePO4。研究表明,制得的花状LiFePO4介孔材料表现出高的初始嵌锂能力,这是由于高的比表面积所产生的(如图6所示)。

图6 (a,b)未包覆碳以及(c,d)包覆碳的三维花状LiFePO4 SEM图像[37]
在插层电池中,由于离子在电极之间进行嵌入/脱嵌过程,会导致电极膨胀发生机械变形。这也会进一步导致电极在循环过程中产生降解和溶解现象。由于用于水溶液电解质的电极更厚,这种现象会更加明显。较厚的电极需要克服传统上可以通过薄电极解决的问题,如高速离子传输。适当粘结剂的选择对厚格式电极的速率性能的提高有巨大的影响。聚偏二氟乙烯(PVDF)是锂离子电池中应用最广泛的粘结剂。但其使用N-甲基吡咯烷酮(NMP)作为溶剂,具有严重的安全和环境问题,而水溶性可处理粘合剂,例如:聚四氟乙烯(PTFE)、羧甲基纤维素(CMC)粘结剂,更便宜、更环保、更容易用于电极制造,是未来发展的方向[38]。
水系锂离子电池的容量在充放电循环中衰减很快,对于这一问题,虽然可以研究多种水系锂离子电池体系使其性能提高,但是通过提高电极材料的稳定性来提高电池寿命是水系锂离子电池急需解决的问题。
4.2 正极材料的优化
在合成正极材料的过程中,科研人员为提高其稳定性已经做了大量的工作。不幸的是,由于材料的充放电周期寿命短,许多合成的正极材料不足以用于商业生产。从实际应用来看,为了提高电池的性能,科研人员的许多工作都集中在正极材料结构的修饰和成分的优化上。
4.2.1 电极材料包覆
对电极材料进行包覆是改善其性质的一种方法。对LiFePO4材料进行包覆,可以提高其放电容量与循环稳定性,也可提高Li+的扩散速率和电极的倍率性能。迄今为止,碳涂层、金属氧化物、金属氟化物以及聚吡咯(PPy)等涂层都有了一定的应用。
碳涂层技术提供了一种在水溶液电解质中提高电池循环性能的有效方法,多项研究结果表明包覆碳的LiFePO4材料在循环稳定性方面有显著提高。Noerochim等人[39]成功合成了含9%碳、14.5%碳和17.8%碳三种不同碳含量以及不含碳的LiFePO4/C材料。研究表明,含9%碳的LiFePO4/C材料充放电效果最好(如图7所示);Zhang等人[40]研究了作为正极材料的LiFePO4/C复合材料在水溶液电解质中的物理和电化学性能。LiFePO4/C显示了优异的速率能力和循环能力。其电化学性能的提高是由于均匀、导电的碳保证了Li+的扩散路径,使电极间有连续的电接触;Duan等人[41]采用溶胶-凝胶法和煅烧法制备了包覆碳纳米管(CNTs)和絮状碳层的橄榄石型LiFePO4正极材料,通过对比实验研究了絮状碳层对水系锂离子电池电化学性能的改善作用。结果表明,由于絮状碳层的添加,Li+扩散系数增加了一个数量级。
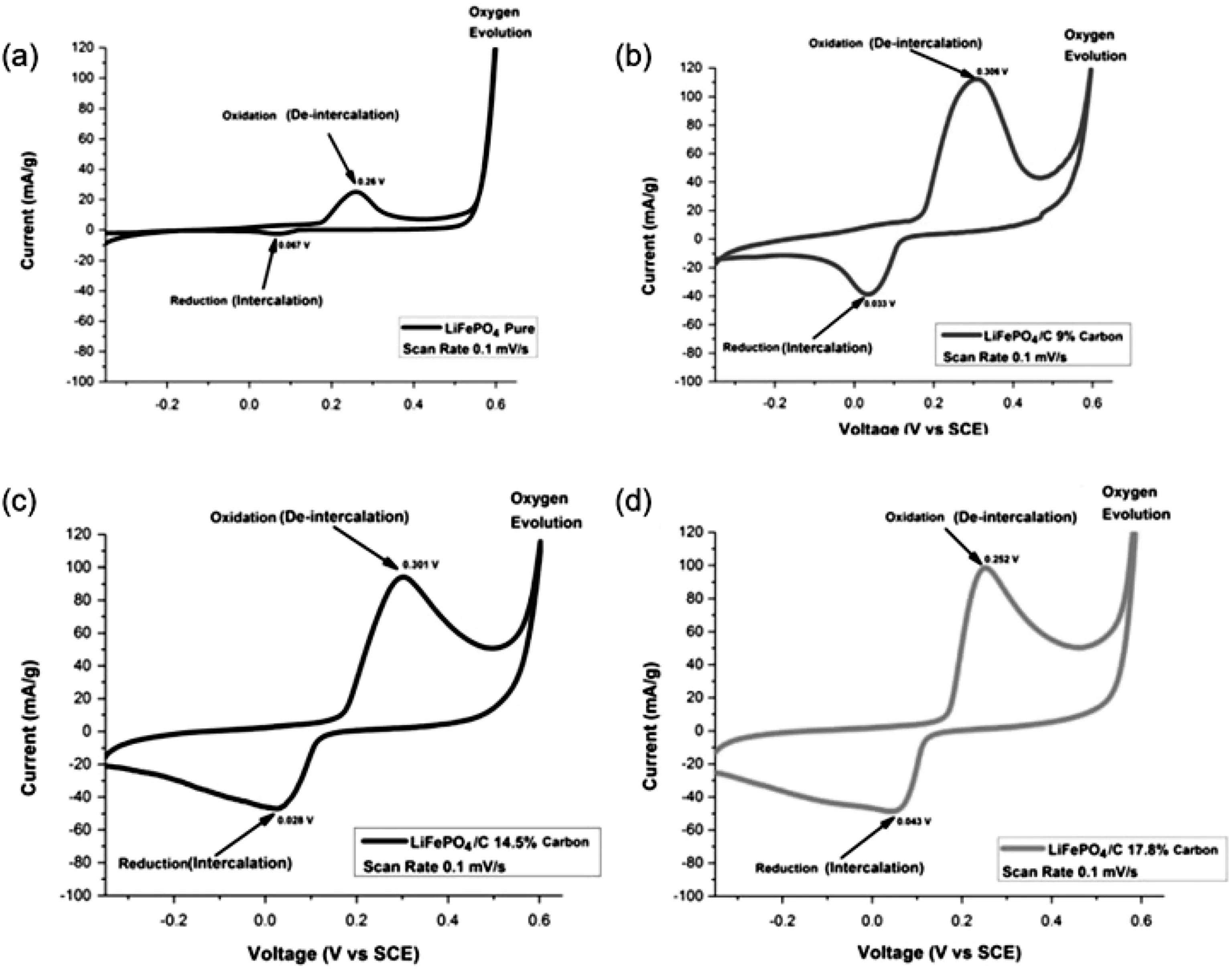
图7 不包覆以及包覆不同含量碳的LiFePO4/C材料在pH为13的1 M Li2SO4溶液,0.1 mV·s-1的扫描速率下的循环伏安曲线图:(a)不含碳;(b)含9 %碳;(c)含14.5 %碳;(d)含17.8 %碳[39]
对LiMn2O4材料进行包覆可以降低锰离子在电解质溶液中的溶解度,提高电池性能。Zhu等人[42]制备了具有LaF3涂层的LiMn2O4复合材料。研究表明,含有3 wt% LaF3的材料(L-3-LMO)是最佳复合材料。它在10 C的速率下能提供109.5 mAh·g-1的放电容量,在100次循环后电池容量还保持在107.9 mAh·g-1;Tron等人[43]采用简单的化学沉积方法在LiMn2O4粉末上制备了均匀的AlF3涂层。研究表明,包覆2 wt% AlF3的LiMn2O4材料具有最好的性能。在1 M Li2SO4水溶液中,与原始材料相比,被包覆的LiMn2O4成功地降低了电解质溶液与活性物质之间的副反应,降低了电极材料的表面劣化,其容量保持率可达90%,具有更长的循环寿命;Schuppert等人[44]利用原位法在LiMn2O4上包覆了多孔氧化铁纳米涂层。研究表明,包覆涂层的LiMn2O4材料表面形成的Li2MnO3显著减少,从而提高了LiMn2O4结构的稳定性。由于氧化铁纳米涂层的包覆,在500次深度充放电循环过程中,LiMn2O4材料保持了的电化学稳定性和结构完整性。
也可对LiCoO2材料进行包覆,提高电池的循环稳定性。Tian等人[45]对LiCoO2材料进行改性,用TiO2进行包覆并分析了它的充放电行为。当电流密度增加到一定程度时,有涂层的LiCoO2材料的放电容量远高于无涂层的LiCoO2材料,且有涂层的LiCoO2材料在100个循环周期后的放电容量无明显下降。
4.2.2 电极材料添加剂
除了对正极材料进行包覆,外加物质也会对正极材料的性质产生影响。Li等人[46]研究了在加入和不加入聚丙烯酸铵(PAA-NH4)分散剂的情况下,LiCoO2的分散性能和相应的电池性能。研究表明,PAA-NH4可以吸附在LiCoO2和KS-6石墨粉上,使其在水悬浮液中稳定,未添加PAA-NH4的LiCoO2薄片具有明显的粉体团聚和粘结剂在粉体周围聚集的现象。但过量的PAA-NH4的加入也对LiCoO2电极的电子传导、粘附强度和电化学性能有不利影响(如图8所示);Stojkovi等人[47]研究了碳酸乙烯(VC)对Li1.05Cr0.10Mn1.85O4中Li插入性能的影响。在无添加剂的情况下,其初始放电容量为80 mAh·g-1,在50次循环后,放电容量下降到初始值的44.1%。当VC添加量为1 wt%时,其初始放电容量为112 mAh·g-1,100次循环后仍保持82%的放电容量;由于电解液的温度范围较窄,限制了可充电电池的低温性能,尽管水溶液电解质的冰点比传统锂离子电池的低,但其冰点仍高达0 ℃,Tron等人[48]在水溶液中添加乙二醇水溶液防冻添加剂,以提高水系锂离子电池的低温性能。适当含量的乙二醇扩大了水溶液电解质的温度范围,达到了低冰点和高离子电导率之间的平衡,从而增强了其循环性能,降低了电极的极化作用。此外,通过改变防冻剂的含量还可以控制纳米LiFePO4材料中锂离子的嵌入/脱嵌过程,从而提高离子电导率。具有防冻添加剂的水系可充锂离子电池有利于电动汽车、高空无人机、潜艇、机器人和航空航天等应用的各种复杂操作。

图8 (a) PAA-NH4在LiCoO2和KS-6石墨上的吸附作用随PAA-NH4加入量的变化;(b) PAA-NH4加入量对LiCoO2和KS-6石墨在水悬浮液中沉降高度的影响;(c) PAA-NH4浓度对LiCoO2电极片黏附强度和表面电阻的影响[46]
5 水系锂离子电池正极材料的制备方法
水系锂离子电池正极材料的制备方法主要分为固相法和液相法。固相法包括固相合成法,在合成正极材料时一般使用高温固相合成法;液相法包括水热法、溶胶-凝胶法和共沉淀法等方法。
5.1 高温固相合成法
高温固相合成法是在高温下固体反应物之间通过接触反应形成氧化物的方法,由反应物经过球磨法或其它混合法的预处理或者直接煅烧而获得产物。这种方法成本低,工艺简单,形成的产物不团聚、产量大,也是常用的掺杂方法。这种方法也存在一定的问题,比如能耗大、效率低且容易混入杂质等。
5.2 水热法
水热法是以水作为溶剂,将粉体原料进行溶解再结晶的方法。它在高压密闭环境下进行,一般包括配制、水热反应、过滤、洗涤等操作。水热法可以使用廉价的原料,合成晶粒发育完整、粒度小、分布均匀的产物。由于水热法在操作过程中很少采用有机化合物,且合成一维纳米结构是提高电池正极材料倍率性能的有效方法,所以水热法经常用于电极材料的制备,也是常用的掺杂和包覆方法。Duan等人[49]采用水热法经过煅烧制备了LiFePO4/C/石墨烯正极材料。研究表明,采用LiFePO4/C/石墨烯作为正极组成的电池在0.5 C速率下提供了153 mAh·g-1的容量,即使在50 C的速率下经过200次循环后也仍能提供95 mAh·g-1的放电容量。优异的倍率性能表明该正极材料具有良好的电化学性能,在储能和大功率电源领域拥有巨大的潜力。但是由于水热法高温高压的制备条件,该方法对设备的依赖也很强,限制了它的发展。所以,水热法在逐渐向低温条件下发展。
5.3 溶胶-凝胶法
溶胶-凝胶法使用高活性的前躯体,利用水解、缩聚反应等原理,在液相条件下先形成溶胶体系,再形成凝胶,然后进行煅烧等过程,最终合成纳米材料。这种方法不需要很高的温度,可以在很短的时间内就实现分子水平的均匀,宜合成各种新型材料,也是常用的掺杂和包覆方法。Duan等人[41]通过溶胶-凝胶法制备了覆盖石墨烯和碳层的橄榄石型LiFePO4,然后进行煅烧,所得到的复合物被用作正极建立了水系可充电锂离子电池系统。研究表明,该系统在1 C速率下提供了158 mAh·g-1的容量,即使在50 C的速率下经过250次循环后也仍能提供110 mAh·g-1的放电容量。但是一般溶胶-凝胶法过程复杂制备时间较长,使用的原料也有许多有机物,不仅有害健康而且还价格昂贵,目前还存在一定的缺陷。
5.4 共沉淀法
共沉淀法是指通过加入沉淀剂,直接得到溶液中的多种阳离子(前驱体)的方法。得到的前驱体再经洗涤、干燥、煅烧等过程形成最终产物。这种方法制备的产物粒度小且分布均匀,也是常用的包覆方法。化学沉积氧化法、简单的化学沉积法、原位法、简单有效的高温自生压力法也是常用的掺杂和包覆方法。Li等人[50]为研究合成工艺对LiFePO4正极材料前驱体FePO4·2H2O性能的影响,通过该方法制备了一系列FePO4·2H2O粒子。研究表明,表面活性剂、陈化时间和超声时间对FePO4·2H2O颗粒的团聚和形貌均有显著影响。共沉淀法虽然具有工艺简单,时间短等优点,但是沉淀剂的加入可能引起团聚等现象,是反应的缺点。
6 展望
本文从水系锂离子电池正极材料的种类、改进方法和制备方法这三方面系统的整理了水系锂离子电池正极材料的研究进展。水系锂离子电池有价格低廉、无毒无害、安全性能高、离子电导率高等优势,是更具前景的储能器件。层状LiCoO2、尖晶石型LiMn2O4和磷酸盐系电极材料作为常见的水系锂离子正极材料具有易合成、比容量高等一系列优势。水系锂离子电池电解液中质子的嵌入/嵌脱反应,以及电极的溶解反应是电极材料的主要副反应。可以通过添加电极材料添加剂,对电极材料进行掺杂、包覆来解决这些问题,以提高电池的循环性能。目前关于水系锂离子电池正极材料的研究还不算全面,今后可以从以下两方面进行研究。
(1)以现有的正极材料为基础,在材料的配比、制备方法以及改性工艺上进行优化,以提高电极材料在水系锂离子电池中的稳定性。水系锂离子电池中容量衰减的问题一直存在,通过对电极材料进行改进是解决这一问题的方法之一。
(2)研究全新的水系锂离子正极材料。合成成本低、易制备、放电电压高、稳定性好、无环境污染的正极材料将对水系锂离子电池工业产生巨大影响。

