降纤酶制备中β-丙内酯对脂包膜病毒灭活能力研究
张洪波 赵成跟 黄兴建

摘要:目的 研究降纤酶制备工艺中β-丙内酯对脂包膜指示病毒的灭活能力,为该产品病毒安全性评价提供依据。方法 用微量滴定法测定β-丙内酯工艺处理前后各批次样品中指示病毒VACV和VSV的滴度,按Reed-Muench法計算病毒滴度,并计算β-丙内酯处理前后各批次样品中各指示病毒的滴度下降值。结果 β-丙内酯静置灭活2h后,蛇毒溶液中VACV滴度均降至检出限1.7 logs以下,滴度平均下降值≥4.3 logs;8h后,蛇毒溶液中VSV滴度均降至检出限1.7 logs以下,滴度平均下降值≥5.0 logs。对照组蛇毒溶液静置24h后VACV滴度平均下降0.4 logs,VSV滴度平均下降0.3 logs。结论 降纤酶制备工艺中的β-丙内酯工艺是一个有效的灭活脂包膜病毒的工艺步骤。
关键词:尖吻蝮蛇蛇毒;β-丙内酯;VACV;VSV
Abstract: Objective To study the ability of β-Propiolactone to inactivate lipid-encapsulated indicator viruses in the preparation process of defibrase, and to provide a basis for the virus safety evaluation of the product. Methods Microtiter method was used to determine the titers of indicator viruses VACV and VSV in each batch of samples before and after the β-Propiolactone process. The virus titer was calculated according to the Reed-Muench method, and the titer of each indicator virus in each batch of samples before and after the β-Propiolactone treatment was calculated. Decline value. Results After the BPL was inactivated for 2 hours, the VACV titer in the snake venom solution fell below the detection limit of 1.7 logs, and the average titer decrease was ≥4.3 logs. After 8 hours, the VSV titer in the snake venom solution fell to the detection limit of 1.7. Below logs, the average drop in titer is ≥5.0 logs. The VACV titer of the snake venom solution in the control group decreased by 0.4 logs and the VSV titer decreased by 0.3 logs after being allowed to stand for 24 hours. Conclusion The β-Propiolactone process in the preparation of defibrase is an effective process step for inactivating lipid-enveloped viruses.
Keywords: Agkistrodon venom; BPL; VACV; VSV
【中图分类号】R97 【文献标识码】A 【文章编号】2107-2306(2021)09--03
降纤酶是从尖吻蝮蛇蛇毒中提取分离得到的一种类凝血酶,是以丝氨酸为活性中心的蛋白水解酶,直接作用于纤维蛋白原,释放血纤肽A(FPA),生成非交联的纤维蛋白,具有显著的去纤、降粘、溶栓等作用,临床上广泛应用于治疗和预防心脑血管血栓性疾病[1]。
然而蛇毒粗毒成分非常复杂, 除类凝血酶外还含有神经毒素、细胞毒素、肌肉毒素等多种活性成分,为引起各种毒副作用的主要原因[2];现行降纤酶质量标准要求降纤酶产品纯度达到SDS-PAGE电泳纯, HPLC测定纯度需大于90%[3],而天然蛇毒中的类凝血酶绝大多数为酸性蛋白质, 经典的蛋白质提纯方法如盐析、热变性、酸碱变性、有机溶剂沉淀、超速离心等, 由于专一性差和分辨率不高,不能有效去除病毒类杂质,已很少用于降纤酶的制备。
β-丙内酯(BPL)是一种杂环类烷化剂,可作用于病原体DNA或RNA,改变病毒核酸结构,使病毒失去传染性,从而达到灭活目的,而不直接作用于蛋白,对病毒具有很强的灭活作用,可以单独用来灭活病毒或与紫外线照射结合应用,具有易水解、灭活时间段等优点[4-7]。
在证明生产过程中病毒灭活的研究中,灭活研究的指示病毒应选择制品可能污染的病毒或理化性质相似的病毒,至少应包括单链和双链的RNA及DNA、脂包膜和非脂包膜、强和弱抵抗力、大和小颗粒等病毒;至少应包括一种对物理和/或化学有明显抗性的病毒。本研究参照《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术评审一般原则》[8],选择脂包膜病毒牛痘病毒(vaccinina Virus,VACA)和水疱性口腔炎病毒(Vesicular Stomatitis Virus,VSV)作为研究的指示病毒,旨在探索降纤酶制备工艺中BPL对指示病毒VACA和VSV的灭活能力,为该产品病毒安全性评价提供依据。
其中其中VACV属脂包膜双链DNA病毒,大小300nm×250nm,中等理化抗性;VSV属脂包膜单链RNA病毒,大小75×175nm,低理化抗性。
1 材料及方法
1.1 样品
尖吻蝮蛇蛇毒(批号:M192017001、M192018001、M192018002)由本公司提供。
1.2 指示病毒及细胞
VACA病毒(批号:20180820)、VSV病毒(批号:20180306)由苏州良辰生物医药科技有限公司购
自中国典型培养物保藏中心,并进一步扩增成工作病毒。
Vero细胞由苏州良辰生物医药科技有限公司购自中国科学院典型培养物保藏委员会细胞库,并进一步传代为工作细胞。
1.3 主要试剂
β-丙内酯(批号:20171101)、牛血清白蛋白(批号:224X055、224X0520)购自北京莱宝科技有限公司,抗五步蛇血清(批号:试20170903)购自上海赛伦生物科技有限公司,MEM培养基(批号:AD15805276)购自通用电气医疗系统贸易发展(上海)公司Hyclone细胞培养部,胎牛血清(FBS)(批号:20150804)购自兰州民海生物工程有限公司。
1.4 方法
实际工艺中β-丙内酯处理的温度为2~8℃,本研究选择工艺条件中较难灭活病毒的条件即较低的温度(3±1℃)进行试验;取样时,尖吻蝮蛇蛇毒溶液用MEM培养基50倍稀释并用抗五步蛇血清中和以终止取样后的BPL对病毒的继续灭活以及降低样品对指示细胞的影响。据此设计了一系列实验组和对照组,实验组设置0、1h、2h、4h、8h和24h六个取样点,用以考察不同时间段β-丙内酯对指示病毒的灭活能力;对照组设置白蛋白对照、起始滴度对照组、细胞毒性对照、未处理对照、中和剂对照、终止效果对照、病毒对照和细胞阴性对照。
试验组:尖吻蝮蛇蛇毒溶液加入0.1%β-丙内酯溶液混匀定容后按9:1(样品:病毒,V:V)比例加入指示病毒VACV和VSV,使β-丙内酯的浓度为0.025%,搅拌混匀后置于3±1℃恒温水浴静置灭活,于各取样时间点取样,用MEM培养基50倍稀释并用20%抗五步蛇血清中和后测定病毒滴度。
白蛋白对照组:以牛血清白蛋白代替尖吻蝮蛇蛇毒,经相同工艺浓度、相同工艺过程处理后,测定各取样点的病毒滴度。
起始滴度对照组:取与试验组相同浓度的尖吻蝮蛇蛇毒和牛血清白蛋白,按9:1(样品:病毒,V:V)比例加入指示病毒VACV和VSV,用MEM培养基50倍稀释后测定病毒滴度。
细胞毒性对照组:尖吻蝮蛇蛇毒溶液用MEM培养基50倍稀释加入20%抗五步蛇血清中和、0.1%β-丙内酯溶液用MEM培养基稀释使成0.025%的溶液、尖吻蝮蛇蛇毒溶液经β-丙内酯处理后用MEM培养基50倍稀释,分别加入指示细胞Vero细胞,在倒置显微镜下观察Vero细胞生长状况。
未处理对照组:尖吻蝮蛇蛇毒溶液和牛血清白蛋白溶液加入指示病毒VACV和VSV,于3±1℃水浴静置24h,测定病毒滴度。
中和剂对照组:抗五步蛇血清用MEM培养基50倍稀释后加入指示病毒VACV和VSV测定病毒滴度。
终止效果对照组:三批次β-丙内酯灭活蛇蛇毒溶液中VACV和VSV第24h取样的样品其50倍稀释度的细胞孔(测定为阴性的细胞孔)分别进行盲传三代,在倒置显微镜下观察Vero细胞生长状况。
病毒对照组:取指示病毒VACV和VSV,按1:9(病毒:培养基,V:V)比例加入MEM培养基,再用MEM培养基50倍稀释后测定病毒滴度。
细胞阴性对照组:MEM培养基加入指示细胞Vero细胞,在倒置显微镜下观察Vero细胞生长状况。
用微量滴定法测定实试验组和对照组样品的病毒滴度,并将不同时间点所取的尖吻蝮蛇蛇毒样品用细胞维持液(含2%FBS的MEM培养基)做10倍梯度稀释至10-7,立即加入已接种Vero细胞的96孔板中,置于5%CO2培养箱,37℃孵育(VACA用Vero细胞培养168h,每隔72h换液一次;VSV用Vero细胞培养72h),在倒置显微镜下观察指示细胞的病变情况。按Reed-Muench法计算病毒滴度(以半数细胞感染剂量TCID50表示,TCID50对数值=高于50%组病变的病毒稀释度的对数值+距离比例),并计算β-丙内酯处理前后各批次样品中各指示病毒的滴度下降值。
为了确认尖吻蝮蛇蛇毒样品中指示病毒是否完全被灭活,在滴定β-丙内酯灭活蛇毒溶液中VACV和VSV第24h取样的样品时,分别将培养168/72h后未出現Vero细胞病变的50倍稀释度的测定细胞孔,反复冻融3次(放置于-35℃冰箱,待完全凝固后取出,置于37℃培养箱中融化,如此反复冻融3次),离心取上清液,分别滴加至接种Vero细胞的96孔板中,37℃吸附1h后换含有2%FBS的MEM培养基,置于37℃、5%CO2培养箱中培养(VACA用Vero细胞培养168h,每隔72h换液一次;VSV用Vero细胞培养72h)。在倒置显微镜下观察Vero细胞生长状况,如未观察到细胞病变,重复上述操作2次,如仍观察不到细胞病变,即为盲传三代无病变,表明样品中指示病毒VACV和VSV均被完全灭活。
2 结果
2.1 β-丙内酯灭活试验
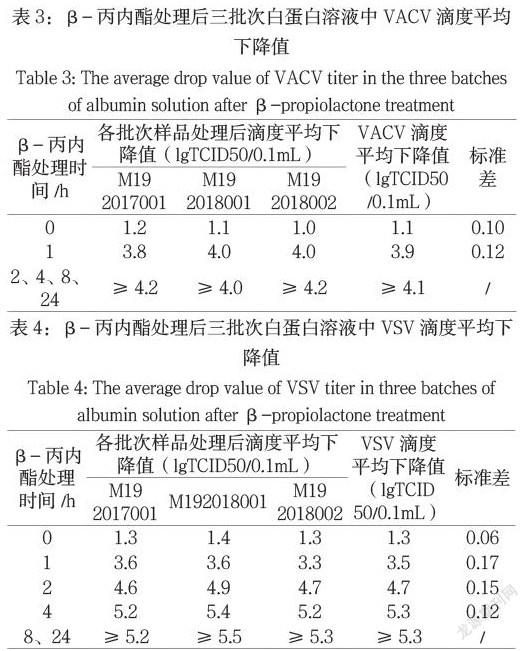
经0.025%BPL灭活2h三批次蛇毒溶液中VACV滴度均降至检测限1.7 logs以下,滴度平均下降值≥4.3 logs;灭活8h三批次蛇毒溶液中VSV滴度均降至检测限1.7 logs以下,滴度平均下降值≥5.0 logs。
2.2 对照试验
2.2.1白蛋白对照试验,经0.025%β-丙内酯灭活2h三批次牛血清白蛋白中VACV滴度均降至检测限1.7 logs以下,滴度平均下降值≥4.1 logs;灭活8h三批次牛血清白蛋白中VSV滴度均降至检测限1.7 logs以下,滴度平均下降值≥5.3 logs。
2.2.2起始滴度对照试验,尖吻蝮蛇蛇毒和牛血清白蛋白起始滴度与试验组不存在差异。
2.2.3细胞毒性对照试验,Vero细胞生长良好。
2.2.4未处理对照试验,三批次蛇蛇毒溶液中VACV滴度平均仅下降0.4 logs,三批次牛血清白蛋白溶液中VACV滴度平均仅下降0.3 logs;三批次蛇蛇毒溶液中VSV滴度平均仅下降0.3 logs,三批次牛血清白蛋白溶液中VSV滴度平均仅下降0.2 logs。
2.2.5中和剂对照试验,三批次抗五步蛇血清中VACV和VSV滴度平均仅下降0.4 logs。
2.2.6终止效果对照试验,指示细胞Vero细胞均正常生长,即盲传三代无病变。
2.2.7细胞阴性对照试验,Vero细胞正常生长。
3 讨论
细胞毒性试验结果显示20%的抗五步蛇血清能中和尖吻蝮蛇蛇毒,β-丙内酯处理后的样品其50倍稀释度对Vero细胞生长均无影响,因此指示病毒VACV和VSV的滴度最低检测限均为1.7 logs。
试验组三批次终止效果验证对照和病毒起始滴度差均<0.5 logs,表明所取样品经终止反应(用培养基50倍稀释并用抗五蛇血清中和)后对指示病毒不再具有灭活作用,对指示细胞也不再具有毒性作用,因此本研究中采用培养基50倍稀释并用抗五步蛇血清中和以终止β-丙内酯灭活并消除蛇毒毒性的方法是有效的。
中和剂对照中,相同浓度的抗五步蛇血清中加入指示病毒VACV和VSV后,与病毒本身滴度相比,其滴度下降值均<0.5 logs,表明该中和剂本身对指示病毒VACV和VSV均没有灭活作用,用该五步蛇血清中和蛇毒对病毒灭活效果不会产生影响。
未处理对照中,蛇毒溶液和牛血清白蛋白溶液中加入指示病毒后随实验组于3±1℃水浴静置24h,三批次样品中VACV和VSV滴度下降值均<0.5 logs,表明相同工艺时间内样品本身对指示病毒VACV和VSV均没有灭活作用。
三批次β-丙内酯灭活蛇毒溶液中VACV和VSV第24h取样的样品其50倍稀释度的细胞孔(测定为阴性的细胞孔)分别进行盲传三代,指示细胞Vero细胞均正常生长,即盲传三代无病变,表明指示病毒VACV和VSV被完全灭活。
《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术评审一般原则》中规定“对于生物组织提取制品应包含两种从机制上能够互补的有效工艺步骤,至少一个处理步骤应具有针对非脂包膜病毒的去除和/或灭活效应;”“一般将病毒感染性滴度减少≥4 logs的处理步骤认可为有效的病毒去除/灭活工艺步骤。”,《血液制品去除/灭活病毒技术方法及验证指导原则》[9]中规定“如果制品的生产工艺中包含两步或两步以上病毒去除/灭活方法,应该分别进行病毒灭活效果验证。”“病毒降低量(log10)≥4 logs,表示该步骤去除/灭活病毒有效。如因检测方法造成病毒降低量<4 logs时,应盲传三代,如无病毒检出,可认定是有效的灭活病毒方法”。
因此本次研究表明降纤酶制备工艺中的β-丙内酯工艺是一个有效的灭活脂包膜病毒的工艺步骤。
参考文献:
[1]陈艳坤,刘诗翔.蛇毒降纤酶的研究进展[J],西南国防医药,2012,22(2):223-225.
[2]罗晓清,杨化新,金少鸿,等.降纤酶研究进展[J].中国药事,2008,22(11):1008-1013.
[3]国家食品药品监督管理局.国家药品标准[S].化學药品地方标准升为国家标准第十六侧,WS1-XG-031-2000.88-89.
[4]石真真,李倬.动物血清病毒灭活研究进展[J].甘肃农业,2011,(05):9-12.
[5]蒋建江,戚凤春,胡艳灵,等.BPL对甲型肝炎病毒的灭活效应[J].中国生物制品学杂志,2012,25(5):529-530.
[6]冯若飞,樊得英,韦鹏建,等.BPL对脑心肌炎病毒你灭活效果的试验[J].中国兽医杂志,2011,47(8):19-21.
[7]姜立民,林晓波,高磊,等.BPL对狂犬病病毒的灭活效果[J].国际流行病传染病学杂志,2014,41(2):137-139.
[8]国家食品药品监督管理局.生物组织提取制品和真核细胞表达制品的病毒安全性评价技术评审一般原则[S].2005.
[9]国家药品监督管理局.血液制品去除/灭活病毒技术方法及验证指导原则(国药监注[2002]160号)[S].2002.

