颅内动脉瘤的现代研究进展与中医药潜在治疗策略
吴恺怿,张 琳,黄娜娜,林佳坤,孙 蓉, 4
颅内动脉瘤的现代研究进展与中医药潜在治疗策略
吴恺怿1, 2, 3,张 琳3,黄娜娜2,林佳坤1,孙 蓉2, 4*
1. 山东中医药大学,山东 济南 250355 2. 山东大学第二医院,山东 济南 250033 3. 天津中医药大学,天津 301617 4. 山东大学高等医学研究院,山东 济南 250012
颅内动脉瘤(intracranial aneurysm,IA)是颅内动脉血管因先天异常或后天损伤等因素导致局部的血管壁扩张,在血流动力学负荷和其他因素作用下,IA逐渐发展乃至破裂引发蛛网膜下腔出血,引起严重的精神症状甚至危及生命。其发病机制复杂,可能与细胞损伤的继发反应关系密切,同时该过程还受炎症反应影响而加重。提出通过抑制炎症反应阻断动脉瘤发生发展过程的中下游环节,从而阻止或延缓IA的发生发展,降低破裂风险的潜在干预策略;自噬与凋亡二者对血管平滑肌细胞表型转换有协同作用,此过程可能为治疗IA的潜在机制。将中药对心脑血管病调控平滑肌细胞的表型转化和自噬、调控炎症通路的机制进行梳理和挖掘,对中药作为延缓IA发生和发展的治疗策略进行展望。
颅内动脉瘤;炎症;自噬;凋亡;中药治疗策略
颅内动脉瘤(intracranial aneurysm,IA)是指颅内动脉血管由于先天异常或后天损伤等因素导致局部的血管壁损害,在血流动力学负荷和其他因素作用下,逐渐扩张形成的异常膨出。多发于颅底动脉分叉处尤是Willis动脉环及其主要分支等血管壁所受血流冲击较大的部位,具有自发性破裂出血的倾向[1]。随着影像学技术的发展,提早发现的动脉瘤可以采用血管介入、手术夹闭或者药物干预等方式进行防治,减少由动脉瘤破裂引起的致死、致残等问题。但血管介入和手术夹闭的治疗方法均存在出血以及并发症的风险,对于治疗风险和动脉瘤破裂后果还需谨慎权衡。目前,祖国医学对IA并未给予确切的认识,但考虑其病位和发病症状,常将其归于“中风”“头痛”范畴。目前中医对IA的辩证分型标准尚未统一,主要围绕IA破裂致蛛网膜下腔出血(subarachnoid hemorrhage,SAH),研究中医药对其临床干预的多途径、整合优势的疗效,发现可有效干预IA的发生发展。本文总结了炎症反应、平滑肌细胞表型变化、自噬与凋亡等与动脉瘤发生、发展有关的机制和关键指标,为探索IA的中医药防治策略提供新思路。
1 现代医学对IA的发病机制与治疗策略研究进展
1.1 IA形成的影响因素
IA破裂是引起蛛网膜下腔出血的最常见病因,患者轻则表现为突发头痛、呕吐、意识障碍,癫痫样发作及脑膜刺激征;重则产生压迫症状、导致偏瘫、动眼神经麻痹及梗阻性脑积水。患者呈现轻重不一的神经功能障碍、失语、深浅感觉减退、失明、精神症状等,甚至危及生命。目前虽然IA的病因病机尚不完全清晰,但与先天遗传和后天因素密切相关[2]。基因突变导致的蛋白异常表达会直接或间接影响动脉壁结构、功能血管内皮细胞稳定性降低, 既使血流作用力不变,也易形成IA;且血流动力学增加、动脉粥样硬化(atherogenesis,AS)等也是影响IA形成的重要因素[3-4],尤其是壁面切应力的变化可直接促发局部内皮细胞功能改变和血管重塑;AS的关键病因是脂代谢异常,可致神经退行性变,影响IA的生成。此外,高血压、性别、年龄、甚至吸烟等不良生活习惯也诱发和加重AS,促进动脉内膜变性,形成IA。
1.2 颅内动脉瘤的治疗干预策略研究进展
颅内动脉瘤临床主要以血管介入治疗[5]和开颅夹闭治疗[6]为主。临床手术夹闭治疗较血管介入治疗可以降低动脉瘤破裂复发,但患者术后认知功能恢复和围术期并发症发生率较不如血管介入治疗,且位置较深的动脉瘤破裂不适于用手术夹闭治疗。两者均存在出血等并发症的风险。因此,亟待寻找一种从发病机制入手的药物对IA的发生、发展和破裂进行有效干预。
目前临床主要应用非选择性环氧合酶和选择性环氧合酶-2(cyclooxygenase 2,COX-2)抑制剂这两大类非甾体抗炎药减轻IA进展[7]和破裂过程中的炎症反应,从而用于IA治疗。Gruszka等[8]开展临床初步研究表明阿司匹林以其抑制炎症反应,用于降低颅内动脉瘤破裂风险的潜在治疗药物,仍需进一步扩大研究对象进行前瞻性随机设计,以评估阿司匹林在预防小型、无症状、未破裂的颅内动脉瘤中的作用。他汀类药物[9-10]因降低人血胆固醇含量、增强血管壁防御能力,降低内皮性反应,抑制颅内动脉瘤患者病情进展、降低破裂风险。近来肠道菌群[11]也在颅内动脉瘤发生发挥了一定作用,补充牛磺酸或菌群丰度有助于形成治疗IA的新策略,尤其是不宜手术或手术出现并发症的非破裂IA患者。
2 血管平滑肌细胞功能与IA的关系
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)功能的变化,包括其表型转化、自噬以及凋亡等,在IA的发病机制中起到重要作用。总结见图1。
2.1 血管平滑肌细胞的表型变化与IA的关系
VSMCs表型转化最早是由Chamley- Campbell[12]等观察到VSMCs在体外呈现的2种形态变化,VSMCs可从收缩型(分化型)平滑肌细胞变为合成型(去分化型)。收缩型VSMCs以收缩型基因表达水平高以及增殖、迁移、细胞外基质(extracellular matrix,ECM)合成低为特点[13-14]。近年来研究发现VSMCs表型变化是VSMCs在受到环境影响(即处于机体发育的不同阶段或血管疾病的不同病理状态)而出现的形态、功能和结构的变化。机体血管中的VSMCs通过收缩控制血管的管径和张力,其呈现收缩表型作用的蛋白如平滑肌α肌动蛋白(smooth muscle alpha actin,SMα-actin)、平滑肌22α等。当血管出现损伤或血管局部环境发生变化时,VSMCs会呈现极大的功能可塑性,从“收缩/分化型”向“合成/去分化型”转变,随着其表型转化,血管收缩相关的蛋白表达降低,而与VSMCs的增殖、迁移等相关的标志蛋白表达提升。研究发现,VSMCs表型转换是IA、AS等血管病发生和发展的重要步骤,诸多因素如炎性因子、转录因子、脂质、血管活性因子、血流剪切力及活性氧等对VSMCs的功能和表型均具有调节作用[15-16]。
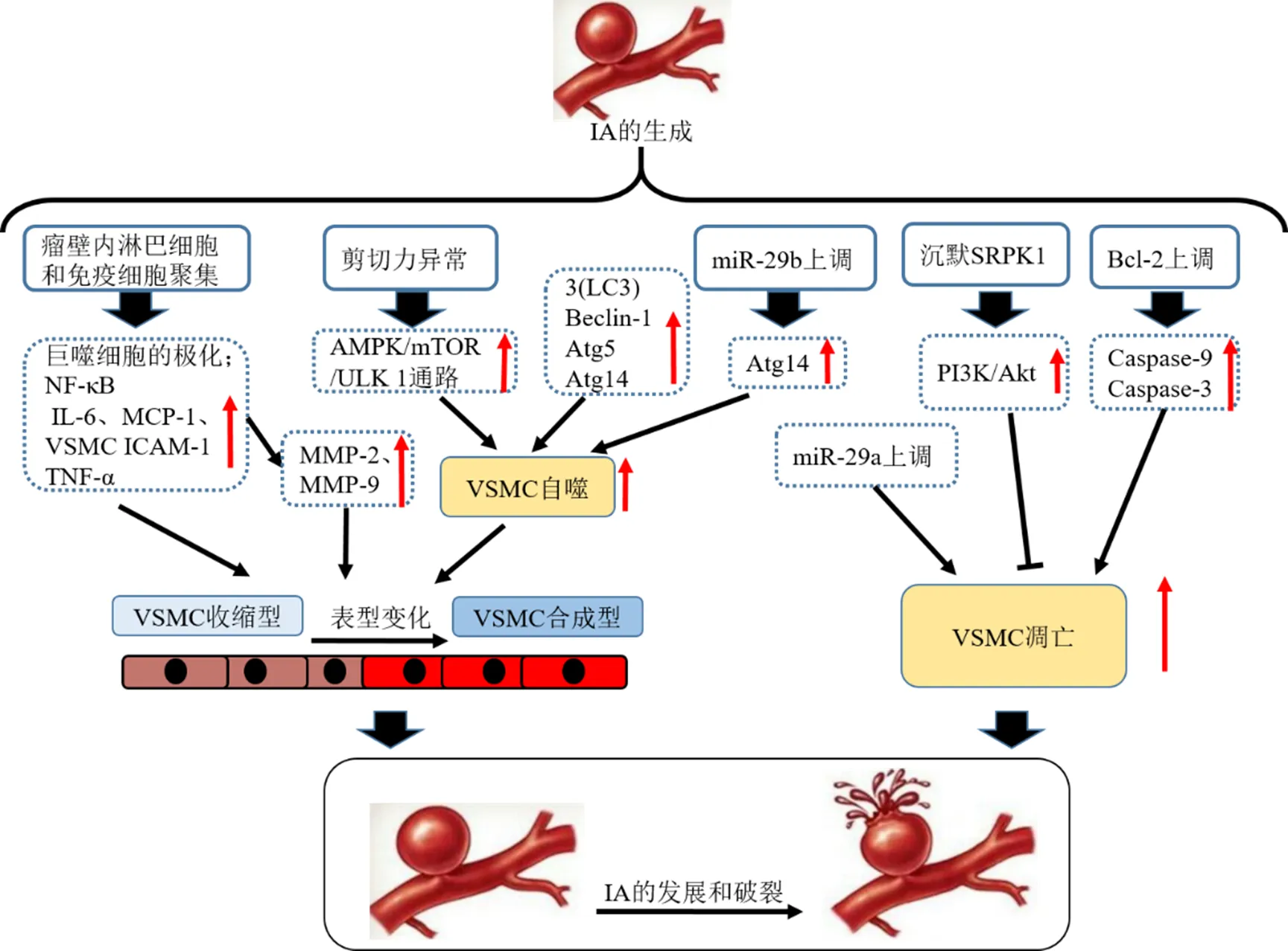
图1 VSMC炎症、自噬、表型变化及凋亡与IA病理进程的关系
VSMCs的表型变化主要由环境因素和遗传程序调控,现有对血小板衍生生长因子(platelet-derivedgrowth factor,PDGF)和转化生长因子-β(transforming growth factor-β,TGF-β)研究得较为深入。研究显示,PDGF促进VSMCs去分化型的表达,会提升细胞增殖和迁移的速率。PDGF家族共有5种同源二聚体,研究表明[17],血小板衍生生长因子-BB(PDGF-BB)可诱导Krüppel样因子4(Krüppel-like factor 4,KLF4)的表达和磷酸化,促进KLF4与NF-κB的相互作用,抑制KLF4与信号传导蛋白3、人组蛋白脱乙酰化酶2的结合,从而实现VSMCs去分化。另有结果显示,PDGF信号还可通过促进miR-221的表达[18],抑制miR-143/145的表达,调节VSMCs去分化[19]。TGF-β超家族是一类分泌型多肽信号分子,与PDGF信号的作用恰好相反,可抑制KLF4的表达,促进KLF4的降解,促进miR-143/145的表达等,维持VSMCs分化表型。Shi等[20]的研究表明,Nrf-2的激活抑制了体内IA的发展,Nrf-2的激动可抑制VSMCs从收缩型向合成型的表型改变,同时减轻H2O2诱导的VSMCs增殖、迁移和凋亡,最终实现对IA形成、发展的抑制作用。
总结目前报道,PDGF、TGF-β与Nrf-2在基因、分子层面共同调控VSMCs表型的转化。相关机制可随着研究的不断深入,可作为临床治疗的潜在指导。
2.2 血管平滑肌细胞的自噬与IA的关系
VSMCs受血流剪切力影响,呈现收缩或舒张改变血管内径,同时动脉壁VSMCs以及细胞间基质(extracellular matrix,ECM)的变化引起动脉的慢性改变[21]。自噬通过调节细胞功能参与血管功能的调控,与IA的发生、发展和破裂的过程相关[22]。在IA的初始阶段,VSMCs自噬激活可显著增强VSMCs的增殖及迁移能力,并且促使VSMCs由收缩型向合成型转化,成为IA形成的始动因素;随着IA的发展,自噬与细胞凋亡之间的关系由拮抗作用转变为协同作用或促进作用,大量凋亡的VSMC导致IA的破裂。抑制自噬可抑制VSMCs的表型转化,进而阻止IA的形成及进展[22]。
有报道显示AMPK/mTOR/ULK1信号通路与剪切力介导的自噬作用有关[23],Sun等[24]研究发现剪切力变化激活AMPK/mTOR/ULK1通路的自噬而促进VSMCs表型调控,可成为延缓IA发生、发展的机制;另有研究显示,活化的AMPK/mTOR信号与SPARC介导自噬有关[25],提示SPARC通过AMPK/mTOR信号通路介导自噬激活,调节VSMCs表型变化,干预IA的发生和发展。另有临床研究证实,正常人血管组织、未破裂和破裂的IA组织中,自噬相关基因自噬微管相关蛋白轻链3、Beclin-1、自噬相关蛋白-5 (Atg5) 和Atg14的mRNA表达水平依次升高。基因敲除显著促进VSMCs的增殖和迁移,通过直接激活ATG14介导的自噬,下调诱导的VSMCs表型调节,这些均是自噬参与IA的形成、发展和破裂过程的证据。
2.3 血管平滑肌细胞的凋亡与颅内动脉瘤的关系
VSMCs的过度凋亡可能是IA形成和破裂的重要机制[26]。冯政哲等[27]发现血流动力学异常作为VSMCs凋亡使动因素,与B淋巴细胞瘤-2(B cell lymphoma 2 family protein,Bcl-2)介导的线粒体途径激活天冬氨酸特异性半胱氨酸蛋白酶-9(cysteine protease,Caspase-9)有关,均参与了IA的早期形成。
Nakajima等[28]通过研究IA患者组织,发现VSMCs在表型变化过程中,其收缩型、合成型细胞均会出现凋亡,其组织中半胱氨酸天冬氨酸特异性蛋白酶-3(Caspase-3)mRNA表达量显著升高,故认为IA后期VSMCs由增殖转向凋亡,成为IA瘤壁变薄、破裂的关键因素。刘东阳等[29]也在IA破裂患者血清中确认了Caspase-3呈高表达,这均提示细胞凋亡、坏死会在IA后期导致瘤壁脆弱并自发破裂。VSMCs的凋亡与IA发生、发展、破裂密切相关。
采用siRNA沉默基因可通过PI3K/Akt信号通路抑制VSMCs凋亡,同时PI3K/Akt通路会促进VSMCs增殖和血管重构。Zhao等[30]研究发现miR-29a下调会减少人脑VSMCs的凋亡,同时在IA模型证实miR-29a的高表达可能通过线粒体途径促进细胞凋亡。因此,miR-29a可能通过调节线粒体凋亡途径参与IA进展,可作为IA治疗的潜在靶标。Wang等[31]的研究中,探讨了IA中膜联蛋白A3(annexin A3,ANXA3)的沉默与c-Jun N端激酶(c-Jun-terminal kinase,JNK)信号传导途径在IA中的相互作用,随着VSMCs中ANXA3的沉默或JNK信号通路的抑制,VSMCs降低了Bax、MMP-9等凋亡标志物的表达,同时提升了SMα-actin、β-微管蛋白和Bcl-2的表达,这表明ANXA3联合JNK信号通路的磷酸化调控IA中的VSMC功能和表型变化,从而减轻IA的发展。
综上所述,自噬对VSMCs表型转化及凋亡存在复杂的调节网络,并且与凋亡调节通路有着多层次,多元化关系。自噬与凋亡协同作用,使血管内皮细胞从增殖像过度凋亡过程进行转变,从而促进IA发生发展。随着VSMCs自噬调控其表型转化及凋亡分子机制的深入研究,有望在IA的不同发展阶段,通过精确调控VSMC自噬与凋亡来寻找治疗和预防IA的有效靶点。
3 基于炎症反应调控的颅内动脉瘤病理进程研究
研究显示,临床动脉瘤标本中白介素-6(interleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子的表达均出现了改变,提示炎症反应与IA病程关系密切。
IL-6来源于活化T细胞和成纤维细胞的淋巴因子,与IA发生发展有关。孙军等[32]比较了正常人与颅内动脉瘤患者对比治疗前后和对照组血清中IL-6水平,发现IA治疗前IL-6水平显著高于治疗后和对照组,治疗后与对照组的IL-6水平无显著性差异。赵曙虹等[33]经免疫组化染色,检测动脉瘤的瘤壁组织和正常血管壁中IL-6的着色部位,发现正常血管壁各层均无明显IL-6的阳性表达,而动脉瘤壁组织的内膜、中膜、外膜均有IL-6的阳性表达,由此,说明IL-6升高与IA的生成和破裂有关。张国忠等[34]研究了汉族人基因多态性与IA的关系,认为有一定的相关性,尤其是C等位基因频率增高与IA的发病有关。其机制如下:(1)IL-6可通过增加内皮细胞炎症加重颅内动脉粥样硬化从而增加了IA发生率。(2)等位基因频率增加导致血清中IL-6表达增加,从而加重了患者血管内皮损伤,导致血管壁脆性增加,胶原蛋白减少,IA发生率增加。Kao等[35]证明IL-6水平高低是一种独立的预后生物标志物,可用于鉴别IA破裂后神经功能不良的高危患者。Ni等[36]证明IL-6和巨噬细胞集落刺激因子可作为IA发病前和蛛网膜下腔出血治疗后3 d内血管有无痉挛的可靠早期标志物。Hosaka等[37]在动物上证明IL-6不能独立于单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)之外促进动脉瘤愈合,在MCP-1介导的动脉瘤愈合中,骨桥蛋白的表达依赖于IL-6;抑制IL-6受体可显著抑制MCP-1介导的动脉瘤愈合过程中骨桥蛋白的表达。IL-6和骨桥蛋白是MCP-1介导的动脉瘤内愈合的关键下游介质。
IL-1β作为促炎细胞因子,在血管平滑肌细胞(vascular smooth muscle cells,VSMCs)和细胞外基质中产生许多有害效应。IL-1β[38]可直接诱导VSMCs凋亡,从而促进动脉瘤壁变薄。上调IL-1β和核因子κB(nuclear factor kappa-B,NF-κB)通路表达,动脉瘤壁胶原生物合成将明显抑制。胶原生物合成减少有助于延缓IA进展,乃至阻止IA破裂。Moriwaki等[39]在小鼠模型中发现IL-1β[40]是诱导人血管平滑肌细胞间黏附分子-1和血管细胞黏附分子- 1表达的强效诱导剂,可通过募集和滞留单核细胞和中性粒细胞等炎症细胞在AS发病机制,来发挥干预IA形成和发展的作用。
TNF-α作为一种重要的促炎细胞因子与IA病变过程相关。张秋建等[41]探讨了触珠蛋白Hp2-2与TNF-α在IA破裂伴随SAH的临床意义,发现预后不良组血浆中HP2-2及TNF-α水平显著高于预后良好组,证实血浆Hp2-2和TNF-α水平对评估动脉瘤性蛛网膜下腔出血患者病情及预后情况有重要价值。Jayaraman等[42]研究发现TNF-α和Fas相关死亡结构域蛋白表达增加可促进血管和免疫细胞的炎症和凋亡,进而削弱血管壁弹性、对脑内动脉产生损害。Ali等[43]发现,TNF-α在动脉瘤形成和破裂过程中加速对VSMCs的病理损伤,促使这些细胞从收缩型向合成型和促炎型转变,对IA形成有重要影响。范凤飞等[44]观察了乌司他丁对颅内动脉瘤栓塞手术患者促炎细胞因子水平,发现乌司他丁能抑制患者血清中促炎性细胞因子的释放,减轻炎症反应介导的脑缺血再灌注损伤,对颅内动脉瘤栓塞手术患者具有一定的脑保护作用;另有部分学者对TNF-α相关基因多态性与IA相关性进行研究,潘英等[45]采用聚合酶链-限制性片段长度多态性方法对广东汉族118例IA患者基因多态性进行检测,显示患者中T/T和T/C基因型频率与正常组相比有统计学意义;认为基因多态性与中国广东汉族人群IA发生有一定相关性。Hu等[46]发现肿瘤坏死因子-α-3959 T>C与IA风险增加显著相关,1个新的TNF-α位点与中国人IA发生密切相关。
MCP-1[47]作为机体内一种重要炎细胞因子,对单核巨噬细胞有较强趋化作用,趋化单核巨噬细胞浸润受损的脑实质,因此,脑髓液或血清中含量高低能间接反映脑组织损伤情况。MCP-1[48-50]在囊性动脉瘤壁以及动脉瘤壁内局灶性表达增高表明本病发展是单核细胞不断聚集的慢性炎症过程,MCP-1与动脉瘤发展有一定相关性,有效阻断该过程就可能防止IA发生。
基质金属蛋白酶(matrix metalloproteinase,MMP)作为细胞外基质降解和重构的主要介质,也可以是IA发生、发展和破裂的标志。MMP-9、MMP-2[51-52]在罹患IA、破裂IA患者血和瘤壁组织中表达较高,特别是MMP-9[53-54]蛋白在IA患者血清中呈较高水平,其过度表达致脑动脉壁胶原纤维及内弹力层破坏是IA形成主要原因之一;血浆MMP-2、MMP-9有望成为脑动脉瘤早期诊断标志物。
巨噬细胞在颅内动脉瘤壁中扮演关键炎症角色,肥大细胞、中性粒细胞通过分泌MMP和弹性蛋白酶参与IA发生和发展[55]。古龙等[56]采用基因芯片技术对IA中mRNA表达进行富集分析,发现IA基因表达上调或下调主要涉及细胞因子调节、白细胞激活及分化、炎症免疫应答等过程。Ishibashi等[57]研究发现IA形成过程中,瘤壁肥大细胞数显著增加,其脱颗粒和释放细胞因子可促进IA发生;抑制脱颗粒过程,就减轻炎症导致的内侧变薄,来发挥治疗IA的疗效。巨噬细胞[58]M1和M2极化表型产生不同的细胞因子调控炎症,调控细胞外基质重构进而调控IA发生和发展。文献报道[59-62]外周血中性粒细胞与淋巴细胞的比值与炎症程度、IA破裂程度有关,联合Hunt-Hess分级或PHASES评分对IA及其预后进行综合性评估。
在炎症通路方面,唐海双[63]研究发现TNF-α可诱导人脑VSMCs发生表型转化,与其激活Wnt1/β-catenin信号通路相关,增加炎症因子表达。因此,通过干预Wnt1/β-catenin通路介导的IA中VSMCs表型转化有望成为IA治疗新方向。进一步研究发现基质细胞衍生因子-lα及趋化因子受体CXCR4[64]也参与VSMCs表型转化并通过诱导VSMCs表达MMPs调控血管重构和促进炎细胞趋化,从而影响IA的形成、发展和破裂。TLR4/ NF-κB[65-67]传导通路激活与调节IA形成和破裂过程中慢性炎症反应和颅内动脉瘤中膜VSMCs凋亡。NF-κB[68]使下游巨噬细胞募集和血管炎症相关受体基因转运进而在IA形成起始阶段发挥了一定作用。丝裂原活化蛋白激酶信号通路[69]通过调控细胞周期和基因表达,参与血管壁重塑、平滑肌细胞增殖和内膜形成而与IA病程密切相关。这些为IA治疗提供潜在新策略。
4 中医药对IA的认识和形成潜在治疗策略的展望与分析
4.1 中医药对IA的认识
祖国医学对IA并无确切认识,但由于病位在脑,瘤体破裂后以蛛网膜下腔出血为主,故部分学者[70-72]将其归为中医“中风”“头痛”范畴。主要病因为恼怒忧思、饮食不节、嗜酒纵欲等诱发机体阴阳失调,脏腑气血不畅,瘀血内生蕴结以及不通不荣则发为疼痛。近来主要病机为风、火热、痰、瘀,主要证型为气虚证、阴虚阳亢证[73]等证候表现,针对风、血瘀、火热、痰瘀等所采取的主要治则为平熄内风、活血化瘀、清热化痰,恢复期治疗主要采用益气、养血等扶正治法。
现代研究证实中药对动脉瘤性蛛网膜下腔出血以及动脉瘤栓塞术后的脑血管痉挛有确切的疗效,部分医家也对其相关证型进行了总结。主要是通过对IA发病机制的角度,结合目前已有的疗效和药理学证据,对其干预IA潜在作用机制归纳如下,见图2。
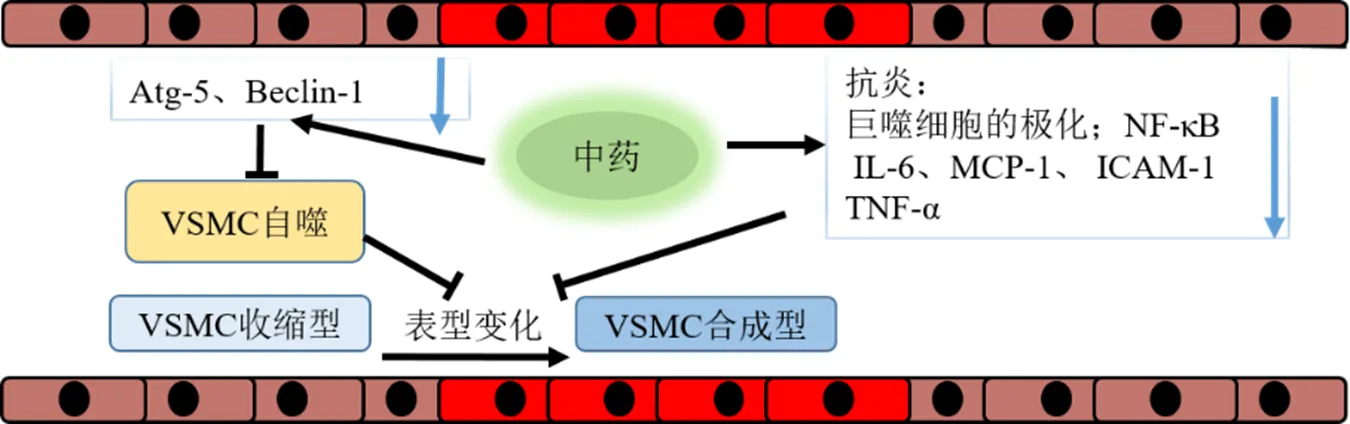
图2 中药对IA干预的潜在机制示意图
4.2 中药干预动脉瘤性蛛网膜下腔出血和栓塞术后脑血管痉挛疗效确切
陈俊臣等[74]进行解痉汤对动脉瘤性蛛网膜下腔出血后脑血管痉挛患者保护作用研究,发现解痉汤可有效缓解颅内出血和血管痉挛的症状,降低血管性血友病因子和内皮素水平,改善血管内皮细胞功能。李文涛[75]观察了血肿消颗粒对动脉瘤性蛛网膜下腔出血栓塞患者术后血管痉挛的临床疗效,显示血肿消颗粒能促进脑血流恢复,有效减少栓塞术后的血管痉挛症状。何婉玲等[76]观察了川芎嗪预防和治疗给药对IA围手术期脑血管痉挛患者的效果,显示川芎嗪降低颅动脉瘤破裂性蛛网膜下腔出血患者介入围手术期的脑血管痉挛发生率。但国梅等[77]观察了通络活血饮和丹参注射液对动脉瘤栓塞术后脑血管痉挛患者的临床疗效,发现两者均能增加缺血区的脑部血流量,减轻血管痉挛的症状,对血管内皮功能有良好的改善效应。
4.3 基于调控VSMCs表型转化的中药干预IA的展望
VSMCs增殖和表型转化是IA发展和破裂,动脉粥样硬化和高血压血管重塑等许多心血管疾病的病理特征;上述疾病多属于中医“血瘀证”的范畴,在治疗中选择益气活血、化瘀的药物为主。许多的中药复方、单位药和中药成分具有抑制VSMCs表型转化的作用。林萍等[78-79]发现益气活血汤对机械血管损伤家兔VSMCs表型变化以及血小板衍生生长因子-B表达有影响,益气活血汤可抑制VSMCs表型从收缩型变为合成型,因此,提示益气活血汤可能对IA发生和发展具有延缓效应。张庆刚等[80]研究麝香保心丸对大鼠VSMCs表型影响,显示具有α-SMA和肌球蛋白重链(Smooth muscle Myosin heavy chain,SM-MHC)标记的收缩型平滑肌细胞数量增加,同时抑制大鼠VSMCs的细胞周期,提示麝香保心丸可通过抑制VSMCs表型转化、抑制其增殖的方式预防和延缓IA的发生和发展。
李琦等[81]观察了当归和黄芪提取物对VSMCs增殖和分化型基因作用的影响,发现当归和黄芪会促进SMα-actin的表达,下调平滑肌胚胎型肌球蛋白重链和骨桥蛋白的表达,即这2种药物能抑制成纤维细胞生长因子诱导的VSMCs表型转化,同时也抑制VSMCs的DNA合成,提示当归和黄芪提取物可通过VSMCs表型的转化和复制延缓IA的发生和发展。段文卓等[82]探究了红花和郁金提取物对高糖诱导的大鼠VSMCs表型变化和增殖情况的影响,结果显示药物作用下的表型以收缩型为主,中药作用下的细胞DNA合成速率低于高糖诱导的细胞,这说明红花和郁金提取物能有效抑制大鼠VSMCs表型的转变同时抑制细胞的增殖,对IA的发生、发展有潜在的延缓作用。
中药单体对VSMCs表型的调控作用也有报道,粉防己碱(tetrandrine,TET)是祛风止痛中药防己的主要活性成分之一,目前临床主要用于痛风性关节炎、心血管疾病、风湿病和肿瘤等疾病的治疗。刘明华等[83]研究显示,TET能抑制VSMCs细胞中的PDGF,减轻VSMCs的表型变化,同时可降低PDGF介导的细胞内Ca2+浓度,抑制、等肿瘤基因的表达,进而抑制VSMC增殖的作用。张新明等[84]研究发现TET可通过下调p38-MAKP信号通路减轻内膜损伤引起的VSMCs增殖和表型转化。以上结果提示,TET可通过抑制细胞中PDGF的表达、p38-MAKP信号通路从而抑制VSMCs的增殖和表型转化,从而减缓IA的发展。朱丽华等[85]在体外观察了平肝熄风药物天麻主要活性成分天麻素对血小板衍生生长因子-BB(plateletderived growth factor-BB,PDGF-BB)诱导平滑肌细胞迁移的影响,结果显示天麻素能抑制PDGF-BB诱导的JNK磷酸化从而抑制VSMCs的迁移,以上研究提示相关祛风类药物的活性成分均有干预VSMCs功能的作用,对IA的发生、发展有潜在的干预作用。童国新等[86]发现甲基莲心碱通过减少SM1、calponin1和SMα-actin蛋白表达抑制人脐静脉VSMCs的增殖,由此认为甲基莲心碱对IA和动脉粥样硬化等血管病有潜在的防治作用。总结中药对VSMC细胞周期和表型转化机制见图3。

图3 中药对VSMC细胞周期和表型转化干预作用示意图
4.4 基于调控VSMCs自噬的中药干预IA的展望
刘红权等[87]发现犀角地黄汤对内毒素诱导的脑中动脉栓塞大鼠模型有干预作用,该方能显著抑制自噬相关基因、的mRNA表达发挥脑保护作用。郝国强等[88]研究发现丹参酸IIA能抑制过氧化低密度脂蛋白诱导的人脐静脉内皮细胞的效应蛋白Beclin-1表达,有保护受损血管内皮细胞的作用。
综上所示,以清热解毒、凉血散瘀为功效的犀角地黄汤和活血化瘀药物丹参的活性成分具有抑制细胞中自噬相关基因的表达,这提示以上药物具有减轻IA患处细胞自噬作用的潜力,减缓IA的发展。
4.5 基于调控炎症通路的中药干预IA的展望
姬梦姣[89]研究证实补阳还五汤对AS小鼠炎症因子水平有降低作用和促进抗炎因子水平增高作用,其机制与调控M1/M2巨噬细胞极化枢纽PKM2/HIF-1α关系密切,该方使巨噬细胞向M2表型分化,起到减轻血管炎症的作用。贾丽超等[90]研究了当归芍药散对代谢性炎症反应小鼠的作用,发现当归芍药散可降低模型小鼠血脂和IL-6、MCP-1的表达,并通过调控NF-κB和活化和过氧化物酶体增生物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ),通抑制小鼠体内代谢性炎性反应,从而有减缓动脉瘤的发展的作用。TNF-α可诱导VSMCs中ICAM-1的表达,在病变早期,促使单核细胞向内皮细胞粘附、迁移,在进展期病变。曹晋[91]观察了失笑散含药血清对大鼠VSMCs的影响,实验发现TNF-α可诱导平滑肌细胞 ICAM-1表达增强(<0.01),失笑散可降低TNF-α诱导的ICAM-1mRNA水平及蛋白表达,且呈剂量依赖性(<0.01),可延缓动脉粥样硬化的病程。万磊等[92]探究了丹参对动脉粥样硬化家兔血管的作用,研究发现丹参可上调Bcl-2的表达,下调Bax的表达;丹参中的单体成分丹参酮IIA和丹酚酸B均可以调控VSMCs中NF-κB通路,抑制细胞间黏附分子-1、单核细胞趋化蛋白1的表达,具有延缓IA的发生发展的潜在作用。
综上,当归芍药散、补阳还五汤、丹参中的丹参酮IIA和丹酚酸B均通过调控NF-κB通路、影响巨噬细胞极化,减轻血管内炎症,未来在预防和延缓脑动脉瘤的发生发展中形成新的治疗策略。中药对IA的潜在调控机制,见图3。
5 结语与讨论
IA破裂致蛛网膜下腔出血具有高致残率和死亡率。目前,随着影像学检查技术的发展,IA检出率日渐增高,除了手术夹闭和血管介入治疗以外,寻找药物对IA的发生和发展进行干预治疗势在必行。
VSMCs的表型变化与自噬、凋亡之间的协同作用使其从增殖向过度凋亡过程进行转变,通过调控VSMCs功能促进IA的发生和发展;炎症反应在IA形成后加重细胞损伤其中多种免疫细胞通过多条信号通路参与调节。报道显示,临床最常用的治疗策略是介入治疗和夹闭手术,抗炎药物有望在IA的不同发展阶段,通过抑制炎症反应阻断IA发生发展过程的中下游环节和调控VSMCs自噬和干预其表型变化,对IA进行预防和治疗。
中医对IA病因病机的认识,主要与风、火热有关,临床以痰瘀证、血瘀证、气虚证、阴虚阳亢证为多见,治疗运用平熄内风、活血化瘀、清热、化痰等治法,术后采用益气、养血等扶正治法调护。结合目前中医药对IA治疗的研究进展和中药及其有效物质对心脑血管内炎症的调控作用,以及药物对VSMCs的增殖、表型转化和自噬等机制的干预作用,提出中药干预IA发生、发展和破裂的潜在防治策略。以活血化瘀、益气活血、祛风止痛为功效的方剂、药物以及中药提取物可分别通过降低血管内炎症反应,调控VSMCs功能和表型的变化最终实现对IA潜在的预防和治疗作用。
中医药对疾病的辨证论治,多靶点作用的协调配合共同实现对机体功能的调节,活血化瘀药和方剂对IA中的炎症病理状态具有调控潜力,如丹参活性成分丹参酮IIA和丹酚酸B均具有抗炎活性,补阳还五汤等益气活血方剂也可通过减轻血管内炎症,具有延缓脑动脉瘤的发生发展的潜在调控能力。目前对活血化瘀药物的生物学解读是围绕药物改善血液流变学、改善微循环、抗血栓以及扩张血管和增加器官血流量,然而对血流动力学改变引起的IA病理学变化机制并不确定,活血化瘀药物能否通过改善局部血液流变学进而改善IA也还待进一步的研究;另一方面,相关活血化瘀药物对血管内炎症疾病的作用确切,其抗炎机制是否是活血、止痛、益气等功效的科学内涵之一,还尚待深度研究与解读。平滑肌细胞功能的变化是IA发生和发展的关键基础,本文中涉及祛风类药物的活性成分粉防己碱和天麻素均有干预VSMCs功能的作用,对IA的发生、发展有潜在的干预作用,结合目前对平熄内风药物的认识,其主要药理作用与抗炎、镇静、止痛等,平熄内风的科学内涵与平滑肌细胞功能的调控是否存在联系,还尚需进一步的研究。
IA形成、发展及破裂是患者遗传因素,生活习惯及动脉瘤自身特点和多种致病因素共同作用的结果,因此,通过多角度、多方面寻找治疗IA的有效靶点和有效策略有重要临床意义。本文从中药及其活性成分抗血管炎症、抗VSMCs自噬和表型变化等方面的作用与IA的部分发病机制相对应,为中药成为IA新的潜在有效治疗策略提供文献依据,其治疗效应特点及机制将会进一步深入研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 胡小辉, 张世明. 颅内动脉瘤形成机制的研究进展 [J]. 中国临床神经科学, 2016, 24(4): 453-456.
[2] 邓汉顺, 王清华. 颅内动脉瘤的形成原因及破裂因素研究进展 [J]. 医学综述, 2018, 24(15): 3018-3022.
[3] 蔡明辰, 吕仁杰, 韩松林, 等. 颅内动脉瘤形成及破裂因素的研究进展 [J]. 世界最新医学信息文摘, 2019, 19(61): 118.
[4] 寿涛涛, 孙晓阳, 丁涟沭. 颅内动脉瘤形成的相关因素研究 [J]. 临床神经外科杂志, 2019, 16(4): 362-366.
[5] 蒋定尧, 钱聪. 颅内动脉瘤血管内介入治疗进展 [J]. 浙江医学, 2019, 41(19): 2033-2036.
[6] Jiang Z, Chen Y, Zeng C,. Neurosurgical clipping versus endovascular coiling for patients with intracranial aneurysms: A systematic review and meta-analysis [J]., 2020, 138: e191-e222.
[7] Fisher C L, Demel S L. Nonsteroidal anti-inflammatory drugs: A potential pharmacological treatment for intracranial aneurysm [J]., 2019, 9(1): 31-45.
[8] Gruszka W, Zbroszczyk M, Komenda J,. The role of inflammation and potential pharmacological therapy in intracranial aneurysms [J]., 2018, 52(6): 662-669.
[9] 李秀云. 用他汀类药物治疗未破裂颅内动脉瘤的临床研究 [J]. 当代医药论丛, 2019, 17(22): 123-124.
[10] 翟晓东, 于嘉兴, 马永杰, 等. 他汀类药物治疗未破裂颅内动脉瘤的研究进展 [J]. 中国脑血管病杂志, 2018, 15(5): 256-258.
[11] Li H, Xu H, Li Y,. Alterations of gut microbiota contribute to the progression of unruptured intracranial aneurysms [J]., 2020, 11(1): 3218.
[12] Chamley-Campbell J, Campbell G R, Ross R. The smooth muscle cell in culture [J]., 1979, 59(1): 1-61.
[13] Davis-Dusenbery B N, Wu C, Hata A. Micromanaging vascular smooth muscle cell differentiation and phenotypic modulation [J]., 2011, 31(11): 2370-2377.
[14] Owens G K, Kumar M S, Wamhoff B R. Molecular regulation of vascular smooth muscle cell differentiation in development and disease [J]., 2004, 84(3): 767-801.
[15] Wan W F, Ding Y, Xie Z Y,. PDGFR-β modulates vascular smooth muscle cell phenotype via IRF-9/SIRT-1/NF-κB pathway in subarachnoid hemorrhage rats [J]., 2019, 39(7): 1369-1380.
[16] Ledard N, Liboz A, Blondeau B,. Slug, a cancer- related transcription factor, is involved in vascular smooth muscle cell transdifferentiation induced by platelet-derived growth factor-BB during atherosclerosis [J]., 2020, 9(2): e014276.
[17] 高蕊, 董丽华, 谢肖立, 等. PDGF-BB对血管平滑肌细胞表型标志物表达的影响 [J]. 中国病理生理杂志, 2010, 26(12): 2301-2305.
[18] Davis B N, Hilyard A C, Nguyen P H,. Induction of microRNA-221 by platelet-derived growth factor signaling is critical for modulation of vascular smooth muscle phenotype [J]., 2009, 284(6): 3728-3738.
[19] Quintavalle M, Elia L, Condorelli G,. MicroRNA control of podosome formation in vascular smooth muscle cellsand[J]., 2010, 189(1): 13-22.
[20] Shi Y, Li S, Song Y,. Nrf-2 signaling inhibits intracranial aneurysm formation and progression by modulating vascular smooth muscle cell phenotype and function [J]., 2019, 16(1): 185.
[21] Jamous M A, Nagahiro S, Kitazato K T,. Endothelial injury and inflammatory response induced by hemodynamic changes preceding intracranial aneurysm formation: Experimental study in rats [J]., 2007, 107(2): 405-411.
[22] Sun L Q, Zhao M M, Zhang J B,. MiR-29b downregulation induces phenotypic modulation of vascular smooth muscle cells: Implication for intracranial aneurysm formation and progression to rupture [J]., 2017, 41(2): 510-518.
[23] 袁广胜, 吴海东, 陈胜利, 等. 细胞自噬调控颅内动脉瘤血管平滑肌细胞表型转化的体外研究 [J]. 中国免疫学杂志, 2019, 35(11): 1337-1340.
[24] Sun L, Zhao M, Liu A,. Shear stress induces phenotypic modulation of vascular smooth muscle cells via AMPK/mTOR/ULK1-mediated autophagy [J]., 2018, 38(2): 541-548.
[25] Li T, Tan X, Zhu S,. SPARC induces phenotypic modulation of human brain vascular smooth muscle cells via AMPK/mTOR-mediated autophagy [J]., 2019, 712: 134485.
[26] 郭付有, 宋来君, 孙红卫, 等. 破裂颅内动脉瘤组织中Caspase-3 mRNA的表达与血管平滑肌细胞的凋亡测定 [J]. 郑州大学学报: 医学版, 2007, 42(5): 877-878.
[27] 冯政哲, 张海峰, 于瀛, 等. 线粒体途径介导的细胞凋亡在兔颅内动脉瘤生成中的作用 [J]. 中国脑血管病杂志, 2015, 12(1): 32-36.
[28] Nakajima N, Nagahiro S, Sano T,. Phenotypic modulation of smooth muscle cells in human cerebral aneurysmal walls [J]., 2000, 100(5): 475-480.
[29] 刘东阳, 唐万忠, 隋爱华, 等. 血清Caspase-3水平与颅内动脉瘤的相关性研究 [J]. 中国临床神经外科杂志, 2014, 19(8): 477-479.
[30] Zhao W, Zhang H, Su J Y. MicroRNA‑29a contributes to intracranial aneurysm by regulating the mitochondrial apoptotic pathway [J]., 2018, 18(3): 2945-2954.
[31] Wang Y, Wang C, Yang Q,. ANXA3 silencing ameliorates intracranial aneurysm via inhibition of the JNK signaling pathway [J]., 2019, 17: 540-550.
[32] 孙军, 温昌明, 张保朝. 颅内动脉瘤患者肿瘤坏死因子-α和白细胞介素-6的表达及其作用机制 [J]. 中国老年学杂志, 2017, 37(4): 927-928.
[33] 赵曙虹, 王亚明, 马文群, 等. 肿瘤坏死因子α和白细胞介素6在颅内动脉瘤中的表达及相关分析 [J]. 中国脑血管病杂志, 2015, 12(1): 22-26.
[34] 张国忠, 冯文峰, 黄理金, 等. 汉族人白细胞介素-6- 174G/C基因多态性与颅内动脉瘤的关联性研究[J]. 中国神经精神疾病杂志, 2009, 35(4): 254-256.
[35] Kao H W, Lee K W, Kuo C L,. Interleukin-6 as a prognostic biomarker in ruptured intracranial aneurysms [J]., 2015, 10(7): e0132115.
[36] Ni W, Gu Y X, Song D L,. The relationship between IL-6 in CSF and occurrence of vasospasm after subarachnoid hemorrhage [J]., 2011, 110(pt 1): 203-208.
[37] Hosaka K, Rojas K, Fazal H Z,. Monocyte chemotactic protein-1-interleukin-6-osteopontin pathway of intra-aneurysmal tissue healing [J]., 2017, 48(4): 1052-1060.
[38] Aoki T, Kataoka H, Ishibashi R,. Reduced collagen biosynthesis is the hallmark of cerebral aneurysm [J]., 2009, 29(7): 1080-1086.
[39] Moriwaki T, Takagi Y, Sadamasa N,. Impaired progression of cerebral aneurysms in interleukin-1 beta- deficient mice [J]., 2006, 37(3): 900-905.
[40] Wang X, Feuerstein G Z, Gu J L,. Interleukin-1 beta induces expression of adhesion molecules in human vascular smooth muscle cells and enhances adhesion of leukocytes to smooth muscle cells [J]., 1995, 115(1): 89-98.
[41] 张秋建, 王大巍, 束汉生. 触珠蛋白(Hp2-2)和肿瘤坏死因子(TNF-α)在颅内动脉瘤破裂伴蛛网膜下腔出血的临床价值研究 [J]. 齐齐哈尔医学院学报, 2019, 40(19): 2384-2386.
[42] Jayaraman T, Berenstein V, Li X,. Tumor necrosis factor alpha is a key modulator of inflammation in cerebral aneurysms [J]., 2005, 57(3): 558-564.
[43] Ali M S, Starke R M, Jabbour P M,. TNF-α induces phenotypic modulation in cerebral vascular smooth muscle cells: Implications for cerebral aneurysm pathology [J]., 2013, 33(10): 1564-1573.
[44] 范凤飞, 王瑞娟, 张庆国. 乌司他丁对颅内动脉瘤栓塞手术患者血清肿瘤坏死因子α和白细胞介素-6的影响 [J]. 实用医学杂志, 2015, 31(13): 2078-2080.
[45] 潘英, 孙卫文, 李明昌, 等. 广东汉族人颅内动脉瘤与肿瘤坏死因子TNFα-1031基因多态性的相关性研究 [J]. 解剖学研究, 2011, 33(4): 278-280.
[46] Hu J T, Luo J, Wang H,. Association of TNF-α-3959T/C gene polymorphisms in the Chinese population with intracranial aneurysms [J]., 2017, 63(3/4): 349-354.
[47] 杨冯睿, 易汉, 彭良玉, 等. 杏仁核MCP-1/CCR2通路在大鼠神经病理性痛中的作用 [J]. 中华麻醉学杂志, 2018, 38(07): 850-854.
[48] 曹勇, 赵继宗, 王硕, 等. 单核细胞趋化蛋白1和巨噬细胞炎性蛋白-1α在颅内动脉瘤壁内的表达 [J]. 首都医科大学学报, 2002, 23(3): 211-214.
[49] 黄孝宇. 单核细胞趋化蛋白-1细胞间黏附分子-1及核转录因子-kappa在人颅内动脉瘤中的表达及临床意义 [J]. 中国实用神经疾病杂志, 2019, 22(10): 1074-1080.
[50] 贾文清, 何晓光, 赵继宗, 等. 单核细胞趋化蛋白-1在颅内动脉瘤壁的表达 [J]. 中国卒中杂志, 2009, 4(11): 869-872.
[51] 赵曙虹, 李利敏, 马文群, 等. 基质金属蛋白酶类在颅内动脉瘤中的表达 [J]. 中国脑血管病杂志, 2013, 10(1): 18-21.
[52] 赵业禹. MMP-2、MMP-9及TIMP-1在脑动脉瘤患者血浆中的表达及意义 [D]. 南昌: 南昌大学, 2012.
[53] 鲁晓花, 王洪生. 血清MMP-9水平与颅内动脉瘤的相关性研究 [J]. 河北医学, 2015, 21(7): 1161-1162.
[54] 马良, 付强, 关俊宏. 实验性大鼠脑动脉瘤形成过程中MMP-2、MMP-9表达的动态变化 [J]. 中华神经外科疾病研究杂志, 2013, 12(3): 197-200.
[55] 柏星铖, 张光绪, 马骏, 等. 颅内动脉瘤与炎症的关系及其潜在治疗药物 [J]. 临床神经外科杂志, 2020, 17(2): 232-235.
[56] 古龙, 周牮, 彭建华, 等. 颅内动脉瘤的相关信号通路基因集富集及免疫浸润分析 [J]. 中国实验方剂学杂志, 2020, 26(7): 178-185.
[57] Ishibashi R, Aoki T, Nishimura M,. Contribution of mast cells to cerebral aneurysm formation [J]., 2010, 7(2): 113-124.
[58] 王雅琪, 金静华. 巨噬细胞在颅内动脉瘤发生发展中的作用研究进展 [J]. 浙江大学学报(医学版), 2019, 48(2): 204-213.
[59] Cho A, Czech T, Wang W T,. Peri-interventional behavior of the neutrophil to lymphocyte ratio in patients with intracranial aneurysms [J]., 2020, 141: e223-e230.
[60] 杜君, 王永红, 李永强. 颅内动脉瘤患者中性粒细胞与淋巴细胞比值和Hunt-Hess分级的相关性分析 [J]. 重庆医科大学学报, 2016, 41(1): 61-64.
[61] 王丽, 牟英峰, 陈曦, 等. PHASES评分联合中性粒细胞/淋巴细胞比值监测汉族人群颅内动脉瘤破裂 [J]. 新医学, 2020, 51(5): 365-369.
[62] 杨宇宏, 张志珺. 外周血中性粒细胞/淋巴细胞值与脑血管病相关性研究进展 [J]. 东南大学学报(医学版), 2017, 36(2): 301-305.
[63] 唐海双. Wnt1/β-catenin信号通路调控平滑肌细胞表型转化在颅内动脉瘤发生中的作用机制研究 [D]. 上海: 中国人民解放军海军军医大学, 2019.
[64] 闫亚洲, 唐海双, 黄清海. SDF-1α/CXCR4信号通路在颅内动脉瘤中的研究进展 [J]. 中国临床医学, 2019, 26(01): 122-125.
[65] 贾禄, 吉宏明, 任少华, 等. Toll样受体4/核因子-кB信号通路在人颅内动脉瘤形成和破裂过程中的激活 [J]. 中国药物与临床, 2016, 16(9): 1274-1277.
[66] 贾禄, 游潮. TLR4/NF-κB信号通路在颅内动脉瘤形成和破裂中的作用机制[A].// 中华医学会、中华医学会神经外科学分会. 2011中华医学会神经外科学学术会议论文汇编[C]. 中华医学会、中华医学会神经外科学分会: 中华医学会, 2011: 1
[67] 王俊凯. Toll样受体4和核因子-κB在颅内动脉瘤组织中的表达及作用机制 [J]. 中国老年学杂志, 2017, 37(14): 3427-3429.
[68] Aoki T, Kataoka H, Shimamura M,. NF-kappaB is a key mediator of cerebral aneurysm formation [J]. Circulation, 2007, 116(24): 2830-2840.
[69] 迟海本, 翟宝进, 焦德让. 颅内动脉瘤与MAPK信号传导通路 [J]. 国际神经病学神经外科学杂志, 2010, 37(02): 168-171.
[70] 胡明哲, 陈香岩, 陈发军. 中医药治疗蛛网膜下腔出血研究进展 [J]. 新中医, 2020, 52(20): 18-20.
[71] 刘昌亚, 胡学斌, 丁砚兵. 颅内动脉瘤破裂蛛网膜下腔出血介入治疗前后中医证候变化临床研究 [J]. 亚太传统医药, 2018, 14(09): 157-158.
[72] 朱敏, 詹增土, 王梅平. 缺血性中风中医证型分布与血脂、颈动脉超声征象及Hcy的相关性研究[J]. 世界中医药, 2019, 14(4): 1046-1050.
[73] 中风病辨证诊断标准(试行) [J]. 北京中医药大学学报, 1994(03): 64-66.
[74] 陈俊臣, 任晓乐, 李倩, 等. 解痉汤治疗动脉瘤性蛛网膜下腔出血后脑血管痉挛临床研究 [J]. 陕西中医, 2020, 41(8): 1055-1058.
[75] 李文涛. 血肿消颗粒防治动脉瘤性蛛网膜下腔出血栓塞术后血管痉挛的临床观察 [D]. 郑州: 河南中医学院, 2014.
[76] 何婉玲, 袁惠萍, 罗鹏. 川芎嗪在颅内动脉瘤介入围手术期脑血管痉挛预防的临床效果观察 [J]. 世界中西医结合杂志, 2017, 12(04): 524-526.
[77] 但国梅, 惠晓婕, 韩晓霞, 等. 通络活血饮合丹参注射液治疗颅内动脉瘤栓塞术后脑血管痉挛疗效及对血管内皮功能指标的影响 [J]. 现代中西医结合杂志, 2020, 29(22): 2477-2480.
[78] 林萍. 益气活血方对实验兔机械损伤后血管平滑肌细胞增殖和凋亡的研究 [D]. 沈阳: 辽宁中医药大学, 2006.
[79] 林萍, 杨关林, 周鑫. 益气活血汤抑制实验兔PDGF表达和血管平滑肌细胞表型转变的研究 [J]. 辽宁中医药大学学报, 2009, 11(7): 200-202.
[80] 张庆刚, 高瑞兰, Chong B H, 等. 麝香保心丸对血管平滑肌细胞表型转化和增殖的影响 [J]. 中华中医药学刊, 2014, 32(4): 906-909.
[81] 李琦, 温进坤, 韩梅. 黄芪和当归对血管平滑肌细胞表型标志基因表达和细胞增殖的影响 [J]. 中国动脉硬化杂志, 2004(02): 147-150.
[82] 段文卓, 宫海民. 红花、郁金对血管平滑肌细胞表型及增殖变化的影响 [J]. 中国病理生理杂志, 2000(10): 116-117.
[83] 刘明华, 谢伟蓉, 章卓, 等. 粉防己碱对糖尿病大鼠VSMCs增殖的抑制作用 [J]. 中药材, 2009, 32(12): 1867-1870.
[84] 张新明, 张新平. 粉防己碱对VSMC表型转化和p38及MKP-1表达的影响 [J]. 实验室研究与探索, 2008(6): 41-44.
[85] 朱丽华, 关红菁, 王朗, 等. 天麻素对血小板衍生生长因子-BB诱导大鼠血管平滑肌细胞迁移的影响 [J]. 国际脑血管病杂志, 2012, 20(3): 189-192.
[86] 童国新, 李晓春, 王宁夫, 等. 甲基莲心碱对人脐静脉血管平滑肌细胞增殖及表型调节的影响 [J]. 中国现代应用药学, 2011, 28(5): 387-390.
[87] 刘红权, 王玉, 郭立中, 等. 犀角地黄汤对脑缺血大鼠的自噬相关蛋白Atg-5、Be-clin-1表达的研究 [J]. 南京中医药大学学报, 2014, 30(1): 61-64.
[88] 郝国强, 邢壮杰, 郑新, 等. 丹参酮IIA对ox-LDL诱导血管内皮细胞自噬效应蛋白Beclin1表达的影响 [J]. 安徽医药, 2015, 19(12): 2393-2396.
[89] 姬梦姣. 补阳还五汤调节巨噬细胞极化抗ApoE-/-小鼠动脉粥样硬化的实验探究 [D]. 南京: 南京中医药大学, 2020.
[90] 贾丽超, 周明学, 张蕾, 等. 当归芍药散对代谢性炎性反应小鼠血脂和血清炎性反应因子IL-6、MCP-1及NF-κB、PPARγmRNA表达的影响 [J]. 首都医科大学学报, 2014, 35(6): 813-817.
[91] 曹晋. 失笑散含药血清对大鼠血管平滑肌细胞细胞间粘附分子-1表达的影响 [D]. 重庆: 第三军医大学, 2011.
[92] 万磊, 许涛, 李树生. 丹参预防家兔动脉粥样硬化的分子机制 [J]. 现代中西医结合杂志, 2006(22): 3045-3046.
Advances in study of pathogenesis and potential TCM therapeutic strategies for intracranial aneurysms
WU Kai-yi1, 2, 3,ZHANG Lin3, HUANG Na-na2, LIN Jia-kun1, SUN Rong2, 4
1 Shandong University of Traditional Chinese Medicine, Jinan 250355, China 2. The Second Hospital of Shandong University, Jinan 250033, China 3. Tianjin University of Traditional Chinese Medicine (TCM), Tianjin 301617, China 4. Advanced Medical Research Institute, Shandong University, Jinan 250012, China
Intracranial aneurysm (IA) is a gradual expansion of intracranial arteries caused by congenital abnormalities or acquired injuries. It’s an abnormal bulge due to the load of hemodynamics and other factors. The aneurysm gradually develops and even ruptures causing subarachnoid hemorrhage, and that can cause severe psychiatric symptoms and even life-threatening. It has complicated pathogenesis. The latest research shows that the occurrence of IA may be closely related to the secondary reaction of cell injury, and the process is getting aggravated affected by inflammation. Article proposes a potential intervention strategy which is blocking the middle and downstream links of inflammatory response to delay the occurrence and development of IA, and to reduce the risk of IA’s rupture; Both autophagy and apoptosis have an effect on the phenotype of vascular smooth muscle cells, this synergistic effect may be a potential mechanism for the treatment of IA. The article prospects the treatment strategy of TCM, by exploring the mechanism of TCM in regulating phenotype transformation and autophagy in smooth muscle cells, and regulating inflammatory pathways for cardiovascular and cerebrovascular diseases were sorted out and summarized respectively.
intracranial aneurysm; inflammation; autophagy; apoptosis; TCM treatment strategies
R285
A
0253 - 2670(2021)21 - 6732 - 11
10.7501/j.issn.0253-2670.2021.21.032
2021-04-25
国家自然科学基金面上项目(81773997);山东省自主创新和成果转化项目(2014ZZCX02104);泰山学者工程专项经费项目(ts201511107)
吴恺怿,男,硕士研究生,研究方向为中药药理与毒理。E-mail: 13553168069@163.com
孙 蓉,女,博士,二级教授,博士生导师,从事中药药理与毒理研究。E-mail: sunrong107@163.com
[责任编辑 王文倩]

