当归根部中主要有效成分的动态积累和转化研究
雒 军,王引权, 3,吴国泰,王 艳,王振恒,荔淑楠,彭 桐
当归根部中主要有效成分的动态积累和转化研究
雒 军1, 2,王引权1,2, 3*,吴国泰1,王 艳1,王振恒1,荔淑楠1,彭 桐1
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中药质量与标准研究重点实验室,甘肃 兰州 730000 3. 西北中藏药协同创新中心, 甘肃 兰州 730000
分析当归中阿魏酸和藁本内酯等主要有效成分在其根部的积累规律和转化机制。采用HPLC法测定不同生长期当归根部中阿魏酸、阿魏酸松柏酯和藁本内酯等8种苯酞类挥发油成分的含量,结合体外转化研究成果进行分析。阿魏酸和阿魏酸松柏酯含量从苗期到根膨大期沿着相同的方向不断增加,而从根膨大期到收获期分别逐渐降低和升高,朝2个相反的方向变化,提示在当归体内可能存在阿魏酸和松柏醇转化为阿魏酸松柏酯的过程。藁本内酯和5种转化产物含量总体随生长期呈现上升趋势,尤其从根膨大期到成药期增长速度极快,符合成药期特性;藁本内酯含量远远大于其他6种苯酞类转化产物洋川芎内酯I、洋川芎内酯H、阿魏酸松柏酯、洋川芎内酯A、正丁基苯酞、欧当归内酯的含量,提示在当归活体内藁本内酯的转化程度不高,具体转化机制有待进一步研究。阿魏酸和藁本内酯在不同生长期具有不同的积累和转化规律,可为当归药材生产、炮制和质量评价提供理论支持。
当归;阿魏酸;阿魏酸松柏酯;藁本内酯;药效成分;转化;洋川芎内酯I;洋川芎内酯H;洋川芎内酯A;正丁基苯酞;欧当归内酯
药用植物中药用成分大多为植物生长过程中面对各种生物和非生物胁迫产生的次生代谢物质,在特定的自然生态环境和栽培方法长期干预下,植物会产生适应性进化,产生特定的基因型和特定的基因表达模式,调控药用植物活体内药效物质的积累和转化[1]。而这些药效物质在药材加工过程中也会在体内生物酶和物理、化学等因素的作用下发生化学反应和相互转化[2]。因此,研究药效物质在药用植物生长发育过程中药用部位的累积和转化规律对研究中药材品质形成理论及其调控等均具有重要现实意义。
当归为伞形科植物当归(Oliv.) Diels的干燥根。当归主要药效成分为有机酸(酚)类、挥发油类和当归多糖类成分等[3-4]。《中国药典》2020年版规定当归中含挥发油不得少于0.4%(mL/g),含阿魏酸不得少于0.05%(按干燥品计)[5]。当归挥发油中以活性组分藁本内酯含量为最高,道地药材岷归中的藁本内酯含量可达1%以上。现代药理研究证实阿魏酸和藁本内酯均具有广泛的药理活性[6-8],也是评估当归药材质量的主要含量指标。目前,有关当归加工干燥过程中阿魏酸和藁本内酯转化的研究较多。王涛等[9]和李韶菁等[10]报道在当归加工过程中阿魏酸含量会增加,其机制是阿魏酸松柏酯在光照和高温下极易分解为阿魏酸,引起阿魏酸含量增加。藁本内酯为苯酞类物质,具有不稳定的苯酞结构,易发生氧化、脱氢、水解等或异构化为其他结构相似的苯酞类化合物。唐力英等[11]报道鲜切干燥加工相比传统阴干后切片加工当归药材藁本内酯含量可因药材离体且内部暴露于光、热条件下分解而下降。房鑫等[12]报道藁本内酯室温放置1个月后采用色谱法测定转化物,基本全部转化为14个组分,其中主要包括7’-羧基-芎萘呋内酯、欧当归内酯A、洋川芎内酯I、-丁烯基苯酞和洋川芎内酯A等。然而,就阿魏酸和藁本内酯在当归生长期内根部的积累和转化规律鲜见报道。本研究重点开展了当归在不同生长期阿魏酸和藁本内酯以及各自主要相互转化产物的动态含量变化,初步探讨当归药效成分生物合成和积累规律及可能的生物转化机制,为当归药材采收时间、加工炮制和质量控制提供科学依据。
1 仪器与材料
1.1 仪器
Agilent1260型高效液相色谱仪(美国Agilent科技公司);AgilentTC-C18色谱柱(250 mm×4.6 mm,5 μm,美国Agilent);KQ-500DB型超声波提取仪(昆山市超声仪器有限公司);BP121S型电子分析天平(德国赛多利斯公司);XS-02型多功能药材粉碎机(上海兆申科技有限公司)。
1.2 试剂
对照品阿魏酸(批号B20007)、阿魏酸松柏酯(批号B20126)、藁本内酯(批号B20492)、洋川芎内酯A(批号B21461)、洋川芎内酯H(批号B21462)、洋川芎内酯I(批号B21463)、欧当归内酯A(批号B20927)、正丁基苯酞(批号B21649)均购自上海源叶生物科技公司,质量分数均大于98%。色谱级甲醇、乙腈、甲酸购自赛默飞世尔科技有限公司,超纯水由超纯水机制备。
1.3 供试当归样品
当归药材品种为“岷归1号”,种植地点位于当归道地产区甘肃岷县西寨镇(海拔2380 m,北纬34º49',东经104º08')。2018年4月行常规施肥(N:156 kg/hm2,P:144 kg/hm2,K:60 kg/hm2)后移栽种苗,之后行田间常规管理。分别在4月(苗期)、6月(叶丛期)、8月(根膨大期)、10月(成药期)和11月(收获期)采取新鲜植株10株,迅速去掉地上部分,用去离子水清洗根部泥土后,带回实验室后储藏于−80 ℃超低温冰箱用作HPLC分析材料。本研究所用当归经甘肃中医药大学王引权教授鉴定为伞形科植物当归(Oliv.) Diels的根。
2 方法
2.1 对照品溶液的制备
精密称取适量阿魏酸、阿魏酸松柏酯、藁本内酯、洋川芎内酯A、洋川芎内酯H、洋川芎内酯I、欧当归内酯A和正丁基苯酞对照品,置5 mL棕色量瓶中,缓慢加入适量甲醇,轻轻摇晃至完全溶解,并定容至刻度即得质量浓度分别为2.070 0、0.870 0、8.256 8、1.151 0、1.586 2、1.245 0、0.685 2、1.942 5 mg/mL的对照品溶液。
2.2 供试品溶液制备
取出储藏于超低温冰箱的当归根,在相同部位取大约5 g置于液氮预冷却的研钵中,在液氮保护下迅速研磨为粉末。取0.5 g粉末置于小三角瓶,加入5 mL甲醇后超声(220 W、80 Hz、室温)提取40 min,提取完成后提取液经0.22 μm有机相滤膜滤过,滤液装于小棕瓶用于HPLC分析。对于测定总阿魏酸的样品,研磨后加入5 mL甲醇-2%碳酸氢钠溶液(95∶5)替代甲醇,以使阿魏酸松柏酯水解为阿魏酸,其他方法同上。
2.3 色谱条件
采用Agilent 1260 HPLC系统分析,分离柱为AgilentTC-C18(250 mm×4.6 mm,5 μm);流动相为0.1%甲醇水(A)-乙腈(B),梯度洗脱:0~20 min,19%B;20~60 min,19%~95%B;60~75 min,95%~100%B;波长为280 nm;柱温30 ℃,体积流量1.0 mL/min,进样量10 μL;色谱图见图1。

1-阿魏酸 2-洋川芎内酯I 3-洋川芎内酯H 4-阿魏酸松柏酯 5-洋川芎内酯A 6-正丁基苯酞 7-藁本内酯 8-欧当归内酯A
2.4 方法学考察
2.4.1 标准曲线的绘制 精密移取“2.1”项中8种对照品母液适当体积于同一量瓶并加甲醇定容至5 mL成为混合对照品溶液;将混合对照品溶液依次以2倍梯度稀释成为7个质量浓度的混合对照品,微孔滤膜过滤后行HPLC分析,记录色谱峰峰面积;以各对照品进样质量浓度为横坐标(),以对应的色谱峰峰面积为纵坐标()绘制标准曲线并进行回归分析。结果表明各对照品在检测质量浓度范围内线性关系良好(表1)。

表1 标准曲线回归方程
2.4.2 空白试验 精密吸取甲醇溶液10 μL,在“2.3”项的色谱条件下进样检测,结果表明在实验条件下甲醇溶剂对紫外检测器检测结果无影响。
2.4.3 精密度试验 精密吸取配制好的同一混合对照品,在“2.3”项的色谱条件下连续进样6次,记录共有峰的相对保留时间和相对峰面积,并计算RSD值。8种成分保留时间和峰面积RSD均在0.7%~2.0%,说明仪器精密度良好。
2.4.4 稳定性试验 配制混合对照品,在“2.3”项的色谱条件下立即上机测定(即为0 h),然后在1、2、4、8、12、24 h进样测量。记录峰面积,计算RSD值。结果显示所有成分12 h内较稳定,8种成分峰面积RSD在0.8%~2.5%。为保证检测样品的稳定性,本实验所有样品均为新鲜提取、配制,并用棕色瓶于4 ℃避光冷藏,于2 h内完成测定。
2.4.5 重复性试验 精密称取相同质量当归粉末6份,按照“2.2”项方法制备样品溶液,按照“2.3”项色谱条件进样测定,记录试验测定各种化学成分的质量分数并计算其RSD值。8种成分质量分数RSD均在0.9%~2.0%。
2.4.6 加样回收率试验 将样品按照“2.2”项制备6份供试品溶液,分别精密加入混合对照品溶液制得样品,进样分析,计算阿魏酸、洋川芎内酯I、洋川芎内酯H、阿魏酸松柏酯、洋川芎内酯A、正丁基苯酞、藁本内酯、欧当归内酯8个成分的平均加样回收率,依次为99.88%、99.75%、99.91%、99.77%、100.91%、99.88%、99.91%、99.88%,RSD分别为0.74%、1.01%、1.03%、1.32%、0.82%、0.91%、1.01%、1.03%。
2.5 数据分析
3 结果与分析
3.1 当归中8种单体成分的测定
采用HPLC分析了当归阿魏酸、阿魏酸松柏酯和6种苯酞类挥发油成分的含量。在测定条件下能够有效地分离检测到6种化学成分,未检测到洋川芎内酯H和正丁基苯酞2种成分(图1)。在检测到的6种成分中,含量最高者为藁本内酯,其次为阿魏酸和阿魏酸松柏酯,其他3种成分含量极低。根据文献报道洋川芎内酯H和正丁基苯酞成分在干燥后的当归药材中能够检出,而本实验未能检出,其原因可能是洋川芎内酯H和正丁基苯酞是药材在离体干燥过程中转化的产物,本实验所用当归为新鲜冷冻当归样品,藁本内酯未完成有效转化。
3.2 阿魏酸含量动态积累和转化分析
测定了6种药效物质在当归不同生长期4月(苗期)、6月(叶丛期)、8月(根膨大期)、10月(成药期)和11月(收获期)含量动态变化(图2)。由图可见当归主要药效物质阿魏酸含量(图2-A)从苗期到根膨大期快速持续上升,之后到成药期和收获期缓慢下降;而阿魏酸松柏酯含量(图2-B)从苗期开始持续上升,到收获期达到最大值;从苗期到根系膨大期二者含量沿着相同的方向不断增加,而从根膨大期到收获期分别逐渐降低和升高,朝2个相反的方向变化,说明二者可能存在相互转化的现象。
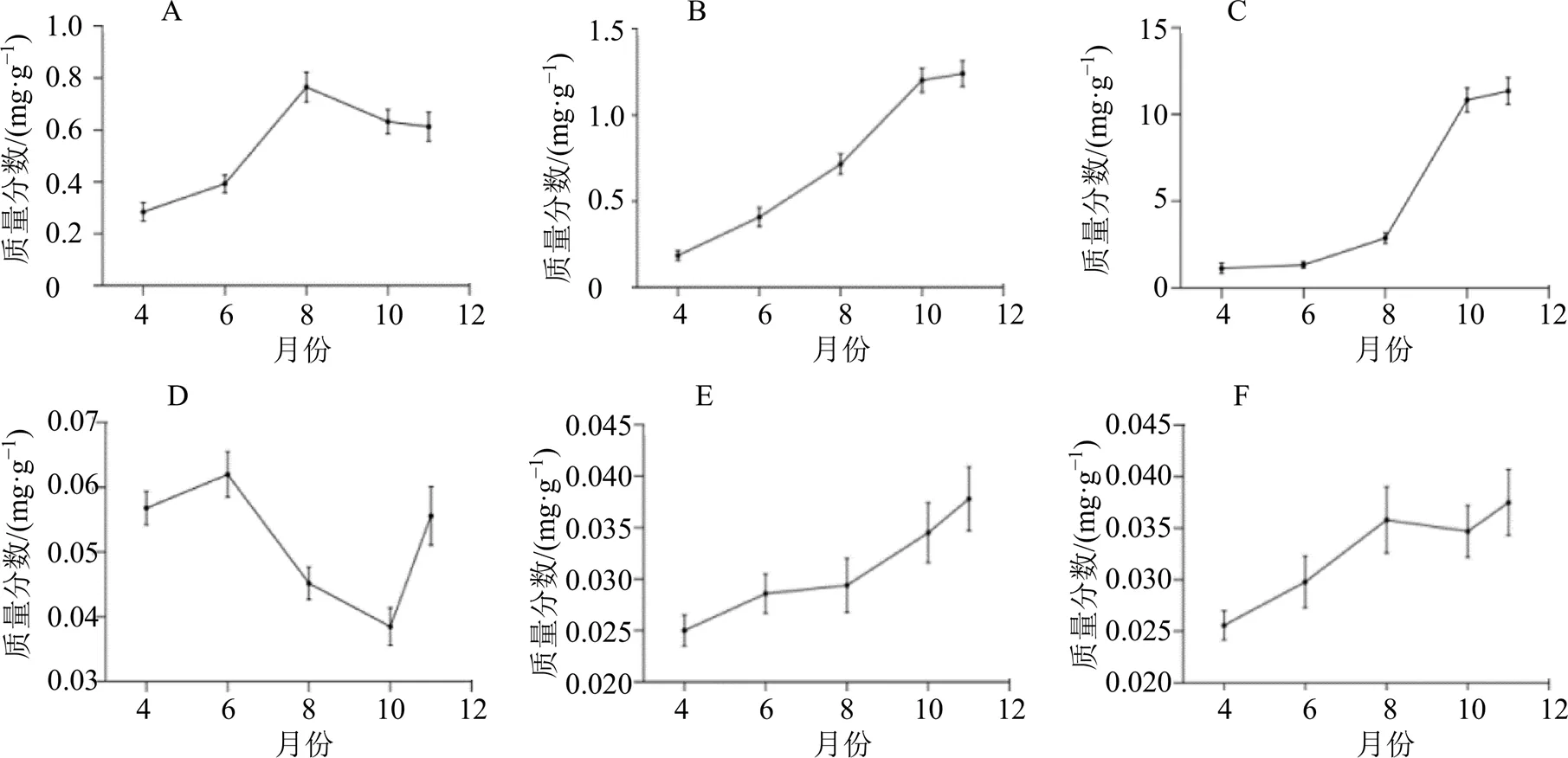
A-阿魏酸 B-阿魏酸松柏酯 C-藁本内酯 D-洋川芎内酯A E-洋川芎内酯I F-欧当归内酯A
3.3 藁本内酯及转化产物含量动态积累和转化分析
结果显示藁本内酯含量(图2-C)从苗期到根膨大期缓慢上升,从膨大期到成药期急速上升,到收获期达到最大值。洋川芎内酯I和欧当归内酯A总体呈现随生长期逐渐上升的趋势,洋川芎内酯A随生长期呈现不规则的变化趋势(图2-D~F)。
3.4 药效物质与生长期相关性分析
Poisson相关性分析(表2)表明蒿本内酯、阿魏酸松柏酯和总阿魏酸(游离阿魏酸与转化的阿魏酸之和)含量与当归生长期呈现极显著的相关性(<0.01),阿魏酸含量与当归生长期呈现显著的相关性(<0.05);总阿魏酸与阿魏酸松柏酯含量之间存在极显著的相关性(<0.01),与阿魏酸含量之间存在显著的相关性(<0.05);阿魏酸和阿魏酸松柏酯含量之间存在中等强度的相关性,相关系数为0.62。

表2 Poisson相关性分析
*表示相关系数具有统计学意义(<0.05),**表示相关系数具有统计学意义(<0.01)
*Indicates that the correlation coefficient is statistically significant (< 0.05),**Indicates that the correlation coefficient is statistically significant (< 0.01)
4 讨论
研究表明在含有阿魏酸的当归、川芎等中药材的体外干燥过程中阿魏酸和阿魏酸松柏酯存在相互转化作用,其机制是阿魏酸松柏酯可以在光照、高温等作用下容易水解为阿魏酸和松柏醇,也有研究表明除物理因素外药材体内可能含有生物酶促进二者的转化[13]。故有些学着提出了“游离阿魏酸”和“总阿魏酸”的概念,将植物体中本来就含有的那部分阿魏酸认为是游离阿魏酸,将游离阿魏酸和其他途径分解生成的阿魏酸之和称作总阿魏酸,建议在用化学分析方法评价中药质量时,应优先采用“总阿魏酸”的含量作为评价指标[14],基于《中国药典》2020年版未对当归含量测定内容修订,因此以阿魏酸含量评价当归药材质量应该注意此问题。阿魏酸在体内的代谢通路研究表明阿魏酸在植物体内经4-香豆酸辅酶A连接酶(4CL)催化成为阿魏酰辅酶A(feruloyl-CoA),再经过肉桂酰辅酶A还原酶(cinnamoyl-CoAreductase,CCR)和肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)转化为松柏醇,松柏醇再经过过氧化物酶/漆酶聚合为G-木质素[15-16]。综合阿魏酸在体内和体外的已知相互转化过程,在当归体内还可能存在阿魏酸和松柏醇转化为阿魏酸松柏酯的过程,以此推断在当归根膨大期到成药期和收获期,阿魏酸转化为阿魏酸松柏酯,一方面阿魏酸松柏酯作为阿魏酸的库存方式,在机体需要的时候又可以转化为阿魏酸,另一方面减少木质素的合成,减少当归根部的木质化程度,这种转化可能对当归生殖特性、抽薹机制和药用部位的形成具有重要的作用。
藁本内酯是当归药材最主要的挥发油成分,其与阿魏酸和阿魏酸松柏酯在当归药材的质量控制和药效成分开发方面具有重要地位[17-18]。藁本内酯作为苯酞类化合物,化学特性决定其具有不稳定性的因素,房鑫等[12]报道藁本内酯室温放置1个月后采用色谱法测定转化物,基本全部转化为本研究测定的5种产物得能共14个组分。但李桂生等[19]研究发现在藁本内酯在提取当归总挥发油中性质在常温下基本稳定,未出现纯品状态下的异构化反应,可能原因是挥发油本身含有一定比例的藁本内酯异构化产物,使异构化反应趋于平衡所致。本研究测定了藁本内酯及其5个主要转化成分洋川芎内酯A、洋川芎内酯H、洋川芎内酯I、欧当归内酯A和正丁基苯酞在当归不同生长期含量动态变化。洋川芎内酯I和欧当归内酯A总体呈现随生长期逐渐上升的趋势,洋川芎内酯A随生长期呈现不规则的变化趋势,但这些转化产物的总体含量很低。藁本内酯含量远远大于转化产物的含量,由此说明在当归活体内藁本内酯的转化程度不高,是挥发油的核心组成成分。藁本内酯含量在膨大期到成药期极速增长,说明当归挥发油类药效物质积累主要发生在成药期,但其体内具体转化机制有待进一步探究。
中药效物质在药材离体干燥过程中会在体内生物酶和物理、化学等因素的作用下发生分解和相互转化,该过程对中药材加工炮制具有重大的影响和意义,而药效物质在药效部位得动态积累和转化则是药效物质形成的基础。本研究发现当归主要药效物质阿魏酸和藁本内酯含量与当归生长期具有密切的相关性,而且在当归不同生长阶段具有不同的积累规律和可能的转化机制,本研究可为当归药材采收时间、加工炮制、质量控制和种质资源的选育提供一定的科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 杨利民, 张永刚, 林红梅, 等. 中药材质量形成理论与控制技术研究进展 [J]. 吉林农业大学学报, 2012, 34(2): 119-124.
[2] 孙嘉辰, 李霞, 王莹, 等. 中药加工炮制过程中质量标志物的研究进展 [J]. 中草药, 2020, 51(10): 2593-2602.
[3] 王惠珍, 晋玲, 张恩和. 海拔对当归中阿魏酸量的影响及关键因子分析 [J]. 中草药, 2013, 44(2): 219-223.
[4] 宋秋月, 付迎波, 刘江, 等. 当归的化学成分研究 [J]. 中草药, 2011, 42(10): 1900-1904.
[5] 中国药典 [S]. 一部. 2005: 139.
[6] Chao W W, Lin B F. Bioactivities of major constituents isolated from(Danggui) [J]., 2011, 6: 29.
[7] 王迎超, 黄怡, 王毅, 等. Z-藁本内酯对人脐静脉内皮细胞保护作用及其机制研究 [J]. 中草药, 2013, 44(9): 1157-1161.
[8] 汤浩, 高庆剑, 陆铖, 等. 阿魏酸和异阿魏酸对HepG2细胞增殖及其细胞色素P450酶的影响 [J]. 中草药, 2014, 45(12): 1726-1730.
[9] 王涛, 林良斌, 张巧玲, 等. 川芎晒干过程中阿魏酸和阿魏酸松柏酯含量的变化 [J]. 植物科学学报, 2015, 33(2): 259-263.
[10] 李韶菁, 张迎春, 苏培瑜, 等. 阿魏酸松柏酯的研究进展 [J]. 中国实验方剂学杂志, 2011, 17(3): 229-231.
[11] 唐力英, 王祝举, 宋秉生, 等. 当归饮片趁鲜切制的可行性探讨 [J]. 中国中药杂志, 2010, 35(23): 3147-3150.
[12] 房鑫, 熊智, 林晓, 等. 藁本内酯的稳定性及其主要转化产物研究 [J]. 天然产物研究与开发, 2014, 26(9): 1339-1344.
[13] 谢京晶, 赵静, 李绍平. 基于化学成分变化的当归药材保质期预测 [J]. 中国中药杂志, 2008, 33(16): 1997-2001.
[14] Lu G H, Chan K, Leung K,. Assay of free ferulic acid and total ferulic acid for quality assessment of[J]., 2005, 1068(2): 209-219.
[15] 刘敬, 李文建, 王春明, 等. 当归中有效成分阿魏酸的生物合成及调控 [J]. 中草药, 2008, 39(12): 1909-1912.
[16] Vanholme R, de Meester B, Ralph J,. Lignin biosynthesis and its integration into metabolism [J]., 2019, 56: 230-239.
[17] 汪程远, 杜俊蓉, 钱忠明. 藁本内酯的研究进展 [J]. 中国药学杂志, 2006, 41(12): 889-891.
[18] 裴媛, 谭初兵, 徐为人, 等. 当归苯酞类和萜类成分作用的虚拟评价 [J]. 中草药, 2010, 41(6): 938-941.
[19] 李桂生, 马成俊, 李香玉, 等. 藁本内酯的稳定性研究及异构化产物的GC-MS分析 [J]. 中草药, 2000, 31(6): 405-406.
Dynamic accumulation and transformation of ferulic acid and ligustilide in root of
LUO Jun1, 2, WANG Yin-quan1, 2, 3, WU Guo-tai1, WANG Yan1, WANG Zhen-heng1, LI Shu-nan1, PENG Tong1
1. Gansu University of Chinese Medicine, Lanzhou 730000, China 2. Key Laboratory of Chemistry and Quality for Traditional Chinese Medicines of the College of Gansu Province, Lanzhou 730000, China 3.Northwest Chinese Tibetan medicine Collaborative Innovation Center, Lanzhou 730000, China
To analyze the accumulation rule and possible transformation mechanism of ferulic acid and ligustilide, the main pharmacodynamic components ofroot.The contents of ferulic acid, coniferyl ferulate and six phthalides in roots ofat different growth stages were analyzed by HPLC combined with the results of in vitro transformation studies.The content of ferulic acid and coniferyl ferulate increased in the same direction from seedling stage to root enlargement stage, while gradually decreased and increased from root enlargement stage to harvest stage changing in two opposite directions. It was suggesting that there may be a process of conversion of ferulic acid and coniferyl alcohol into coniferyl ferulate in the root of. The content of ligustilide and five transformed products showed an increasing trend with the growth period, especially from the root enlargement stage to the medication stage, which accorded with the characteristics of medication stage. The content of ligustilide was much greater than that of the other five phthalides, suggesting that the transformation degree of ligustilide inin vivo was not high, and the specific transformation mechanism needs to be further clarified.Ferulic acid and ligustilide have different accumulation and transformation rules in different growth periods. This study can provide theoretical support for the production, processing and quality evaluation ofmedicinal materials.
(Oliv.) Diels; ferulic acid; ligustilide; pharmacodynamic component; transformation; senkyunolide I; senkyunolide H; coniferyl ferulate; senkyunolide A; butylphthalide; levistolide A
R286.2
A
0253 - 2670(2021)21 - 6663 - 06
10.7501/j.issn.0253-2670.2021.21.024
2021-03-03
国家重点研发计划项目“中医药现代化研究”专项(子课题)(2017YFC1700705);甘肃省教育厅双一流重大科研项目(GSSYLXM-05);甘肃中医药大学扶贫科技专项(2019FPZX-1);甘肃省教育厅高等学校创新能力提升项目(2019B-101);甘肃中医药大学中青年基金项目(ZQ2015-5)
雒 军,男,博士研究生,研究方向为中药质量综合评价研究。E-mail: luojunnwnu@126.com
王引权,男,教授,博士生导师,博士,研究方向为中药质量综合评价研究。Tel: (0931)8768293 E-mail: kjkfpp@163.com
[责任编辑 时圣明]

