EphA2在宫颈病变组织中的表达及其与上皮间质转化 的关系
班振英,蔡欣桐,智艳芳,张威,杜艳敏,李珍,刘丽萍
(郑州大学第三附属医院,河南 郑州 450052)
0 引言
宫颈癌是女性最常见的恶性肿瘤之一,虽然近年来早期宫颈癌筛查使患者生存率明显提高,但研究显示,肿瘤的侵袭、转移仍是宫颈癌患者死亡的重要原因,严重威胁女性健康[1,2]。
上皮间质转化(Epithelial mesenchymal transition, EMT)是上皮源性细胞的形态改变、极性消失、细胞间连接减弱、间隙增大等使其获得间质型细胞特征的细胞变化过程,EMT的发生已被证实是恶性肿瘤浸润及转移的重要原因[3,4]。EMT过程涉及一些标志蛋白如E-cadherin,N-cadherin,vimentin,slug,snail,Twist,ZEB等的表达变化。其中E钙粘蛋白(E-cadherin)是Ca2+依赖性上皮源性蛋白,在EMT过程中通常表达降低[5]。波形蛋白(vimentin)是间质源性Ⅲ型中间纤维(IFs)蛋白之一,其在肿瘤中表达增加被认为是EMT的重要标志[6]。
促红素人肝细胞受体A2(erythropietin-producinghuman hepatocellular,EphA2)是Lindberg等人发现具有酪氨酸激酶活性的Eph亚家族成员之一,由976个氨基酸构成的多肽, 主要表达于细胞-细胞连接处,作用于细胞生长、迁移等过程[7]。近年来多项研究表明,EphA2在参与肿瘤的发生发展时其表达与EMT过程密切相关,可以促进肿瘤细胞增殖,参与肿瘤的侵袭和转移[8,9]。但在宫颈癌中EphA2与EMT的相关研究较少。本实验旨在研究EphA2在宫颈癌组织中的表达情况及与EMT过程中E-cadherin,vimentin表达的相关性,以期为早期预防宫颈癌的复发转移和基因治疗提供新的思路。
1 材料与方法
1.1 临床资料
收集2017年至2020年经我院确诊并手术切除的宫颈组织117例,其中正常宫颈组织30例,HSIL组织30例,宫颈鳞癌组织57例(其中不伴转移37例,伴转移20例)。收集患者临床病理资料包括:年龄,组织学分级,肌层浸润深度,分化程度,淋巴结转移。所有病例均为原发性肿瘤,初次手术治疗,手术前未行放、化疗治疗,不合并心脑血管肾等严重内科疾病。
1.2 方法
1.2.1 制备组织芯片
术中切除组织标本经10%的中性福尔马林固定后石蜡包埋,切取厚度4μm做HE染色,由两名临床经验丰富的副高职称以上病理科医师阅读切片,标记癌变组织部位,于对应蜡块上用打孔器取大小约1cm×1cm×2mm蜡块组织编号并记录临床病理资料。另取大小4cm×2cm×1cm空白蜡块,用注射器针头划网格状,在每个网格交叉点处用打孔器取1cm×1cm×2mm大小蜡块制成模块,将已编号的蜡块组织依次放入阵列模块中。温箱中加热使所有编号组织与阵列模块融为一体。冷却后切取厚度4μm薄片,80℃烤箱2h。采用二甲苯脱蜡后,梯度酒精水化,热修复法修复抗原。
1.2.2 免疫组织化学SP法
检测组织芯片上EphA2、E-cadherin、vimentin的表达。每张芯片重复实验三次。抗原修复缓冲液(基因科技上海股份有限公司货号GT100410批号2019121601),EphA2购于(Cell Signaling Technology,货号#6997),非特异性染色抗原阻断剂(基因科技上海股份有限公司货号GK600511-A批号2019072301)酶标羊抗鼠/兔IgG聚合物(基因科技上海股份有限公司货号GK600511-B批号2019072301),DAB染色液(基因科技上海股份有限公司货号GK600511批号2019072301)具体过程参照说明书。根据说明书阴性对照为PBS液代替一抗;阳性对照为卵巢癌组织。
1.2.3 免疫组化结果的判读
每张切片随机观察5个高倍视野,根据阳性细胞比例计数:阳性细胞占总细胞数<10%--0分;10%~25%--1分;26%~50%--2分;51%~75%--3分;>75%--4分。染色深度评分:无染色—0分;淡黄色—1分;黄色~棕黄色—2分;棕褐色—3分。总评分=阳性细胞数评分×染色深度评分。总评分0分—阴性(-);1~4分—弱阳性(+);5~8分—阳性(++);9~12分—强阳性(+++)。阴性与弱阳性为低表达,阳性与强阳性为高表达[10]。三次重复实验后评分取平均值。
1.2.4 Western Blot检 测EphA2、E-cadherin、vimentin蛋白表达
随机选取正常组、HSIL组、宫颈癌组组织,每组6例,液氮冻存,经RIPA组织蛋白裂解液裂解、研磨、超声破碎。使用BCA 蛋白定量试剂盒测定蛋白浓度。取 30μg蛋白上样,SDS-PAGE 电泳,分别加入兔抗人多克隆抗体(PBS稀释1∶20000),孵育过夜,加入辣根酶标记的二抗孵育,ECL化学发光、显影,Image J 软件分析灰度,以β-actin为内参 (PBS稀释1∶2 000),目标蛋白灰度值和内参照条带灰度值的比值表示蛋白相对表达量。
1.3 统计学分析。
应用SPSS 26.0软件进行统计学处理。计数资料之间比较采用χ2检验,计量资料以(±s)表示,计量资料采用t检验,相关性分析采用spearson相关检验,以P<0.05为差异有统计学意义。
2 结果
2.1 EphA2、E-cadherin、vimentin在正常组、HSIL组、宫颈鳞癌组中的表达情况
EphA2主要表达于细胞质和细胞膜,E-cadherin主要表达于细胞膜,vimentin主要表达于细胞质。三者在宫颈癌组中的表达与正常组及HSIL组均有明显差异,如表1所示(P<0.05)。其中宫颈鳞癌组中的EphA2、E-cadherin、vimentin的阳性表达率分别为 64.91%(37/57),29.82%(17/57), 57.89%(33/57)。

图1 不同宫颈组织中EphA2的表达(SP法,×200)A:正常宫颈组;B:HSIL组;C:宫颈鳞癌组

图2 不同宫颈组织中E-cadherin的表达(SP法,×200) A:正常宫颈组织中E-cadherin在细胞膜上阳性表达;B:HSIL组织中E-cadherin表达减弱;C:宫颈鳞癌组织中E-cadherin表达阴性

图3 不同宫颈组织中Vimentin的表达(SP法,×200)A:正常宫颈组;B:HSIL组;C:宫颈鳞癌组
2.2 EphA2、E-cadherin、vimentin在宫颈癌组织中的表达及其与临床病理因素的关系
如表2所示,宫颈癌组织中EphA2在伴有深肌层浸润(>2/3纤维肌层)宫颈癌组织中表达明显高于无深肌层浸润的组织(χ2=7.822,P<0.01),在伴有淋巴转移组中的表达较无转移组中表达有明显升高,差异有统计学意义(χ2=5.459,P<0.05)。与年龄、FIGO分期、分化程度、肿瘤大小、组织学分型差异均无统计学意义。
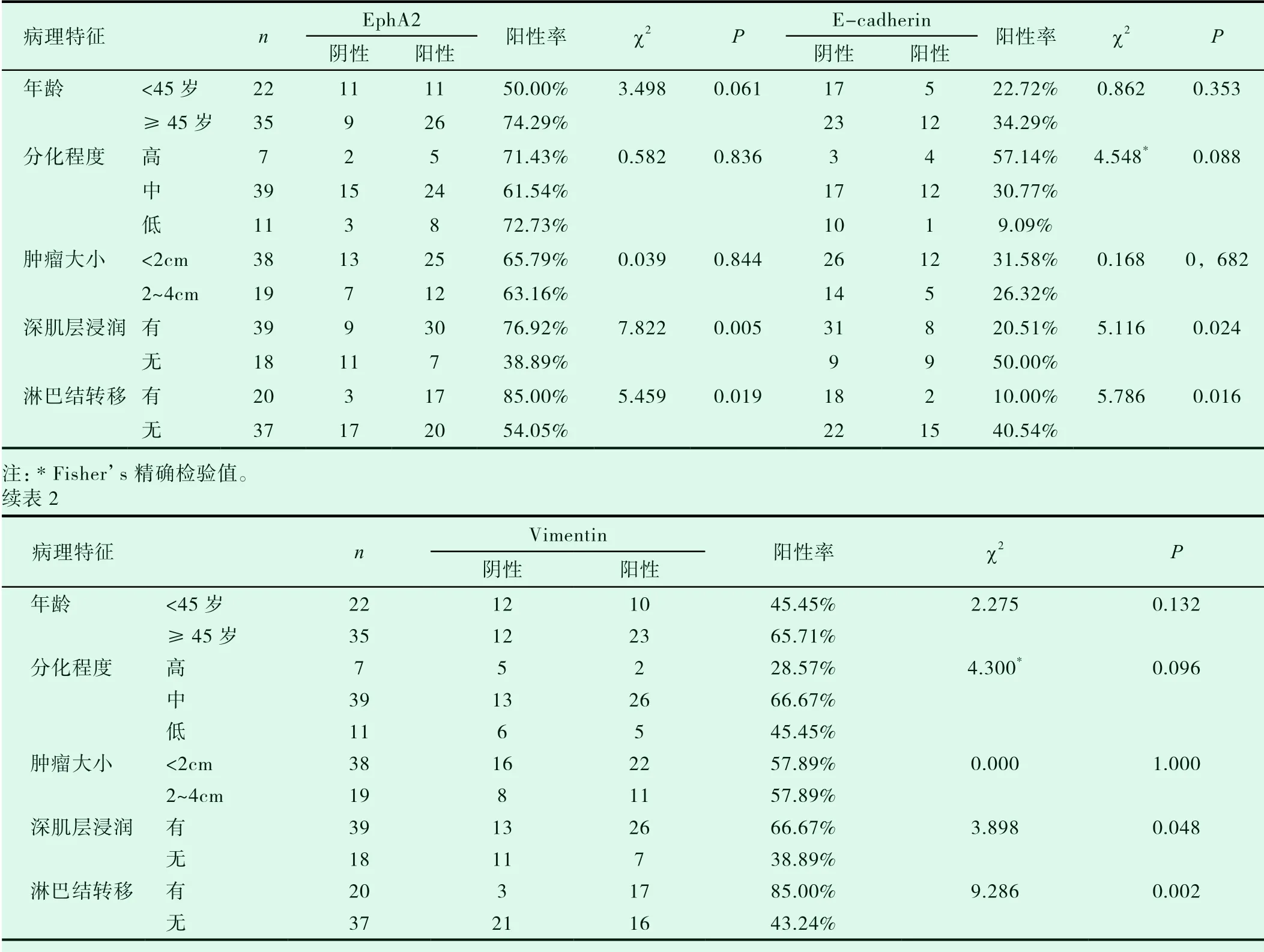
表2 EphA2在宫颈癌中的表达与临床病理特征的关系(n,%)
E-cadherin在伴有淋巴结转移组中的表达较无转移组中表达有明显降低,差异有统计学意义(χ2=5.786,P<0.05),在伴有肌层浸润的宫颈癌组织中的表达较无肌层浸润组织中的表达明显降低(χ2=5.116,P<0.05),与年龄、分化程度、肿瘤大小差异均无统计学意义。
vimentin在伴有肌层浸润宫颈癌组织中表达明显高于无肌层浸润的组织(χ2=3.898,P<0.05)在伴有淋巴转移组中的表达较无转移组中表达有明显升高,差异有统计学意义(χ2=9.286,P<0.01),与年龄、分化程度、肿瘤大小差异均无统计学意义。
2.3 EphA2与E-cadherin、vimentin在宫颈癌组织中表达的相关性分析
在 宫 颈 癌 组 织 中,EphA2,vimentin表 达 升 高,而E-cadherin表达明显降低。采用Spearman’s秩相关性分析,如表3所示,宫颈癌中EphA2的表达与vimentin阳性表达呈正相关(r=0.490,P<0.01);与E-cadherin表达呈负相关(r=-0.324,P<0.05)。

表3 宫颈癌组织中EphA2、E-cadherin、vimentin表达的相关性分析
2.4 Western Blot 检测结果
如图4所示,EphA2在正常宫颈组,HSIL组,宫颈癌组中的表达依次升高,与正常宫颈组相比,宫颈癌组中表达增高(P<0.05)差异有统计学意义。E-cadherin在三组组中的表达依次降低。Vimentin在三组中表达依次升高,且在宫颈癌组中的表达明显高于正常宫颈组及HSIL组(P<0.05)。

图4 Western blot 法检测EphA2、E-cadherin、vimentin的蛋白表达
3 讨论
EphA2主要表达于成人上皮细胞的细胞-细胞连接处,细胞生长、迁移及血管生成等过程[11]。研究发现激活cAMP/PKA通路可调节EphA2表达的同时对EMT标志物E-cadherin同样具有调节作用[12]。在肿瘤发展中,EMT过程涉及另一重要信号通路为Wnt /β-catenin信号通路[13]。在胃癌中,针对EphA2的调控因子miR-302B,可通过阻滞细胞周期抑制细胞增殖,并通过调节EphA2产生信号转导级联,减弱N-钙粘蛋白的表达及Wnt/β-catenin/EMT信号通路的功能来抑制胃癌细胞的上皮转移[9]。在另一项研究中也同样证实,EphA2可通过Wnt/β-catenin信号通路促进EMT的发展[14]。
本研究发现 EphA2 与患者年龄、病理类型,肿瘤大小无关(P>0.05),但在不同的浸润深度及有无淋巴结转移中的表达均有显著性关系(P<0.05),且随着淋巴结转移的出现,EphA2 的表达随之增高,因此 EphA2 的高表达可能与宫颈癌的发生、发展、浸润、转移有关;
E-钙黏蛋白(E-cadherin)是Ⅰ型钙粘蛋白的原型。有关食管癌的最新研究表明,通过沉默G3BP1观察到Wnt/β-catenin和PI3K/Akt的表达水平下调,E-cadherin显著升高,抑制食管癌细胞的增殖、迁移和侵袭[15]。在肝癌组织中,Ras相关家族成员Rab23,通过上调转化生长因子-β(TGF -β)激活Rac途径,促进N-钙粘蛋白及vimentin表达,降低E-cadherin的表达,促进EMT过程及肿瘤细胞的迁移扩散[16]。在非小细胞肺癌的EMT过程中,通过Ras/ERK/Snail1途径的激活,使E-cadherin表达降低[17]。在宫颈癌细胞中研究表明E-cadherin表达受氯化钾共转运蛋白3(KCC3)负性调节,过表达的KCC3通过抑制E-cadherin基因的转录并加速蛋白体依赖性β-catenin的蛋白降解而抑制E-cadherin /β-catenin复合物的形成,从而减弱细胞间联系,增强肿瘤细胞的侵袭性和增殖能力,促进EMT刺激肿瘤进展[18]。
F-波形蛋白(Vimentin)属Ⅲ型中间丝蛋白,与微管、微丝共同构成维持细胞结构和形态的细胞蛋白骨架。作为EMT过程中经典的间质细胞型标志物,vimentin在多种肿瘤中表达升高,如结肠癌、肺癌、乳腺癌[19-21]等,并与肿瘤的侵袭和转移密切相关。在有关结肠癌的研究中发现,miR-21协同转化生长因子β(TGF-β),激活Rac通路上调vimentin的表达,促进EMT过程及肿瘤的侵袭和转移[19]。同时,在宫颈癌中也观察到,miR-21过表达促进锌指E盒结合同源盒(ZEB1,为E-cadherin的阻遏物)和vimentin的表达升高,促进EMT进程及肿瘤转移[22],但具体机制有待进一步研究。
本研究发现EphA2在宫颈癌中阳性表达增高的同时出现E-cadherin蛋白的表达下降和vimentin蛋白的表达升高的现象。我们对EphA2、E-cadherin蛋白、vimentin蛋白表达之间的相关性进行了分析,结果发现宫颈癌中EphA2的表达与E-cadherin蛋白的表达呈负相关;与vimentin蛋白的表达呈正相关。侯福涛等[23]在胃癌中的研究也发现了相似结论.这些研究均表明EphA2与EMT之间可能存在着某些潜在的联系,提示EphA2可能通过参与 EMT的过程从而在宫颈癌的侵袭与转移过程中发挥重要作用。但其具体作用机制仍不清楚。EphA2有望成为宫颈癌诊断与治疗的新的潜在靶标,但仍需进一步实验证实。

