废旧钴酸锂电池正极活性物质高效湿法浸出动力学研究
周钦文,陈文婧,王石泉,郑莹,刘建文
(1.湖北大学化学化工学院, 湖北 武汉 430062; 2.武昌首义学院城市建设学院, 湖北 武汉 430064)
0 引言
锂电池种类繁多,包括一次锂电池、二次锂电池等. 一次锂电池包括Li/MnO2电池以及其他一次锂电池. 二次锂电池包括锂离子电池、金属锂负极二次电池、水溶解锂离子电池等. 并且锂离子电池相比其他电池如银锌电池、铅酸电池、镍氢电池等有很多优点,包括体积小、质量轻、循环寿命长、无记忆效应等,因此被广泛应用于手机、笔记本电脑、数码相机等便携设备中[1-3]. 因此在大量需求下使得锂离子电池的产量逐年增加[4-8]. 全球电动汽车市场的蓬勃发展是锂离子电池中金属矿价上涨的直接原因,这就导致了锂离子电池需求的快速增长与原材料稀缺的矛盾凸显,使得废旧锂离子电池的回收工作迫在眉睫[9-15]. 锂离子电池的寿命一般为3年,当其使用寿命结束后,就会产生大量的废旧锂离子电池,这些废旧锂离子电池如果处理不当就会造成资源浪费、环境污染以及可能的能源危机.
目前,国内外对废旧钴酸锂电池的回收,主要对其中的金属锂和钴进行再利用. 回收方法主要分为两种: 火法冶金法和湿法冶金法. 火法工艺相对简单,但也存在热处理能耗较高,对环境会造成二次污染等缺点. 湿法冶金法相较于火法对有价金属的回收率更高,操作条件也较为温和,最重要的是对环境污染较小,因此湿法冶金成为目前国内外研究者广泛采用的方法.
本研究选择柠檬酸作为浸出剂对废旧钴酸锂电池正极活性物质进行浸出研究,柠檬酸是一种常见的有机弱酸,柠檬酸与钴酸锂反应后的废液容易处理,对环境造成的污染小. 以废旧钴酸锂电池经预处理得到的正极活性物质为研究对象,深入研究湿法浸出的反应动力学,考察不同温度、转速、起始反应物粒径等因素对浸出效率的影响,从而确定柠檬酸高效湿法浸出钴酸锂反应的活化能及反应控制原理.
1 实验部分
1.1 实验原理柠檬酸是一种常见的弱有机酸,在溶液中并不是完全分解,使用柠檬酸做为浸出剂浸出LiCoO2可以描述为一个三层的反应. LiCoO2与C6H8O7·(H2O)溶液的浸出反应可描述为如下方程式:
6H3Cit(aq)+2LiCoO2(s)+H2O2(aq)=2Li+(aq)+6H2Cit-(aq)+2Co2+(aq)+4H2O+O2(g)
(1)
6H2Cit-(aq) + 2LiCoO2(s) + H2O2(aq)=2Li+(aq)+2Co2+(aq)+6HCit2-(aq)+4H2O+O2(g)
(2)
6HCit2-(aq) + 2LiCoO2(s) + H2O2(aq)=2Li+(aq)+2Co2+(aq)+6Cit3-(aq)+4H2O+O2(g)
(3)
LiCoO2电极中的Co为+3价,Co3+不易溶于水,具有强氧化性,在水中一般以Co2+的形式存在. 因此,从反应式(1)到(3)可以看出,LiCoO2电极中Co的浸出是一个还原浸出过程,在具备还原条件的体系中才有较好的浸出效果. 过氧化氢可以促进反应. 反应(1)是将三价钴离子还原为二价钴离子的主要浸出反应. 因此,在用酸浸出LiCoO2的过程中需要添加H2O2溶液以提高钴的浸出效率.
浸出的原理是利用柠檬酸破坏LiCoO2的结构,从而使LiCoO2中的钴溶解进入溶液,以便回收钴元素. 浸出完成后,溶液中主要金属离子为Co2+和Li+,并同时存在有少量Fe、Cu、Zn、Ni、Ca等杂质金属离子,而乙炔黑粉末和一些残留粘结剂则不参加浸出反应留在渣中.
1.2 实验原料对集中收集的废旧锂离子电池开展破碎分选预处理工作,手动将废旧锂离子电池的外包装去除、使用放电电路对废旧锂离子电池进行放电处理、手动使用工具将电池铝制或钢制外壳分解以便取出其中的电芯、分离出废旧电池中的正极材料. 取出正极极板,用有机溶剂浸泡极板,得到正极活性材料,将其干燥,研磨成粉末即获得废旧钴酸锂材料.
1.3 实验方法
1.3.1 实验流程 1)称取一定质量的柠檬酸置于250 mL三口烧瓶中,加入蒸馏水,待柠檬酸完全溶解后,再向烧瓶中加入1 mL过氧化氢溶液. 2)称取2 g(准确至0.000 1 g)钴酸锂粉末加入烧瓶中,将三口烧瓶放入水浴锅中设定温度,开启搅拌器进行反应.3)考察不同温度、转速、起始反应粒径对浸出效率的影响. 废旧电池电极活性物质以高温高效湿法浸出,最后得到含钴的滤液.
1.3.2 实验准备 1)假设柠檬酸与钴酸锂完全反应,可以得出完全反应的反应式如下:
2H3Cit(aq)+2LiCoO2(s)+H2O2(aq)=2Li+(aq)+2Cit3-(aq)+2Co2+(aq)+4H2O+O2(g)
(4)
由反应式(4)可以看出,1 mol的钴酸锂只需1 mol的柠檬酸浸出,但是柠檬酸为有机弱酸,实际反应过程中不可能与钴酸锂完全反应,所以在实验过程中,取过量的柠檬酸与钴酸锂完全反应. 本实验选用柠檬酸过量3.5倍. 2)固液比增大并不能使浸出效率增加. 因为当固液比较高时,溶液主体中反应生成物的浓度也随之增大,使电极表面的生成物向溶液主体扩散更加困难,因此浸出效率反而降低. 本实验选用固液比为20 g/L来浸出钴酸锂粉末. 3)由于离解过程的柠檬酸经历一场吸热反应,并且随着温度的升高更多的氢离子出现在溶液中. 因此,LiCoO2的浸出效率随着温度的升高而升高. 当温度增长至90 ℃,浸出效率最高,但是温度高于90 ℃后柠檬酸开始逐渐从溶液中蒸发. 所以在研究转速和起始反应粒径对钴酸锂浸出反应的关系时选用反应温度为90 ℃.
1.3.3 钴离子的测定 仪器选用TAS-990原子吸收分光光度计,钴空心阴极灯,乙炔钢瓶,空压机. 按照每20、60、120、180、240 min取出1 mL钴酸锂与柠檬酸的反应溶液,将反应溶液过滤,并将滤液移入250 mL容量瓶中,加入蒸馏水稀释至刻度,摇匀, 作为样品测定钴离子的浓度.
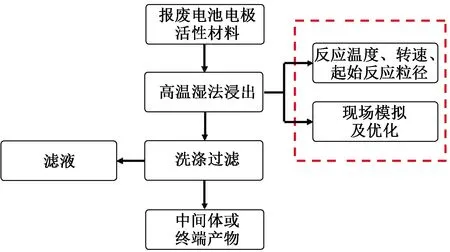
图1 废旧锂离子电池正极活性材料的技术路线
2 结果与讨论
2.1 钴酸锂浸出效率影响规律
2.1.1 温度对浸出率的影响 实验参数:转速300 r/min,固液比20 g/L,摩尔比1∶3.5,反应时间4 h. 按实验流程在70 ℃,75 ℃,80 ℃,85 ℃,90 ℃条件下进行浸出反应.
从图2温度与浸出效率的关系曲线可以看出,温度对浸出效率的影响显著,升高温度可以明显提高浸出效率. 70 ℃时浸出效率最低,仅为62.2%. 当温度从70 ℃升高至90 ℃时,以5 ℃为间隔,浸出效率分别提高了4.74%,7.7%,5.93%,5.92%,并在90 ℃达到最大值86.49%. 温度升高,浸出效率显著提高. 由此可见,钴酸锂中化学键的断裂需要一定的活化能.

图2 反应温度对原料中金属浸出效率的影响
2.1.2 转速对浸出率的影响 实验参数:反应温度90 ℃,固液比20 g/L,摩尔比1∶3.5,反应时间4 h. 按实验流程在300、400、500、600、800 r/min条件下进行浸出反应.
从图3转速与浸出效率的关系曲线可以看出,转速对于钴酸锂浸出效率的影响较小;当转速从300 r/min升高至600 r/min时,浸出效率仅提高了1.19%. 提高搅拌速度,可减小扩散层厚度[17],有利于浸出剂柠檬酸迅速扩散到钴酸锂颗粒表面与之反应,故转化率会提高. 但当搅拌速度提升至800 r/min时,浸出效率急剧下降,因为此条件下,外扩散已经不是控制浸出速度的最慢步骤. 由于搅拌过于剧烈,造成钴酸锂颗粒和液体同步转动,浆液无法混匀;同时,离心力加大,导致固液分离,反应物无法充分接触,故而转化率降低.
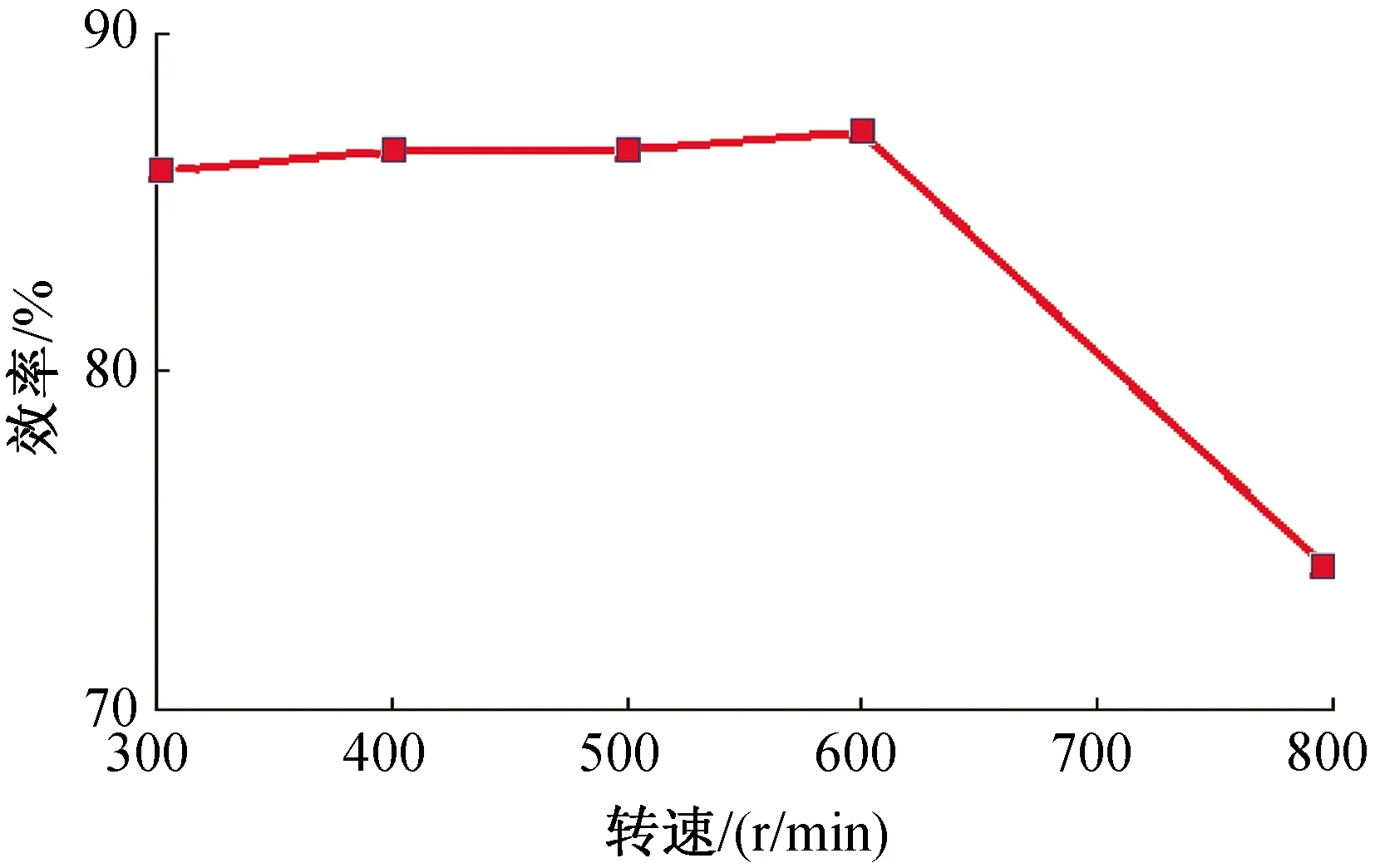
图3 反应转速对原料中金属浸出效率的影响
2.1.3 起始反应粒径对浸出率的影响 实验参数:反应温度90 ℃,固液比20 g/L,摩尔比1∶3.5,反应时间4 h. 用分样筛对钴酸锂粉末进行筛分,筛分后的物料粒径在0.038 5 mm至0.054 mm,0.054 mm至0.063 mm,0.063 mm至0.075 mm,0.075 mm至0.105 mm之间,然后进行浸出反应.
从图4起始反应粒径与浸出效率的关系曲线可以看出,起始反应粒径对浸出效率的影响显著;当平均起始反应粒径从0.046 25 mm增大至0.058 5 mm时,浸出效率从87.7%降至85.92%. 随着平均起始粒径继续增加,浸出效率逐渐减小. 平均起始反应粒径增大至0.090 0 mm时,浸出效率降为81.78%. 该反应为固液多相反应,反应速度会随接触表面积的增大而提高. 颗粒粒度越小,比表面积越大,固液接触面积越大[18]. 当浸出反应属于化学反应控制时,减小颗粒粒度,可提高浸出率[19].
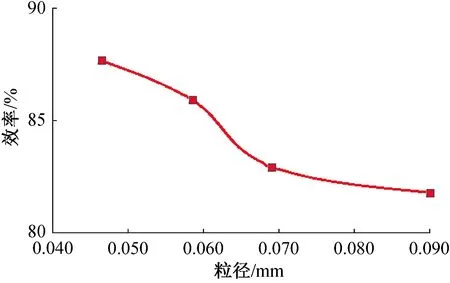
图4 起始反应粒径对原料中金属浸出效率的影响
2.2 钴酸锂浸出动力学
2.2.1 钴酸锂浸出反应步骤 由于钴酸锂浸出反应是一个多相反应体系,因此反应物之间要实现化学反应,必须以它们之间的相互接触为前提[20]. 根据流体-固体反应的多相反应过程和酸浸实验的结果分析,柠檬酸与钴酸锂之间的多相反应过程步骤如下:1)柠檬酸反应物由柠檬酸本体相扩散到LiCoO2表面;2)柠檬酸反应物在正极材料中反应物的表面经过吸附、反应,生成产物柠檬酸钴等,在经过酸浸产物的晶核形成、长大和脱附等过程,实现界面和局部的化学反应步骤;3)酸浸产物通过扩散离开固液界面;多相反应的速度一般由吸附、化学反应和扩散3个步骤决定. 由于吸附很快达到平衡,所以多相反应的速度主要由化学反应和扩散决定[21]. 上述1)和3)两步是扩散过程,2)是化学反应过程. 反应的实际速度由最慢的一步决定,这一步成为整个反应的控制步骤.
2.2.2 柠檬酸浸出的反应活化能 不改变其他因素,随时间的增加(20、60、120、180、240 min),不同反应温度与浸出效率的关系见图5.
假设柠檬酸与钴酸锂的浸出反应为化学反应控制. 按照化学反应控制速度方程对图5中数据进行拟合. 结果见图6.
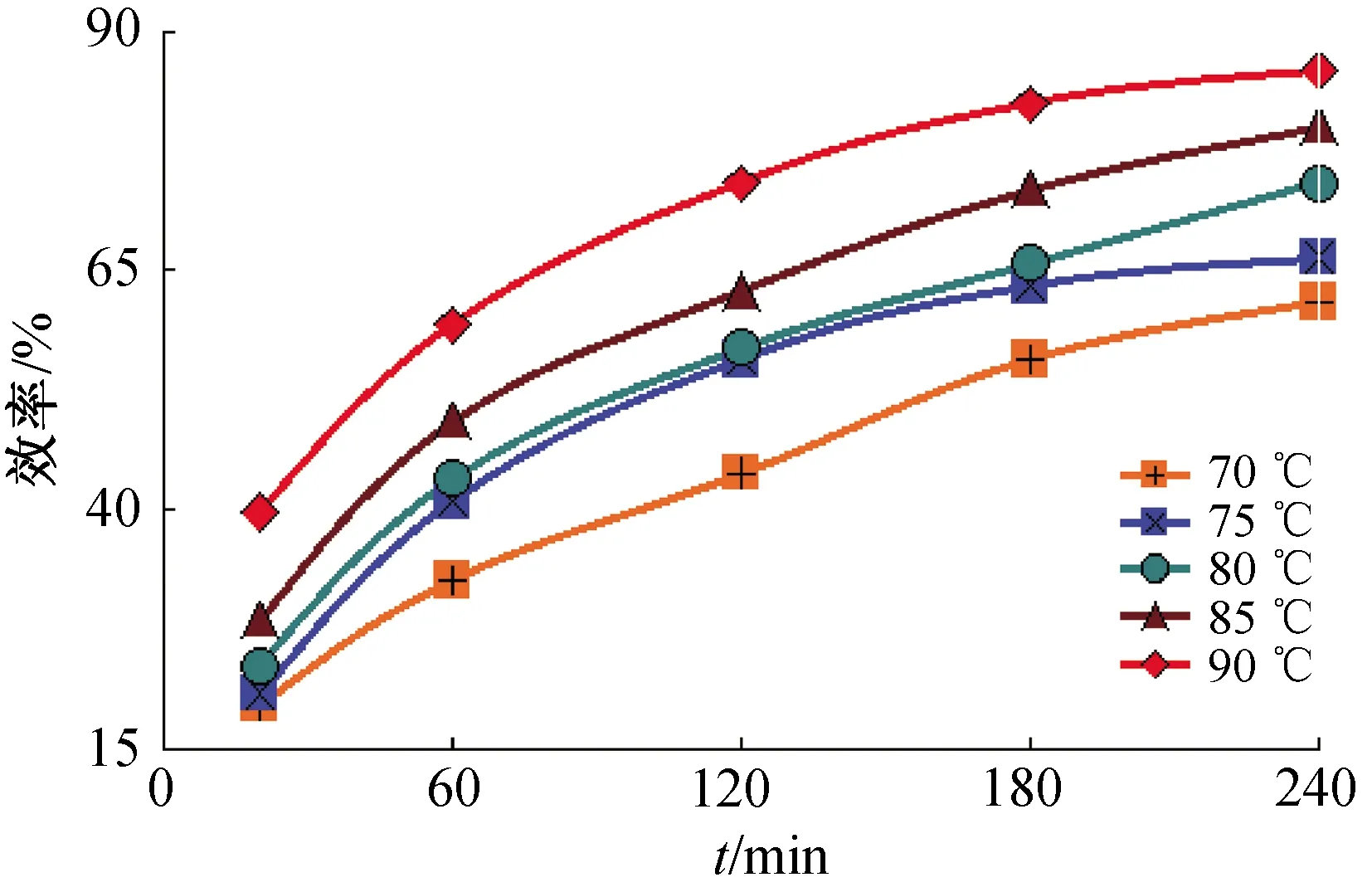
图5 反应时间对原料中金属浸出效率的影响

图6 不同反应温度的浸出动力学曲线
图6 中动力学方程式为:
90 ℃: 1-3(1-X)2/3+2(1-X)=0.001 7t+0.049 0
(5)
85 ℃: 1-3(1-X)2/3+2(1-X)=0.001 4t+0.007 8
(6)
80 ℃: 1-3(1-X)2/3+2(1-X)=0.001 1t+0.000 8
(7)
75 ℃: 1-3(1-X)2/3+2(1-X)=0.000 9t+0.010 5
(8)
70 ℃: 1-3(1-X)2/3+2(1-X)=0.000 7t-0.004 2
(9)
X为浸出效率(%);t为浸出时间(min).
式(5)~(9)中方程的相关系数R2分别为0.975 0, 0.997 5, 0.998 4, 0.964 2, 0.994 3,均大于0.960 0,说明拟合度高. 各浸出温度下,综合反应速率常数对数值lnK的计算结果见表1.
由表1中数据可以作出柠檬酸与钴酸锂浸出反应阿雷尼乌斯曲线.
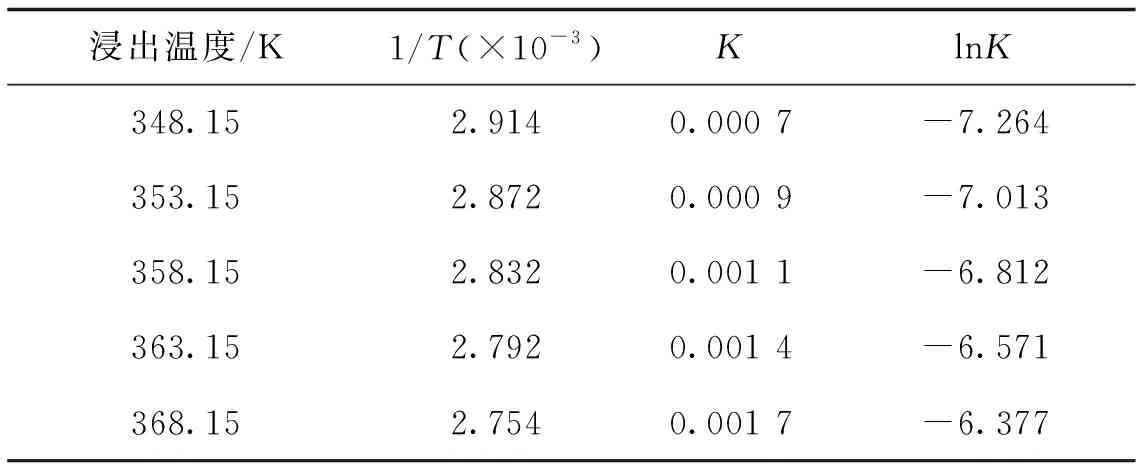
表1 不同浸出温度下综合反应速率常数对数值

斯曲线的斜率为E/R.图7中直线斜率为-5.541 9,所以活化能为46.075 kJ/mol,大于42 kJ/mol,即浸出为化学反应控制.
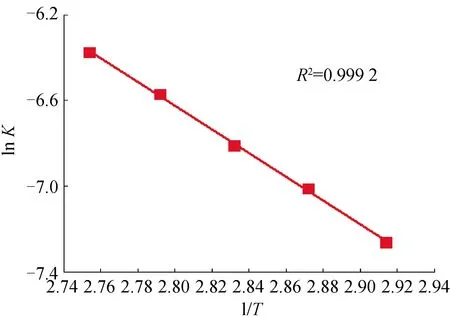
图7 柠檬酸与钴酸锂浸出反应的阿雷尼乌斯曲线
2.2.3 起始反应粒径的浸出动力学研究 同一反应在不同反应条件下机理有可能会发生改变. 因此每一种机理应该在具体条件下具体分析,这样才能避免单一机理所带来的局限性,更要在实践中反复检验才能做出最后的结论. 因此通过改变起始反应粒径来验证柠檬酸浸出为化学反应控制. 不改变其他因素,随时间的增加(20,60,120,180,240 min),不同平均起始反应粒径与浸出效率的关系见图8.
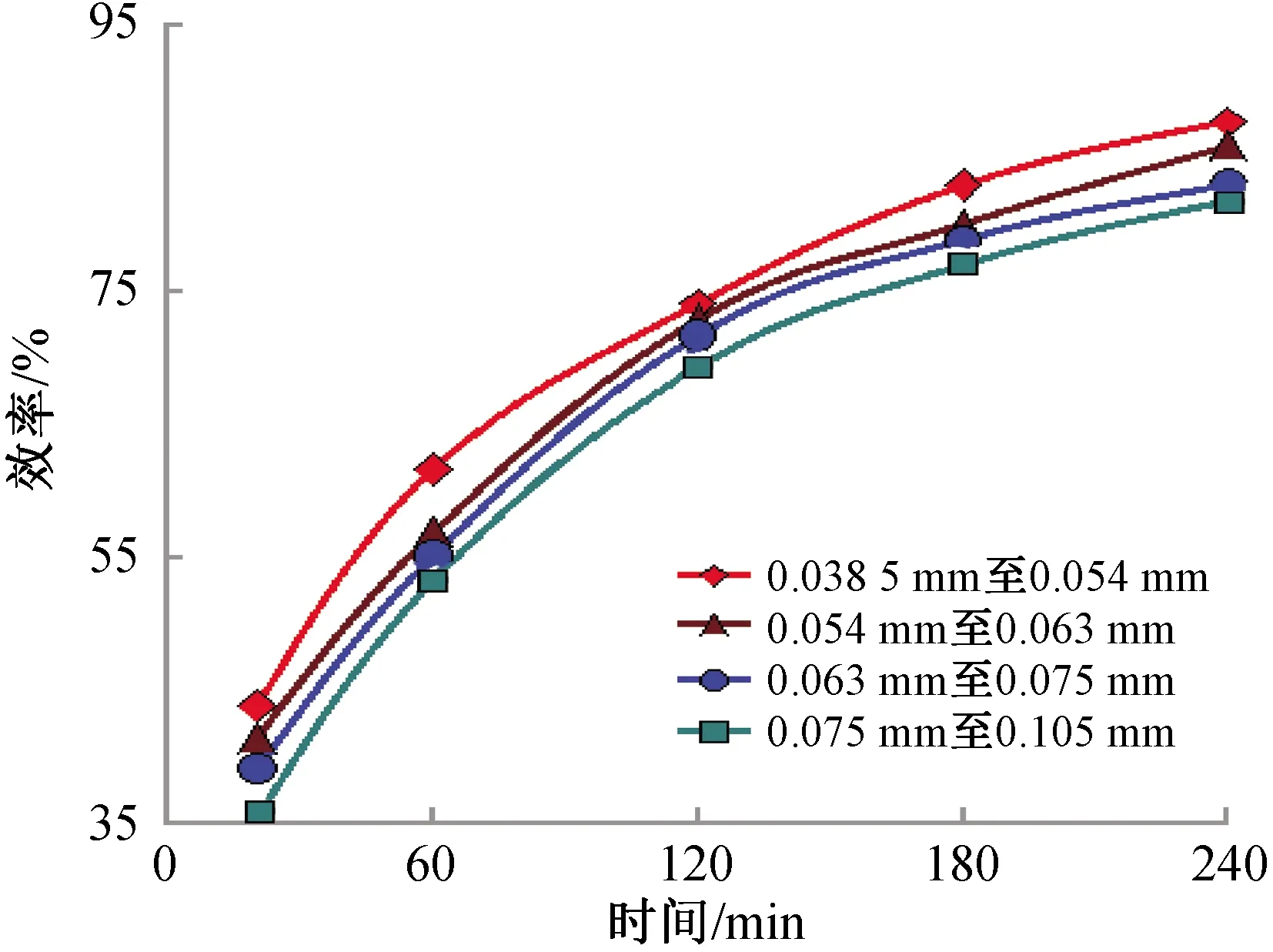
图8 反应时间与起始反应粒径对原料中金属浸出效率的影响
假设柠檬酸与钴酸锂的浸出反应为化学反应控制. 按照化学反应控制速度方程对图8中数据进行拟合,结果见图9.
由图9可得到不同起始反应粒径的综合反应速率常数K.将K与对应的起始反应粒径的倒数1/r0作图,如图10所示,综合反应速率常数与起始反应粒径的倒数1/r0呈线性关系,说明柠檬酸浸出反应为化学反应控制.

图9 不同起始反应粒径的浸出动力学曲线
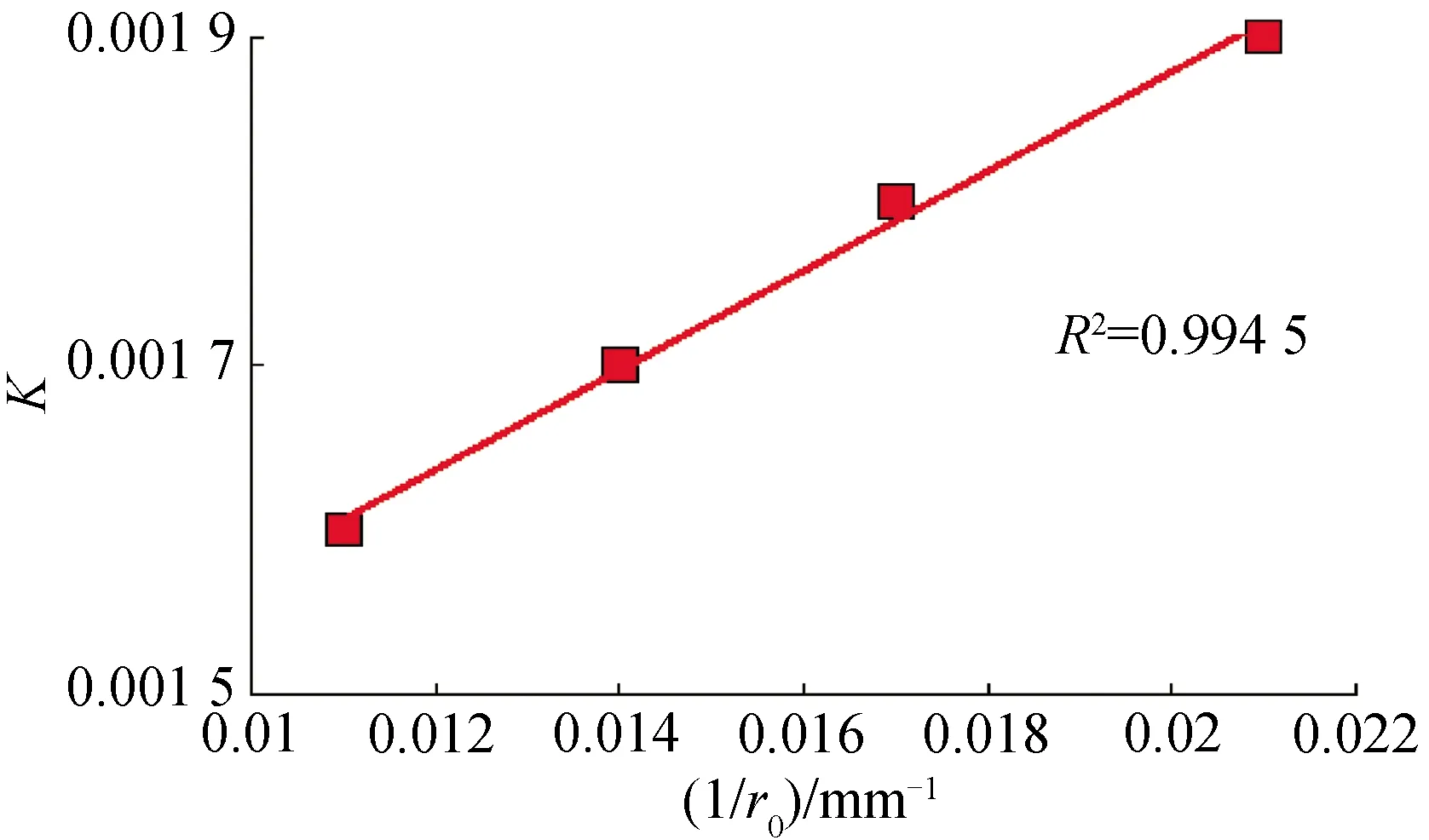
图10 1/r0与K的关系
3 结论
采用柠檬酸浸出废旧锂离子电池中的钴酸锂,物料粒度和浸出温度对钴酸锂转化率影响显著,而搅拌速度是钴酸锂转化率的次要影响因素. 减小物料粒度、适当提高浸出温度可大幅度增加钴酸锂的转化率,在反应温度90 ℃,固液比20 g/L,摩尔比1∶3.5,反应时间4 h,转速600 r/min,物料粒径0.038 5~0.054 mm条件下,金属的浸出率最大可达87.7%. 用柠檬酸浸出废旧锂离子电池中的钴酸锂,浸出动力学方程可用1-3(1-X)2/3+2(1-X)描述,反应的表观活化能为46.075 kJ/mol,并且通过起始反应粒径对浸出效率影响的验证说明浸出过程受化学反应步骤控制. 本工作通过研究柠檬酸湿法回收废旧钴酸锂材料的最佳条件实现了废料中金属离子的高效提取,但是往往材料中金属元素的多样性会造成研究湿法浸出条件的繁琐,今后对报废锂离子电池材料的再生可以从材料整体回收出发,从而节约回收成本并达到资源的高效再利用.

