16S rRNA分子生物学方法探究牛奶中的细菌菌群
在食品安全导向下,社会大众对奶制品安全的重视程度显著提高。分析牛奶出现质量问题的核心诱因,微生物污染首当其中。总的来看,牛奶中的细菌来源渠道不外乎奶牛自体患病、挤奶、加工、储存、运输等关节。但即使在规范、合规的牛奶生产程序中,发生微生物污染的可能性仍然较高。为了加强牛奶质量管控,应采取恰当的手段方法,即分子生物法,探究市面牛奶中的细菌菌群。
一、资料与方法
1.基础资料。样品采集:选择市面超市在售的4个牛奶品牌的5类牛奶,即30天常溫保质期的高温灭菌奶、2-6℃7天保质期的巴氏消毒牛奶,然后将这些牛奶样品标记为A、B、C、D、E的名称。其中,A、B、C样品属性为高温灭菌类,D、E样品则为巴氏灭菌类,且C、D为同一品牌厂家生产的常温奶及巴氏奶,各个牛奶样品的采集皆为一个批次。
试剂型号:本次研究中运用了DNA Stool试剂盒、Cycle-Pure试剂盒、Trans DH5α细胞、SYBR?FASTqPCR试剂盒。
仪器设备:在本次研究中所应用到的仪器设备有:GeneAmp PCR System光度计、Allgre X-22R离心机、PowerPac Basic电泳仪等。
2.方法。(1)提取DNA。采取Collado等方法,选择100mL的牛奶,精准提取其中7150×g的细菌DNA,在离心20min后,去除样品表层溶液,对底部沉淀物进行采集,并使用5mL的TE(1×)再次进行悬浮沉淀处理。应用DNA提取专用试剂盒,对沉淀物的DNA加以提取。提前准备50?L规模的TE(1×),将已收获的DNA提取物置入其中充分溶解。使用分光光度计对DNA浓度进行准确检测,同时选用1%浓度的琼脂糖凝胶开展电泳检测工作,提取片段DNA,最后将样品放置在-20℃恒温的冰箱内冷藏保存。
(2)对16S rRNA进行PCR扩增。承载338F-CCTACGGGAGGCAGCAG及534R-ATTACCGCGGCTGCTG对16s rRNA-v3区施以扩增,获得PremixTapVersion2.010L的PCR反应式。具体反应条件有:一是5min、95℃的预变处理;二是30s、94℃的变性处理;三是30s、5℃的退火处理;四是40min、紫外光的电泳条带观察等。然后运用纯化试剂盒对PCR产物加以纯化处理,及时测量其质量浓度,收获纯化物。
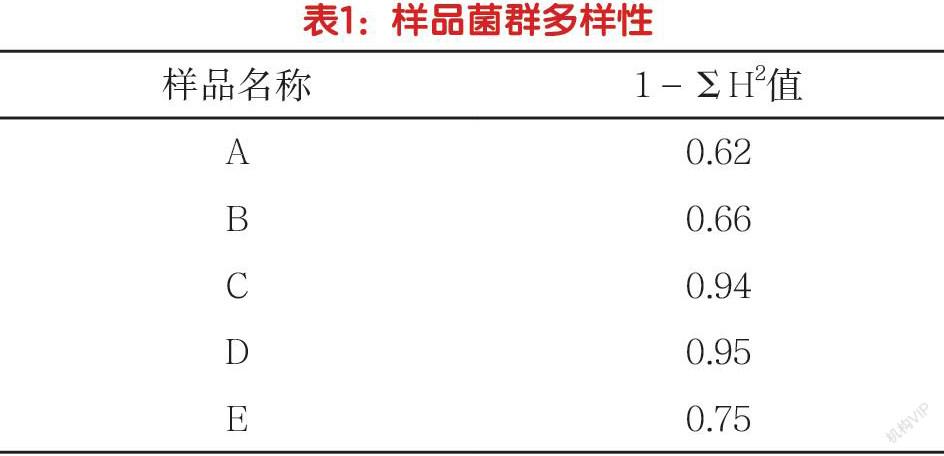
(3)分析基因序列。比对测序序列,当MAX indent超出98%后,需及时记载相对应序列的对标细菌署名及起末位点。依照一致位点,操作BioEdit软件程序,对所获得的序列进行16S rRNA-v3区的二次扩增,并引用ClustalX(1.83)比对序列。以H表示菌属序列数在全部均属总数中的百分比占比,通过1-ΣH2客观评价各个样品中的DNA多样性。
(4)PCR定量细菌总数。PCR定量曲线的获取可以质粒为凭证,需将其施以10倍梯度的标准化稀释,具体反应系为:SYBR?Green Master Mix(2×)10?L。
二、结果
1.牛奶DNA提取及PCR扩增。本次试验完成了15个样品DNA的细菌基因组提取,分析电泳结果,DNA展现出了弥散状,且不具备主带。在开展PCR扩增处理后,可收获到190bp的片段,对照后发现其并无增条带。
在保证各个品牌牛奶皆可参与克隆试验的基础上,随即抽取了5个扩增物展开T-A克隆操作。各个样品均获得了不少于1000个的克隆,并再次随即选择了100个克隆物参加测序。
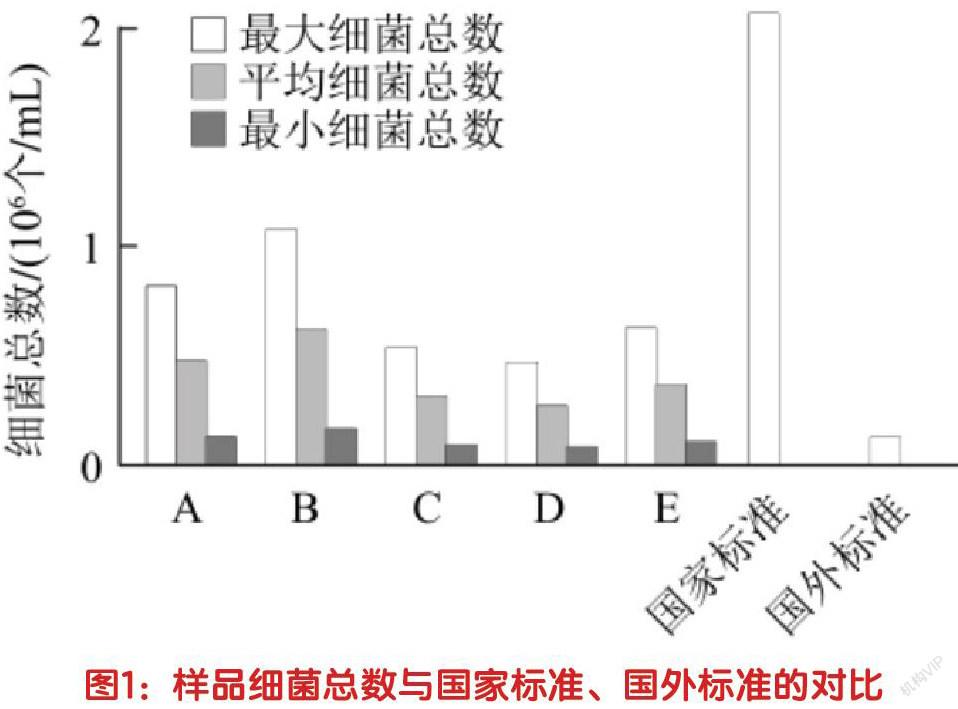
2.牛奶样品内的细菌总数。以16S rRNA现有基因数量为判断牛奶样品中细菌数的载体,分析结果为:全部样品中皆带有一定数量的基因片段。因各类细菌内均含有2-15个的16S rRNA基因拷贝数,所以本次试验围绕绝对定量信息数据展开了最大化以及最小化的二次处理,并依照国家标准对结果进行了对比,如图1所示。利用最少细菌的基因拷贝数结算其最多持有的细菌总数,发现样品中的最大细菌数仍然未超出国家标准。
3.菌种判断分析。对最终随即抽选的5个样品的克隆加以测序,得到了16S rRNA-V3区的472条序列。其中,A样品为93条序列,包括21种不同序列;B样品为92条序列,包括27种不同序列;C样品为95条序列,包括41种不同序列;D样品为96条序列,包括51种不同序列;E样品为95条序列,包括30种不同序列。
经菌属鉴定,这些基因序列中共有452条可精准定位到5个细菌纲、17个细菌属,即占比12%的芽孢杆菌纲、占比82%的β-变形菌纲、占比3%的黄杆菌纲、占比1%的放线菌纲、占比2%的γ-变形菌纲。
4.牛奶细菌的多样性。本次试验中,牛奶样品可定位到属的有A-E,分别为5、5、11、8、8个,其间差异较大。为进一步掌握样品的细菌多样性,针对其序列开展了多样性的专项分析,结果见表1所示。结果显示,C、D样品的菌群多样性明显超出了A、B样品。
三、讨论
1.16S rRNA-V3区的克隆测序判断细菌菌群。通过分子生物学的科学方法使用提取样品中的细菌DNA,并对其加以细化分析,兼顾PCR序列扩增等多元手段剖析样品的菌群多样性及细菌结构,是现阶段国内外分子试验研究中的常用模式。本次研究中,使用试剂盒提取牛奶样品的细菌DNA,并对其施以PCR序列扩增,成功收获了PCR产物。再进行T-A克隆及测序工作,得到了试验所用的5种牛奶样品的16S rRNA-V3的详细性序列信息,并对其信息数据进行了综合比较、判断。结果显示,该方法的标准操作能够提取市面牛奶的细菌DNA,且这些基因组可用于后续的下游试验。
2.牛奶细菌总数较大。本次试验表明,虽然样品牛奶内含的细菌总量均未超出国家安全标准,但比较国外105个/mL规格的细菌总量标准,样品细菌总数仍处于高水平。而这一现象的产生原因,或许可归结于我国奶源大多来自于散养户,在饲料、卫生、养殖等方面的管理不当,从而导致生奶细菌数难以控制,且长期储存待售也可致使细菌迅速滋生繁殖。对此,我国监管部门应加大对奶源中细菌总数的管理力度,提高奶制品质量。
3.各品牌牛奶的菌群结构存在明显差异。对于优势菌群来讲,本次试验中的5个样品展现出了不同占比。但针对同一属的样品细菌而言,其在同一样品内呈现出了较强的细菌序列相似性,具有较近的直接亲密关系。分析试验结果,造成牛奶样品不同菌群结构的原因为奶源差异,因奶源的不同使得其环境内现存的菌群结构不尽相同。
综上,本次研究选择了市面所售4个品牌的牛奶进行16S rRNA分子生物学方法的试验研究,结果表明样品牛奶内皆含有一定数量的细菌,虽然数量总量未超出国家标准,但仍需采取规范奶源管理、加强市场监管等措施,逐步降低牛奶内含有的细菌数,从而提高我国奶制品的质量,确保消费者购买到安全、健康的奶制品。
作者简介:李思佳(1987-),女,宁夏人,硕士研究生,助教,研究方向为生物化学与分子生物学。

