心血管植入型电子器械植入围术期非维生素K 口服抗凝药的管理现状
胡清韵综述,陈柯萍审校
心血管植入型电子器械(CIED)包括永久起搏器、埋藏式心脏复律除颤器(ICD)、心脏再同步化治疗(CRT)起搏器和除颤器等,主要用于治疗缓慢型和快速型心律失常、心力衰竭及预防心原性猝死[1]。随着人口老龄化的加剧,CIED 的需求量逐年增加。全球范围内,心脏起搏器年植入量超过100 万台,ICD 的年植入量达40 万台[2]。许多植入CIED 的患者合并有心房颤动(房颤)或其他疾病,需长期接受抗凝治疗。在植入永久起搏器、ICD及CRT的患者中,使用口服抗凝药的比例分别为14%、35%、50%,且绝大多数是因房颤抗凝[3-5]。在CIED 植入围术期,需着重关注抗凝患者的出血风险,尤其是囊袋出血风险。囊袋出血虽不致命,但会显著增加术后感染和二次手术的风险,延长住院时间,增加医疗花费[6]。目前,除血栓低危(年均血栓风险<5%)患者可考虑停药3~4 d 外,通常建议CIED 植入围术期不停用华法林,手术当天维持国际标准化比值(INR)低于治疗值上限(一般≤3,部分心脏瓣膜病患者≤3.5)[3]。
近些年,非维生素K 口服抗凝药(NOAC)的出现,给抗凝治疗提供了新的选择。与华法林相比,NOAC 具有起效快、半衰期短、相互作用少,无需常规监测等优势。2020 年欧洲心脏病学会(ESC)房颤管理指南也推荐非瓣膜性房颤患者优先考虑NOAC 抗凝[7]。随着NOAC 的地位提高,应用NOAC 的患者不断增加[8]。目前,通常推荐CIED植入围术期停用NOAC,术前24~48 h 停药,术后24~48 h 再恢复服药,且不建议进行桥接抗凝[3]。但现有研究,不足以证实围术期停药是NOAC 管理的最佳办法,关于围术期是否应停用NOAC 尚存争议。因此,本文就间断或不间断NOAC 对CIED 围术期出血及血栓风险进行综述,以期为围术期抗凝管理提供参考。
1 间断NOAC 的安全性
血栓高危患者需长期抗凝治疗,若间断服药可能增加血栓风险,而抗凝药洗脱不完全可能增加出血风险。因此,CIED 植入围术期间断NOAC 的安全性一直备受关注。ARISTOTLE、Dresden NOAC等研究显示,短期停用NOAC 对多数有创操作是安全的[9-10]。也有许多研究通过与华法林相对比,评估CIED 植入围术期间断NOAC 的安全性。较早的一项研究,基于RE-LY 研究的数据,比较口服达比加群和华法林患者在CIED 植入围术期的出血风险,结果显示,两组间的出血发生率差异无统计学意义[11]。Madan 等[12]进一步开展回顾性队列研究,发现间断NOAC 患者的囊袋出血发生率低于华法林抗凝患者,但两组间差异无统计学意义(0%vs.7%,P=0.09),且华法林组中1 例患者术后出现血性心包积液并死亡。前瞻性研究也有相似结果,在围术期停用NOAC 的情况下,囊袋出血发生率在达比加群组和华法林组间差异无统计学意义(8% vs.3%,P=0.075);但达比加群组出现了1 例短暂性脑缺血发作(TIA)[13]。除达比加群外,其他NOAC 在CIED 植入围术期的安全性也被证实。通过 对ROCKET AF、RE-LY、ENGAGE AF-TIMI 48等随机对照研究的数据进行分析,在围术期停药的情况下,与华法林相比,现有的NOAC(如利伐沙班、依度沙班等)均不增加囊袋出血风险[14-16]。部分研究具体数据见表1。
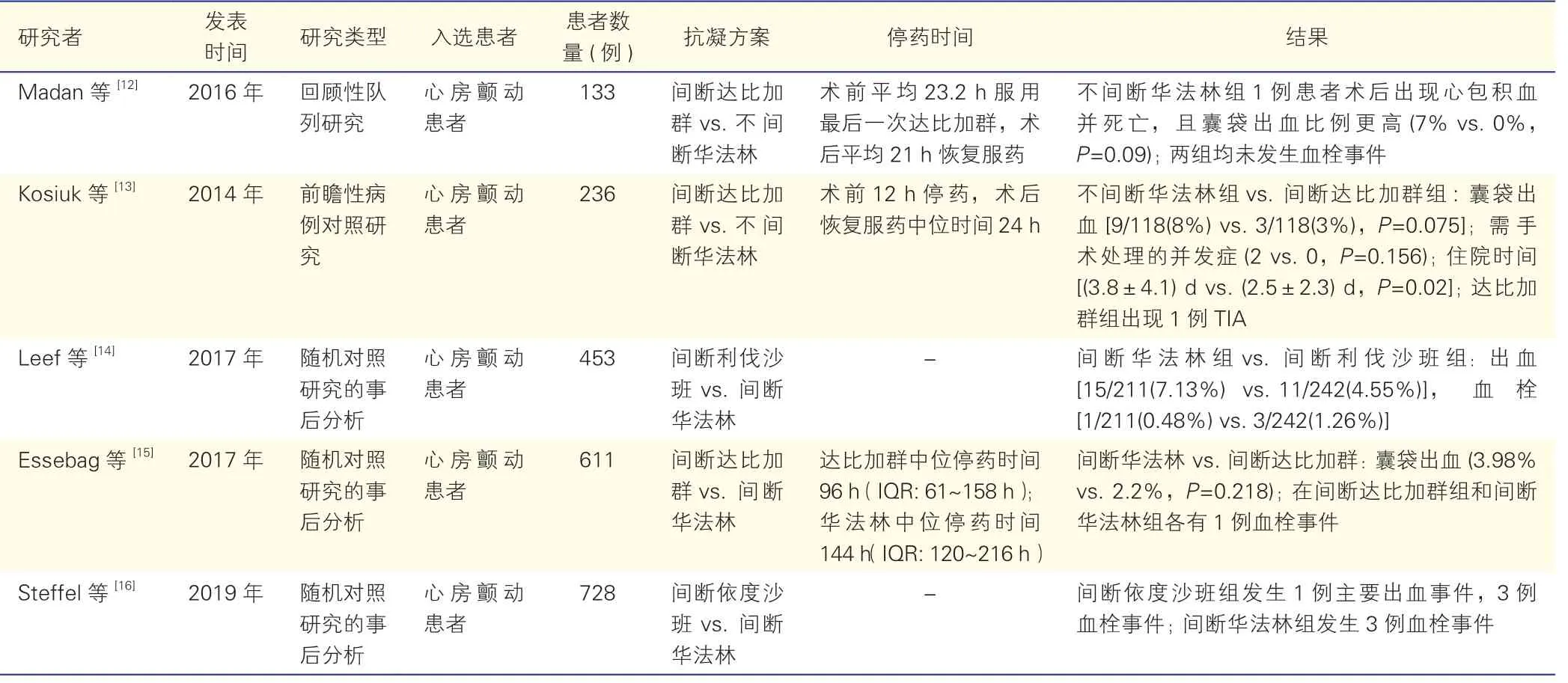
表1 间断NOAC 围术期安全性的相关研究情况
CIED 植入围术期停用NOAC 不增加出血风险,但是否增加血栓风险,是否需与其他抗凝药物桥接?目前基于华法林抗凝患者的研究显示,肝素或低分子肝素桥接治疗会显著增加围术期囊袋出血及相关并发症发生风险,且不桥接治疗不增加血栓风险[17-20]。因此,对于使用华法林抗凝的患者,不建议围术期桥接治疗。尽管在NOAC 抗凝患者中,尚缺乏桥接治疗增加出血风险的相关数据,但通常也不建议桥接治疗。
上述研究均证实了CIED 植入围术期,间断NOAC 且不桥接治疗的安全性。因此,在实际临床操作中,也更倾向于在围术期间断NOAC。然而,围术期间断抗凝策略在真实世界中的应用仍有较大差异。Canadian 研究调查了加拿大的22 家医疗中心,82%的中心所有患者均在术前停用NOAC,18%的中心对部分患者会考虑不间断NOAC,72.7%的中心常规不进行围术期桥接,多数中心(15/17)出血事件发生率在0%~5%[21]。ESS-PREDI 研究调查了欧洲CIED 植入围术期的抗凝情况:在接受NOAC 抗凝的患者中,88.7%间断NOAC,其中25.6%接受桥接治疗。NOAC 组的轻度囊袋出血发生率低于华法林组(1.4% vs.11.4%,P=0.042),但两组其他出血并发症差异无统计学意义[22]。同期的另一项研究显示,在美国植入CIED 的房颤患者,NOAC 抗凝比例为14%,围术期停药率达65%,桥接率为10%,围术期出血及血栓事件均罕见[23]。尽管CIED 植入围术期间断NOAC 的安全性,在真实世界中也得到证实。但各中心围术期停药率的差异,也反映出该领域缺乏操作规范的现状。
2 不间断NOAC 的安全性
既往研究及真实世界的数据说明了CIED 植入围术期间断NOAC 的安全性,但不间断NOAC 是否一定增加出血风险?如果围术期可不间断NOAC,将简化临床工作,便于统一管理。为解决上述问题,有研究进一步比较了不间断和间断NOAC 在CIED植入围术期的风险。
2013 年,Rowley 等[24]观察到,在25 例CIED 植入围术期不间断达比加群的患者中,未出现明显出血和血栓事件,提示不间断NOAC 可能是安全的。回顾性研究也得出相似结果,不间断与间断达比加群的出血风险差异无统计学意义(2.1% vs.0%,P=0.69)[25]。2018 年进行的单中心RCT,研究将口服NOAC(包括利伐沙班、达比加群、阿派沙班)且预计植入CIED的101 例患者随机分为间断NOAC 组和不间断NOAC组。间断组于术前24 h 停用利伐沙班或阿派沙班,依据肌酐清除率于术前24~48 h 停用达比加群;所有NOAC 均在术后24 h 内恢复服药。不间断NOAC 组出现1 例囊袋出血合并感染,间断NOAC 组未出现囊袋出血,且均未发生其他出血和血栓事件。因术前无需等待药物洗脱,一定程度上缩短了不间断NOAC 组的住院时间[26]。BRUISE CONTROL-2 研究进一步聚焦于栓塞中-高危(包括:CHA2DS2-VASc ≥2 分或预计进行复律/术中除颤阈值测试)的房颤患者。定义主要终点为发生需外科处理或停用NOAC、导致住院时间延长的主要出血事件。结果显示,间断和不间断NOAC 组的主要出血事件发生率均为2.1%,其他出血和血栓事件的发生率差异也无统计学意义[27]。综合分析BURISE CONTROL-1 和BURISE CONTROL-2 的 研究数据,在不间断NOAC 的前提下,NOAC 与华法林相比也不增加CIED 植入围术期的出血风险[28]。
真实世界的观察性研究也有类似结果。Tsai 等[29]观察了100 例围术期未停用NOAC 的患者,仅出现一例可自行吸收的囊袋血肿和一例ICD 植入术后的血性心包积液。该结果支持CIED 植入围术期不间断NOAC 是安全的。但对于植入ICD 的患者,由于脉冲发生器体积大、电极导线粗,可能导致出血风险增加,应更慎重考虑是否间断NOAC。2020 年,Crete 等[30]荟萃分析进一步证实不间断NOAC 的安全性,在不间断NOAC 和间断NOAC 组间,显著囊袋出血(1.5% vs.0.9%)、所有出血事件(5.4% vs.2.4%)、血栓事件的发生率差异均无统计学意义。部分研究具体数据见表2。
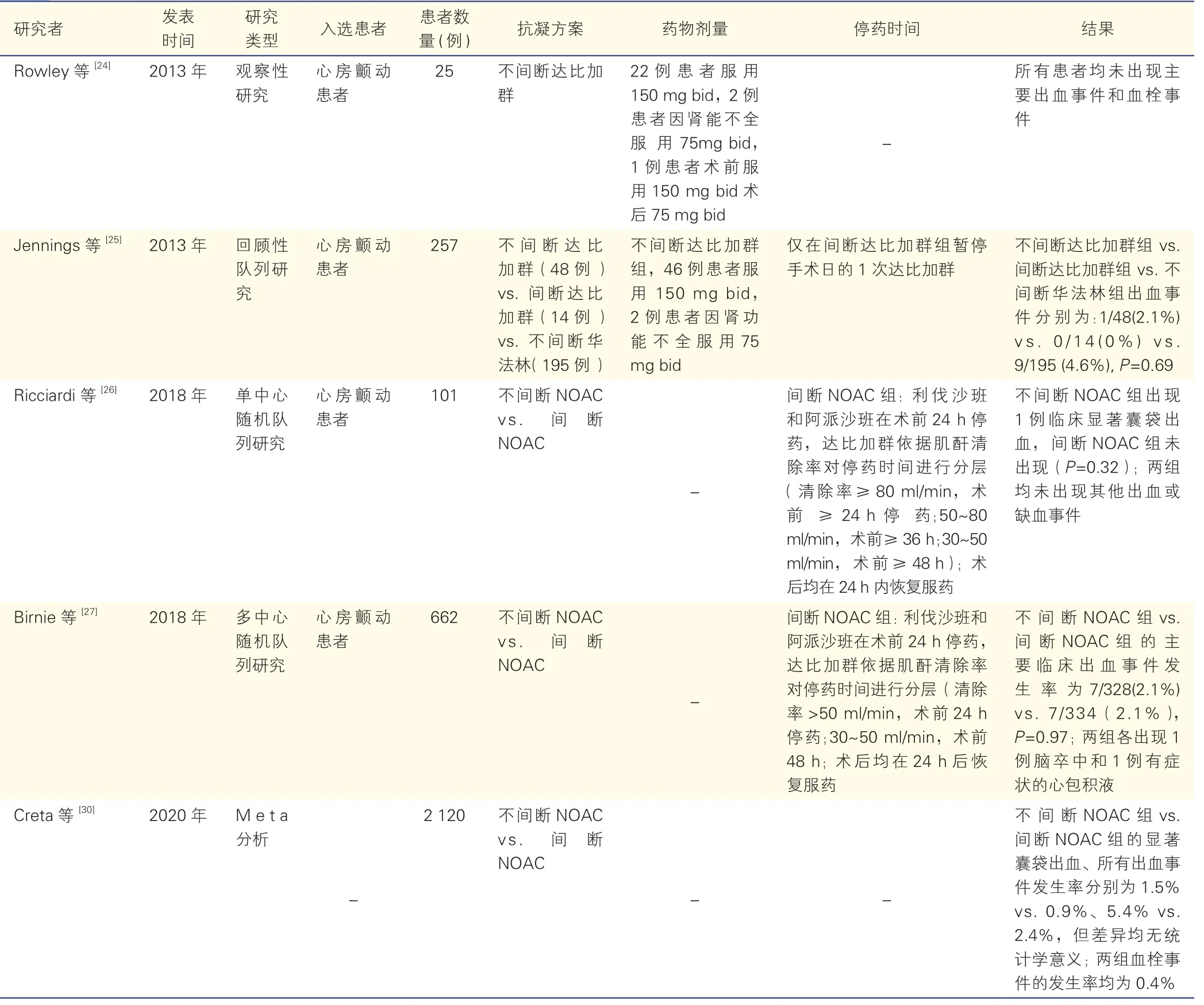
表2 不间断NOAC 的围术期安全性的相关研究
上述研究提示,CIED 围术期不间断NOAC 也是安全的,这给围术期抗凝管理提供了另一种选择。现有研究表明,不间断NOAC 不显著增加CIED 围术期出血风险,而间断NOAC 也不显著增加围术期血栓风险。基于目前的临床证据,两种抗凝选择均有其可行性和安全性,未能明确围术期的最佳处理策略。这可能是因为CIED 围术期并发症发生率低所致,需要进一步更大规模的研究以得出明确结论。
3 有待探究的问题
不同CIED 植入术式,是否会影响围术期NOAC 管理?传统起搏器往往经锁骨下静脉或腋静脉植入电极导线,在前胸部制作囊袋。而皮下ICD、无导线起搏器等,在囊袋的大小和位置、穿刺部位等方面,与传统起搏器均有不同。仅有少量回顾性研究显示,在植入皮下ICD 的患者中,不间断或桥接与间断口服抗凝药相比,会增加围术期出血风险,并延长住院时间[31-32]。但在植入无导线起搏器的患者中,是否间断抗凝似乎不影响并发症发生率,总体围术期出血和血栓风险均较低[33-34]。不同术式可能需要不同的抗凝策略,但有待进一步研究评估。
围术期出血及血栓还受其他因素影响,如患者自身出血或血栓的风险、是否合用抗血小板药物[28]等,在制定围术期NOAC 管理策略时,还应综合考虑所有影响因素。另外,现有关于CIED 植入围术期NOAC 管理的研究,多纳入的是房颤患者,对于深静脉血栓、肺栓塞等其他抗凝适应证的患者,NOAC 管理方案仍需要进一步研究。
4 结论
随着CIED 植入量增加及NOAC 在房颤抗凝等领域中地位的提高,CIED 植入围术期需进行NOAC管理的比例不断增加。现有数据,尚不能界定围术期NOAC 管理的最佳方案,真实世界中各中心的实际操作也存在差异。CIED 植入围术期间断或不间断NOAC 都存在其合理性,有待未来大规模随机对照研究进一步比较。除了是否间断NOAC外,特殊术式、抗凝指征、患者自身风险分层、合并用药或非药物干预对NOAC 管理的影响,同样值得研究者及临床医生关注。
利益冲突:所有作者均声明不存在利益冲突

