USP7调节EGR1的表达对喉癌细胞生物学行为的影响
李娇,刘海
(1.遂宁市中心医院 耳鼻咽喉头颈外科,四川 遂宁 629000; 2.川北医学院附属医院 耳鼻咽喉头颈外科,四川 南充 637000)
头颈部肿瘤是世界上发病率排名第五的高发肿瘤,且发病率在逐年增加[1],而喉癌是耳鼻咽喉头颈外科最常见的一种恶性肿瘤,占头颈部肿瘤的20%[2],病理类型以鳞状细胞癌最为多见,少部分为腺癌,其发生率男性高于女性,但每年女性患者的比例在逐年上升,在我国以东北地区发病率最高,目前认为吸烟和饮酒对喉癌的发生均有乘积效应,石棉、多环芳烃、纺织粉尘、胃食管反流病[3]以及病毒感染等都是喉癌发生的风险因素[4]。
鉴定喉癌发生过程中涉及的机制不仅可以为喉癌的治疗寻找新的靶标,也可以为诊断和预后提供参考证据。转录因子是在转录调节中起作用的细胞蛋白,都是通过顺式作用元件发挥其抑制或诱导基因表达的功能,主要根据它们与靶启动子序列的相互作用模式分类,早期生长反应基因1(early growth response,EGR1)EGR1是转录调节因子的一种,其能在有丝分裂原刺激后在细胞中表现出Fos样诱导动力学,与正常细胞相比,在肿瘤细胞中EGR1表达量很低甚至不表达[5]。前期实验已证明泛素特异性蛋白酶7(ubiquitin specific protease 7,USP7)在喉癌中的表达及临床意义以及脂质体转染siRNA敲低USP7后对喉癌细胞的增殖、迁移和凋亡的影响[6]。并将敲低USP7后的喉癌细胞通过转录组测序技术筛选出差异性表达基因[7],但是目前在喉癌中尚未见USP7和EGR1相关性的报道,本实验拟检测经转录组测序筛选后的与喉癌增殖、迁移相关基因EGR1的表达并进一步探讨在喉癌细胞中USP7与EGR1之间的关系,以寻找在喉癌中存在的可能的分子治疗靶标。
1 材料与方法
1.1 细胞株与主要试剂
HEp-2细胞购自Boster生物工程有限公司,DMEM培养基,胎牛血清,青霉素-链霉素双抗,胰酶均购自美国HyClone公司,病毒载体USP7 siRNA片段,病毒载体Negative siRNA片段购自上海吉玛生物制药有限公司,兔抗人USP7多克隆抗体,山羊抗兔IgG二抗购自美国Proteintech Group公司,兔抗人EGR1多克隆抗体购自美国CST公司,USP7上下游引物,EGR1上下游引物均购自生工生物工程(上海)股份有限公司,逆转录试剂盒购自赛默飞世尔科技(中国)有限公司,Trizol试剂购自上海联迈生物工程有限公司,CCK8试剂盒,ECL化学发光超敏试剂盒,RIPA裂解液均购自中国碧云天生物技术公司,Transwell小室购自美国Millipore生物科技有限公司,结晶紫购自北京索莱宝科技有限公司。
1.2 仪器
SDS-PAGE电泳仪,转膜仪,成像仪,酶标仪均购自美国BIO-RAD公司,PCR仪购自瑞士Roche Diagnostics公司,倒置荧光显微镜购自德国Leica公司,-80℃冰箱购自美国Thermo公司。
1.3 细胞培养及转染
HEp-2细胞用含10%胎牛血清,1%青霉素-链霉素双抗的DMEM培养基于37℃、5% CO2的孵箱中进行培养,收集成对数生长期细胞以2 105/孔细胞接种于6孔板中,继续培养24 h,当细胞融合度约20%~30%时,加入siRNA-USP7慢病毒、阴性对照病毒、空白组不加任何东西,继续培养8 h后更换培养基。72 h后观察荧光表达量,转染率大于90%,继续培养,根据后续实验要求提取RNA及蛋白质。
1.4 Western blot检测USP7及EGR1蛋白的表达
RIPA细胞裂解液裂解已转染的HEp-2细胞,提取总蛋白,并用BSA检测总蛋白浓度,取100 μg蛋白进行变性,10%分离胶进行SDS-PAGE电泳,将目标蛋白转移至PVDF膜上。用TBST液洗膜5 min,5%脱脂奶粉封闭1 h,加入USP7及EGR1抗体(1∶1 500),4℃摇床孵育过夜,TBST洗膜5次,每次10 min,加入山羊抗兔IgG二抗,室温摇床上孵育1 h,TBST洗膜5次,每次10 min。显影曝光,用Image-Lab图像分析系统对蛋白条带灰度值进行分析。
1.5 Q-PCR检测USP7及EGR1mRNA的表达
Trizol试剂裂解已转染的HEp-2细胞,提取总RNA,用琼脂糖凝胶电泳实验检测RNA质量,用逆转录试剂盒将RNA逆转录成cDNA,根据PCR反应体系进行配制预混液,LightCyclerPCR仪上设置PCR反应条件:预变性,变性,退火,延伸,熔解,降温,分析Real Time PCR的扩增曲线和溶解曲线,采用2-ΔΔCT法进行相对定量分析,观察USP7、EGR1的表达情况。
1.6 CCK8实验检测细胞增殖
设置实验组(USP7阻低组)、阴性对照组、空白组,96孔板中进行细胞培养及转染,每组设置5个复孔。分别于转染后24、48、72 h每孔加入CCK8试剂10 μL,避免产生气泡,然后将细胞放入CO2培养箱孵育1.5 h,酶标仪检测450 nm波长的吸光度值,分析细胞增殖情况。
1.7 Transwell实验检测细胞迁移
将转染后的HEp-2细胞饥饿12~24 h,Transwell小室放入24孔板中,将转染后的HEp-2细胞以每孔50 104个接种到小室,下室加入600 μL完全培养基,继续培养24 h,用PBS洗2次,甲醛固定30 min,再用PBS洗2次,甲醇透明20 min,PBS洗2次0.1%结晶紫染色15 min,棉签轻轻搽去上层未迁移细胞,显微镜下观察计数小室下层细胞。
1.8 统计学分析
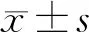
2 结果
2.1 细胞转染结果
细胞转染72 h后,荧光倒置显微镜下观察同一视野下白光和荧光细胞数目,实验组、阴性对照组转染率均达到90%以上,USP7敲低建模成功后才可进行下一步实验,见图1。

图1 同一视野下USP7实验组、阴性对照组细胞的转染率 (荧光 ×200) A:普通光学显微镜; B:荧光显微镜下实验组细胞; C:荧光显微镜下阴性对照组细胞
2.2 Western blot结果
采用Image J软件测量灰度值进行相对定量分析,USP7和EGR1蛋白的相对表达量见图2、3。SiRNA-USP7慢病毒在喉癌HEp-2细胞中成功敲低USP7的表达后验证到EGR1表达上升。
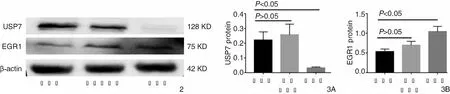
图2 Western blot检测USP7、EGE1蛋白表达 图3 USP7、EGE1蛋白表达水平柱状图 3A:各组中USP7蛋白相对表达量; 3B:各组中EGR1蛋白相对表达量
2.3 总RNA质量检测
总RNA提取后,琼脂糖凝胶电泳结果如图4所示,空白组、阴性对照组及实验组28 s、18 s、5 s RNA 3条带集中,无拖尾现象等,表示总RNA提取的质量合格,可以进入下一步的实验。

图4 总RNA琼脂糖凝胶电泳结果
2.4 RT-PCR结果
慢病毒转染后,提取实验组、阴性对照组、空白组细胞的RNA,通过RT-PCR检测USP7、EGR1mRNA的表达水平,各组细胞USP7、EGR1 mRNA的PCR扩增及相对表达量见图5、6。采用2-ΔΔCT法对各组进行相对定量分析,结果显示在敲低USP7表达后的细胞中检测到EGR1表达量较空白组及阴性对照组均升高。
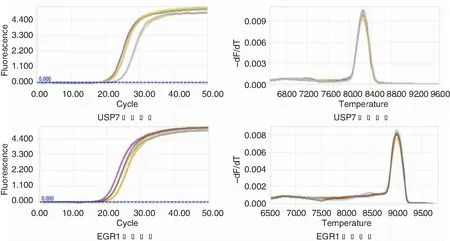
图5 USP7与EGR1的扩增曲线和溶解曲线
2.5 CCK8实验检测USP7敲低后喉癌细胞增殖能力
转染后24、48、72 h后各组喉癌细胞增殖情况见图7,阴性对照组和空白组在24、48、72 h差异均无统计学意义(P>0.05),实验组和空白组在24、48、72 h差异均具有统计学意义(P<0.05)。
2.6 Transwell实验检测敲低USP7后喉癌细胞迁移能力
HEp-2细胞穿过Transwell小室膜的细胞见图8、9,先于10倍镜下观察视野中细胞数量,20倍镜下随机选取5个视野计算平均值即为迁移细胞个数,数据显示空白组、阴性对照组、实验组细胞数分别为142±2.82、124.6±8.96、32.4±9.70。阴性对照组和空白组之间差异无统计学意义(P>0.05),实验组和空白组间差异具有统计学意义(P<0.05)。
图6 USP7及EGR1 mRNA表达水平 6A:为各组中USP7 mRNA相对表达量; 6B:为各组中EGR1mRNA相对表达量
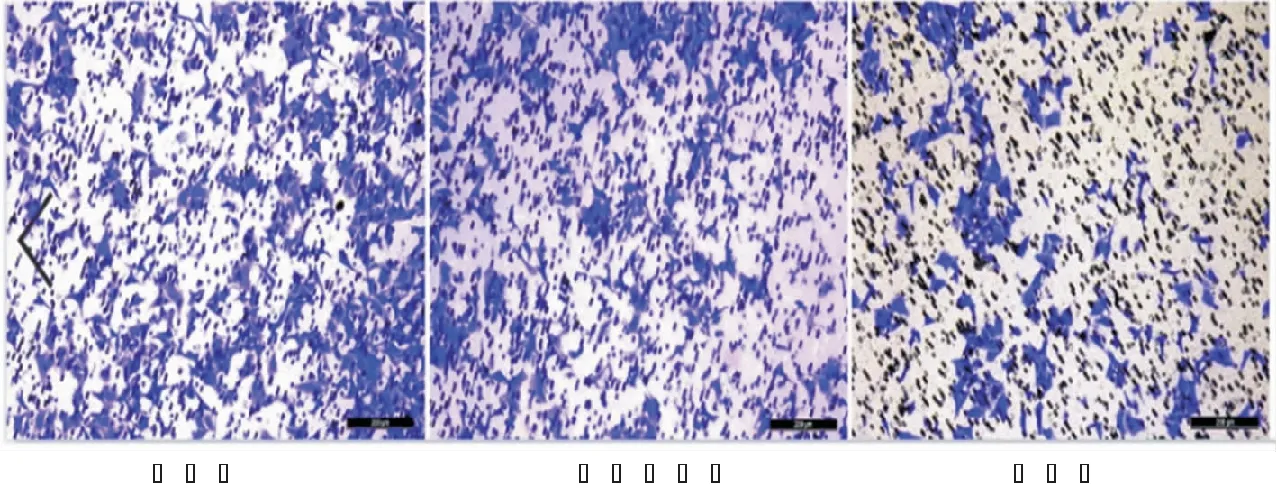
图8 Transwell检测喉癌细胞的迁移能力 (结晶紫 ×200)
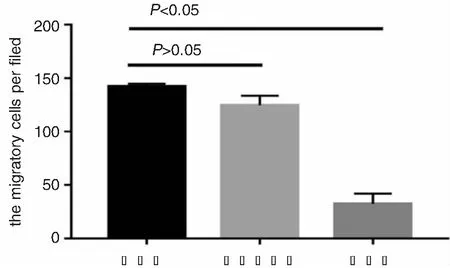
图9 喉癌细胞的迁移能力柱状图
3 讨论
目前喉癌的诊断方式有电子纤维喉镜检查、颈部CT扫描以及金标准组织病理检查共同诊断。治疗目标是治疗癌症、保留喉功能、最大限度的提高患者生活质量[8]。但约60%确诊喉癌时已是Ⅲ期或Ⅳ期[4]。此时癌细胞已发生深部侵袭、远处转移或淋巴结转移,目前治疗方案有喉切除,单纯同步放化疗,全喉切除+颈淋巴结清扫+放化疗,TPF诱导化疗+同步放疗联合,靶向治疗+同步放化疗联合,微波热疗+放疗,基因治疗等治疗手段[9],但总体疗效仍较差,其5年生存率约为60.7%[8],患者生存质量差,对患者的生理、心理以及经济等方面[10]均造成很大影响。由于喉部在发声、吞咽功能以及生活质量方面有重要作用,因此对喉癌的研究具有重要的社会意义[8]。
随着分子生物学的逐渐成熟,越来越多的研究证实肿瘤的发生发展与许多基因表达异常相关,认为肿瘤细胞生长的调节取决于许多基因家族,如原癌基因、抑癌基因、细胞生长因子、生长因子受体以及立即早期转录因子。USP7是去泛素化蛋白酶家族一员,已在前期研究中被证明在喉癌的进展中作为癌基因发挥作用。EGR1是转录调节因子的一种,其结构域由3个锌指结构Cys2His2,经最简单的ββα折叠后形成,其能在有丝分裂原刺激后在成纤维母细胞、上皮样细胞和淋巴细胞中表现出Fos样诱导动力学,其细胞遗传学位置位于5q31.2,与正常细胞相比,在肿瘤细胞中EGR1表达量很低甚至不表达,已有研究证明外源性EGR1在人各种肿瘤细胞中的表达显著降低了肿瘤细胞的生长致癌性,相反,反义RNA抑制内源性EGR1表达,促进细胞生长和转化。EGR1基因产物直接调控转化生长因子β-1(TGFβ-1)基因的表达,并在细胞模型中发现EGR1通过诱导TGFβ-1抑制人类肿瘤生长[8]。大量研究已证明EGR1属于立即早期基因(IEG)家族编码转录因子,在目前已报道的研究中既可作为肿瘤抑制因子也可作为致癌因子,但其在喉肿瘤的表达尚未见报道[11]。
EGR1是一种多功能转录因子,可以作为一种肿瘤抑制基因,直接调节p53/TP53,PTEN和TGF-β1表达。在体内和体外模型中,细胞内Ca2+增加是导致细胞凋亡的核心过程。p53对细胞内Ca2+的升高具有诱导作用,研究发现EGR1通过直接结合并转录激活下游标靶基因p53启动子,诱导p53表达增加从而导致细胞凋亡[12]。并且,在动物模型的研究中发现原代小鼠胚胎成纤维细胞中EGR1经电离辐射后p53水平增高导致细胞凋亡增加,EGR1促凋亡的功能主要体现在EGR1靶基因RB1与MDM2(鼠双微体蛋白2)结合以防止MDM2介导的p53降解[13]。同时亦有研究者通过对肝细胞癌基因芯片数据分析得出EGR1在肝癌细胞中表达下调,与其预后相关[14]。TGF-β是一种能在多种细胞类型中控制细胞增殖、分化以及其他功能的肽类,TGF-β的活化可导致细胞凋亡,而信号失调则能增加肿瘤细胞转移机率。TGF-β1通常对上皮来源的细胞有抑制作用,但对某些间叶细胞则有刺激或促进作用。反过来,TGF-β1的表达受到几种富含GC的元件的调节,这表明EGR1可能通过刺激TGF-β1的分泌发挥抑制生长作用,其反过来充当自分泌或旁分泌剂以抑制增殖。已有研究表明外源性EGR1的表达显著降低了人纤维肉瘤HT-1080细胞的生长和致瘤性,HT-1080细胞稳定表达EGR-1导致TGF-β1分泌增加并且表现出与EGR1表达量成比例的生长抑制。相反地通过在HT-1080细胞中增加抗TGF-β1抗体能完全逆转稳定表达的EGR1对细胞的生长抑制作用,这些结果表明EGR-1是控制生长调节分子TGF-β1的表达的一种潜在调节机制[8]。EGR1在食管癌中的高表达则可能对于维持染色质稳定、抑制细胞增殖、促进细胞分化和凋亡有重要作用,并且能通过激活细胞周期蛋白D1促进细胞从G0/G1期进入G2/M期,进而调节细胞生长分化达到抑制食管癌进展的作用[15]。EGR1能促进骨髓细胞系分化,EGR1缺失与急性髓系白血病相关[16]。
差异性显示是一种筛选差异性表达的新型肿瘤抑制基因的方法,主要用于筛选在正常细胞中表达而在肿瘤细胞中减少或丢失的基因。Sager等[17]提出将癌症相关基因细分为突变或缺失的基因(I类)和调节中改变的基因(II类),从癌症治疗角度看,I类和II类之间的区别有重大意义,纠正I类基因突变或丢失的治疗方法是基因置换或填补基因缺陷的方法,即从基因治疗方面入手将新的遗传物质重新载入细胞内,从而达到治疗肿瘤的目的。相反,II类基因的治疗方法是再表达,如可以通过合适的代谢物或逆转异常调节的药物进行治疗,而不必替换间接参与的突变基因。Huang等[18]在对乳腺癌的研究中提出EGR1具有肿瘤抑制特性,属于II类肿瘤抑制基因的类型。并且发现与正常乳腺细胞相比,乳腺癌细胞中EGR1表达下降或不表达,并且表达的EGR1能降低癌细胞的转移和转化能力,通过外源性药物处理后使小鼠乳腺肿瘤中的低表达的EGR1水平上升,从而得出结论EGR1表达丧失可能使肿瘤生长的失调并且EGR1充当肿瘤抑制基因。有学者[19]在对胶质母细胞瘤细胞系的研究中发现EGR1基础表达几乎不可检测,其主要是通过ARF-MDM2-p53途径发挥抑制作用,EGR1蛋白作为p53或TGF-β受体,特异性地结合人TGF-β1启动子的GCE位点,EGR1的再表达促进TGF-β1表达增加和分泌,并且证明在U251细胞系中EGR1表达致细胞生长速率下降,是胶质瘤进展期间被抑制的目标[20]。Kim等[21]发现在鼻咽癌组织与正常鼻咽组织相比EGR1表达是下降的,并且揭示了EGR1在鼻咽癌PFS(无进展生存期)和OS(总生存期)中的阳性诊断意义。电离辐射暴露与某些编码转录因子的早期立即基因的激活有关,如JUN、FOS和早期生长反应家族基因。另有学者[22]发现EGR1是在辐射诱导传导信号的关键基因,其包含有辐射诱导的DNA序列,介导的响应电离辐射的靶基因均为凋亡基因的效应器如:TNF-α、p53、Rb和Bax,从而通过消除诱导的辐射抗性而导致肿瘤细胞生长停滞或凋亡。该研究发现EGR1敲低抑制了辐射诱导的细胞凋亡,得出在喉癌患者中EGR1可能与经放化疗诱导细胞凋亡后喉功能保存呈正相关,因此,表明EGR1可作为喉咽部肿瘤接受放、化疗治疗敏感性的有效生物学指标[23]。本实验经RT-PCR和Western方法从基因和蛋白水平检测出在阻低USP7后的喉癌细胞中EGR1表达上升,因此我们推测EGR1在喉癌的发生发展过程中发挥抑癌因子作用。
综上所述,本实验发现,经慢病毒USP7敲低后喉癌细胞的增殖和迁移能力较空白组喉癌细胞增殖和迁移能力明显下降,同时敲低后细胞组中EGRI表达较空白组基因及蛋白量表达上升,因此,我们推测EGR1可能作为肿瘤抑制基因在喉癌细胞增殖及迁移方面发挥作用,因此在未来喉癌的治疗中可以从基因治疗方面进一步研究设计提高EGR1的表达,为喉癌的治疗及改善喉癌预后等方面提供实验依据。

