采用熔解曲线法进行RHD c.1227G>A基因检测研究
马 玲,刘太香,薛 敏
江苏省血液中心输血研究室,江苏 南京 210042
Rh 血型系统因其复杂多态性及临床重要性而备受关注,其中RhD抗原免疫原性最强,相应的抗D是导致胎儿新生儿严重溶血的最主要抗体,因而RhD 阴性孕妇妊娠及血液安全管理需格外重视[1]。RhD 抗原存在诸多的变异型,根据红细胞膜上D 抗原表达的数目和性质,大致可分为弱D、部分D以及东亚人群常见的Del型等。各种RhD变异型基因背景机制不一,免疫原性也不相同,尤其是Del表型的检测及个体RhD 抗原免疫应答情况值得重视。Del表型最初由Okubo等[2]报道,其D抗原表达非常弱,每个红细胞膜上D抗原拷贝数低于200个[3],常规血清学检测不出,需要通过吸收放散技术才能检测到。有调查发现东亚人群中初筛为RhD 阴性者中17%~30%为Del 型,其中约98%的分子遗传背景为RHD 基 因exon 9 c.1227G>A 同义突变(RHD*01EL.01)[4],因此该型又被称为亚洲型DEL 血型(Asia type DEL 血型)。有研究报道在亚洲型DEL孕妇中,均未发现抗D抗体产生,因此提议,Del型孕妇可以免去孕期频繁的抗体筛查和抗D免疫球蛋白注射[5-6],这一理论如果获得推广应用无疑有良好的社会效益。因而,研究第一步,建立RHD c.1227G>A基因位点高效、便捷的检测方法十分必要。
常规Del表型的血清学检测是通过吸收放散的方法,该操作步骤较繁琐,对检测人员的手法和经验有一定要求,易导致差错。随着DEL型分子机制的阐明,血型基因检测方法的发展为DEL型鉴定提供了新的技术手段。本研究旨在建立用于检测RHD c.1227G>A 基因分型的熔解曲线分析法,该方法基于单核苷酸熔解温度差异而形成不同形态熔解曲线,具有较高的敏感性,可以检测出单个碱基的差异,同时避免了常规PCR方法后续上样、电泳、成像等操作,缩短了检测时间,且减少了PCR 产物交叉污染的可能性,现报道如下。
1 材料和方法
1.1 材料
1.1.1 样本来源
2018 年10 月—2020 年1 月于本中心进行产前检查的孕妇87例,年龄21~41 岁,中位年龄29 岁;RhD 初筛试验结果均为阴性,采外周静脉EDTA 抗凝血约3 mL;经本人知情同意,且研究经本中心伦理委员会批准。
1.1.2 主要试剂和仪器
IgG/IgM 型抗D 试剂(Sanquin 公司,荷兰);IgG型抗D 试剂(上海血液生物医药有限责任公司);基因组DNA 提取试剂盒(北京原平皓生物公司);2×Taq PCR Mix(南京博尔迪生物科技有限公司);SYBR Green Master(Roche,瑞士);人类红细胞RhD基因分型试剂盒(PCR⁃SSP)(天津秀鹏生物技术);Labofuge 400R 低温高速离心机(Heraeus 公司 德国);ND⁃100⁃Spectrophotometer DNA 定量分析仪(NanoDrop 公司 美国);Alphalmager HP 凝胶成像系统、ABI 7300扩增仪(Applied Biosystem公司,美国)。
1.2 方法
1.2.1 血清学试验
采用间接抗人球试验的方法,使用3~4 种不同克隆的IgG 或IgM/IgG 型抗D 试剂进行RhD 阴性确认。对于结果为阴性的样本进行吸收放散试验,检测是否为Del 型。具体操作步骤参考文献方法[7]并略为修改,吸收用试剂为IgG/IgM型抗D与IgG型抗D试剂混合使用,吸收时间为1 h。
1.2.2 引物设计
查找GenBank数据库中RHD基因序列(序列号为NG007494),针对1227A特异性位点,应用Primer 5 引物设计软件进行扩增引物设计。经过预实验,优化后的引物序列参见表1。另采用引物β⁃actin作为内参序列[8]。
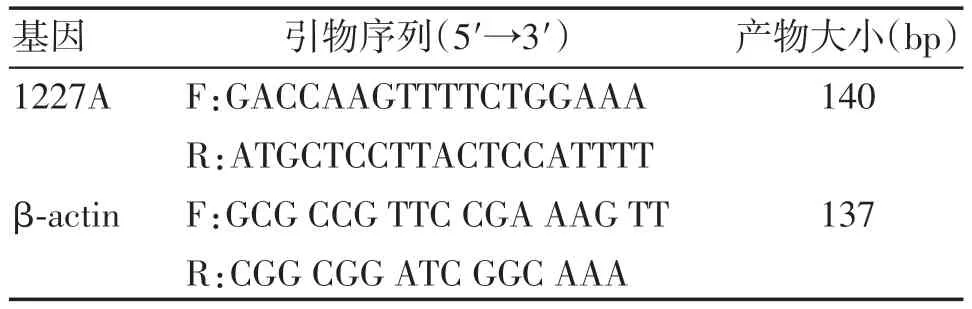
表1 荧光定量PCR所用引物
1.2.3 基因组DNA提取
离心吸取孕妇白膜层细胞,按照DNA提取试剂盒操作要求提取基因组DNA,采用ND⁃100⁃Spectro⁃photometer DNA 定量分析仪测定DNA 含量与纯度,样品-20 ℃保存待用。
1.2.4 熔解曲线分析
采用荧光定量PCR 分别扩增RHD exon 9 c.1227G>A 及β⁃actin(作为内参)。PCR 总体积为20 μL,引物浓度为300 nmol/L,调整DNA 模板含量约为50 ng(可以低至至少1 ng),2×SYBR Green mix 10 μL。PCR 条件为:50 ℃温育2 min,95 ℃预变性10 min,之后95 ℃变性15 s,60 ℃退火延伸1 min共40 个循环。所有反应均设3 个复孔,并以水为模板设空白对照。PCR 反应结束后,使用仪器默认的熔解曲线分析程序(95 ℃15 s,60 ℃1 min,95 ℃15 s,60 ℃15 s)进行分析,期间连续监测荧光信号,根据熔解温度(melting temperature,Tm)值的差异进行基因分型。
1.2.5 对比研究
采用商品化RHD 阴性鉴定基因检测试剂盒(PCR⁃SSP 法)对上述标本进行同步检测,严格按说明书操作。PCR 反应条件为:96 ℃2 min,随后96 ℃20 s,68 ℃60 s,5 个循环;96 ℃20 s,65 ℃50 s,72 ℃45 s,10 个循环;96 ℃20 s,62 ℃50 s,72 ℃45 s,15 个循环;72 ℃5 min,最后4 ℃保存。PCR扩增产物在2%琼脂糖凝胶中电泳(100 V,30 min),用凝胶成像系统分析结果。
1.2.6 RHD基因测序
参考文献方法[9],对RHD 外显子9 进行测序分析,PCR 总体积为20 μL,引物浓度为200 nmol/L,PCR 条件为:95 ℃,5 min;95 ℃30 s,61 ℃30 s,72 ℃1 min,35个循环;72 ℃10 min,4 ℃保存。PCR产物经纯化后直接进行测序分析,测序引物同扩增引物。使用Sequencing Analysis 6 和SeqScape v3.0软件进行测序图谱分析和序列比对。
1.3 统计学方法
采用SPSS 19.0软件进行数据分析,计数资料采用例数和构成比进行统计描述,并通过配对χ2检验比较熔解曲线法与PCR⁃SSP 法结果的差异;采用灵敏度、特异度、阳性预测值、阴性预测值、符合率和约登指数等指标对熔解曲线法进行评判。P<0.05为差异有统计学意义。
2 结果
2.1 血清学结果
87例标本中,RhD确认试验结果阳性者6例;对其余81例标本进行RhD吸收放散试验,结果为阳性者共15例。
2.2 熔解曲线分析
对全部87例样本分别进行RHD exon 9 c.1227G>A 及β⁃actin 荧光定量PCR 扩增,并对扩增产物进行熔解曲线分析。前者的Tm 值约为73 ℃,后者约为88 ℃,扩增阳性者分别在相应位置处出现单一峰型。在空白对照结果为阴性的前提下,两种熔解峰均出现时,判定为RHD exon 9 c.1227G>A 阳性;只有β⁃actin峰时,判定为RHD exon 9 c.1227G>A阴性;无β⁃actin 峰时,判为试验无效(图1)。共计16例样本检测出含有RHD c.1227G>A(占比18.4%)。
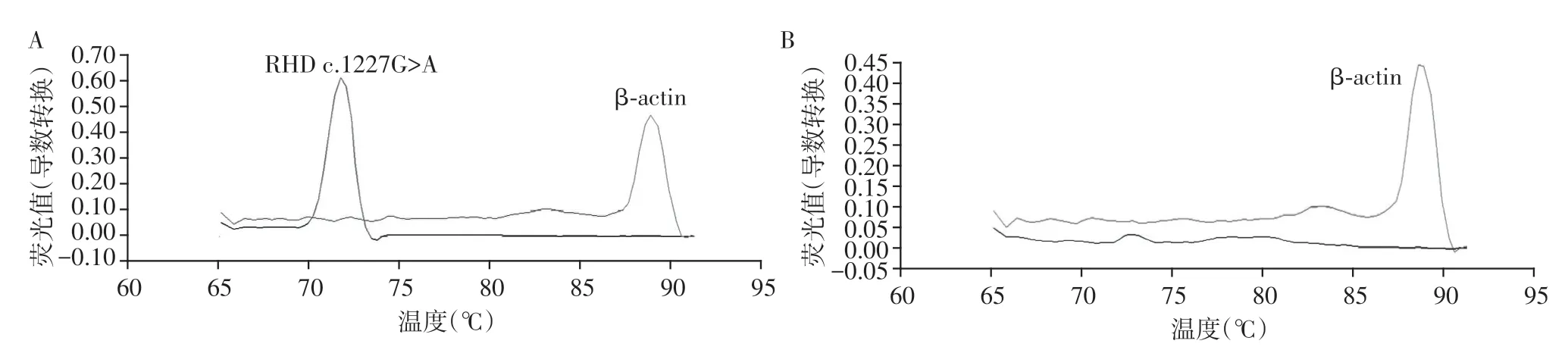
图1 RHD c.1227G>A 及β⁃actin基因扩增的熔解曲线
2.3 熔解曲线法与PCR⁃SSP方法比较
87例样本同步采用商品化RHD 阴性鉴定基因检测试剂盒(PCR⁃SSP 法)进行检测,将熔解曲线法结果与之比较,结果一致,相同的16例样本均含有RHD c.1227G>A(χ2=0.038,P=0.845)。
2.4 测序结果
对1例吸收放散试验结果为阴性,基因检测结果为阳性的样本进行RHD外显子9测序分析,证实含有c.1227G>A(图2)。
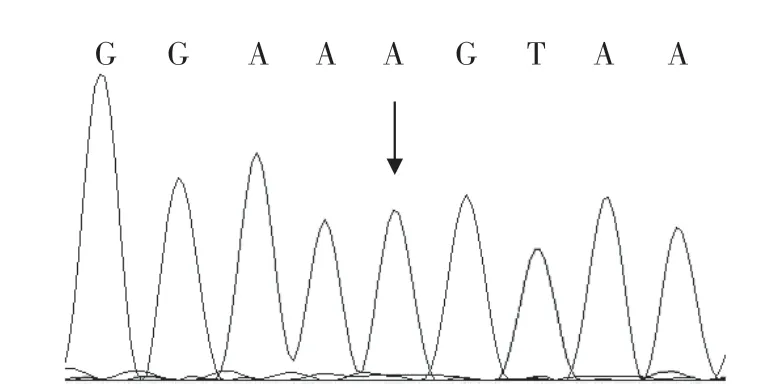
图2 某样本RHD exon 9测序结果
2.5 方法学评价
统计结果显示,采用熔解曲线分析法检测RHD c.1227G>A 位点的灵敏度为100%,特异度为100%,阳性预测值为100%,阴性预测值为100%,约登指数为1.0,总符合率达100%。
3 讨论
亚洲型DEL 血型的分子遗传背景为RHD 基因exon 9 存在c.1227G>A 同义突变,由于1 227 位为exon 9 3′端最后1位碱基,该突变虽未导致氨基酸的变化,但可能影响mRNA 的正常拼接或拼接效率,导致RHD基因表达水平降低,这也一定程度上解释了为何Del 表型RhD 抗原表位没有变化,但抗原数量却明显减少[10]。用于Del血型检测的吸收放散试验并未常规用于临床检测,因此Del 表型个体一直被当成RhD 阴性对待。Del 表型个体,尤其是亚洲型DEL 的检测及个体RhD 抗原免疫应答情况值得研究;故本研究旨在建立高效、便捷的RHD c.1227G>A等位基因检测方法。
本研究首先对于RhD 抗原确认结果为阴性的样本进行吸收放散试验,该操作步骤较为繁琐,对检测人员的手法和经验有一定要求,操作不当易产生错误结果。本次试验血清学检测出15例Del 表型,另有1例标本经荧光定量PCR 熔解曲线分析及PCR⁃SSP 的方法表明为亚洲型DEL,后经测序方法证实。该样本血清学方法漏检可能原因是样本保存时间过长或吸收方法试验操作不熟练,因样本量不足,未进行血清学重复验证。
血清学方法只能检测出Del 表型,并不能明确其分子机制。现已知导致Del表型的等位基因已超过17 个,如RHD(IVS3+1A)、RHD c.3G>A、RHD c.1227G>A 等[11]。对于中国人最常见 的RHD c.1227G>A检测,常用的检测手段为PCR⁃SSP法,但该方法的不足之处在于PCR 结束后,需开盖上样、电泳、成像等操作,耗时较长,且增加了产物交叉污染的风险;而熔解曲线分析法是一种PCR后产物分析技术,利用双链DNA 在升温过程中,由于长度、GC含量等因素而产生不同的解离特征,结合荧光检测,在闭管环境下,由仪器自动实现对单核苷酸多态性鉴别分析,避免人为判断误差,具有操作简单、结果判断直观等特点,现已广泛用于基因分型、甲基化检测等研究。熔解曲线分析技术可分为探针熔解曲线(probe melting curve)和荧光染料熔解曲线(fluorescent dye melting curve)两大类。Sun 等[12]报道了一种荧光探针熔解曲线分析法,可同时检测RHD 1227G和RHD 1227A等位基因,该方法难点在于“锚定探针”和“检测探针”的合理设计,如何实现高效率结合多种靶序列,产生多个可区分的熔点峰;由于该方法需要2种荧光标记探针,检测成本较高。
荧光染料熔解曲线法无需探针设计,操作简单且成本较低,因而本研究优先考虑采用此方法。根据RHD c.1227G>A 基因位点设计并合成序列特异性引物,β⁃actin作为内参,单一扩增目的基因,选用SYBR Green Ⅰ染料法。SYBR Green Ⅰ为非饱和型荧光染料,非特异性与双链DNA结合,操作简单,性价比高;虽然精准度较饱和染料稍低,但完全满足本实验要求。本次共对87例标本进行检测,其中16例含有RHD c.1227G>A等位基因,与商品化RHD阴性鉴定基因检测试剂盒(PCR⁃SSP 法)结果一致,RHD c.1227G>A阳性率为18.4%;熔解曲线方法的灵敏度及特异度均为100%。
王霓等[13]建立了RHD c.1227G>A 荧光染料熔解曲线分型方法,设计2 条特异性引物和1 条通用引物,产物RHD 1227A和RHD 1227G的熔解曲线分别为75 ℃和77 ℃,根据结果可鉴别出RHD 1227A+/G-、1227A-/G+、1227A+/G+及1227A-/G-4 种基因型。不过该方法仅能分析Del 型标本是否存在RHD 1227G 和1227A 位点,对于RHD 1227A+/G-的标本无法得知其是RHD 1227A/1227A,还是RHD1227A/d,同样也无法区分RHD 1227G/1227G 和1227G/d,若需进行区分,还需进一步RHD合子型检测。本研究建立的方法与之相比,目的不同,因而研究手段更为简单直接。本研究旨在检测出是否存在RHD c.1227G>A 等位基因,而并不关注RHD 1227G 的存在与否。由于RHD c.1227G>A 是亚洲型DEL 血型的分子遗传背景,其RhD 抗原表位没有发生变化,该基因型个体是否会对RhD抗原免疫产生抗D抗体值得研究。Xu 等[5]研究发现,808例RhD 阴性孕妇中,178例为DEL 型,其中94%存在c.1227G>A 突变,均未产生抗D 抗体。Shao 等[6]也同样发现,199例RhD阴性孕妇中,22.1%为DEL型,均为c.1227G>A突变且未产生抗D抗体。因此提议,该Del型孕妇可以免去孕期频繁的抗体筛查和抗D免疫球蛋白注射。因此本研究目的在于对RhD 初筛阴性的孕妇进行RHD c.1227G>A检测,该位点检出意味着为亚洲型DEL,因此不会产生抗D抗体,无论样本是纯合子、杂合子,或者合并其他RHD变异型情况,该等位基因的检出具有重要指向意义。
综上所述,本研究建立了一种RHD c.1227G>A基因检测的熔解曲线分析方法,该方法简单直接,可以高效、快速地进行RHD c.1227G>A等位基因检测,在RhD阴性孕妇筛查中具有较大的应用价值。

