颠茄种子质量检验方法研究
范 为, 熊维政, 董诚明, 李 磊, 郭 立, 冯言颜
(1.河南中医药大学, 郑州 450046; 2.河南羚锐制药股份有限公司, 河南 信阳 465550)
颠茄(AtropabelladonnaL.)又称“野山茄”“颠茄草”,是茄科(Solanaceae)颠茄属(AtropaL.)多年生草本,原产于欧洲地中海地区和小亚细亚,20世纪30年代引入我国[1]。颠茄味微苦、辛,有毒,主要有效成分为托烷类生物碱,具有镇痛、抗炎、活血等药理活性[2-3]。颠茄是我国药典规定的唯一托品烷类生物碱药源植物,颠茄草饮片在中医临床处方上使用较少,现常将颠茄草制备成流浸膏、浸膏、酊剂、片剂等成药制剂供临床使用[4]。
现阶段颠茄为种子繁殖,一年生栽培,全草采收。中药材种子质量关乎最终的产量与质量,颠茄草因其产地分布零散,标准化种植基地仍在建设中,缺乏基础性的生药研究,目前对颠茄的研究多集中在化学成分、毛状根等方面,国内至今未见关于颠茄种子质量的报道。本研究参考农作物种子检验规程[5],对颠茄种子检验方法进行研究,以期为颠茄种子标准的制定提供依据,为颠茄草规范化种植基地的建设积累科研资料。
1 材料和方法
颠茄种子于2019年6月28日采自河南省新县浒湾乡河南羚锐制药中药材种植基地,经河南中医药大学董诚明教授鉴定为颠茄(AtropabelladonnaL.)的成熟干燥种子。
1.1 种子真实性鉴定[6]
随机取颠茄种子100粒,置于体式显微镜下观察种子表面性状特征[7],并记录种子长、宽、厚的数值(mm),重复3次。
1.2 扦 样
按照净度分析试验不能少于2 500粒种子、送检样品的重量超过净度分析量10倍的原则,用四分法分取样品进行试验[8]。
1.3 净度分析
考虑颠茄种子混杂的细小尘屑影响净度分析的准确性与可操作性,先将待分析的种子过20目筛,再进行净度分析。用镊子将杂质拣出并分别称重,重复3次,计算净度。
1.4 千粒重测定
千粒重量测定方法如下: 1) 百粒法:每组100粒种子,重复8次; 2) 五百粒法:每组500粒种子,重复6次; 3) 千粒法:每组1000粒种子,重复3次。每组种子分别称重(g),结果精确到0.001 g,计算三种方法称量结果的平均值、标准差和变异系数。
1.5 水分测定
颠茄种子水分测定采用整粒低恒温烘干和整粒高恒温烘干2种方法进行试验。随机取2份净种子,每份约2 g,分别于(105±2)℃和(130±2)℃条件下烘干,重复3次。种子含水量计算公式如下:
种子含水量(%)=[(M2-M3)/(M2-M1)]×100%;
式中:M1为称量瓶质量,M2为称量瓶及样品烘干前质量,M3为称量瓶及样品烘干后质量。
1.6 生活力测定
采用TTC染色法,用pH 6.5~7.0的磷酸缓冲溶液将TTC配制成0.1%、0.3%、0.5%的溶液,避光保存。前期预试验发现颠茄种皮透水性较弱,整粒种子直接染色效果差,故将种子浸于常温蒸馏水中过夜[9],用刀片将种子纵切,暴露胚或剥取胚,备留染色用。选取TTC浓度(A)、染色时间(B)、染色温度(C)为考察因素,每个因素选取三个水平,避光染色,以生活力为评价指标,用L9(33)安排试验,因素水平见表1[10]。每处理300粒种子,3次重复,每重复100粒种子。

表1 颠茄种子TTC染色法因素水平表
1.7 发芽试验
1.7.1发芽床的影响试验
设置纸上(设1~3层)、纸间、沙上、沙间四种发芽床,30 ℃恒温黑暗培养箱中发芽。各处理种子的试验量为100粒,3次重复。
1.7.2温度的影响试验
以2层滤纸做发芽床,于5、10、15、20、25、30、35 ℃恒温黑暗,15 ℃/25 ℃、20 ℃/30 ℃变温黑暗条件下进行发芽试验,各处理种子的试验量为100粒,3次重复。
1.7.3光照的影响试验
以2层滤纸做发芽床,于12 h光照/12 h黑暗和全黑暗,30 ℃恒温条件下进行发芽试验。各处理种子的试验量为100粒,3次重复。
2 结果与分析
2.1 颠茄种子性状
颠茄种子三角状肾形、椭圆形或卵形,长1.6~2.3 mm,宽1.0~1.8 mm,厚0.4~1.0 mm,灰黄色或深褐色,无光泽。表面具微凸的细网纹。背面宽圆,腹面近平截,种脐位于腹面微凸处,具绒毛。胚乳丰富,胚呈环状弯曲,乳白色(见图1)。

图1 颠茄种子特征图
2.2 扦 样
颠茄种子净度分析试样量大于3 g,送检样品量不少于30 g。
2.3 净度分析
颠茄种子净度分析结果见表2。3次重复的结果误差在5%以内,表明此分析方法准确可行。

表2 颠茄种子净度分析结果
2.4 千粒重测定结果
颠茄种子千粒重测定结果见表3。3种方法测定值的变异系数均小于4.0%,3种方法均可行。百粒法所需种子量少,因此颠茄种子千粒重量测定采用百粒法。

表3 颠茄种子千粒重测定结果
2.5 水分测定
颠茄种子水分测定结果见表4。整粒低恒温(105±2)℃烘干4 h后水分含量无显著性变化,整粒高恒温(130±2)℃烘干2 h后水分含量无显著性变化,且该方法测得的种子含水量较高,宜采用整粒高恒温(130±2)℃烘干2 h测定颠茄种子含水量。
表4 颠茄种子水分测定结果
2.6 生活力测定
颠茄种子生活力测定试验结果见表5,由试验极差R得出影响因素大小为TTC浓度>染色温度>染色时间。根据综合评分,按单指标方法做直观分析,得出TTC法测定颠茄种子生活力的最佳条件为A2B3C2,即纵切或剥取种子胚,在0.3%TTC溶液中30 ℃恒温黑暗条件下染色3 h(见图2)。

注:A~D为有生命活力的胚;E~H为无生命活力的胚。

表5 不同TTC浓度、染色时间、染色温度对颠茄种子生活力的影响
2.7 发芽率测定
2.7.1发芽床选择
不同发芽床对颠茄种子萌发的影响见表6,纸上、纸间、沙上、沙间发芽床对种子发芽率影响不显著(p>0.05),纸上、沙上、沙间处理的发芽势显著高于纸间处理的发芽势(p<0.05)。出于经济和便捷考虑,把纸上作为颠茄种子的发芽床。

表6 不同发芽床对颠茄种子发芽率的影响
不同纸张层数(1~3层)对颠茄种子萌发的影响见表7,纸张层数对颠茄种子发芽率和发芽势影响不显著(p>0.05),综合操作便捷性和保湿性能考虑,选用2层作为颠茄发芽的纸张层数。

表7 纸张层数对颠茄种子萌发的影响
2.7.2发芽温度确定
不同温度对颠茄种子萌发的影响见图3,种子在10、15、20、25、30、35 ℃恒温及15 ℃/25 ℃、20 ℃/30 ℃变温条件下终发芽率分别为0、24.00%、42.33%、63.67%、88.00%、47.00%、51.67%、86.00%发芽势分别为0、4.33%、35.67%、45.67%、57.67%、47.00%、29.67%、83.67%。种子在30 ℃与20 ℃/30 ℃变温条件下的终发芽率无显著性差异,且显著高于其他处理(p<0.05)。综合以上结果,颠茄种子发芽温度以30 ℃恒温和20 ℃/30 ℃变温条件最好,30 ℃恒温条件便于操作,建议在实际生产中应用。
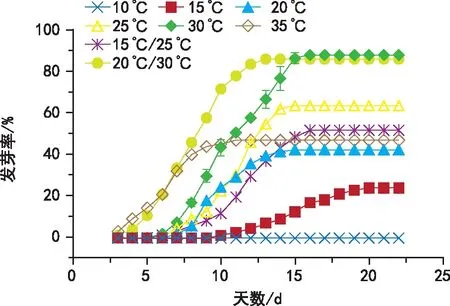
图3 不同温度培养条件下颠茄种子发芽率的变化
2.7.3发芽光照选择
不同光照条件对颠茄种子萌发的影响见表8,颠茄种子在全黑暗条件下的发芽率和发芽势显著高于12 h光照/12 h黑暗的处理(p<0.05),因此颠茄发芽宜在全黑暗条件下进行。

表8 光照条件对颠茄种子萌发的影响
2.7.4颠茄种子发芽首次和末次计数时间
在确定的最优条件发芽试验中,颠茄种子发芽起始时间为第5~6天 (图4),发芽终止时间为第14天。因此颠茄种子发芽试验首末次计数时间为5~14 d。

图4 颠茄种子发芽形态
3 结论与讨论
本研究从净度、千粒重、含水量、生命活力、发芽率试验对颠茄种子质量进行了初步研究,适用于颠茄种子质量检验。目前,颠茄种子须由人工采收。在预实验中发现,少数种子籽粒瘦弱且种皮颜色较浅,这类种子发芽率极低,或者发芽完成的时间超过正常值,考虑这类种子成熟度不够,种皮颜色、种子大小与种子质量的联系需进一步研究[11],颠茄植株的花序形态为二歧聚伞花序,进入花期后顶花序上的果实便开始成熟且生长时间长,成熟度高于植株顶端的果实,关于种子的采种时间与成熟度的划分方法的研究还有待进一步开展。
在进行水分测定预实验时,由于颠茄种子颗粒较小且胚乳中脂质成分较多,粉碎后的种子互相发生粘黏,使试验不可控因素增多,权衡试验可操作性与结果准确性,最终选择整粒法进行水分测定试验;此外,在颠茄种子生活力试验中,整粒种子直接染色效果较差,剥取种子胚具有不可操作性,将种子纵切进行染色效果较好;在发芽试验中考察了不同温度处理,结果表明,30 ℃恒温和20 ℃/30 ℃变温处理的种子发芽率最高,可达到85%以上。颠茄种子发芽完成的时间较长,而颠茄又存在最佳采收期的问题,建议实际育苗时可使用一些商品育苗基质[12],以提高种苗质量,同时使其出苗一致,进而确保药材高产和质量稳定。此外,颠茄种子种皮透水性弱且较硬实,本实验发芽前采用50 ℃水浸种,搅拌冷却后再浸泡12 h作为发芽前的种子处理,种子处理方法还有待进一步考察。
2020年版《中国药典》规定颠茄草的采收期为“开花至结果期”,全草采收,本课题组通过产地调研发现,在实际生产中颠茄常经医药公司承包给农户种植,出于种植面积有限和留种的考虑,农户常将种子单独出售,破坏了全草的完整性,很难保证药材质量稳定,应加快推进颠茄草留种基地的建设。
—— 以SI 级钻石的净度分级为例

