牛环曲病毒研究进展
赵 龙,李 昊,汤 承,2,岳 华,2*
(1. 西南民族大学畜牧兽医学院,成都 610041; 2.动物医学四川省高校重点实验室,成都 610041)
牛环曲病毒(bovine torovirus, BToV)主要感染牛的消化道和呼吸道,具有双重组织嗜性。该病毒已被证实为一种重要的牛腹泻病原,并且有可能致呼吸道疾病[1-4]。该病毒于1982年在美国首次报道,命名为“Breda”病毒[5]。1993年,国际病毒分类委员会将该病毒列入套氏病毒目、冠状病毒科、环曲病毒属[6]。2018年,国际病毒分类委员会重新将该病毒列为套式病毒目(Nidovirales)托巴套氏病毒科(Tobaniviridae)环曲病毒亚科(Torovirinae)环曲病毒属 (Torovirus)的成员[7]。
迄今为止,BToV已在全球17个国家检出,其危害受到越来越广泛的重视[3-5,8-17]。根据BToV的HE基因序列特征可将其划分为3个基因型(基因Ⅰ~Ⅲ型)[14,18],当前世界各国主要流行的是Ⅱ型和Ⅲ型[11,14,19-20]。本实验室最近证明了BToV在国内牛群中的存在[11,21],检测到的毒株为Ⅱ型和Ⅲ型。该病毒在国内属于新发牛腹泻病原,本文就BToV的生物学特性、流行概况、所致疾病的临床症状与病理变化、检测方法等进行综述,以期为BToV的研究提供参考。
1 BToV的生物学特性
1.1 基因组结构及蛋白
BToV的基因组为线性单股正链RNA[22],目前GenBank中共有6条BToV基因组序列,它们长度为28 297~28 475 bp,基因组3′端为多聚A尾,5′端非编码区之后为复制酶基因,此基因包括 2 个大的重叠开放阅读框ORF1a和ORF1b,分别编码聚合蛋白pp1a和pp1b[22-23]。复制酶基因的下游为4 个小的开放阅读框,分别编码4种结构蛋白:纤突蛋白(S)、膜蛋白(M)、血凝素酯酶蛋白(HE)、核衣壳蛋白(N)[22-23]。近年来有学者在ORF1a的5′端鉴定出1个新的编码序列(图1),编码1个由258个氨基酸组成的蛋白质(30K),目前还没有关于该蛋白功能的报道[24]。
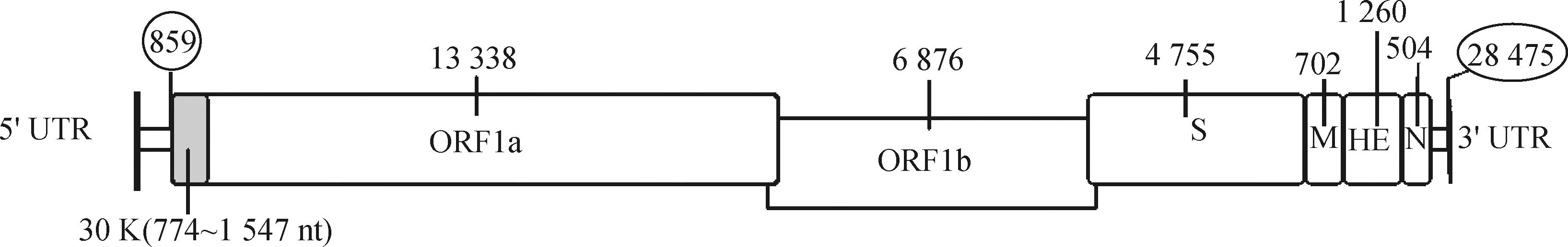
图1 牛环曲病毒(Breda 1)基因组结构示意Fig.1 Diagram of BToV (Breda 1) genome
1.1.1 纤突蛋白S基因编码的纤突蛋白(S蛋白)存在一个“类胰蛋白酶”裂解位点(1 003~1 007 aa),可将S蛋白裂解为S1和S2两个亚基[25-26]。与冠状病毒类似,目前认为BToV的S1亚基负责与宿主细胞表面的受体结合,S2亚基则介导病毒与宿主细胞的膜融合,在病毒的感染过程中起着重要作用[7,27]。该蛋白还具有N端信号序列,一个假定的C端跨膜锚定结构域和两个七肽重复结构域,并且该蛋白是诱导机体产生中和抗体的重要抗原,与病毒的致病性、组织嗜性和宿主范围密切相关[23,26,28]。
目前GenBank中共有25条完整BToVS基因,长度为4 752~4 755 bp,编码1 583~1 584个氨基酸,核苷酸相似性和氨基酸相似性分别为90.7%~99.9%和89.8%~99.9%。基于完整S基因氨基酸序列的遗传进化树表明,国内毒株在进化树上聚为2个不同的分支,分别与日本毒株和土耳其毒株的亲缘关系最近,表明国内BToV毒株具有遗传多样性(图2)[13,11]。值得注意的是,其中一个分支上的7个毒株均为S基因重组毒株,重组区域位于S1亚基[21],重组毒株分别来自四川、西藏、河南,表明这种重组毒株已经在国内存在流行,鉴于S1亚基在与宿主受体结合方面起着重要作用,这种重组毒株的生物学特性值得进一步研究。
1.1.2 血凝素酯酶蛋白HE基因编码的血凝素酯酶蛋白具有凝集素结构域(R)、酯酶结构域(E)、膜近端结构域(MP)三个结构域[18,29]。在病毒感染的初期,BToV的HE蛋白帮助病毒实现与7,9-di-O-acetylated Sias和9-mono-O-acetylated Sia两种唾液酸的可逆性结合,从而逃避宿主的免疫作用[18,29]。这种具有受体破坏酶活性的结构蛋白还在A群β冠状病毒、C型流感病毒、传染性鲑鱼贫血病毒这3类病毒中发现[30-32]。环曲病毒和A群β冠状病毒的HE蛋白以及C型流感病毒的HEF蛋白三者具有30%的序列相似性,并且认为环曲病毒和冠状病毒的HE蛋白起源于同一祖先[29]。该蛋白与病毒的毒力改变、组织嗜性改变、和跨种间传播密切相关[30-32],在病毒的感染与进化中起着重要作用[29]。
目前,GenBank中BToVHE基因共有39条,长度为1 251~1 260 bp,编码416~419个氨基酸,核苷酸相似性和氨基酸相似性分别为71.8%~100%和71.0%~100%,基于完整HE基因的遗传进化树显示,国内Ⅱ型毒株聚为2个不同的分支,分别与荷兰、土耳其毒株亲缘关系最近,显示出国内基因Ⅱ型毒株具有遗传多样性(图3)。而国内Ⅲ型毒株聚为一支,与土耳其Ⅲ型毒株亲缘关系最近,表明Ⅲ型毒株在国内具有独特的遗传进化趋势(图3)。
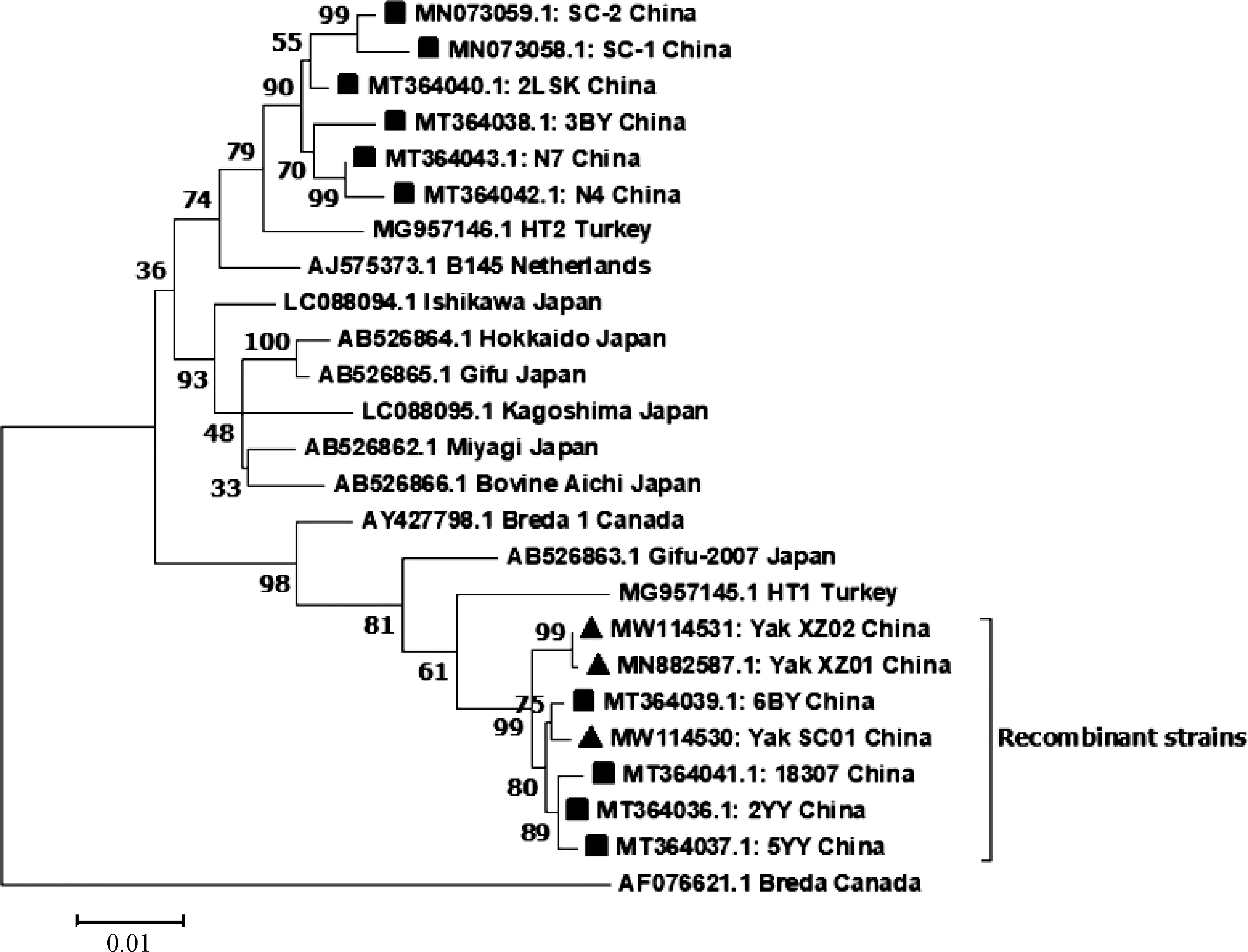
▲和■分别表示我国牦牛源和牛源的BToV毒株Black triangle and black box represent BToV strains from yak and cattle in China, respectively图2 完整S基因氨基酸序列最大似然法进化树Fig.2 Phylogenetic tree based on the aa sequences of the complete S gene
BToV的HE基因与猪环曲病毒(PToV)HE基因密切相关,2003年,Smits等[14]的研究显示,基因Ⅱ型BToV毒株是由原型(Ⅰ型)毒株与PToV在HE基因的3′端发生重组而来,而基因Ⅲ型BToV毒株可能是Ⅱ型BToV毒株与一种未知的ToV在HE基因的中间区域发生重组而来。而本实验室近期研究表明,Ⅲ型BToV毒株可能是由Ⅰ型毒株AF076621.1和Ⅱ型毒株AB661461.1在HE基因的中间区域(105~1 083 bp)重组而来,该重组分析结果与先前报道[14]不同的原因可能是本实验室在做重组分析时加入了GneBank中近年新登录的BToVHE基因序列。这种通过HE基因同源重组产生新基因型毒株可能是病毒在进化过程中逃避宿主免疫的一种策略[14]。冠状病毒的HE蛋白的氨基酸突变可能会影响病毒与受体的结合,进而改变病毒的组织嗜性,造成病毒的跨种间传播(如HCoV-OC43毒株)[31,33-34],这提醒我们不要低估环曲病毒可能存在的跨种间传播能力。
1.2 BToV的遗传进化
目前,GenBank中共有6条BToV基因组序列,1条为加拿大原型毒株Breda 1[22],2条基因Ⅱ型毒株来自日本[19],其余3条均为作者实验室近期登录,包括2条基因Ⅱ型毒株和1条牦牛基因Ⅲ型毒株[11,21]。6条BToV基因组序列核苷酸相似性为82.0%~99.2%。牦牛BToV基因组与其余5条相比,核苷酸相似性为82%~97%,与国内奶牛源BToV基因组SC2基因组相似性最高。基于基因组的遗传进化树显示,国内牦牛BToV基因组与国内奶牛BToV基因组SC1和SC2亲缘关最近,表明牦牛BToV可能是由国内奶牛毒株传播而来,但两者也有一定的遗传距离,可能与牦牛宿主及生活环境的独特性有关。国内3个BToV毒株与日本BToV毒株的亲缘关系较近,并且相比最早报道的原型毒株Breda 1,由于原型毒株Breda 1与PToV发生重组[19],导致目前流行的BToV基因Ⅱ型和Ⅲ型毒株与PToV的亲缘关系更近 (图4)。
BToV的进化有以下几种表现:1) 氨基酸突变,ORF1a非常容易发生氨基酸的缺失和替换[35],同时S基因和HE基因也存在着氨基酸的突变[11,13],这些氨基酸突变可能是病毒适应宿主和环境从而发生的改变。2)基因重组,目前,GneBank中登录的6个BToV基因组中,除最早登录的原型毒株Breda 1以外,其余5个BToV毒株均为重组毒株,其中4个毒株重组区域位于ORF1b 3′端至HE基因的3′端[11,19],1个毒株的重组区域位于S基因[21],并且这5个重组毒株的HE基因也存在重组事件,重组形式表现为单断点重组和区域重组[14,21]。氨基酸突变的累积和基因重组使得BToV具有丰富的遗传多样性,甚至进化出新的基因型毒株。分析GneBank中登录的HE基因,目前世界各国流行的毒株均是重组后的基因Ⅱ型和Ⅲ型毒株[11,14,19-21],不同基因型毒株流行情况的改变可能与HE基因的重组有关。
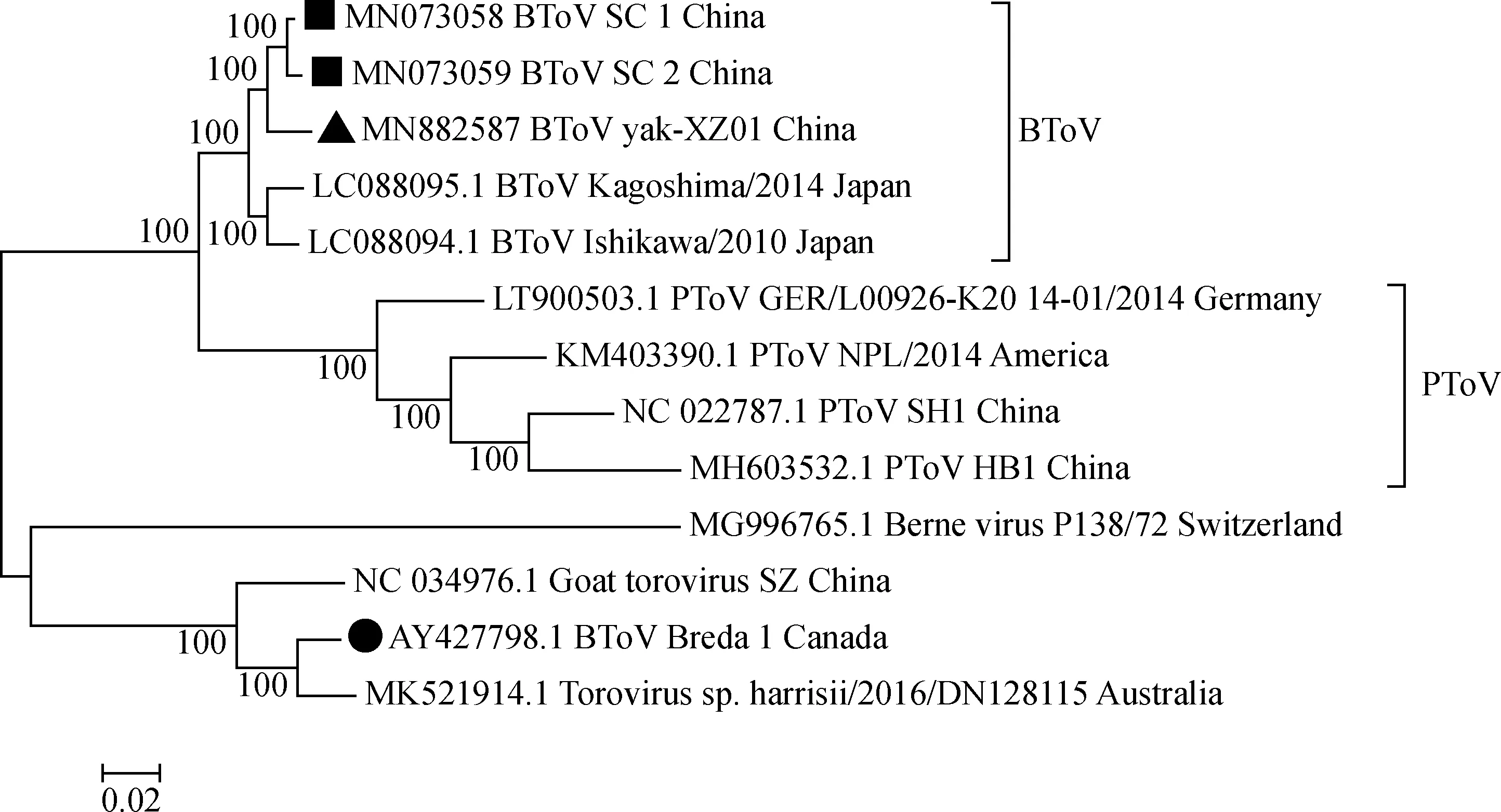
▲、■、●分别表示牦牛源毒株、国内牛源BToV毒株、BToV原型毒株Breda1Black triangle, black box, and black circles represent BToV strains from yak, cattle in China, and prototype strain (Breda1), respectively图4 环曲病毒基因组核苷酸序列最大似然法进化树Fig.4 Phylogenetic tree based on the nucleotide sequences of the complete genome
1.3 抗原性
前期的报道显示,BToV S蛋白功能与BCoV S蛋白类似,是感染过程中诱导机体产生中和抗体的重要蛋白[23,36],但目前暂无关于该蛋白中和抗原表位的报道。本实验室前期研究发现部分毒株S基因S1亚基存在重组事件[21],该现象对S蛋白抗原性的影响还有待于进一步研究。
1.4 理化特性
BToV对温度十分敏感,当温度高于4 ℃时,BToV的传染性在24~48 h内消失,31~43 ℃时毒力显著降低,50 ℃可迅速灭活,但在18~25 ℃可保持形态特征和血凝素特异性至少稳定10 d[23,37]。在4 ℃保存时,则在92~185 h传染性会有明显的降低,2~3周后传染性消失[23,37]。因此,BToV需保存在-20~-70 ℃,以保持病毒的稳定性和传染性[23,37]。反复冻融或高速离心可使BoTV的S蛋白脱离从而丧失病毒的侵染力,甚至分解[23]。BToV对磷脂酶C、胰蛋白酶和糜蛋白酶不敏感,且后两者会增强BToV的感染性,对氯仿和二乙醚敏感,处理后病毒感染性消失[23,37]。目前还没有关于BToV的pH抗性具体信息,但马环曲病毒(EToV)在pH 2.5~10.3处于稳定状态[23,37]。
1.5 血凝特性
BToV可凝集大鼠和小鼠的红细胞,不凝集人O 型血、牛、鸡、豚鼠、仓鼠的红细胞[23]。
2 流行概况
病牛和带毒牛均是传染源,其粪便中含有大量病毒[23]。该病毒的传播途径主要以粪-口传播,但也有文献报道该病毒在牛鼻腔拭子中检出,表明该病毒可经呼吸道传播[2-3,23]。目前,BToV的易感动物只有牛,包括肉牛、奶牛和牦牛。主要感染3月龄以内犊牛,但也有导致成年奶牛发生腹泻的报道[2]。
2.1 国外流行情况
目前,已在中国、美国、日本、南非、荷兰、德国、土耳其、巴西等 17个国家检出BToV[3-5,8-17],阳性率为1.74%~43.20%。血清学检测结果表明该病毒已经在欧美国家广泛流行,来自荷兰和德国的成年牛血清样本中,BToV抗体阳性率高达94%[38],在美国,BToV抗体阳性率也高达88.5%~89.7%[23],而在英国,BToV抗体阳性率为55%[39]。分析GenBank中现有的39个BToVHE基因,目前世界各国流行的毒株主要为基因Ⅱ型和Ⅲ毒株[11,14,19-20],其中最早登录的3个BToV毒株均为基因Ⅰ型毒株,报道于加拿大[22]、美国[26]和荷兰(GenBank登录号: Y10866.1);基因Ⅱ型毒株现有24个,主要报道于日本[2]、中国[11]和荷兰[14]等国;基因Ⅲ型毒株共12个,仅在中国[21]、土耳其(GenBank登录号:MG957145.1)和荷兰[14]有报道。
2.2 国内流行情况
国内关于BToV检测报道较少[11,13,21],师志海等[13]从河南地区的奶牛和肉牛中检测到BToV,阳性率分别为4.07%和3.06%。本实验室也从四川、陕西、辽宁奶牛中检出BToV,阳性率为5.12%~69.56%,并且从四川阳性样本中鉴定出基因Ⅱ型毒株[11]。本实验室近期还在来自西藏、青海、四川藏区牦牛腹泻样本中检出BToV,阳性率为3%~11.8%[21],并从西藏牦牛腹泻样本中鉴定出BToV基因Ⅲ型毒株。可见BToV已经在国内牛群中存在和流行,未来应进一步关注该病毒在牛腹泻中的生物学意义。
3 所致疾病的临床症状与病理变化
BToV主要引起犊牛腹泻,也可导致成年牛腹泻[1-2]。尽管目前还无使用BToV细胞分离株人工感染牛的报道,但使用排除其他病原的BToV阳性腹泻粪便过滤物灌喂8日龄以内的犊牛后,24 h即出现腹泻症状,观察到绿黄软粪或深棕色的水样粪便,随后腹泻加重并伴有脱水症状,96 h时开始死亡。对其肠黏膜组织进行病理学检查,发现犊牛感染BToV后空肠、回肠、盲肠等肠道黏膜均有不同程度病变,大肠部分区域坏死、部分细胞出现空泡变性、坏死,肠绒毛萎缩和融合等,因此证实该病毒是一种致牛腹泻病原[1,23,37]。BToV也可在具有呼吸道病症的牛呼吸道样本中检出[3],但其与呼吸道疾病的相关性还有待证实。
4 BToV的检测技术
4.1 病原检测
4.1.1 电镜观察 电镜是观察 BToV 最直接的方法,BToV 病毒粒子在电镜下形态呈圆形或肾形等,具有多形性[23]。该病毒可使用免疫电镜技术(IEM)进行特异性鉴定[5]。
4.1.2 PCR检测 针对BToV的检测主要依靠RT-PCR和Real-time RT-PCR方法。目前已报道的有6种普通RT-PCR检测方法和4种巢式RT-PCR检测方法[8,10-11,17,40-43],以及2种Real-time RT-PCR方法[44-45]。其中靶向S基因的检测方法有5种[17,40-43],靶向M基因有4种[10-11,42,44],靶向N基因有3种[8,42,45]。与Real-time RT-PCR方法相比,RT-PCR方法和巢式RT-PCR的引物所扩增片段较长,既能用于检测又能用于遗传进化分析;但是RT-PCR方法的灵敏度低于Real-time RT-PCR方法,且不能用于定量检测。
本实验室前期研究发现国外报道的RT-PCR[10,42]和Real-time RT-PCR方法[45]对国内BToV毒株的检出效果并不理想,可能是国内BToV毒株在国外检测引物的扩增位点上具有不同程度的核苷酸突变。有研究表明,由于S基因编码的纤突蛋白位于病毒粒子表面,容易受环境压力影响而发生突变,不宜作为检测靶标基因[42],而M基因和N基因的保守性更为突出,适宜作为检测靶标基因[42]。因此,人们重新建立了靶向M基因的RT-PCR方法[11],该方法检测结果优于国外报道的PCR方法[10,42,45],可用于检测国内BToV毒株。
4.1.3 分离培养 前期研究表明,BToV只能在日本学者Aita等[2]筛选的特定HRT-18细胞克隆株(HRT-18 Aichi 克隆株)上进行分离培养,接种病毒后产生以细胞膨大(enlargement of cells)为特征的细胞病变,随后细胞死亡脱落形成空斑[2,46-48],而对其他来源的HRT-18细胞以及Vero和MDBK传代细胞不易感,无法分离培养[2]。
4.1.4 基于酶联免疫吸附试验的抗原检测技术 1987年,Brown等[39]以豚鼠抗BToV血清作为一抗,牛抗BToV血清作为二抗建立了检测BToV抗原的双抗体夹心ELISA法;2003年Hoet等[41]将该方法进一步优化,对1999—2001年美国俄亥俄州地区259份牛粪便样本进行检测,BToV阳性率为9.7%。但由于BToV抗原制备困难,且粪便背景值较高,容易对检测造成干扰,因此该检测方法并不广泛适用。
4.2 抗体检测
目前,只有一种基于酶联免疫吸附试验的抗体检测方法报道。1987年Brown等[39]以牛抗BToV血清为一抗,从粪便中纯化得到的BToV作为抗原建立了检测BToV抗体的竞争ELISA法;1989年Koopmans等[38]对该方法进一步优化,对1985年期间荷兰的1 313份牛血清和德国的716份牛血清进行BToV抗体检测,阳性率分别高达94%和90%,表明该病毒已经存在广泛流行。但由于BToV抗原分离纯化困难,该方法并未得到广泛应用。
5 防控措施
目前,尚无针对BToV的任何疫苗,也没有特异性的治疗抗体。犊牛及时饲喂初乳可获得母源抗体保护,有效减少发病[23]。由于病牛粪便是主要传染源,隔离病牛,做好环境消毒是预防该病的重要措施[23]。对于病牛和脱水严重的牛应及时补液,调节酸碱平衡和电解质平衡,防止继发感染[23]。
6 问题与展望
自1982年首次报道BToV以来,迄今已有38年历史,但该病毒的基础研究和应用研究仍然薄弱[37,49]。首先,病毒的分离鉴定是病毒生物学特性和疫苗研究的基础,进一步建立和优化BToV的分离培养体系是需要解决的问题。第二,BToV的S蛋白在病毒的感染过程中发挥重要作用,但关于S蛋白功能结构鉴定以及与宿主细胞受体的相互作用等研究还未见报道。第三,BToV与呼吸道疾病的相关性有待研究。第四,在国内仍然欠缺系统的BToV流行病学资料。因此,进一步开展上述领域的研究,对BToV的基础生物学和应用研究有重要意义。
7 结 语
BToV在国内属于新发现牛腹泻病原,目前已在国内奶牛和牦牛中分别检测到基因Ⅱ型和Ⅲ型毒株,但国内不同基因型毒株的流行情况仍不明确,相关防控措施仍比较欠缺。因此,进一步加强对国内BToV的病原生物学、流行病学、诊断和防控技术等研究对于牛腹泻的防控具有重要意义。

