胀气变质食醋理化指标及细菌多样性分析
牟娟,刘芳,王兴洁,刘爱平,敖晓琳,2,李建龙,刘书亮,2*
1(四川农业大学 食品学院,四川 雅安, 625014)2(四川农业大学,食品加工与安全研究所,四川 雅安, 625014)
食醋作为一种酸性调味品和防腐剂在世界范围内被普遍使用。中国传统酿造食醋多以固态发酵为主,其工艺复杂且发酵处于开放环境,由复杂微生物菌群共同作用代谢产生众多风味物质,使食醋具有一定的营养和独特的风味。由于传统食醋酿造的开放式环境,食醋发酵、转运、暂存、陈酿及包装过程管理不善,易导致食醋成品发生微生物污染[1]。污染的部分微生物能在食醋中生长代谢引起食醋变质,主要表现为胀气、产膜、发黏、返浑及沉淀增多等现象[2],其中胀气主要表现为塑料袋(瓶)醋出现鼓包(瓶)现象,玻瓶醋开瓶时发生较大的爆破音甚至出现瓶炸裂现象,夏季尤为严重。这些变质现象不仅影响食醋的感官、口感、体态及品质,也极大降低了食醋的营养及应用价值,给食醋产业带来了较大的困扰。目前引起食醋胀气的微生物分为可培养和不可培养微生物[3-4],这类污染微生物及其对食醋的影响尚未明晰。采用高通量测序技术(highthroughput sequencing technology)对胀气变质食醋的微生物基因序列进行分析,能够快速鉴定胀气变质食醋中微生物的种属和丰度[5]。本文主要对胀气变质食醋和正常食醋的理化指标和感官指标进行测定,再结合高通量测序技术,了解引起食醋胀气的细菌多样性,从而为食醋产业中胀气问题的解决提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 样品
不同批次胀气变质食醋成品样品(B1~B8)、生醋(C1~C4)、发酵醋醅(P1~P6)、正常食醋成品样品(Z1~Z6)均采集于四川某麸醋厂。胀气食醋高倍稀释液样品:采用胀气变质醋液进行10倍递增稀释,取稀释液接种于4°~5°无菌醋液培养至醋液产气,选取最高稀释液接种能引起胀气的培养醋液,编号B9~B14。
1.1.2 主要试剂
NaOH、HCl、CuSO4、ZnSO4、邻苯二甲酸氢钾、亚甲基蓝指示剂、酒石酸钾钠、冰乙酸、亚铁氰化钾[K4Fe(CN)6]、葡萄糖、甲醛溶液(均为AR级),均购于成都市科隆化学品有限公司。
乙腈、甲醇(HPLC级),瑞典Oceanpak公司;乳酸、乙酸标准品(纯度≥99.5%),天津市光复精细化工研究所;丙酮酸(纯度≥99.5%),北京世纪奥科生物技术有限公司。
1.1.3 培养基
PCA培养基:胰蛋白胨5.0 g,酵母浸粉2.5 g,葡萄糖1.0 g,琼脂15.0 g,蒸馏水1 000 mL,pH(7.0±0.2),121 ℃灭菌15 min。用于菌落总数计数。
虎红培养基:蛋白胨5.0 g,葡萄糖10.0 g,KH2PO41.0 g,MgSO40.5 g,琼脂20.0 g,1/3 000孟加拉红溶液100 mL,蒸馏水900 mL,氯霉素0.1 g,121 ℃灭菌15 min。用于霉菌酵母菌计数。
醋酸菌培养基:酵母粉10.0 g,葡萄糖10.0 g,蒸馏水1 000 mL,琼脂20.0 g,121 ℃灭菌20 min,使用前添加30 mL无水乙醇。用于醋酸菌计数。
MRS培养基:蛋白胨10.0 g,牛肉膏10.0 g,酵母粉5.0 g,K2HPO42.0 g,柠檬酸二铵2.0 g,CH3COONa 5.0 g,葡萄糖20.0 g,吐温-80 1 mL,MgSO40.58 g,MnSO40.25 g,琼脂20.0 g,蒸馏水1 000 mL,pH 6.2~6.4,121 ℃灭菌15 min。用于乳酸菌计数。
1.1.4 仪器与设备
显微镜,日本OLYMPUS公司;LC-10A2010C HT液相色谱仪,日本Shimazu公司;Agilent 7890A-5979C气相色谱质谱仪,美国Agilent有限公司;My CyclerTM Thermal Cycler PCR仪,美国Bio-Rad公司;MINI-SUB CELL.GT电泳仪,美国伯乐公司。
1.2 实验方法
1.2.1 胀气变质食醋与正常食醋的感官指标对比评价
分别取相同酸度的胀气变质食醋和正常食醋样品,对体态、色泽、黏度、浑浊度、沉淀量以及气味进行评价[6]。
1.2.2 胀气变质食醋与正常食醋理化指标的对比分析
4°~5° 无菌醋液:将6°左右原醋液与蒸馏水按体积比2∶1混合后,115 ℃灭菌20 min。
样品处理:取40 mL胀气变质醋样离心得菌体沉淀,用4 mL无菌的4°~5° 醋液重悬沉淀,按接种量2%接入490 mL无菌4°~5° 醋液中混匀。将接种的混合醋液分装于2个塑料软瓶中,1瓶置于37 ℃恒温培养箱中培养至胀气(为胀气变质后食醋),另1瓶置于4 ℃冰箱中冷藏(为胀气变质前食醋或正常食醋),实验设3个重复[7]。
pH测定:采用pH计测定。
总酸含量测定:参考GB/T 5009.41—2003[8]。
氨基酸态氮含量测定:参考GB 5009.235—2016[9]。
还原糖含量测定:参考GB 5009.7—2016[10]。
总糖含量测定:亚铁氰化钾滴定法[11]。
1.2.3 胀气变质食醋和正常食醋的有机酸含量测定
样品前处理:取10 mL醋样分别加入K4Fe(CN)6(质量浓度为106 g/L)溶液和ZnSO4(质量浓度为300 g/L)溶液各2 mL,用水定容至100 mL,静置30 min,用0.22 μm水相微孔滤膜过滤,再经C18固相萃取小柱过滤,收集5 mL滤液供HPLC检测,每个样品重复测定3次。配制有机酸标准混合液,根据峰面积绘制标曲,HPLC条件参考文献[12]。
1.2.4 胀气变质食醋和正常食醋的挥发性物质含量测定
样品处理及GC-MS条件参考文献[13]。
数据处理:由NIST检索谱库,选择挥发性成分匹配度>80%的化合物,再根据峰面积归一化来计算各化合物的相对含量(%)。
1.2.5 胀气变质食醋沉淀物镜检及胀气变质食醋微生物计数
取1 mL胀气醋样10 000 r/min离心1 min后得菌体,用200 μL无菌生理盐水重悬菌体,然后革兰氏染色镜检观察菌体形态并照相[7]。
选择不同批次胀气变质食醋样品,用无菌生理盐水进行梯度稀释,取100、10-1的样品稀释液1 mL于培养皿,倾注PCA培养基、虎红培养基、醋酸菌培养基及MRS培养基,置于适宜条件下培养一定时间进行平板计数,每个稀释度做2个平行。其中PCA平板于(30±1) ℃培养(48±2) h;虎红平板于(28±1) ℃培养5 d;醋酸菌平板于(30±1) ℃培养(48±2) h;MRS平板于(36±1) ℃厌氧培养(72±2) h。
1.2.6 胀气变质食醋细菌多样性分析
对测试样品提取细菌总DNA,采用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌基因组16S rDNA的V4区进行扩增。使用Illumina公司建库试剂盒构建文库,对获得的高通量测序数据进行过滤和拼接,之后选取97%以上的序列作OTU聚类分析。最后使用QIME、Mothur和R等软件对样本进行细菌群落结构及物种差异分析。
2 结果与分析
2.1 胀气变质食醋与正常食醋的感官评价结果
色泽与风味是衡量食醋品质的重要指标。食醋发酵过程由于微生物生长代谢作用,产生酸类、酯类、醇类、羰基化合物、酚类物质以及乙酸、乳酸、柠檬酸、琥珀酸及苹果酸等非挥发性酸和挥发性酸,这些物质共同赋予了食醋丰富的滋味[14]。优质食醋的色泽呈现黑褐色或透亮的红棕色,其色泽主要是由酿醋过程中还原糖和氨基酸发生美拉德反应形成[14]。对胀气食醋与正常食醋的感官指标比较分析发现(表1),正常食醋液体清亮且呈红棕色,醋香醇厚。而胀气食醋发生明显的产气现象,颜色变深,摇动后出现浑浊,液体流动性变差,醋香弱且有淡腐臭味,瓶底明显可见大量泥状沉淀。因此,引起食醋产气(胀气)的微生物,可能由于其菌体自身繁殖及其代谢产物造成食醋产气、浑浊及沉淀等现象[15-16]。

表1 胀气变质食醋与正常食醋感官品质的差异Table 1 Sensory evaluation of swollen vinegar and normal vinegar
2.2 胀气变质食醋与正常食醋理化指标的对比分析
食醋中污染微生物能利用食醋的营养成分进行生长和代谢,将还原糖2次发酵生成乳酸和乙酸,导致食醋糖类物质减少、总酸含量升高[17]。由表2可知,根据6批次胀气食醋与正常食醋的平均值比较,胀气食醋pH降低约0.05~0.10,说明引起食醋胀气变质的污染微生物能够适应低pH环境且可以保持生长繁殖。胀气食醋总酸含量比正常食醋平均增加约为10%,孙文丽等[18]分析胀气食醋的总酸含量比正常食醋高0.5倍,说明胀气变质食醋的总酸含量增高。而总糖和还原糖分别约降低50%和60%,且由理化指标间的相关性分析可知(表3),总酸和还原糖之间具有一定相关性,其总酸-还原糖相关系数为0.596,显著性系数为0.069。

表2 胀气变质食醋与正常食醋的理化指标比较结果Table 2 Physical-chemical properties of swollen vinegar and normal vinegar

表3 理化指标间的相关性分析Table 3 Correlation analysis of the physical-chemical properties
2.3 胀气变质食醋与正常食醋的有机酸含量差异
有机酸种类与含量对食醋的酸味品质具有较大影响。胀气变质食醋与正常食醋的有机酸含量结果如图1所示,空白对照组不接种胀气变质食醋的菌体沉淀,其在37 ℃培养和4 ℃存放的结果一致,所测指标没有变化。所测6个不同批次的食醋发生胀气变质后,乳酸和乙酸含量分别平均升高约500、180 mg/100mL。胀气食醋的乳酸含量达2 000 mg/100mL,一方面是由于四川麸醋中乳酸含量高于乙酸[19],另一方面是由于食醋中污染微生物通过多种代谢途径产生乳酸。而丙酮酸的含量显著减少,其机制是由于丙酮酸在生物代谢过程中作为重要的中间转换物质,在污染微生物产生的乳酸脱氢酶作用下被转化生成乳酸,在乙酸脱氢酶作用下被转化生成乙酰辅酶A,进而生成乙醇和乙酸,表明食醋胀气污染微生物能够将丙酮酸代谢生成乳酸和乙酸。
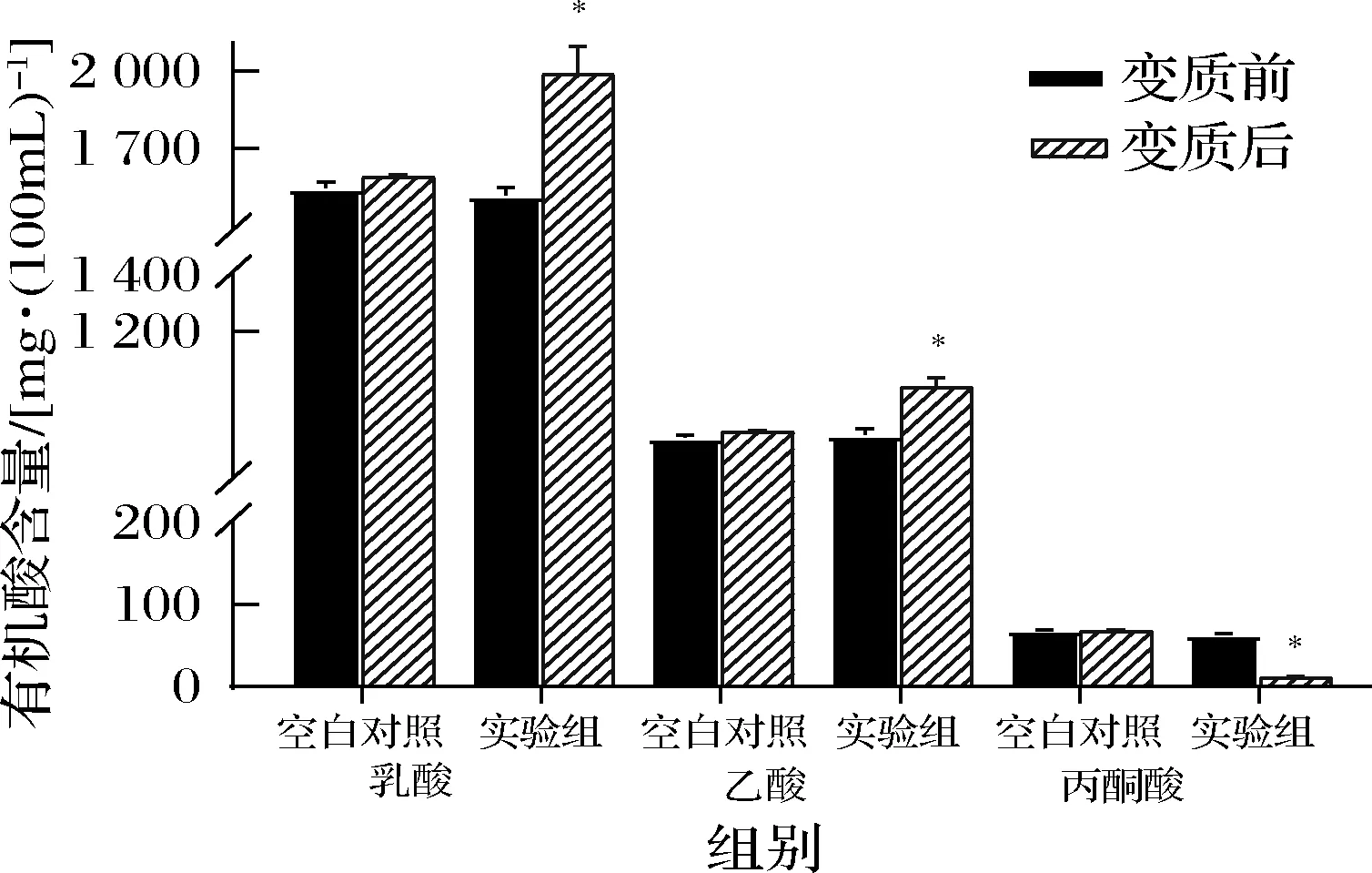
图1 胀气变质食醋与正常食醋中有机酸含量变化Fig.1 Variation of organic acid content in swollen vinegar and normal vinegar注:*表示差异显著(P<0.05)(下同)
2.4 胀气变质食醋与正常食醋的挥发性物质差异
对6组胀气变质食醋与正常食醋样本采用固相微萃取结合GC-MS测定其挥发性成分,同时使用SIMCA 14软件分析风味主成分。由图2-A可知,胀气变质食醋与正常食醋有明显的分布区间距离,说明食醋胀气变质前后的挥发性成分组成有较大的差别。由图2-B可知,胀气变质食醋与正常食醋的差异挥发性成分主要为乙酸、糠醛和糠醇。由图3可知,胀气变质食醋中乙酸含量比正常食醋中增加约10%,糠醇含量明显增加,增量约为5%(是正常食醋的2倍),而糠醛显著性降低,减少量约为35%。当食醋中糠醇含量为8 mg/L以上时,则产生令人不悦的异味,导致食醋风味变差,这与感官评价结果一致[20]。KOOPMAN等[21]以CupriavidusbasilensisHMF14为研究对象,发现在醛还原酶和醇脱氢酶的作用下,糠醛能与糠醇互相转化,与此同时糠醛在醛氧化酶的作用下可以转化为糠酸,而该代谢途径存在于不同微生物中,例如乳酸菌[22]。由此推测胀气食醋中污染微生物也能通过醛还原酶将糠醛转化生成糠醇。此外,胀气食醋中苯甲醛含量稍有减少,苯甲醛具有杏仁味和焦糖味,是麸醋中含量最丰富的醛类物质[23]。这些主要挥发性物质的变化共同影响着食醋的风味。

A-主成分分析图;B-主成分图图2 胀气变质食醋与正常食醋主成分分析图和主成分图Fig.2 Principal component analysis diagram and principal component diagram of swollen vinegar and normal vinegar

图3 胀气变质食醋与正常食醋中部分挥发性成分含量变化Fig.3 Variation of volatile components in swollen vinegar and normal vinegar
2.5 胀气变质食醋菌体沉淀镜检及微生物计数结果
图4为随机抽取3批次胀气食醋的沉淀镜检结果,均为细菌形态,革兰氏染色阳性(G+),杆状、单个排列,可初步判定食醋胀气污染微生物为G+杆状细菌。根据国家标准方法对6批次胀气食醋中菌落总数、霉菌和酵母菌数、乳酸菌数及醋酸菌数进行检测,所测胀气食醋样品均未检出相关菌落,这与马净丽等[24]研究结果一致。因此推断引起食醋胀气的这类微生物不能被国标规定方法检出。也正是由于该类污染微生物在食醋生产中不能被检出,在运输和售卖过程中由于受到摇晃、光照及温度的影响,使污染微生物在醋液中大量滋生,致使食醋出现胀袋(瓶)、泡沫及沉淀增多等现象。

图4 胀气食醋镜检结果(10×100)Fig.4 The microscopic examination from swollen vinegar(10×100)
2.6 胀气变质食醋细菌多样性分析
运用高通量测序技术对胀气食醋污染细菌菌群、醋醅与生醋细菌菌群进行解析,科水平细菌群落结果如图5所示,所有样本中科水平上共计15种类群,其中乳杆菌科(Lactobacillaceae)在所有样本中相对丰度最高且占比为85%。其次是醋酸杆菌科(Acetobacteraceae),主要集中在样本P1、P4和C1,所占比例分别为2.28%、13.42%和3.33%,与醋醅及生醋中存在大量醋酸菌的结论一致。而其他科水平的细菌占比均较少,推测引起食醋变质胀气的细菌多为乳杆菌科。
采用聚类分析来探索所有样本中的不同细菌,图6为占属水平最高的前10个属的丰度热图。所测样本的乳杆菌属(Lactobacillus)丰度最高,在样本B7、B12、B13中含量均高于97%。其次是未分类的乳杆菌属(unclassifiedLactobacillus),在B3和B11样本中丰度约为50%,占比相对较高。此外,醋酸杆菌属(Acetobacter)丰度主要集中在醋醅P4中,为12%,其他醋醅及生醋样品中丰度略低,而其在部分产气醋样B1、B3和B8中的丰度较低,可能与食醋带有一些醋酸杆菌属死菌体有关。综上可知,在测试样本中属水平丰度最高的是Lactobacillus和unclassifiedLactobacillus两个属,表明引起食醋胀气变质的细菌主要为乳杆菌属细菌,且存在于发酵醋醅及生醋中,在食醋生产后工序过程中可能发生2次污染导致该类细菌进入包装醋产品中,进而在适宜温度条件下生长导致食醋胀气变质。这与ENTANI等[25]及翟磊等[26]于胀气变质食醋源分离获得耐酸乳杆菌属于乳杆菌属的结果一致。在已有报道中,通常采用平板法和高通量测序对胀气食醋中的微生物进行鉴定,研究表明引起食醋胀气的微生物主要有Lactobacillus、芽孢杆菌属(Bacillus)、甲烷球菌属(Methanococcus)、葡萄球菌属(Staphylococcus)及铁丸球菌(Ferroglobus)[18,27-28],其中普遍存在的优势细菌有Lactobacillus和Bacillus细菌,其在胀气变质食醋中数量分别增长了35倍和100倍[28]。这些细菌对酸或热有抗性,加之目前食醋后处理工艺设施设备相对较差,因此在食醋酿造及后处理中较难防控2次污染或杀灭胀气菌[29]。由于本实验测试的胀气变质食醋中细菌并不能通过常规微生物培养方法检出,包括采用MRS平板无乳酸菌菌落检出,结合高通量测序结果推测这类乳杆菌属细菌为不可培养或难培养微生物,与现有报道存在较大差异,今后有必要进行深入研究。

图5 科水平柱状图Fig.5 Mcrobial community bartplot on family level

图6 10个最高丰度细菌属水平热图Fig.6 The heatmap of the 10 highest abundance bacteria genera
3 结论
通过比较胀气食醋与正常食醋理化性质,发现胀气食醋的pH降低、总酸含量增加、总糖和还原糖含量降低;乳酸和乙酸含量升高,而丙酮酸含量明显降低。分析食醋挥发性成分发现,胀气变质食醋中的乙酸和糠醇含量升高,而糠醛苯甲醛含量降低。微生物指标检验结果为胀气食醋中存在大量G+杆菌,而这些细菌不能通过常规培养方法检出,说明引起食醋胀气的微生物可能为不可培养或难培养微生物。此外,基于Illumina MiSeq对胀气变质食醋、高倍稀释液样品、醋醅及生醋中细菌16S rDNA的高通量测序分析,表明所有测试样品丰度最高的细菌为Lactobacillus和unclassifiedLactobacillus,推断引起食醋产气变质的优势细菌为乳杆菌属,其可能为不可培养或难培养微生物,并存在于醋醅及生醋中,食醋产品受到其2次污染导致胀气变质。本研究揭示了胀气变质食醋的理化性质及污染微生物种类,为食醋产业胀气变质菌的防控提供了理论依据。