丛枝菌根对干旱胁迫下油用牡丹幼苗光化学活性的影响
张文科,宋程威,魏冬峰,石兆勇,侯小改*
丛枝菌根对干旱胁迫下油用牡丹幼苗光化学活性的影响
张文科1,宋程威1,魏冬峰2,石兆勇1,侯小改1*
(1.河南科技大学农学院,河南 洛阳 471023;2.洛阳科技职业学院马克思主义学院,河南 洛阳 471822)
采用盆栽法,对重度干旱(土壤相对含水量为30%)和轻度干旱(土壤相对含水量为55%)胁迫3 d和6 d的接种丛枝菌根真菌()的油用牡丹‘凤丹’幼苗叶片叶绿素荧光参数进行测定。结果显示:与未接菌相比,干旱胁迫下接菌‘凤丹’的PSII潜在活性vo和性能指数PIabs均升高;重度干旱胁迫3、6 d,接菌‘凤丹’的o和j较未接菌处理分别显著降低14.5%、29.8%和12.9%和16.2%,Eo和o分别显著提高9.7%、52.2%和8%、23.6%;与未接菌相比,轻度干旱胁迫3、6 d,接菌‘凤丹’的单位面积吸收的光能ABS/CSo、单位面积捕获的光能Tro/CSo、单位面积电子传递的量子产额ETo/CSo、单位面积传递到PSⅠ末端的量子产额REo/CSo均提高,但不显著;重度干旱胁迫3、6 d,接菌‘凤丹’的Tro/CSo、ETo/CSo和单位面积反应中心数RC/CSm分别显著提高37.8%、41.1%、47.7%、73.8%、50.1%、141.8%;干旱胁迫下,接菌‘凤丹’的调节性能量耗散量子产量Y(NPQ)均显著高于未接菌处理,非调节性能量耗散量子产量Y(NO)显著低于未接菌处理。表明,丛枝菌根可以提高干旱胁迫下(尤其是重度干旱下)PSII反应中心活性,增加对光能的吸收和捕获,提高电子传递能力和光化学效率,同时将剩余的光能以热耗散的形式散发,从而避免光损伤,进而提高干旱胁迫下油用牡丹幼苗的光化学活性和抗旱性。
油用牡丹;叶绿素荧光;PSII反应中心活性;光化学效率;丛枝菌根;干旱胁迫
油用牡丹种仁出油率约27%,不饱和脂肪酸含量超过90%[1-3]。水分不足会导致牡丹生长受阻[4]。侯小改等[5]发现干旱胁迫会降低牡丹的叶绿素含量,降低牡丹的光合潜力。孔祥生等[6]认为水分胁迫会造成牡丹超氧阴离子及过氧化氢等活性氧累积,对细胞膜系统造成伤害。刘俊娟[7]研究表明,干旱可引起牡丹光合机构可逆失活或遭破坏,减弱光能转化。
丛枝菌根是陆地生态系统中分布最广泛的共生体之一,可以提高植物抗逆性[8-9]。已有研究发现,丛枝菌根可以提高缺水时杨树的水分利用效率和净光合速率,进而减少生物量的损失[10]。宋凤鸣等[11]认为丛枝菌根可促使在干旱环境下的植株产生更多的渗透调节物质,进而减轻细胞膜受损程度,提高植物的光同化能力。鲁珊珊等[12]研究发现,丛枝菌根可以通过气孔因素和非气孔因素来提高中度干旱胁迫下蓝莓的光合效率,进而提高其抗旱性。陈丹明等[13]研究表明,丛枝菌根真菌可以提高牡丹的叶绿素含量,促进牡丹的生长。
快速叶绿素荧光诱导动力学能够探测出光系统对光能吸收、捕获以及受体侧电子传递的变化,饱和脉冲理论可以探究碳同化开始后植物所吸收光能的分配机制[14-15]。笔者以油用牡丹‘凤丹’为试验材料,分析丛枝菌根对干旱胁迫下‘凤丹’光化学活性的影响,以期为提高油用牡丹的抗旱性提供新思路。
1 材料与方法
1.1 材料
供试材料为1年生油用牡丹‘凤丹’。丛枝菌根菌种为,去除其宿主植物玉米和苏丹草的地上部分,将根段剪碎后与土壤拌匀后作为菌剂接种物。
1.2 试验设计
试验于2018年10月在河南科技大学牡丹种植基地进行。试验共设5个处理:CK,正常浇水(土壤相对含水量75%),不接菌;T1,轻度干旱(土壤相对含水量55%),不接菌;T2,轻度干旱(土壤相对含水量55%),接菌;T3,重度干旱(土壤相对含水量30%),不接菌;T4,重度干旱(土壤相对含水量30%),接菌。每个处理5次重复。培养容器规格为25 cm×15 cm。培养基质为园土与草炭土,质量比1∶1,过筛、121℃灭菌2 h。将长势一致的‘凤丹’幼苗根部在质量浓度为0.6 g/L的苯菌灵溶液中浸泡3 min后移栽。接菌处理每盆加入含有150 g菌剂的1.5 kg基质后移栽。移栽后精细管理,定期浇水,采用称重法控制土壤相对含水量保持在75%左右。至2019年5月20日开始进行干旱胁迫,分别于干旱胁迫后3 d和6 d测定‘凤丹’的叶绿素荧光参数。
1.3 测定项目
1.3.1快速叶绿素荧光诱导动力学曲线测定
于晴天9:00—11:00,选择顶叶下面长势良好的第1片复叶,避开其主叶脉,采用植物效率分析仪M-PEA(英国Hansatech),在饱和脉冲光下暴露1 s后测定快速叶绿素荧光诱导动力学曲线,各处理重复5次。获得参数:PSII潜在活性vo、PSII最大光化学效率vm、以吸收光能为基础的性能指数PIabs、单位面积吸收的光能ABSCSo、单位面积捕获的光能TroCSo、以单位面积电子传递的量子产额EToCSo、单位面积传递到PSⅠ末端的量子产额REoCSo、单位面积反应中心数目RC/CSm= (ABS/CSm)/(ABS/RC)、OJIP荧光诱导曲线的初始斜率o=4(300μs-o)/(m-o)、在J点的相对可变荧光强度j=(jo)/(m-o)、在I时的相对可变荧光强度i=(io)/(m-o)、用于电子传递的量子产额Eo=ETo/ABS、反应中心捕获的激子中用来推动电子传递链中超过A的其他电子受体的激子占用来推动A还原激子的比率o=(1-j)。
1.3.2叶绿素荧光参数的测定
选取顶叶下长势良好的第1片复叶,避开主叶脉,于晴天9:00—11:00使用超便携式调制叶绿素荧光仪MINI-PAM-Ⅱ(德国Walz)测定叶绿素荧光参数。各处理重复5次。将‘凤丹’叶片暗适应30 min后再测定叶绿素荧光动力学曲线(FI)。测得的参数包括PSII实际光量子产量Y(Ⅱ)、调节性能量耗散量子产量Y(NPQ)、非调节性能量耗散量子产量Y(NO),取曲线中到达稳定的3个值的平均值作为测量值。
1.4 数据处理
采用Microsoft Excel 2010和SPSS 22.0软件进行数据处理和分析;采用LSD法进行显著性检验及方差分析。
2 结果与分析
2.1 丛枝菌根对干旱胁迫下‘凤丹’幼苗PSII光化学性能的影响
由表1可知,与对照相比,轻度干旱胁迫3 d后,未接菌的‘凤丹’幼苗的vo值显著下降9.7%,接菌处理较未接菌处理提高9%;重度干旱胁迫3 d后,未接菌处理的vo值较对照显著下降15.5%,接菌处理较未接菌处理显著提高9%。重度干旱6 d后,未接菌的‘凤丹’幼苗的vo值显著下降63.9%,接菌处理较未接菌处理显著提高69.5%。重度干旱胁迫3 d后,未接菌‘凤丹’幼苗较对照显著下降3.3%;重度干旱胁迫6 d后,未接菌处理的vm较对照显著下降28.6%,接菌处理较未接菌处理显著提高23.9%。轻度干旱胁迫3 d、轻度干旱胁迫6 d、重度干旱胁迫3 d、重度干旱胁迫6 d,未接菌‘凤丹’幼苗的PIabs较对照分别显著降低28.9%、42.6%、53.7%、94.2%;与未接菌处理相比,接菌处理‘凤丹’幼苗的PIabs分别提高4%、28.7%、36.3%、274%,其中重度干旱胁迫6 d后差异显著。
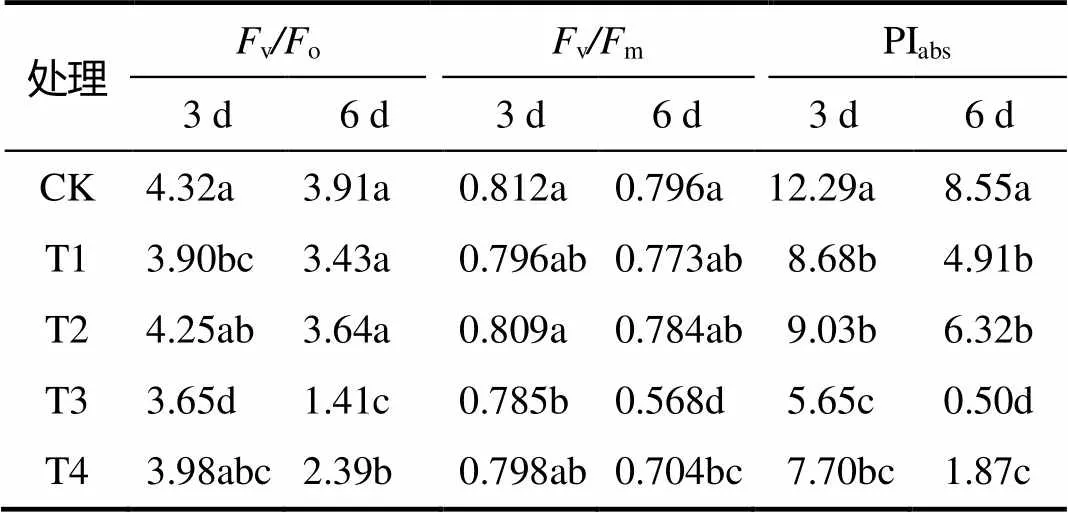
表1 干旱胁迫下接种和未接种丛枝菌根真菌的‘凤丹’幼苗的Fv/Fm、Fv/Fo和PIabs
同列不同字母表示处理间差异显著(<0.05)。
2.2 丛枝菌根对干旱胁迫下‘凤丹’幼苗PSII受体侧的影响
与对照相比,未接菌‘凤丹’幼苗在轻度干旱胁迫3 d、6 d的o分别提高20.7%和33.1%(表2),在重度干旱胁迫3 d、6 d下分别显著提高59.6%和162.2%;与未接菌处理相比,接菌处理的在轻度干旱处理3 d和6 d的o降低8.2%和5.4%,在重度干旱胁迫3 d和6 d分别显著降低14.5%和29.8%。轻度干旱胁迫3 d,未接菌‘凤丹’幼苗的Eo较对照下降5.5%、轻度干旱胁迫6 d、重度干旱胁迫3 d和6 d分别显著下降13.1%、15.7%、57.4%;与未接菌处理相比,重度干旱胁迫3 d和6 d,接菌处理的Eo分别提高9.7%和52.2%,差异显著。与对照相比,轻度干旱胁迫3 d和6 d,未接菌‘凤丹’幼苗的o分别下降3.8%和10.5%;在重度干旱胁迫3 d和6 d时分别显著下降13%和40.6%。重度干旱胁迫3 d和6d,接菌‘凤丹’幼苗的o较对照显著提高8%和23.6%。轻度干旱胁迫3 d和6 d,未接菌‘凤丹’幼苗的i较对照升高9.4%和22.8%;重度干旱胁迫3 d和6 d后分别升高32.4%和88%。与未接菌处理相比,轻度干旱胁迫3 d,接菌‘凤丹’幼苗的j无明显变化,轻度干旱胁迫6 d下降14.5%;重度干旱胁迫3 d和6 d,分别下降12.9%和16.2%,差异显著。未接菌‘凤丹’幼苗的i在轻度干旱胁迫后无明显变化,重度干旱胁迫3 d和6 d,分别升高5.3%和4.9%。

表2 干旱胁迫下接种和未接种丛枝菌根真菌的‘凤丹’幼苗的Mo、φEo、φo、Vj、Vi
同列不同字母表示处理间差异显著(<0.05)。
2.3 丛枝菌根对干旱胁迫下‘凤丹’幼苗PSII反应中心的影响
从表3可知,轻度干旱胁迫3 d和6 d,重度干旱胁迫3 d和6 d后,与未接菌处理相比,接菌处理的ABS/CSo分别提高7.4%、9.5%、35%和12.3%,其中重度干旱3 d处理间差异显著。轻度干旱胁迫3 d后,未接菌‘凤丹’幼苗的Tro/CSo较对照升高11.3%,轻度干旱胁迫6 d、重度干旱胁迫3 d后分别降低7.7%和11.6%,重度干旱胁迫6 d后显著降低25.7%;轻度干旱胁迫3 d和6 d,接菌‘凤丹’幼苗的Tro/CSo与未接菌处理相比分别提高9.2%和11.1%,重度干旱胁迫3 d和6 d分别显著提高37.8%和41.1%。轻度干旱胁迫3 d,未接菌‘凤丹’幼苗的ETo/CSo较对照提高7.2%,接菌处理较不接菌处理提高7.7%;与对照相比,轻度干旱胁迫6 d、重度干旱胁迫3 d和6 d,未接菌‘凤丹’幼苗的ETo/CSo分别显著降低17.6%、22.5%、56.1%,接菌处理较未接菌处理显著提高20.1%、47.7%和73.8%。轻度干旱胁迫3 d,与对照相比,未接菌‘凤丹’幼苗的REo/CSo提高10%,与接菌处理相比提高5.3%;轻度干旱胁迫6 d,未接菌‘凤丹’幼苗的REo/CSo较对照降低7.8%;重度干旱胁迫3 d,未接菌‘凤丹’幼苗的REo/CSo较对照降低23.9%,接菌处理较未接菌处理提高31.1%;重度干旱胁迫6 d,与对照相比,未接菌‘凤丹’幼苗的REo/CSo显著降低38.4%,接菌处理较未接菌处理提高18.3%。轻度干旱胁迫3 d和6 d,重度干旱胁迫3 d和6 d,与对照相比,未接菌‘凤丹’幼苗的RC/CSm分别降低6.9%、23.2%、35.2%、73.8%,在轻度干旱6 d,重度干旱3 d和6 d达到显著性差异;接菌处理较未接菌处理分别提高11.7%、9.6%、50.1%、141.8%,在重度干旱3 d和6 d差异显著。
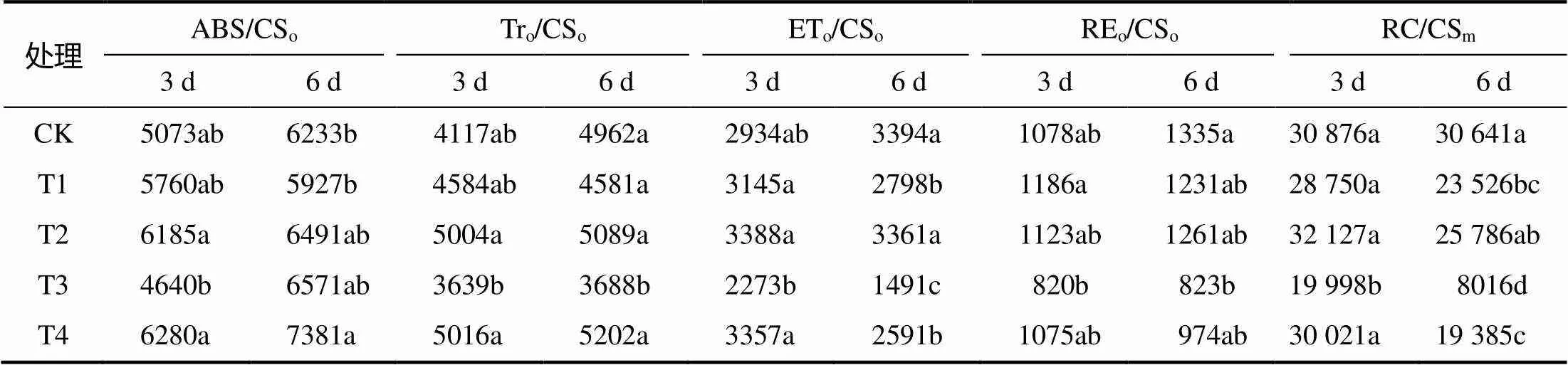
表3 干旱胁迫下接种和未接种丛枝菌根真菌的‘凤丹’幼苗ABS/CSo、Tro/CSo、ETo/CSo、REo/CSo和RC/CSm
同列不同字母表示处理间差异显著(<0.05)。
2.4 丛枝菌根对干旱胁迫下‘凤丹’幼苗碳同化反应启动后光能分配的影响
由表4可以看出,与对照相比,轻度干旱胁迫3 d和6 d,重度干旱3 d和6 d,未接菌‘凤丹’幼苗的Y(II)分别显著降低15.8%、72.9%、23.4%和78.7%;与未接菌处理相比,轻度干旱及重度干旱3 d,接菌处理的Y(II)提高6.3%和14.3%,差异不显著;轻度干旱胁迫6 d和重度干旱胁迫6 d,接菌处理较未接菌处理分别显著提高48.9%和58.7%。轻度干旱胁迫3 d和重度干旱3 d,未接菌‘凤丹’幼苗的Y(NPQ)较对照分别提高3%和12.1%,接菌处理较未接菌处理分别显著提高39.7%和29.1%;轻度干旱胁迫6 d和重度干旱6 d,未接菌‘凤丹’幼苗的Y(NPQ)较对照显著升高146.6%和164.1%,接菌处理较未接菌处理分别显著提高32.5%和31.8%。轻度干旱胁迫3 d和6 d,重度干旱胁迫3 d和6 d,与对照相比,未接菌‘凤丹’幼苗的Y(NO)显著提高23.8%、50.7%、32%和52.7%;与未接菌处理相比,接菌处理显著降低18.7%、32.1%、22.7%和31.9%。

表4 干旱胁迫下接种和未接种丛枝菌根真菌的‘凤丹’幼苗的Y(II)、Y(NPQ)、Y(NO)
同列不同字母表示处理间差异显著(<0.05)。
3 结论与讨论
姜英等[16]发现丛枝菌根可以减轻干旱对柚木的光抑制,提高木棉的PSII的潜在活性。本研究结果表明,未接菌处理‘凤丹’幼苗的vo降低,但是接菌‘凤丹’幼苗的vo在轻度干旱胁迫时与未接菌处理相比有所升高,在重度干旱时显著升高,说明丛枝菌根可以提高干旱胁迫环境下‘凤丹’的PSII反应中心活性,且随着干旱程度的加深,作用更为明显。轻度干旱胁迫和重度干旱胁迫3 d均未使‘凤丹’幼苗v/m有明显变化,接菌较未接菌也无显著差异。重度干旱胁迫6 d,未接菌‘凤丹’v/m显著降低,接菌的v/m较未接菌处理显著升高。有研究发现,vm对干旱胁迫并不敏感,而以吸收光能为基础的性能参数PIabs包含了光能吸收、捕获和转化三个方面来综合反映光系统活性,因此敏感性优于vm[17]。本研究发现,干旱使未接菌‘凤丹’幼苗的PIabs显著降低,接菌则使干旱胁迫处理下‘凤丹’的PIabs升高,且随着干旱时间的延长和干旱程度的加剧,PIabs升高的幅度更大。这说明丛枝菌根可减轻干旱对‘凤丹’的光抑制,增强其光合系统结构与功能的整体性,随着干旱胁迫时间延长和程度加深效果更为明显。这与马坤等[18]在木棉中的研究结果一致。
oEoo等参数可反映PSII受体侧的变化[19]。重度干旱胁迫下未接菌的‘凤丹’o明显升高,接菌使重度干旱胁迫下‘凤丹’的o明显降低,Eoo显著升高,说明丛枝菌根可减少干旱胁迫环境下‘凤丹’幼苗光能中用来还原A的能量所占比例,提高电子传递效率,这可能是因为丛枝菌根可缓解干旱胁迫对‘凤丹’幼苗PSII受体侧的伤害。j、i表示在J点和I点A-的积累量,反映了在J点和I点关闭的反应中心数量[20]。‘凤丹’幼苗在干旱胁迫环境中j和i升高,说明干旱胁迫会引起反应中心关闭。接菌将重度干旱胁迫的j显著降低,i却没有显著变化,这说明丛枝菌根可通过减少在J相的QA-积累量来降低干旱对电子传递的抑制。表明丛枝菌根可将在反应中心捕获的激子更多地用于电子传递,减少A-积累量,进而提高电子传递效率。这可能也是接菌可使干旱胁迫下‘凤丹’幼苗最大光化学效率提高的原因之一。
干旱会导致反应中心的降解或失活,增加剩余有活动反应中心的负担,使ABS/CS、Tr/CS减少,最终导致ET/CS、RE/CS和RC/CS下降[21]。本研究发现,轻度干旱胁迫3 d时,‘凤丹’幼苗的ABS/CSo、Tr/CSo没有降低,反而有所升高,ET/CSo和RE/CSo却降低,这可能是由于轻度干旱使PSII陷入了能量陷阱,持续吸收光能,却不传递光能,从而对反应中心造成了进一步伤害[22]。接菌后,干旱胁迫下‘凤丹’幼苗的ABS/CSo、Tr/CSo、ET/CSo、和RC/CSm都有所上升,且重度干旱胁迫下提高的幅度更大,这说明丛枝菌根能增加干旱胁迫(尤其是重度干旱胁迫)下单位面积内反应中心数量,吸收和捕获较多的光能,而且具有较强的电子传递能力,从而维持‘凤丹’幼苗PSII反应中心在干旱环境下的活性。这与张妮娜[23]在柑橘上的研究结果一致。
干旱胁迫可通过影响光系统活性而改变光能分配[24-25]。干旱胁迫后,未接菌‘凤丹’幼苗的Y(II)降低,Y(NPQ)和Y(NO)升高,说明干旱造成光能中用于光化学反应的比例减小,热耗散和造成光系统损伤的能量增加。干旱胁迫3 d,未接菌‘凤丹’调节性能量耗散量子产量没有明显增加,而调节性能量耗散量子产量却显著提高,这可能是因为未接菌的‘凤丹’光系统对干旱的调节机制不灵敏,过剩的能量没有及时以热量的形式散发,从而导致光系统损伤。谢晓红[26]认为,丛枝菌根可以提高逆境下甜瓜的热耗散能力,进而保护光系统中心不被过量的光能破坏。本研究结果表明,处于干旱环境的‘凤丹’幼苗接菌后Y(NPQ)明显升高,Y(NO)显著降低;Y(II)在干旱胁迫3 d后有所升高,在干旱胁迫6 d后达到显著水平。这表明丛枝菌根能够维持干旱胁迫下‘凤丹’幼苗的热耗散能力,降低光反应中心的热损伤程度,将更多的光能用于光化学反应,从而提高‘凤丹’的光合能力。
综上,在干旱胁迫条件下,丛枝菌根可以提高油用牡丹‘凤丹’PSII反应中心潜在活性和单位面积反应中心数量,增加对光能的吸收和捕获,并显著提高热耗散能力,显著降低干旱对光反应中心的损害,减小A被还原的速率和A-积累量,从而增强电子传递,提高光化学效率,维持较高的光化学活性,在重度干旱胁迫下,这种作用的效果更为明显。
[1] 李晓青,韩继刚,刘炤,等.不同地区凤丹经济性状及其籽油脂肪酸成分分析[J].粮食与油脂,2014,27(4):43-46.
LI X Q,HAN J G,LIU Z,et al.Economic characteristics investigation and seed oil fatty acid composition analysis ofplants in different areas[J].Cereals & Oils,2014,27(4):43-46.
[2] 修宇,吴国栋,陈德忠,等.牡丹绿化油用品种繁殖栽培技术[J].北京林业大学学报,2017,39(1):112-118.
XIU Y,WU G D,CHEN D Z,et al.Propagation and afforestation techniques of tree peonies for greening and seed oil production[J].Journal of Beijing Forestry University,2017,39(1):112-118.
[3] 史瑞雪,王惠玲.特种植物油脂新食品原料的营养生理功效比较研究[J].粮食与食品工业,2016,23(6):13-19.
SHI R X,WANG H L.The comparative study on the nutritional physiological functions in the special vegetable oils of the novel food[J].Cereal & Food Industry,2016,23(6):13-19.
[4] 张雯,徐先英,师生波,等.紫斑牡丹()的光合特性及对土壤干旱胁迫的响应[J].分子植物育种,2020,18(7):2358-2365.
ZHANG W,XU X Y,SHI S B,et al.Photosynthetic characteristics ofand its response to soil drought stress[J].Molecular Plant Breeding,2020,18(7):2358-2365.
[5] 侯小改,段春燕,刘素云,等.不同土壤水分条件下牡丹的生理特性研究[J].华北农学报,2007,22(3):80-83.
HOU X G,DUAN C Y,LIU S Y,et al.Physioecological characteristics of tree peony under different soil water conditions[J].Acta Agriculturae Boreali-Sinica,2007,22(3):80-83.
[6] 孔祥生,张妙霞,王学永,等.水分胁迫下2个牡丹品种生理生化差异比较[J].林业科学,2011,47(9):162-167.
KONG X S,ZHANG M X,WANG X Y,et al. Comparative studies on the physiological and biochemical characteristics of twovarieties under water stress[J].Scientia Silvae Sinicae,2011,47(9):162-167.
[7] 刘俊娟.高温干旱胁迫对牡丹叶PSⅡ功能及光能分配的影响[J].北方园艺,2019(11):72-79.
LIU J J.Effects of high temperature and drought stress on PSII function and light distribution in peony leaves with different resistance[J].Northern Horticulture,2019(11):72-79.
[8] 田蜜,陈应龙,李敏,等.丛枝菌根结构与功能研究进展[J].应用生态学报,2013,24(8):2369-2376.
TIAN M,CHEN Y L,LI M,et al.Structure and function of arbuscular mycorrhiza:a review[J].Chinese Journal of Applied Ecology,2013,4(8):2369-2376.
[9] ZHOU Q,RAVNSKOV S,JIANG D,et al.Changes in carbon and nitrogen allocation,growth and grain yield induced by arbuscular mycorrhizal fungi in wheat (L.) subjected to a period of water deficit[J].Plant Growth Regulation,2015,75(3):751-760.
[10] LIU T,SHENG M,WANG C Y,et al.Impact of arbuscular mycorrhizal fungi on the growth,water status,and photosynthesis of hybrid poplar under drought stress and recovery[J].Photosynthetica,2015,53(2):250-258.
[11] 宋凤鸣,刘建华,刘登彪,等.3种丛枝菌根真菌对任豆生长和抗旱性的影响研究[J].西南林业大学学报(自然科学),2018,38(6):97-105.
SONG F M,LIU J H,LIU D B,et al.Effects of 3 kinds of arbuscular mycorrhizal fungi on the growth and drought resistance of[J].Journal of South- west Forestry University(Natural Sciences),2018,38(6):97-105.
[12] 鲁珊珊,陈乒乒,刘微,等.干旱胁迫条件下AM真菌对蓝莓光合特性及矿质元素含量的影响[J].中国农学通报,2019,35(5):31-35.
LU S S,CHEN P P,LIU W,et al.Arbuscular mycorrhizal fungus affects the photosynthetic characteristics and mineral element concentration of blueberry under drought stress[J].Chinese Agricultural Science Bulletin,2019,35(5):31-35.
[13] 陈丹明,郭娜,郭绍霞.丛枝菌根真菌对牡丹生长及相关生理指标的影响[J].西北植物学报,2010,30(1):131-135.
CHEN D M,GUO N,GUO S X.Effects of arbuscular mycorrhizal fungi on growth and some physiological indices of[J].Acta Botanica Boreali-Occidentalia Sinica,2010,30(1):131-135.
[14] 宋贺,蒋延玲,许振柱,等.玉米光合生理参数对全生育期干旱与拔节后干旱过程的响应[J].生态学报,2019,39(7):2405-2415.
SONG H,JIANG Y L,XU Z Z,et al.Response of photosynthetic physiological parameters of maize to drought during the whole growth period and after the jointing stage[J].Acta Ecologica Sinica,2019,39(7):2405-2415.
[15] 张兴华,高杰,杜伟莉,等.干旱胁迫对玉米品种苗期叶片光合特性的影响[J].作物学报,2015,41(1):154-159.
ZHANG X H,GAO J,DU W L,et al.Effects of drought stress on photosynthetic characteristics of maize hybrids at seedling stage[J].Acta Agronomica Sinica,2015,41(1):154-159.
[16] 姜英,刘雄盛,李娟,等.干旱胁迫下丛枝菌根真菌对柚木光合及荧光参数的影响[J].森林与环境学报,2019,39(6):608-615.
JIANG Y,LIU X S,LI J,et al.Effects of arbuscular mycorrhizal fungi on the photosynthetic characteristics and fluorescence parameters ofseedlings under drought stress[J].Journal of Forest and Environ- ment,2019,39(6):608-615.
[17] 原佳乐,马超,冯雅岚,等.不同抗旱性小麦快速叶绿素荧光诱导动力学曲线对干旱及复水的响应[J].植物生理学报,2018,54(6):1119-1129.
YUAN J L,MA C,FENG Y L,et al.Response of chlorophyll fluorescence transient in leaves of wheats with different drought resistances to drought stresses and rehydration[J].Plant Physiology Journal,2018,54(6):1119-1129.
[18] 马坤,王彦淇,杨建军,等.不同干旱胁迫条件下丛枝菌根真菌对木棉叶绿素荧光参数的影响[J].植物资源与环境学报,2017,26(3):35-43.
MA K,WANG Y Q,YANG J J,et al.Effect of arbuscular mycorrhizal fungi on chlorophyll fluorescence parameters ofunder different drought stress condi- tions[J].Journal of Plant Resources and Environment,2017,26(3):35-43.
[19] 王飞,孙增光,焦念元,等.芝麻与花生间作对芝麻功能叶光合荧光特性的影响[J].应用生态学报,2019,30(11):3787-3794.
WANG F,SUN Z G,JIAO N Y,et alThe effects of sesame/peanut intercropping on photosynthetic fluorescence characteristics in functional leaf of sesame[J].Chinese Journal of Applied Ecology,2019,30(11):3787-3794.
[20] 王飞,刘领,武岩岩,等.玉米花生间作改善花生铁营养提高其光合特性的机理[J].植物营养与肥料学报,2020,26(5):901-913.
WANG F,LIU L,WU Y Y,et al.Mechanism of maize intercropping peanut improving iron nutrition to increase photosynthetic performance of peanut[J].Journal of Plant Nutrition and Fertilizers,2020,26(5):901-913.
[21] 高杰,张仁和,王文斌,等.干旱胁迫对玉米苗期叶片光系统Ⅱ性能的影响[J].应用生态学报,2015,26(5):1391-1396.
GAO J,ZHANG R H,WANG W B,et alEffects of drought stress on performance of photosystem Ⅱ in maize seedling stage[J].Chinese Journal of Applied Ecology,2015,26(5):1391-1396.
[22] 鲁建荣,李向义,薛伟,等.两种荒漠植物叶片脱水下水分生理和PSⅡ活性特征[J].西北植物学报,2013,33(7):1427-1434.
LU J R,LI X Y,XUE W,et al.Characteristics of leaf dehydration on water relation and photosystemⅡactivity in two desert plants[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(7):1427-1434.
[23] 张妮娜.接种丛枝菌根真菌(AMF)对盆栽柑橘幼苗抗旱性的影响[D].重庆:西南大学,2018.
ZHANG N N.Influences of arbuscular mycorrhizal fungi (AMF) inoculation on drought resistance mechanism of the pottedplantlets[D].Chongqing:Southwest University,2018.
[24] 朱成刚,陈亚宁,李卫红,等.干旱胁迫对胡杨PSII光化学效率和激能耗散的影响[J].植物学报,2011,46(4):413-424.
ZHU C G,CHEN Y N,LI W H,et alEffect of drought stress on photochemical efficiency and dissipation of excited energy in photosystem II of[J]. Chinese Bulletin of Botany,2011,46(4):413-424.
[25] 徐祥增,张金燕,张广辉,等.光强对三七光合能力及能量分配的影响[J].应用生态学报,2018,29(1):193-204.
XU X Z,ZHANG J Y,ZHANG G H,et al.Effects of light intensity on photosynthetic capacity and light energy allocation in[J].Chinese Journal of Applied Ecology,2018,29(1):193-204.
[26] 谢晓红.丛枝菌根真菌对弱光及盐胁迫下甜瓜生长和光合作用的影响[D].雅安:四川农业大学,2016.
XIE X H.Effects of arbuscular mycorrhizal fungi on growth and photosynthesis in melon seedlings under weak light with salt stress[D].Yaan,China:Sichuan Agricultural University,2016.
Effect of arbuscular mycorrhiza on photochemical activity of oil tree peony seedlings under drought stress
ZHANG Wenke1,SONG Chengwei1,WEI Dongfeng2,SHI Zhaoyong1,HOU Xiaogai1*
(1.College of Agriculture, Henan University of Science and Technology, Luoyang, Henan 471023, China; 2.Luoyang Vocational College of Science and Technology, Luoyang, Henan 471822, China)
The chlorophyll fluorescence parameters of potted oil peony ‘Fengdan’ seedlings inoculated with arbuscular mycorrhizal fungusunder severe drought(soil relative water content is 30%) and mild drought(soil relative water content is 55%) stress for 3 and 6 days were compared and analyzed. The results showed that the potential PSII activityvoand performance index PIabsof ‘Fengdan’ seedlings inoculated with arbuscular mycorrhiza were increased under different drought stress compared with the non-inoculated seedlings. Compared with the non-inoculated treatment, in inoculated ‘Fengdan’ with 3 and 6 days under severe drought stress,osignificantly decreased by 14.5% and 29.8% respectively;jsignificantly decreased by 12.9% and 16.2% respectively;Eosignificantly increased by 9.7% and 52.2% respectively; andosignificantly increased by 8% and 23.6%, respectively. Compared with the non-inoculated treatment, in inoculated ‘Fengdan’ with mild drought stress for 3days and 6 days, absorption of energy per unit area(ABSCSo), capture of light energy per unit area(TroCSo), quantum yield electron transfered per unit area(EToCSo), quantum yield transfered at the end of PSⅠ per unit area(REoCSo) were improved, but with no significant difference. Compared with the non-inoculated treatment, in inoculated ‘Fengdan’ with under severe drought stress for 3 and 6 days, TroCSowere significantly increased by 37.8% and 41.1% respectively, ETo/CSosignificantly increased by 47.7% and 73.8% respectively, and the number of response centers per unit area(RCCSm) significantly increased by 50.1% and 141.8%, respectively. Under drought stress, regulatory energy dissipation quantum yield Y(NPQ) of inoculated ‘Fengdan’ was significantly higher than that of non-inoculated ‘Fengdan’, and non-regulatory energy dissipative quantum yield Y(NO) was significantly lower than that of non-inoculated. The research showed that arbuscular mycorrhizal can improve PSII reaction center activity under the drought stress, especially under the severe drought, increase the absorption and capture of light energy, improve the efficiency of electron transfer ability and light chemistry, at the same time, more remaining energy distributed in the form of heat dissipation, avoid the light damage, then improve drought resistance and photochemical activity of oil tree peony seedlings under drought stress.
oil tree peony; chlorophyll fluorescence; PSII reactive center activity; photochemical efficiency; arbuscular mycorrhiza; drought stress
S682.1+901
A
1007-1032(2021)05-0523-07
张文科,宋程威,魏冬峰,石兆勇,侯小改.丛枝菌根对干旱胁迫下油用牡丹幼苗光化学活性的影响[J].湖南农业大学学报(自然科学版),2021,47(5):523-529.
ZHANG W K,SONG C W,WEI D F,SHI Z Y,HOU X G.Effect of arbuscular mycorrhiza on photochemical activity of oil tree peony seedlings under drought stress[J].Journal of Hunan Agricultural University(Natural Sciences),2021,47(5):523-529.
http://xb.hunau.edu.cn

2020-12-05
2021-06-02
国家自然科学基金项目(U1804233);河南省教育厅项目(19A2180002)
张文科(1995—),男,河南周口人,硕士研究生,主要从事牡丹生理生态研究,815318227@qq.com.;*通信作者,侯小改,教授,主要从事牡丹生理生态与分子生物学研究,hkdhxg@haust.edu.cn
责任编辑:罗慧敏
英文编辑:罗维

