长期应用稻鳖共生系统对土壤细菌群落结构及其多样性的影响
丁姣龙 孟祥杰 王忍 陈璐 周晶 陈灿 黄璜
摘要:【目的】探究长期应用稻鳖共生系统对稻田土壤养分含量、土壤细菌群落结构及其多样性的影响,为阐释稻鳖共生模式对稻田土壤微生物多样性的影响机制提供科学依据。【方法】以2年稻鳖共生田(RT2)、5年稻鳖共生田(RT5)和8年稻鳖共生田(RT8)为研究对象,采集各处理0~10 cm土层土壤样品,测定土壤养分含量,利用Illumina MiSeq高通量测序技术探究土壤细菌群落结构,对比分析不同应用年限稻鳖共生田的土壤养分含量及土壤细菌群落多样性差异。【结果】长期应用稻鳖共生系统明显提高稻田土壤的全氮、全磷、碱解氮和速效磷含量及土壤pH,5年稻鳖共生田的全磷和速效磷含量显著高于2年稻鳖共生田(P<0.05,下同),8年稻鳖共生田的土壤全氮、全磷、碱解氮和速效磷含量显著高于2年稻鳖共生田,有机质、全钾和速效钾含量均以5年稻鳖共生田最高,8年稻鳖共生田最低。Alpha多样性分析结果显示,土壤细菌群落多样性Shannon指数、PD whole tree指数和Chao1指数均表现为RT5处理>RT8处理>RT2处理。各样本检测到的细菌类群隶属于51门136纲192目337科557属和113种。物种群落组成分析表明,變形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)是稻鳖共生田土壤细菌的主要优势菌群;不同年限的稻鳖共生田土壤细菌群落结构差异主要表现在物种均匀度上,RT2处理的变形菌门、拟杆菌门、放线菌门、酸杆菌门、栖热菌门(Deinococcus-Thermus)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)和奇古菌门(Thaumarchaeota)的相对丰度均存在显著差异;RT8处理则仅在变形菌门、拟杆菌门、浮霉菌门和互养菌门(Synergistetes)4种菌种间具有显著差异。【结论】长期应用稻鳖共生系统可在不施用化肥的情况下,维持土壤主要养分含量,增加稻田土壤细菌群落多样性,扩大优势菌群相对丰度,形成更稳定的土壤微环境。
关键词: 稻鳖共生系统;土壤;细菌群落结构;养分含量
中图分类号: S344.9 文献标志码: A 文章编号:2095-1191(2021)07-1860-09
Effects of long-term application of rice-turtle co-culture on soil bacterial community structure and diversity
DING Jiao-long1, MENG Xiang-jie1, WANG Ren1, CHEN Lu1, ZHOU Jing1,
CHEN Can1,2, HUANG Huang1,2*
(1College of Agriculture, Hunan Agricultural University, Changsha 410128, China; 2Hunan Paddy Field Ecological Planting and Breeding Engineering Center, Changsha 410000, China)
Abstract:【Objective】To explore the effects of rice-turtle co-cultureon soil fertility, soil bacterial community structure and diversity,and to provide a scientific basis for explaining the mechanism of rice-turtle co-culture on soil microbial diversity in paddy fields. 【Method】Soil samples from paddy fields of 2-year rice-turtle co-culture field(RT2) and 5-year rice-turtle co-culture field(RT5) and 8-year rice-turtle co-culture field(RT8) were collected from 0-10 cm soil layer of each treatment to determine the soil nutrient content. Illumina MiSeq high-throughput sequencing technology was used to explore the soil bacterial community structure, and the differences of soil nutrient content and soil bacterial community diversity in rice-turtle co-culture fields with different application years were compared and analyzed. 【Result】Long-term application of rice-turtle co-culture increased soil total nitrogen, total phosphorus, alkali-hydrolyzable nitrogen and avai-lable phosphorus contens and soil pH. The contents of total phosphorus and available phosphorus in 5-year rice-turtle co-culture field were significantly higher than those in 2-year rice-turtle co-culture field (P<0.05, the same below), the contents of total nitrogen, total phosphorus, alkali-hydrolyzable nitrogen and available phosphorus in 8-year rice-turtle co-culture field were significantly higher than those in 2-year field. The contents of organic matter, total potassium and available potassium in 5-year field were the highest, and those in 8-year field were the lowest. The Alpha diversity analysis showed that the Shannon index, PD whole tree index and Chao1 index of soil bacterial community diversity were RT5>RT8>RT2. The bacterial groups detected in each sample belonged to 51 phyla, 136 classes, 192 orders, 337 families, 557 genus and 113 species. The analysis of species community composition showed that Proteobacteria, Bacteroidetes, Acidobacteria and Actinobacteria were the main dominant bacterial communities in paddy soil. The differences of soil bacterial community structure in rice-turtle co-culture in different years were mainly manifested in species evenness. There were significant differences in RT2 in the relative abundance of Proteobacteria, Bacteroidetes, Actinobacteria, Acidobacteria, Deinococcus-Thermus, Firmicutes, Chloroflexi, Planctomycetes and Thaumarchaeota. RT8 treatment only showed significant differences in Proteobacteria, Bacteroidetes, Planctomycetes and Synergistetes. 【Conclusion】Long-term application of rice-turtle co-culture can maintain the contents of soil main nutrients, increase the diversity of soil bacterial community, enlarge the relative abundance of dominant bacterial community, and make soil microenvironment more stable without chemical fertilizer.
Key words: rice-turtle co-culture system; soil; bacterial community structure; nutrient content
Foundation item: National Key Research and Development Program of China(2018YFD0301004)
0 引言
【研究意义】土壤微生物是土壤中重要的活性组分,影响土壤生态系统的养分转化、物质循环、肥力演变及土壤结构变化(李喆等,2010;陈懿等,2020)。土壤微生物能降解动植物残体、分解和利用有机物质,并以代谢产物和残留物等形式参与土壤养分转化过程,从而对生态系统产生影响(邵帅等,2017)。细菌占土壤微生物总量的70%~90%,是土壤微生物中数量最多的类群(周佳等,2020),对土壤结构、养分含量及植物生长发育等起到关键作用(Sims et al.,2013)。土壤细菌群落结构及其多样性受土壤类型、施肥和耕作管理等多种因素的影响(刘昌等,2018;袁仁文等,2020)。近年来,稻田综合种养因其显著的生态优势和经济效益得到较大范围推广,相关研究表明不同的稻田综合种养系统对土壤微生物多样性和群落结构的影响存在差异(周雪芳等,2016;罗衡等,2018)。因此,研究长期应用稻鳖共生模式对稻田土壤细菌群落结构及其多样性的影响,可为探究稻田生态种养对稻田土壤微生物的影响机制,改进稻田生态种养技术及合理利用稻田资源提供参考依据。【前人研究进展】随着稻田综合种养模式的推广应用,近几年对稻田综合种养的研究报道较多。沈建凯等(2010)对生态种养稻田杂草群落进行研究,结果表明生态种养可抑制稻田杂草,具有显著的控草效果,从而有效减少除草剂用量。张苗苗等(2010)对稻鸭共作模式土壤养分动态变化进行检测,结果发现在整个水稻生长期稻鸭共作田的土壤有机质、碱解氮、速效磷和速效钾含量维持在稳定状态,成熟期共生田的碱解氮、速效磷和速效钾含量远高于常规稻田。Liu等(2017)对稻鸭共生田和常规稻田进行土壤理化性质测定比较,结果表明稻鸭共生模式能增大土壤总孔隙度和非毛管孔隙度、提高土壤透气性和氧化还原电位。可见,稻田生态种养对水稻生长发育、稻田土壤肥力和稻田生态系统的可持续性等具有重要意义。在稻田综合种养系统土壤微生物研究方面,周雪芳等(2016)研究表明,稻蛙共作下土壤细菌、放线菌和真菌数量随着共生时间的延长而增加;罗衡等(2018)利用高通量测序技术对稻鳖共生模式下的土壤细菌群落进行分析,结果表明,与稻田单作相比,稻鳖共生稻田表层土壤的细菌群落结构产生明显变化,同时在一定程度上对水稻根系的菌群产生影响;廖咏梅等(2019)对比分析了稻鸭共育和常规管理两种模式下稻田土壤真菌及细菌的种群多样性差异,结果发现稻鸭共育模式的真菌种群结构较丰富,但两种模式的土壤细菌优势门和优势属无明显差异。【本研究切入点】目前,有关稻田综合种养模式的病虫草害、土壤养分、土壤酶活性、水稻产量、稻米品质、温室气体排放和经济效益等方面的研究已较详细(杨治平等,2004;李成芳等,2008;展茗等,2009;周江伟等,2017;常培恩等,2019),而针对稻鳖共生系统对土壤微生物群落的长期定位试验尚未见报道。【拟解决的关键问题】以稻鳖共生模式下2年、5年和8年的稻田为研究对象,采用高通量测序技术对表层土壤细菌群落特征进行分析,旨在探究不同年限稻鳖共生系统对稻田土壤养分含量、土壤细菌群落结构及多样性的影响,为阐释稻鳖共生模式对稻田土壤微生物多样性的影响机制提供科学依据。
1 材料与方法
1. 1 试验地概况
试验地点位于湖南省浏阳市达浒镇金石村孔蒲中家庭农场,该农场于2013年开始进行稻鳖生态种养,为本研究团队的长期定位试验点。试验地区年平均气温16~18 ℃,≥10 ℃年积温为5500 ℃,年均降水量约1350 mm,光、温、热资源充足。
1. 2 试验材料
供试水稻品种为农香32和玉针香,由湖南省水稻研究所提供;供试鳖品种为中华鳖(Pelodiscus sinensis),试验点农场自行孵育。
1. 3 试验方法
选取不同应用年限的稻鳖共生田作为研究对象,即试验设3个处理,分别为2年稻鳖共生田(RT2)、5年稻鳖共生田(RT5)和8年稻鳖共生田(RT8)。
围绕稻田内侧开挖宽约2.0 m、深约0.8 m的环形围沟,围沟总面积小于稻田面积的10%;进、排水装置采用PVC管,进水口设在高地势处,出水口設在低地势处,进出水口用纱网包裹;利用石棉瓦充当防逃板,搭建在稻田四周,将石棉瓦插入地面(30 cm以上),露出部分需高出地面1.5 m;孵化棚设在稻田边缘,约30个/ha。移栽前每公顷施入750~1500 kg生石灰对稻田进行消毒,围沟内移植少许轮叶黑藻、伊乐藻和浮萍(汤亚斌等,2014),稻田外围种植丝瓜以起遮荫作用。
所有共生田均为免耕一季稻栽培,全年不翻耕。每年4月投放体重4~10 g的鳖苗,密度为3000只/ha。每年5月投放鱼苗,四季不定期投放田螺以充当中华鳖的动物性饲料,除田螺和鱼苗外,还不定期投放动物内脏等进行补充喂养。使用三效底改和溴氯海茵粉对稻田进行消毒。每年6月移栽水稻,移栽方式为插秧与抛秧;移栽后一直保持较深的田间水位,在水稻收获前15 d将田间水位降低至稻区平面以下,使鳖回到围沟。每年10月收割水稻,收获后立即灌水高于田面30 cm以上,保持至下一季水稻种植前。全年不施用任何化肥和除草剂。
1. 4 测定项目及方法
1. 4. 1 土壤样品采集及处理 2020年5月25日在一季稻移栽前采集土样。在3个供试稻田中分别随机选取5个点,采集0~10 cm土层土壤,将5点采集的土样混合成1个样品,每个供试稻田取3次重复。每个样品在编号、去除杂质后充分混匀分成2份。一份以液氮速冻后尽快送回实验室冷冻保存,用于土壤微生物多样性分析;另一份用于土壤理化性质测定。
1. 4. 2 土壤理化性质测定 参考《土壤农化分析》(鲍士旦,2000)测定土壤理化性质。经浓硫酸消煮后用流动分析仪法测定土壤全氮和全磷含量,采用火焰光度法测定土壤全钾含量,采用钼锑抗比色法测定土壤速效磷含量,经醋酸铵浸提后用火焰光度计测定土壤速效钾含量,采用扩散法测定土壤碱解氮含量,采用重铬酸钾容量法—稀释热法测定有机质含量,采用pH仪测定土壤pH。
1. 4. 3 测序样品制备与检测 采用CTAB法进行样品总DNA提取,用1%琼脂糖凝胶电泳检测抽提的基因组DNA。PCR扩增和高通量测序委托北京奥维森基因科技有限公司进行。
1. 5 统计分析
利用SPSS 19.0和Excel 2010进行数据整理与分析,使用北京奥维森基因科技有限公司的奥维森云平台完成有效数据统计、OTU聚类分析、Alpha多样性分析(Chao1指数、Shannon指数和Simpson指数等)、物种组成分析及Beta多样性分析等。
2 结果与分析
2. 1 不同年限稻鳖共生田的土壤养分含量比较
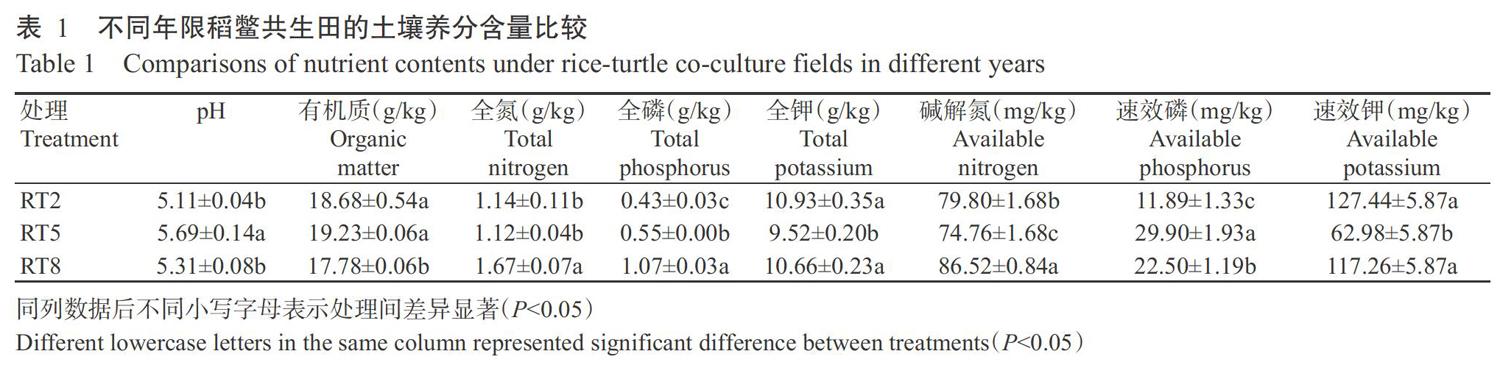
由表1可知,不同年限稻鳖共生田的土壤pH均小于6.00,为酸性土壤。随着共生年限的增加,稻田土壤pH呈先上升后下降的变化趋势,RT5处理的土壤pH最高,显著高于RT2和RT8处理(P<0.05,下同)。与RT2处理相比,RT5处理的土壤有机质、全磷和速效磷含量有所增加,其中全磷和速效磷含量差异显著;RT8处理的土壤全氮、全磷、碱解氮和速效磷含量均显著增加。随着稻鳖共作时间的延长,土壤有机质和速效磷含量先升高后降低,土壤全磷含量逐渐增加,全钾、碱解氮和速效钾含量先降低后升高。由此可知,土壤综合理化性质随稻鳖共生年限的增加发生了不同程度的变化,总体上延长稻鳖共生时间有助于提高土壤肥力,缓解土壤酸化。
2. 2 不同年限稻鳖共生田表层土壤的高通量测序结果
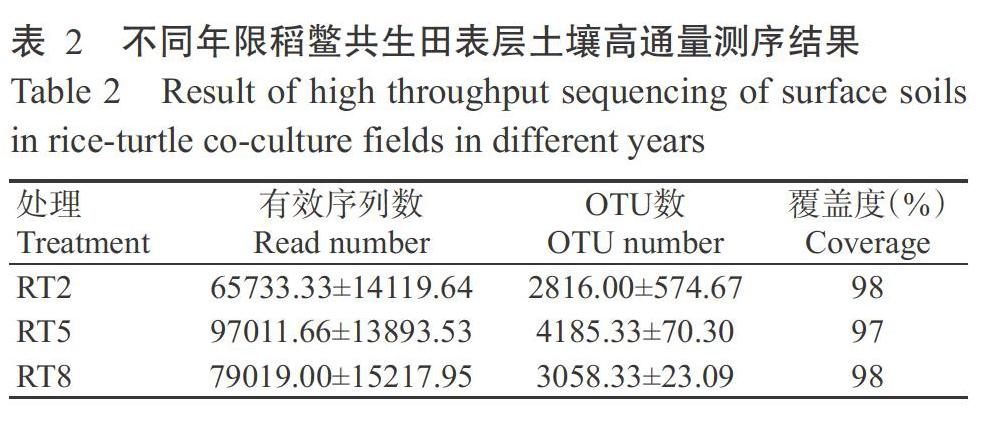
对不同年限共生田9个样品的土壤细菌V3~V4区进行高通量测序,结果(表2)表明,RT2、RT5和RT8处理平均获得65733.33、97011.66和79019.00个有效序列,片段长度集中在200~260 bp。采用Uparse聚类法共产生7028个OTUs,各处理平均OTU数依次为2816.00、4185.33和3058.33。对97%相似水平下的OTU进行生物信息统计分析后,可将细菌类群分为51门136纲192目337科557属113种。
2. 3 不同年限稻鳖共生田土壤细菌群落多样性分析结果
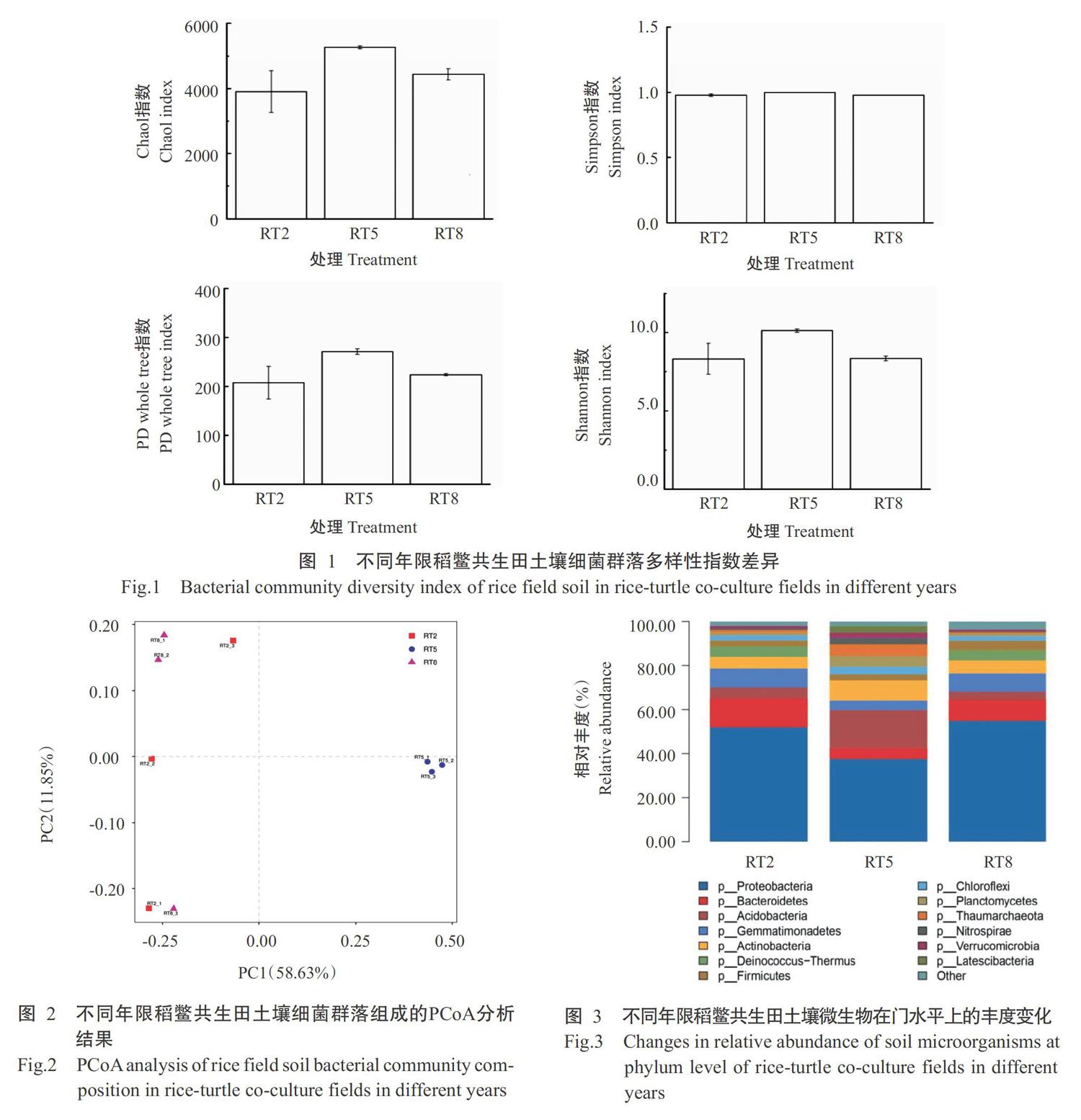
由图1可看出,不同年限稻鳖共生田土壤细菌群落的Simpson指数差异不明显,说明其土壤细菌多样性程度相近;Shannon指数、PD whole tree指数和Chao1指数均表现为RT5处理>RT8处理>RT2处理,即随着稻鳖共生年限的增加,土壤细菌群落多样性和菌种丰富度呈先升高后降低的变化趋势。
2. 4 不同年限稻鳖共生田土壤细菌群落相似度分析结果
PCoA分析常用于研究样本群落组成的相似性或差异性,样品的距离越近,代表群落组成结构的相似度越高。如图2所示,RT2和RT8处理的相对距离较近,而RT5处理与其余2个处理的相对距离较远,说明5年稻鳖共生田的土壤细菌群落组成结构与2年、8年稻鳖共生田的差异较明显,2年稻鳖共生田与8年稻鳖共生田的土壤群落结构相似度较高。
2. 5 不同年限稻鳖共生田土壤优势菌门分析结果
由图3可知,3个处理的土壤细菌群落物种构成较相似,其中RT2处理与RT8处理的相似度相对更高,但各细菌类群的相对丰度存在一定差异。3个处理的土壤细菌种群中相对丰度最高的均为变形菌门(Proteobacteria),在RT2、RT5和RT8处理中分别达52.00%、38.00%和55.00%,RT2处理的主要菌种(相对丰度排名前10位)依次为变形菌门、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、栖热菌门(Deinococcus-Thermus)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)和奇古菌门(Thaumarchaeota);RT5处理的主要菌种(相对丰度排名前10位)依次为变形菌门、酸桿菌门、放线菌门、奇古菌门、 浮霉菌门、拟杆菌门、芽单胞菌门、绿弯菌门、硝化螺旋菌门(Nitrospirae)和匿杆菌门(Latescibacteria);RT8处理的主要菌种前4位与RT2处理相同,随后依次为栖热菌门、厚壁菌门、酸杆菌门、绿弯菌门、浮霉菌门和互养菌门(Synergistetes)。
通过对相对丰度5.00%以上的菌种类群进行分析,稻鳖共生田土壤中变形菌门、拟杆菌门和芽单胞菌门的菌种随着稻鳖共生年限的增加而先减少后增加,放线菌门、酸杆菌门和奇古菌门的相对丰度则先增加后减少。其中,变形菌门和酸杆菌门的相对数量变化幅度最大,RT5处理的变形菌门较RT8处理减少17.4%,较RT2处理减少14.4%;酸杆菌门较RT8处理增加13.5%,较RT2处理增加12.3%。
如图3所示,3个处理的物种均匀度也有所差异。通过对各处理相对丰度排名前10位的菌种进行ANOVA分析,发现RT2处理除单芽胞菌门外,其余9个菌种的相对丰度均存在显著差异;RT5处理除奇古菌门等4种菌种外,其余6种菌种的相对丰度差异显著;RT8处理则仅在变形菌门、拟杆菌门、浮霉菌门和互养菌门4种菌种间具有显著差异。这可能是随着稻鳖共生年限的增长,土壤环境趋于稳定,适宜优势微生物生存,故菌种相对丰度逐步均匀化。
2. 6 不同年限稻鳖共生田土壤优势菌科分析结果
图4为科水平下土壤细菌群落相对丰度大于1.00%的菌种名,Other为相对丰度低于0.01%的物种总和,在分类学数据库中无对应科学名称的物种合并为unidentified。在科水平上,各处理间的土壤细菌群落结构组成及主要菌群相对丰度差异明显。RT2、RT5和RT8处理共有6个相同菌科,相对而言,RT2处理与RT8处理的群落组成相似度更高,有15个相同菌科。RT2和RT8处理中相对丰度最高的为黄单胞菌科(Xanthomonadaceae),分别为11.31%和8.01%,RT5处理的亚硝化单胞菌科(Nitrosomonadaceae)相对丰度最高,为4.29%。RT2、RT5和RT8处理中共有的优势菌群还有鞘脂单胞菌科(Sphingomonadaceae)、芽单胞菌科(Gemmatimonadaceae)、Blastocatella-ceae_Subgroup_4和Chitinophagacea。与RT2处理相比,RT8处理的细菌群落中黄单胞菌科和黄杆菌科的相对丰度明显减少,交替单胞菌科和产碱杆菌科的相对丰度则明显增加。
2. 7 不同年限稻鳖共生田土壤细菌LEfSe分析结果
为找到与长期稻鳖共生稻田相关的特定细菌菌种,采用LEfSe分析对样品进行处理以找出组间具有显著性差异的物种。如图5所示,从门到科的分类水平上有18个细菌进化支在统计学上有显著差异。与RT2和RT5处理相比,RT8处理中LEfSe检测到更多具有显著差异的细菌分类群,共11个进化支(1个纲、5个目、5个科),即Synergistia(纲到科)、Micrococcales(目到科)、Burkholderiales(目到科)、Alteromonadales(目到科)、Chromatiales(目到科)。
结合LDA分布柱状图(图6),将显著差异物种进一步细化到属分类水平并对比其影响力。结果表明,在RT8处理中Alteromonadales(目到属)的影响力最大,其次为Burkholderiales(目到科);RT5处理中env_ OPS_17的影响力最大,其次为Anaerolineae(纲到科);RT2中只有2个显著差异物种,影响力依次为Alphaproteobacteria_Incertae_Sedis(未分类)和Thermomonas。
3 讨论
3. 1 长期应用稻鳖共生系统对土壤养分的影响
土壤养分是影响水稻生长的关键因素,缺乏氮素会导致水稻生长缓慢,缺乏磷素则会影响水稻根系生长和花芽分化(王道涵和梁成华,2002)。在水稻生产过程中,通常会施用大量化肥以维持土壤养分供应,致使过剩的营养元素流失进入水体,造成水体富营养化及面源污染(Parry,1998)。本研究结果表明,长期应用稻鳖共生模式对土壤养分含量及pH产生了不同程度的影响,在不施用化肥的情况下,长期应用该模式能有效提高土壤全氮、碱解氮、全磷和速效磷等含量,维持土壤有机质含量,并在一定程度上提高土壤pH,缓解土壤酸化现象。其原因可能是鳖的排泄物和残余饲料为土壤增加养分,鳖的活动起到松土作用,增加了土壤透气性,从而促进营养物质的转化(蒋业林等,2015)。
3. 2 长期应用稻鳖共生系统对土壤微生物种群的影响
土壤微生物作为稻田土壤生态系统中最活跃的组成部分,其多样性和活性对稻田土壤环境发挥重要作用。在稻田综合种养系统中,养殖动物的摄食、排泄和日常活动有翻耕、松土及施肥等效果,可有效改善土壤的透气性和土壤养分,从而对土壤微生物产生影响(赵翔刚等,2017;赵静,2018;周江伟,2018;王强盛等,2019)。本研究结果表明,长期应用稻鳖共生模式可对土壤微生物种群结构、数量和种类产生影响,变形菌门、放线菌门、拟杆菌门和酸杆菌门为各处理共有的优势菌门,3个处理中相对丰度最高的种群均为变形菌门,其中又以8年稻鳖共生田的变形菌门相对丰度最高。已有研究显示,变形菌门以营养丰富的环境中居多,与土壤碳氮比呈负相关,可与其相关的土壤一起提高有机碳的吸收能力(乔沙沙等,2017)。Fierer等(2007)将土壤细菌分为贫营养细菌和富营养细菌,富营养细菌在氮、磷和有机物质含量较充足的环境中数量较多,贫营养细菌则反之。放线菌和酸杆菌被归类为贫营养菌群,在养分较高、质地相对优良的土壤中这2种菌门的相对丰度较低。对比本研究中各处理的酸杆菌门和放线菌门,结果发现这2种菌门均以8年稻鳖共生田的相对丰度最低,表明长期应用稻鳖共生系统,在不施化肥的情况下,通过鳖的排泄物和残饵可维持较高的土壤养分含量。王晶等(2020)关于土壤微生物与碳源代谢活性相关性的研究结果表明,黄单胞菌科与碳水化合物类、氨基酸类、羧酸类、胺类等碳源代谢活性呈显著正相关,亚硝化单胞菌科能促进多聚物类碳源代谢活性。在本研究的主要优势菌科中,黄单胞菌科、交替单胞菌科和亚硝化单胞菌科等为各处理的主要种群,说明稻鳖共生模式的应用在一定程度上提高了碳源代谢活性和微生物代谢功能。此外,在3个不同年限处理中,2年稻鳖共生田的黄单胞菌科相对丰度最高,表明稻鳖共生模式可能在应用初期对微生物代谢功能的影响更显著。
3. 3 长期应用稻鳖共生系统对土壤细菌群落多样性的影响
土壤微生物群落多样性主要对土壤肥力、土传病害、生态系统产出质量和产量产生影响,土壤微生物群落多样性越丰富,越有利于维持土壤环境的稳定,实现高效绿色生产(逄好胜,2016)。细菌是土壤微生物中数量最多、种类最丰富的类群,约占土壤微生物总量的90%。本研究对土壤细菌群落结构的检测结果显示,稻鳖共生田的微生物多样性丰富,各样本共涵盖了细菌类群51门、136纲、192目、337科、557属和113种;与2年稻鳖共生田相比,5年和8年稻鱉共生田的群落结构更复杂,种群多样性指数更高。其原因可能是鳖的排泄物及残饵等为土壤微生物的生长提供了充足养分,也带来了外源微生物,丰富了微生物多样性。群落相似度比较结果显示,8年稻鳖共生田的群落组成与2年稻鳖共生田相似度较高,究其原因可能是随着稻鳖共生模式应用时间的延长,土壤环境趋于稳定,部分外源微生物无法生存或进化,导致部分种群逐渐消失,多样性有所下降,进而逐步形成一个新的稳定的土壤细菌群落。
4 結论
8年稻鳖共生稻田的土壤全氮、全磷、碱解氮和速效磷含量显著高于2年稻鳖共生田,5年和8年稻鳖共生田的土壤细菌群落多样性和菌种丰富度也均高于2年稻鳖共生田。可见,长期应用稻鳖共生系统可在不施用化肥的情况下,维持土壤主要养分含量,增加稻田土壤细菌群落多样性,扩大优势菌群相对丰度,形成更稳定的土壤微环境。
参考文献:
鲍士旦. 2000. 土壤农化分析[M]. 第3版. 北京:中国农业出版社. [Bao S D. 2000. Agrochemical analysis of soil[M]. The 3rd Edition. Beijing:China Agriculture Press.]
常培恩,陈灿,黄璜,杨飞翔. 2019. 稻田养鳖对水稻产量形成及稻米品质的影响[J]. 作物研究,33(5):388-391. doi:10.16848/j.cnki.issn.1001-5280.2019.05.11. [Chang P E,Chen C,Huang H,Yang F X. 2019. Effects of raising turtle inpaddy on yield formation and rice quality[J]. Crop Research,33(5):388-391.]
陈懿,吴春,李彩斌,林叶春,程建中,潘文杰. 2020. 炭基肥对植烟黄壤细菌、真菌群落结构和多样性的影响[J]. 微生物学报,60(4):653-666. doi:10.13343/j.cnki.wsxb.2019 0258. [Chen Y,Wu C,Li C B,Lin Y C,Cheng J Z,Pan W J. 2020. Effect of biochar-based fertilizer on bacterial and fungal community composition, diversity in tobacco-planting yellow soil[J]. Acta Microbiologica Sinica,60(4):653-666.]
蒋业林,侯冠军,王永杰,张静,王士梅,陈红莲. 2015. 稻田养鳖生态系统构建与种养殖技术研究[J]. 安徽农学通报,21(20):94-95. doi:10.16377/j.cnki.issn1007-7731.2015. 20.042. [Jiang Y L,Hou G J,Wang Y J,Zhang J,Wang S M,Chen H L. 2015. Study on ecosystem construction and planting and breeding technology of rice paddy turtle[J]. Anhui Agricultural Science Bulletin,21(20):94-95.]
李成芳,曹凑贵,徐拥华,汪金平,展茗,杨学伟,庞海东. 2008. 稻鸭与稻鱼生态系统土壤微生物量N和土壤酶活性动态[J]. 生态学报,28(8):3905-3912. doi:10.3321/j.issn:1000-0933.2008.08.050. [Li C F,Cao C G,Xu Y H,Wang J P,Zhan M,Yang X W,Pang H D. 2008. Dynamics of soil microbial biomass N and soil enzymes activities in rice-duck and rice-fish ecosystems[J]. Acta Ecologica Sinica,28(8):3905-3912.]
李喆,元野,马力,唐庆明,邹莉. 2010. 不同轮作方式对牡丹江地区烟田土壤微生物数量及分布的影响[J]. 东北林业大学学报,38(7):96-99. doi:10.3969/j.issn.1000-5382. 2010.07.031. [Li Z,Yuan Y,Ma L,Tang Q M,Zou L. 2010. Effects of different rotations on the amount and distribution of soil microorganisms in Mudanjiang tobacco-cropping area[J]. Journal of Northeast Forestry University,38(7):96-99.]
廖咏梅,黄元腾吉,韩宁宁,凌展,邹承武,史鼎鼎,蒋代华. 2019. 稻鸭共育模式下水稻根际土壤真菌和细菌种群多样性分析[J]. 南方农业学报,50(1):65-73. doi:10.3969/j. issn.2095-1191.2019.01.09. [Liao Y M,Huang Y T J,Han N N,Ling Z,Zou C W,Shi D D,Jiang D H. 2019. Analysis of population diversity of fungi and bacteria in rice rhizosphere soil under rice-duck farming model[J]. Journal of Southern Agriculture,50(1):65-73.]
刘昌,黄莺,陈雪,喻奇伟,夏忠文,熊晶,谢志勇. 2018. 有机、无机肥配施比例对植烟土壤细菌组成及烤烟产质量的影响[J]. 河南农业科学,47(6):52-58. doi:10.15933/j.cnki.1004-3268.2018.06.010. [Liu C,HuangY,Chen X,Yu Q W,Xia Z W,Xiong J,Xie Z Y. 2018. Effects of proportion of organic and inorganic fertilizers on tobacco-planting soil bacteria composition,yield and quality of flue-cured tobacco[J]. Journal of Henan Agricultural Sciences,47(6):52-58.]
罗衡,赵良杰,李丰,郭海松,沈竑,刘其根. 2018. 养殖鳖的引入对稻田土壤细菌群落结构的影响[J]. 水产学报,42(5):720-732. doi:10.11964/jfc.20170310730. [Luo H,Zhao L J,Li F,Guo H S,Shen H,Liu Q G. 2018. Effects of the introduction of cultured turtle on soil bacterial community structure in paddy field[J]. Journal of Fishe-ries of China,42(5):720-732.]
逄好胜. 2016. 大兴安岭南坡植被退化对土壤微生物群落多样性的影响[D]. 哈尔滨:东北林业大学. [Peng H S. 2016. Effects of forest degradation on soil microbial diversity in southern slope of Daxingan Mountains[D]. Harbin:Northeast Forestry University.]
乔沙沙,周永娜,刘晋仙,景炬辉,贾彤,李毳,杨欣,柴宝峰. 2017. 关帝山针叶林土壤细菌群落结构特征[J]. 林业科学,53(2):89-99. doi:10.11707/j.1001-7488.20170211. [Qiao S S,Zhou Y N,Liu J X,Jin J H,Jia T,Li C,Yang X,Chai B F. 2017. Characteristics of soil bacterial community structure in coniferous forest of Guandi Mountains, Shanxi Province[J]. Scientia Silvae Sinicae,53(2):89-99.]
邵帅,何红波,张威,赵钰,张旭东. 2017. 土壤有机质形成与来源研究进展[J]. 吉林师范大学学报(自然科学版),38(1):126-130. doi:10.16862/j.cnki.issn1674-3873.2017.01. 023. [Shao S,He H B,Zhang W,Zhao Y,Zhang X D. 2017. Soil organic matter formation and origin:A review[J]. Journal of Jilin Normal University(Natural Science Edition),38(1):126-130.]
沈建凯,黄璜,傅志强,张亚,陈灿,金小马,廖晓兰,龙攀,高文娟,谢小婷. 2010. 规模化稻鸭生态种养对稻田杂草群落组成及物种多样性的影响[J]. 中国生态农业学报,18(1):123-128. doi:10.3724/SP.J.1011.2010.00123. [Shen J K,Huang H,Fu Z Q,Zhang Y,Chen C,Jin X M,Liao X L,Long P,Gao W J,Xie X T. 2010. Effects of large-scale rice-duck eco-farming on the composition anddiversity of weed communityin paddy fields[J]. Chinese Journal of Eco-Agriculture,18(1):123-128.]
湯亚斌,马达文,易翀,程咸立. 2014. 鳖虾鱼稻生态种养试验[J]. 中国水产,(1):54-56. doi:10.3969/j.issn.1002-6681. 2014.01.012.[Tang Y B,Ma D W,Yi C,Cheng X L. 2014. Ecological breeding test of turtle,shrimp,fish and rice[J]. China Fisheries,(1):54-56.]
王道涵,梁成华. 2002. 农业磷素流失途径及控制方法研究进展[J]. 土壤与环境,11(2):183-188. doi:10.3969/j.issn. 1674-5906.2002.02.016. [Wang D H,Liang C H. 2002. Transportation of agriculture phosphorus and control to reduce the phosphorus loss to water:A review[J]. soil and Environmental Sciences,11(2):183-188.]
王晶,马丽娟,龙泽华,闵伟,侯振安. 2020. 秸秆炭化还田对滴灌棉田土壤微生物代谢功能及细菌群落组成的影响[J]. 环境科学,41(1):420-429. doi:10.13227/j.hjkx. 201907183. [Wang J,Ma L J,Long Z H,Min W,Hou Z A. 2020. Effects of straw biochar on soil microbial metabolism and bacterial community composition in drip-irrigated cotton field[J]. Environmental Science,41(1):420-429.]
王强盛,王晓莹,杭玉浩,刘晓雪,李培花. 2019. 稻田综合种养结合模式及生态效应[J]. 中国农学通报,35(8):46-51. [Wang Q S,Wang X Y,Hang Y H,Liu X X,Li P H. 2019. Combination modes and ecological effects of plan-ting-breeding ecosystem in rice field[J]. Chinese Agricultural Science Bulletin,35(8):46-51.]
杨治平,刘小燕,黄璜,刘大志,胡立冬,苏伟,谭泗桥. 2004.稻田养鸭对稻鸭复合系统中病、虫、草害及蜘蛛的影响[J]. 生态学报,24(12):2756-2760. doi:10.3321/j.issn:1000-0933.2004.12.012. [Yang Z P,Liu X Y,Huang H,Liu D Z,Hu L D,Su W,Tan S Q. 2004. A study on the influence of rice-duck intergrowth on spider,rice diseases,insectand weeds in rice-duck complex ecosystem[J]. Acta Ecologica Sinica,24(12):2756-2760.]
袁仁文,刘琳,张蕊,范淑英. 2020. 植物根际分泌物与土壤微生物互作关系的机制研究进展[J]. 中国农学通报,36(2):26-35. [Yuan R W,Liu L,Zhang R,Fan S Y. 2020. The interaction mechanism between plant rhizosphere secretion and soil microbe:A review[J]. Chinese Agricultural Science Bulletin,36(2):26-35.]
展茗,曹凑贵,汪金平,李成芳,袁伟玲. 2009. 稻鸭复合系统的温室气体排放及其温室效应[J]. 环境科学学报,29(2):420-426. doi:10.13671/j.hjkxxb.2009.02.031. [Zhan M,Cao C G,Wang J P,Li C F,Yuan W L. 2009. Greenhouse gas emission from an integrated rice-duck system and its Global Warming Potentials(GWPs)[J]. Acta Scien-tiae Circumstantiae,29(2):420-426.]
张苗苗,宗良纲,谢桐洲. 2010. 有机稻鸭共作对土壤养分动态变化和经济效益的影响[J]. 中国生态农业学报,18(2):256-260. doi:10.3724/SP.J.1011.2010.00256. [Zhang M M,Zong L G,Xie T Z. 2010. Effect of organic rice-duck farming on the dynamics of soil nutrient and associa-ted economic benefits[J]. Chinese Journal of Eco-Agriculture,18(2):256-260.]
赵静. 2018. 鳖稻综合种养模式生态学效应及其机理研究[D]. 杭州:浙江大学. [Zhao J. 2018. Ecological effects and functional mechanism of Chinese softshell turtle(Pe-lodiscus sinensis)-rice co-culture system[D]. Hangzhou:Zhejiang University.]
赵翔刚,罗衡,刘其根,赵良杰,蔡林荣,戴亮亮,张真. 2017.稻田养殖沙塘鳢对稻田水体及底泥微生物群落結构及多样性的影响[J]. 淡水渔业,47(4):8-14. doi:10.13721/j.cnki.dsyy.2017.04.002. [Zhao X G,Luo H,Liu Q G,Zhao L J,Cai L R,Dai L L,Zhang Z. 2017. Influence of the cultured Odontobutis obscurus to the microbial community structure and diversity in rice-fish system[J]. Freshwater Fisheries,47(4):8-14.]
周佳,周灵芝,劳承英,申章佑,李艳英,胡泊,黄渝岚,韦本辉. 2020. 短期不同耕作方式对水稻根际土壤细菌群落结构多样性的影响[J]. 南方农业学报,51(10):2401-2411. doi:10.3969/j.issn.2095-1191.2020.10.011. [Zhou J,Zhou L Z,Lao C Y,Shen Z Y,Li Y Y,Hu B,Huang Y L,Wei B H. 2020. Effects of short term different tillage methods on the diversity of bacterial community in rice rhizosphere soils[J]. Journal of Southern Agriculture,51(10):2401-2411.]
周江伟,刘贵斌,陈灿,黄璜. 2017. 免耕“稻鳖鱼”共生模式的环境经济学分析[J]. 湖南农业科学,(8):98-102. doi:10.16498/j.cnki.hnnykx.2017.008.025. [Zhou J W,Liu G B,Chen C,Huang H. 2017. Environmental economics analysis of no-tillage rice turtle-fish symbiosis model[J]. Hunan Agricultural Sciences,(8):98-102. ]
周江伟. 2018. 稻鳖鱼共生系统环境经济效应及其作用机制研究[D]. 长沙:湖南农业大学. [Zhou J W. 2018. Environment economic effect and its mechanism of rice-turtle-fish symbiosis system[D]. Changsha:Hunan Agricultural University.]
周雪芳,朱晓伟,陈泽恺,朱梦迪,朱劝洁,莫亿伟,曾文涛,胡一鸿,罗文. 2016. 稻蛙生态种养对土壤微生物及无机磷含量的影响[J]. 核农学报,30(5):971-977. doi:10.11869/ j.issn.100-8551.2016.05.0971. [Zhou X F,Zhu X W,Chen Z K,Zhu M D,Zhu Q J,Mo Y W,Zeng W T,Hu Y H,Luo W. 2016. Effects of eco-planting and breeding of rice and frog on soil microorganisms and soluble phosphorus contents[J]. Journal of Nuclear Agricultural Scien-ces,30(5):971-977.
Fierer N,Bradford M A,Jackson R B. 2007. Toward an ecological classification of soil bacteria[J]. Ecology,88(6):1354-1364. doi:10.1890/05-1839.
Liu X,Xu G C,Wang Q S,Hang Y H. 2017. Effects of insect-proof net cultivation,rice-duck farming,and organic matter return on rice dry matter accumulation and nitrogen utilization[J]. Frontiers in Plant Science,8:47. doi:10.3389/ fpls.2017.00047.
Parry R. 1998. Agricultural phosphorus and water quality:A U.S. environmental protection agency perspective[J]. Journal of Environmental Quality,27(2):258-261.
Sims A,Zhang Y Y,Gajaraj S,Brown P B,Hu Z Q. 2013. Toward the development of microbial indicators for wetland assessment[J]. Water Research,47(5):1711-1725.doi:10.1016/j.watres.2013.01.023.
(責任编辑 王 晖)

