香蕉枯萎病菌对不同抗性香蕉品种根系抗氧化能力的影响
韦弟 韦莉萍 周维 覃柳燕 黄素梅 田丹丹 李朝生 龙盛风 何章飞 韦绍龙
摘要:【目的】明確抗枯萎病香蕉品种桂蕉9号、宝岛蕉和南天黄在枯萎病菌(Fusarium oxysporum f. sp. Cubense)侵染前后其根系抗氧化酶活性及抗氧化能力的变化趋势,为揭示香蕉品种对枯萎病的抗性机制提供理论依据。【方法】以荧光标记的尖孢镰刀菌(古巴专化型)4号生理小种菌株(Foc37-GFP)对不同抗性香蕉品种(桂蕉6号、桂蕉9号、宝岛蕉和南天黄)进行接种处理(孢子悬液浓度1.0×106 CFU/mL),分别于侵染第0~6 d取样检测不同香蕉品种根系超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)活性及超氧阴离子自由基(O[-2]·)清除率和总抗氧化能力等生理指标。【结果】经Foc37-GFP侵染后,桂蕉6号根系SOD、POD、CAT和PAL活性呈先上升后下降的变化趋势,至侵染第6 d,POD、CAT和PAL活性均极显著低于抗枯萎病香蕉品种(P<0.01,下同),SOD活性则极显著高于抗枯萎病香蕉品种;根系O[-2]·清除率表现为先上升后下降再上升,至侵染第6 d达最高值;总抗氧化能力前期变化不显著(P>0.05),至侵染第6 d则极显著低于3个抗枯萎病香蕉品种。经Foc37-GFP侵染后,宝岛蕉根系SOD和CAT活性及抗氧化能力呈先下降后上升再急速下降的变化趋势,POD活性先上升后下降,PAL活性和O[-2]·清除率则先上升后下降再上升;南天黄根系SOD活性变化趋势与宝岛蕉的一致,POD、CAT和PAL活性整体上呈先上升后下降的变化趋势,O[-2]·清除率呈上升趋势但变化幅度较小,总抗氧化能力先下降后保持在一定水平上;桂蕉9号根系SOD、POD和PAL活性及O[-2]·清除率均呈先下降后上升再下降的变化趋势,CAT活性先急速下降后急速上升,至第6 d达最高值并接近宝岛蕉的活性水平,但极显著高于南天黄和桂蕉6号,总抗氧化能力呈先上升后下降再上升的变化趋势,与SOD、POD和PAL活性及O[-2]·清除率的变化规律相反,且与宝岛蕉的相反。【结论】感枯萎病香蕉品种桂蕉6号根系抗氧化酶主要通过协同方式发挥抗氧化作用,抗枯萎病香蕉品种宝岛蕉、南天黄和桂蕉9号抗氧化酶主要通过互补方式发挥抗氧化作用;在枯萎病菌侵染期间,不同抗性香蕉品种根系中不同抗氧化酶发挥的主导作用各不相同,从而保持抗氧化酶系统的动态平衡。
关键词: 香蕉;枯萎病菌;根系;抗氧化酶;抗氧化能力
中图分类号: S436.681 文献标志码: A 文章编号:2095-1191(2021)07-1851-09
Effects of Fusarium oxysporum f. sp. cubense on antioxidant capacity in roots of different resistant banana varieties
WEI Di, WEI Li-ping, ZHOU Wei, QIN Liu-yan, HUANG Su-mei, TIAN Dan-dan,
LI Chao-sheng, LONG Sheng-feng, HE Zhang-fei, WEI Shao-long*
(Biotechnology Research Institute, Guangxi Academy of Agricultural Sciences/Guangxi Banana Branch of National Improvement Center for Tropical Fruit Variety/National Joint Engineering Research Center for Genetic
Improvement and Cultivation of Banana Varieties(Guangxi), Nanning 530007, China)
Abstract:【Objective】The change trends of antioxidant enzyme activities and antioxidant capacity in roots of different resistant banana varieties(Guijiao 9, Baodao and Nantianhuang) before and after Fusarium oxysporum f. sp. cubense race4(Foc4) infection were analyzed to lay a foundation for revealingthe resistance mechanism of different banana varie-ties onFusarium wilt. 【Method】The different resistant banana varieties viz., Guijiao 6, Guijiao 9, Baodao, and Nantianhuang were inoculated with the Foc4 strain Foc37-GFP (spore suspension concentration 1.0×106 CFU/mL) by using Foc37-GFP-solution culture method. The activities of superoxide dismutase(SOD), peroxidase(POD), catalase(CAT) and phenylalanine ammonialyase(PAL), superoxide anion(O[-2]·) clearancerate and antioxidant capacity in roots of diffe-rent varieties were detected during 0-6 days of inoculation. 【Result】After inoculatedby Foc37-GFP,the activities of SOD, POD, CAT and PAL in the roots of susceptible variety Guijiao 6 showed the change trend of increasing firstly and then decreasing; the POD, CAT and PAL activities were extremely lower than those of resistant varieties(P<0.01, the same below), while the SOD activity was extremely higher than other varieties on the 6th days. Root O2 clearance rate showed trend of rising, dropping and then rising, and reached the highest value on the 6th days; the total antioxidant capacity did not change significantly at early stage(P>0.05), and was extremely lower than the three resistant banana varieties on the 6th days. After Foc37-GFP infection, the activities of SOD, CAT and antioxidant capacity in root of Baodao banana decreased first, then increased and decreased rapidly;its POD activity increased first and then decreased, and PAL activity and O[-2]· scavenging rate showed a change trend of increasing, decreasing and increasing again. The change trend of SOD activity in roots of Nantianhuang was consistent with that of Baodao banana. On the whole, the activities of POD, CAT and PAL in rootof Nantianhuang increased first and then decreased. It found that O[-2]· scavenging rate increased with less change range, and total antioxidant capacity decreased first and then remained at a certain level. The activities of SOD, POD, PAL and O[-2]· scavenging rate of Guijiao 9 showed a change trend of first decreasing, increasing and decrea-sing;the activity of CAT decreased rapidly first and then increased rapidly, and reached the highest on the 6th day, which was close to the activity level of Baodao, but significantly higher than those of Nantianhuang and Guijiao 6. The total antioxidant capacity showed a change trend of first increasing, decreasing and increasing, which was opposite to the changes of SOD, POD and PAL activities and O[-2]· scavenging rate,and also opposite to those of Baodao. 【Conclusion】The antioxi-dant enzymes in root of susceptible variety Guijiao 6 mainly play an antioxidant role in a synergistic way, while the antio-xidant enzymes of resistant varieties Baodao,Nantianhuang and Guijiao 9 mainly play an antioxidant role through complementary ways. Different antioxidant enzymes in roots of different resistant banana varieties play different leading roles at different periods of Fusarium wilt infection, so as to maintain the dynamic balance of antioxidant enzyme system.
Key words: banana;Fusarium oxysporum f. sp. cubense; root; antioxidant enzyme; antioxidant capacity
Foundation item: National Key Research and Development Program of China(2019YFD1000903); Guangxi Innovation Driven Development Project(Guike AA18118028-2); Basic Scientific Research Project of Guangxi Academy of Agricultural Sciences(Guinongke 2020YM60); Guangxi Banana Innovation Team Construction Project of Modern Agricultural Industrial Technology System(nycytxgxcxtd-16-01)
0 引言
【研究意义】香蕉枯萎病是由尖孢镰刀菌古巴专化型(Fusarium oxysporum f. sp. cubense,Foc)侵染引起的毁灭性病害,是香蕉病害中危害最严重的一种土传性病害,具有发病迅速、蔓延快、危害严重及危害范围广等特点(周维等,2020),至今尚未探索出有效、彻底的枯萎病防治方法,而种植抗枯萎病香蕉品种仍是目前最有效的途径之一(Ploetz,2006,2015;Ghag et al.,2015;李华平等,2019)。在外部各种逆境胁迫条件下,植物已逐渐形成一套完整的保护机制。香蕉抗枯萎病是一个非常复杂的系统性问题,涉及寄主、病原、环境及植株体内的生理代谢和相互作用。当病原微生物入侵植物后,其生理生化发生一系列反应,其中抗氧化酶系统活性变化最活跃,与植物的抗病性反应密切相关(李赤等,2010)。抗氧化酶系统是香蕉响应枯萎病菌侵染的第一道重要防线,在香蕉抵御枯萎病菌侵染过程中发挥重要作用,也是评判香蕉品种抗性的重要依据。因此,在枯萎病菌侵染条件下系统研究不同抗性香蕉品种根系抗氧化酶及抗氧化能力的变化趋势,阐明不同抗性香蕉品种抗氧化酶对枯萎病菌侵染的响应规律,对揭示抗枯萎病香蕉品种的抗性生理机制具有重要意义。【前人研究进展】近年来,已有学者对抗氧化酶活性与各种作物病害间的相关性进行大量研究。周晓慧等(2007)研究发现,接种枯萎病菌后甜瓜植株的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性呈不同程度上升趋势,且抗病材料的SOD和CAT活性高于感病材料,POD活性变化与甜瓜蔓枯病抗性密切相关。姬万丽(2018)对不同倍性西瓜接种枯萎病菌,结果发现4倍体西瓜较2倍体西瓜幼苗根系细胞膜损伤程度低,且4倍体西瓜根系的POD和苯丙氨酸解氨酶(PAL)活性整体上高于其同源2倍体,故推测抗病相关酶活性的升高有利于抵抗枯萎病菌侵染。在香蕉方面,胡莉莉(2006)对5个不同抗性香蕉品种(系)60 d苗龄进行枯萎病菌接种,结果发现POD和PAL的活性变化与香蕉枯萎病菌抗性间存在密切联系,其中POD活性与香蕉品种(系)对枯萎病的抗性呈极显著正相关。李赤等(2010)研究表明,SOD活性与香蕉品种的抗/感枯萎病性能间呈负相关,而POD活性与香蕉品种的抗/感枯萎病性能间不存在相关性,并证实PAL、β-1,3-葡聚糖酶和外切几丁质酶可作为香蕉品种抗枯萎病一个重要的生物化学指标。韩树全(2014)对5个不同抗性香蕉品种与枯萎病菌互作过程中相关酶活性的变化规律进行研究,结果发现高、中抗性香蕉品种的POD活性有不同程度上升趋势,高抗香蕉品种金手指的POD活性显著高于感病香蕉品种。曾蕊等(2014)研究表明,在枯萎病菌的侵染过程中,粉蕉(ABB)和巴西蕉(AAA)的POD、SOD和PAL积极参与香蕉苗体内的抗病反应,而过氧化氢酶(CAT)活性变化与枯萎病菌的侵染无关。吴超等(2015)研究证实,粉杂一号和广粉一号假茎体内的CAT、POD和PPO活性变化可作为香蕉抗枯萎病的一项生理生化指标。张曼(2016)研究发现,宝岛蕉、南天黄和巴西蕉接种枯萎病菌0~15 d,其根系SOD活性均呈先下降后上升再下降再急速上升的变化趋势。董鲜等(2017)研究发现,巴西蕉接种枯萎病菌后其根系、假茎、叶片的PAL和POD活性均随病情的严重程度而不断提高。剧虹伶等(2017)研究表明,抗病香蕉品种的POD活性明显高于感病香蕉品种,且与PAL活性存在一定的相关性。【本研究切入点】目前,在广西种植的抗枯萎病香蕉品种主要有桂蕉9号、宝岛蕉和南天黄,其中桂蕉9号是广西首个自主选育的抗(耐)枯萎病香蕉品种(韦绍龙等,2016),在广西及其周边香蕉产区种植表现出适应性强、抗病性强、产量稳定及果品优良等优势,但有关桂蕉9号、宝岛蕉和南天黄等抗枯萎病香蕉品种抗氧化酶活性及其抗氧化能力的研究至今鲜见报道。【拟解决的关键问题】以感枯萎病品种桂蕉6号为对照,探讨抗枯萎病香蕉品种桂蕉9号、宝岛蕉和南天黄在枯萎病菌侵染前后其根系抗氧化酶活性及抗氧化能力的变化趋势,为揭示香蕉品种对枯萎病的抗性机制提供理论依据。
1 材料与方法
1. 1 试验材料
供试香蕉品种包括桂蕉6号(G6)、桂蕉9号(G9)、宝岛蕉(BD)和南天黄(NTH),均由广西农业科学院生物技术研究所提供,以5~7叶龄香蕉杯苗为试验材料。荧光标记的尖孢镰刀菌(古巴专化型)4号生理小种菌株(Foc37-GFP)由中國热带农业科学院环境与植物保护研究所张欣博士惠赠,-20 ℃保存备用。
1. 2 试验方法
1. 2. 1 病原菌培养与计数 在10 mL的PDA培养液中接入Foc37-GFP菌块(9 mm×9 mm),随后置于180 r/min、30 ℃的摇床上培养9 h,以获得培养母液。将培养获得的母液倒入500 mL的PDA培养液中,继续置于180 r/min、30 ℃的摇床上培养1~2 d。取10 mL菌液,以40 mL无菌水进行稀释,取1 mL稀释后的菌液,再加入9 mL无菌水进行稀释,摇晃均匀,采用血球计数板测定病原菌孢子含量 。孢子含量=每5格孢子总数/5×25×104×稀释倍数。依据计数获得的孢子含量最终稀释制备1.0×106 CFU/mL的孢子悬液,用于接种枯萎病菌处理。
1. 2. 2 枯萎病菌接种处理 根据杨腊英等(2015)的直接浇菌法,将塑料碗改为塑料盆后进行Foc37-GFP接种处理。具体方法:选取不同香蕉品種5~7叶龄杯苗(约高15 cm),洗净根系后分别置于塑料盆(长43 cm、宽30 cm、高21 cm)中,加入Foc37-GFP孢子悬液500 mL进行侵染,然后加入直径0.8~1.0 cm的陶粒以固定香蕉植株。每个品种接菌处理设3个重复,每个重复1盆,每盆种植13~15株苗。
1. 2. 3 根系取样 根据预试验荧光显微镜观察结果,确定病菌侵染0、2、4和6 d为根系取样时间。于Foc37-GFP接种培养0、2、4和6 d后,分别随机选取不同香蕉品种每个重复1~2株植株根系(白根或黑根),经自来水冲洗根表后以无菌水冲洗2次后,参照杨腊英等(2015)方法进行徒手切片并置于载玻片上,以奥特荧光显微镜(TP510)观察Foc37-GFP侵染香蕉根部组织情况。每个品种均以被Foc37-GFP浸染的植株根系为检测样品,每个重复取1~2株植株。将Foc37-GFP浸染植株的白根剪断,经自来水冲洗干净后分别以无菌水和PBS冲洗2次,置于干净毛巾上吸干水分后剪短,装入封口袋进行液氮速冻,-85 ℃保存,用于抗氧化酶等生理指标测定。
1. 2. 4 生理指标测定 香蕉根系样品各生理指标均采用苏州格锐思生物科技有限公司生产的试剂盒(微量法)进行测定。SOD活性采用超氧化物歧化酶(WST)法试剂盒(G0101W)进行测定,POD活性采用过氧化物酶试剂盒(G0107W)进行测定,CAT活性采用过氧化氢酶试剂盒(G0105W)进行测定,PAL活性采用苯丙氨酸解氨酶试剂盒(G0114W)进行测定,超氧阴离子自由基(O[-2]·)清除率采用超氧阴离子自由基清除能力试剂盒(G0129W)进行测定,总抗氧化能力采用总抗氧化能力(FRAP法)试剂盒(G0115W)进行测定。
1. 3 统计分析
试验数据采用Excel 2010和DPS(第4版)进行统计分析。
2 结果与分析
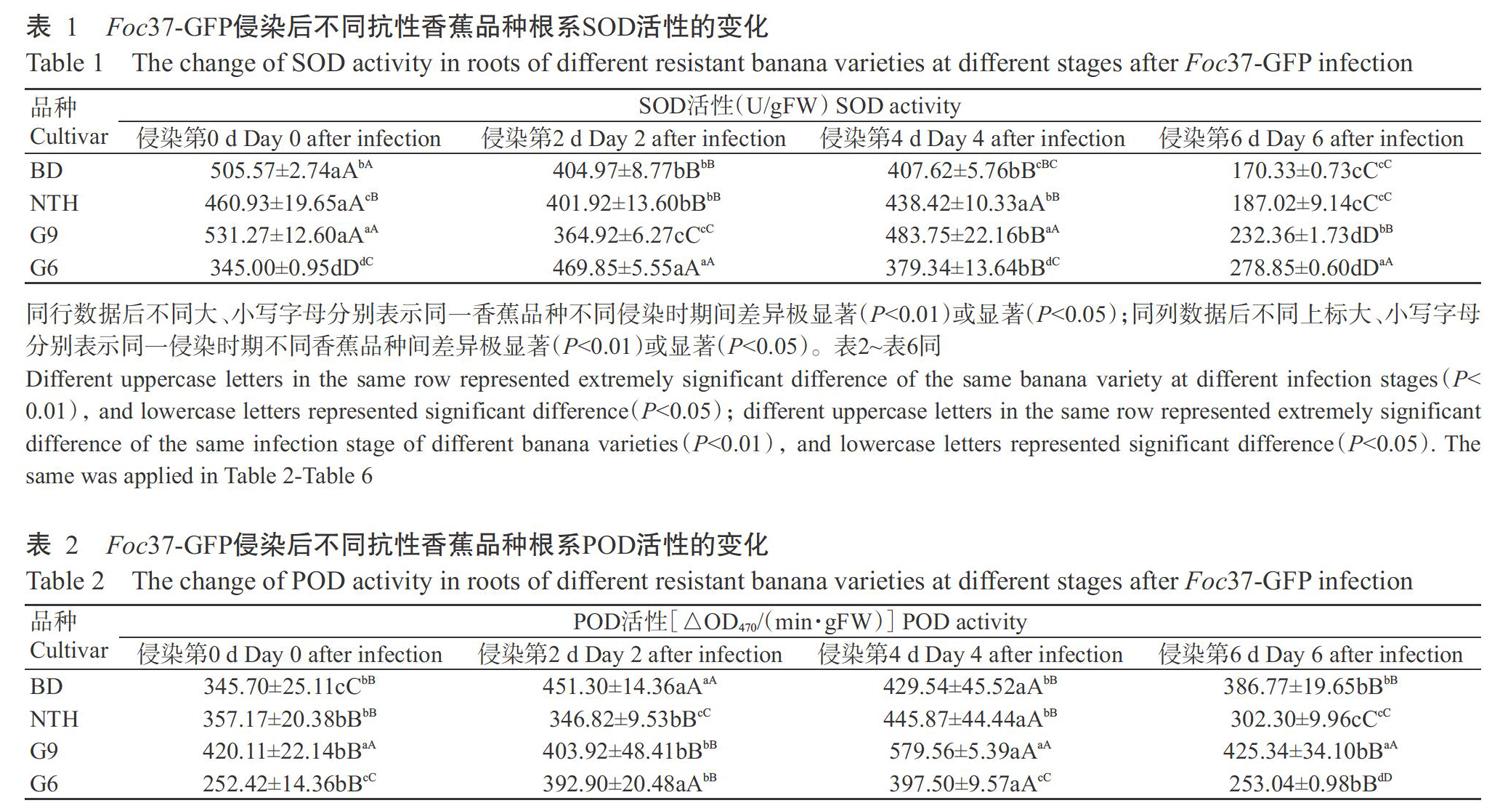
2. 1 不同抗性香蕉品种根系SOD活性差异
由表1可知,在Foc37-GFP侵染不同时期,桂蕉6号根系SOD活性呈先上升后下降的变化趋势,宝岛蕉、南天黄和桂蕉9号3个抗枯萎病香蕉品种的根系SOD活性变化趋势一致,均呈先下降后上升再急速下降的变化趋势。在Foc37-GFP侵染前,3个抗枯萎病香蕉品种的根系SOD活性均极显著高于感枯萎病香蕉品种桂蕉6号(P<0.01,下同)。至Foc37-GFP侵染2~6 d时,3个抗枯萎病香蕉品种的根系SOD活性均呈现不同程度的下降趋势,至侵染第6 d降至最低值;感枯萎病香蕉品种桂蕉6号根系SOD活性于侵染第2 d达最高值,随后呈直线下降趋势,至侵染第6 d其活性极显著高于宝岛蕉、南天黄和桂蕉9号3个抗枯萎病香蕉品种。在3个抗枯萎病香蕉品种中,桂蕉9号根系SOD活性在侵染第2 d极显著低于宝岛蕉和南天黄2个品种,而在侵染第4和6 d均极显著高于宝岛蕉和南天黄2个品种;宝岛蕉和南天黄的根系SOD活性在Foc37-GFP侵染后的变化趋势基本一致。
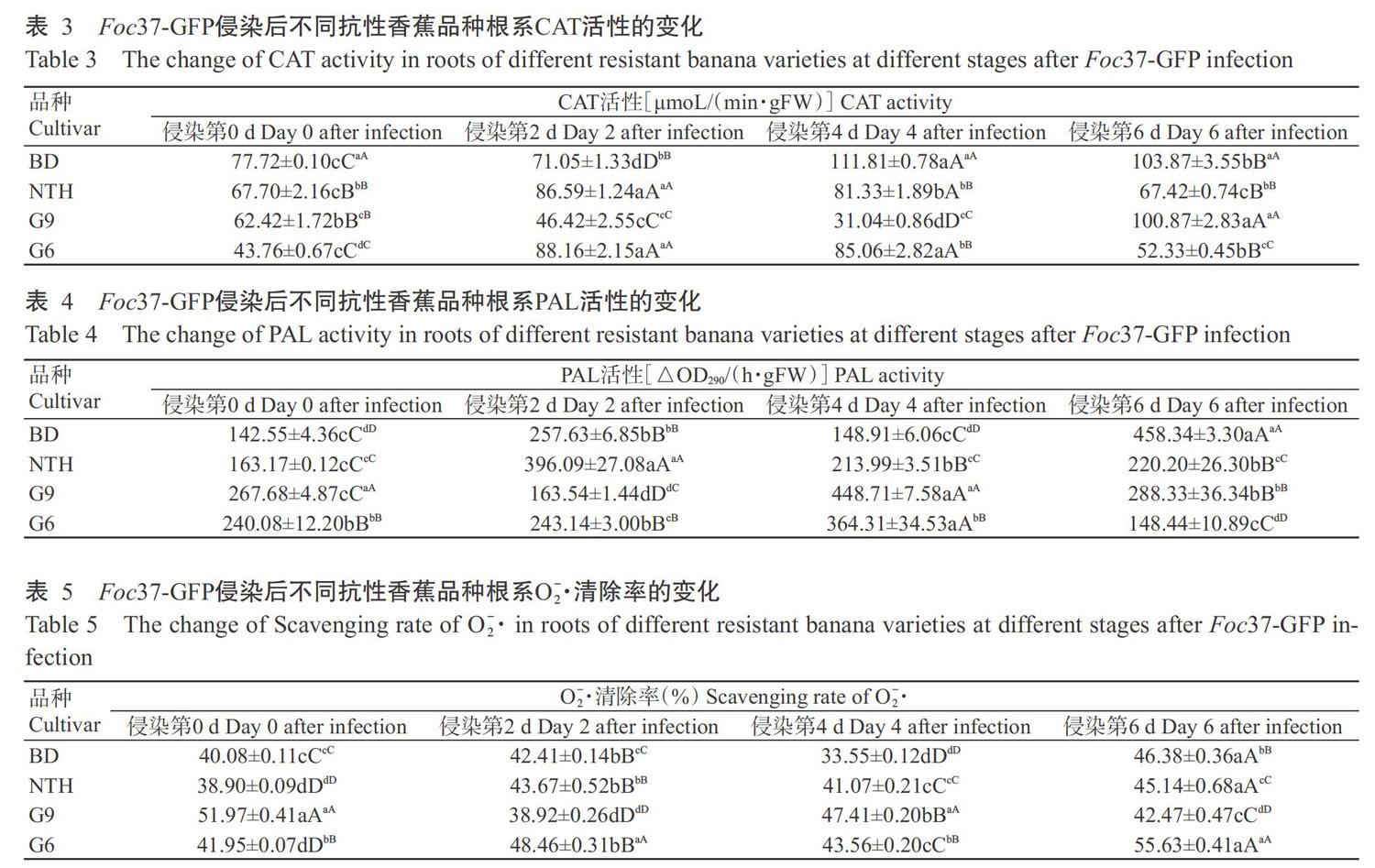
2. 2 不同抗性香蕉品种根系POD活性差异
由表2可知,Foc37-GFP侵染后宝岛蕉和桂蕉6号的根系POD活性均呈先上升后下降的变化趋势,至侵染第6 d,二者的POD活性均高于Foc37-GFP侵染前的水平;南天黄和桂蕉9号的根系POD活性则呈先下降后上升再下降的变化趋势,以侵染第4 d的POD活性最高,至侵染第6 d桂蕉9号根系POD活性略高于Foc37-GFP侵染前的水平,而南天黄根系POD活性极显著低于Foc37-GFP侵染前的水平。总体来看,4个香蕉品种中以桂蕉9号根系POD活性相对较高,其次为宝岛蕉和南天黄,而感枯萎病香蕉品种桂蕉6号根系POD活性相对较低。
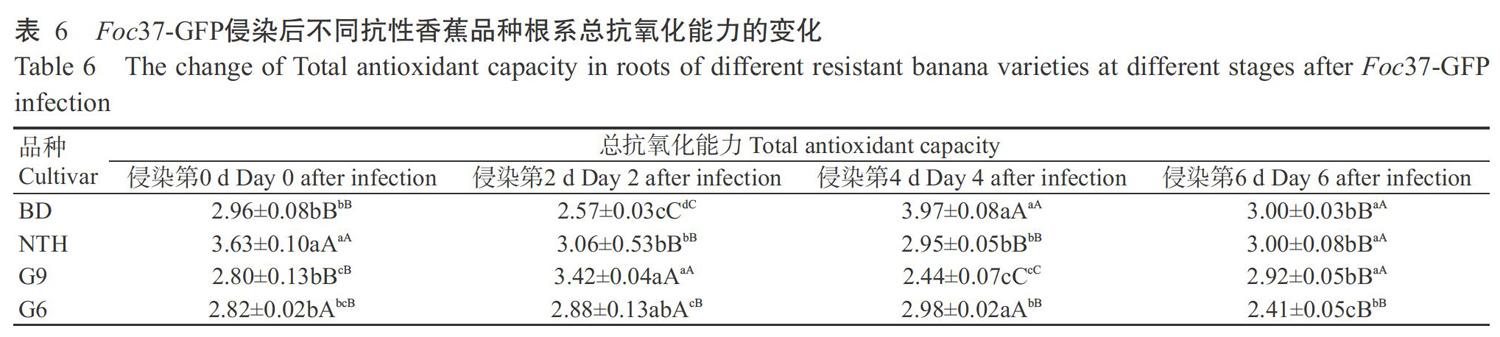
2. 3 不同抗性香蕉品种根系CAT活性差异
由表3可知,Foc37-GFP侵染后桂蕉6号和南天黄的根系CAT活性变化趋势相似,均呈先上升后逐渐下降并接近Foc37-GFP侵染前的水平,至侵染第6 d其CAT活性极显著低于宝岛蕉和桂蕉9号。Foc37-GFP侵染后,宝岛蕉根系CAT活性稍微下降后急剧上升,至侵染第4 d达最高水平,随后略有下降,但CAT活性仍极显著高于桂蕉6号和南天黄,与其SOD活性的变化趋势相似。Foc37-GFP侵染后,桂蕉9号根系CAT活性呈V形变化趋势,即先急速下降再急速上升,在侵染第4 d出现极低的CAT活性水平,至侵染第6 d又急速上升并接近宝岛蕉根系CAT活性水平,也极显著高于南天黄和桂蕉6号。总体来看,4个香蕉品种中以宝岛蕉根系CAT活性相对较高,其次为南天黄和桂蕉6号,而抗枯萎病香蕉品种桂蕉9号根系CAT活性相对较低。
2. 4 不同抗性香蕉品种根系PAL活性差异
由表4可知,Foc37-GFP侵染后桂蕉6号根系PAL活性呈先上升后下降的变化趋势,于侵染第4 d达最高值后急速下降,至侵染第6 d降至最低水平,极显著低于宝岛蕉、南天黄和桂蕉9号3个抗枯萎病香蕉品种,与其SOD、POD和CAT活性的变化趋势基本相似,但出现峰值的时间不同。在3个抗枯萎病香蕉品种中,宝岛蕉根系PAL活性呈先上升后下降再上升的变化趋势,于侵染第6 d达峰值,且极显著高于其他香蕉品种,与其SOD和CAT活性变化趋势相反;桂蕉9号根系PAL活性变化趋势与宝岛蕉恰好相反,于侵染第4 d达最高值,且极显著高于其他香蕉品种;南天黄根系PAL活性与宝岛蕉的变化趋势相似,且Foc37-GFP侵染后的PAL活性始终极显著高于Foc37-GFP侵染前的水平,与其SOD和POD活性变化趋势相反。
2. 5 不同抗性香蕉品种根系O[-2]·清除率差异
由表5可知,Foc37-GFP侵染后桂蕉9号根系O[-2]·清除率呈先下降后上升再下降的变化趋势,且极显著低于Foc37-GFP侵染前的水平,至侵染第6 d极显著低于其他香蕉品種。桂蕉6号、宝岛蕉和南天黄的根系O[-2]·清除率变化与桂蕉9号恰好相反,呈先上升后下降再上升的变化趋势,至侵染第6 d三者的根系O[-2]·清除率均达最高值,极显著高于Foc37-GFP侵染前的水平,且以桂蕉6号的最高。
2. 6 不同抗性香蕉品种根系总抗氧化能力差异
由表6可知,Foc37-GFP侵染后宝岛蕉根系总抗氧化能力呈先下降后上升再下降的变化趋势,侵染第4 d其总抗氧化能力达最高值,极显著高于其他3个香蕉品种,至侵染第6 d又降至接近Foc37-GFP侵染前的水平。桂蕉9号根系总抗氧化能力则表现出与宝岛蕉相反的变化趋势,呈先上升后下降再上升;至侵染第6 d其总抗氧化能力升高至Foc37-GFP侵染前的水平,与宝岛蕉和南天黄的根系总抗氧化能力无显著差异(P>0.05,下同)。Foc37-GFP侵染后,南天黄根系总抗氧化能力先下降后保持在一定水平上,无明显变化,至侵染第6 d其总抗氧化能力与宝岛蕉和桂蕉9号接近。桂蕉6号根系总抗氧化能力在Foc37-GFP侵染后4 d内无显著变化,但至侵染第6 d出现明显的下降趋势,极显著低于宝岛蕉、南天黄和桂蕉9号3个抗枯萎病香蕉品种。
3 讨论
3. 1 香蕉根系抗氧化系统酶活性对枯萎病菌侵染的响应
植物体内存在活性氧产生系统,同时存在相应的清除系统,二者在正常情况下维持动态平衡关系,SOD、POD和CAT是植物体内重要的抗氧化酶(陈雅婷等,2020;马鹏图等,2020)。SOD能将超氧化物催化分解为基态氧和H2O2,而POD和CAT通过催化H2O2转变成H2O,以解除H2O2的毒害作用。香蕉感染枯萎病后,其体内的SOD、POD和CAT活性变化受香蕉抗病性、品种特性及不同组织部位、枯萎病菌侵染时期等多种因素影响(胡莉莉,2006;曾蕊等,2014;吴超等,2015),其变化规律与枯萎病菌诱导及品种抗病性间的关系在不同香蕉品种、组织部位和测定时期也存在明显差异(李赤等,2010;张曼,2016)。本研究结果表明,在Foc37-GFP侵染期间,桂蕉6号根系SOD活性先急速上升,在侵染第2 d达最高值后不断下降,与巴西蕉假茎表现相似(曾蕊等,2014)。部分抗病植物出现高活性的SOD、POD和PPO,主要与清除自由基及形成抑菌的醌类物质有关;部分抗病植物出现较低的SOD和POD活性,则是为了积累活性氧,对病原微生物产生直接的杀伤作用,并促进细胞壁木质化和细胞壁结构蛋白聚合,形成第一道防卫屏障(陈利锋等,1997;潘汝谦等,1998)。庞学群等(2008)研究认为,具有较强抗病性的青香蕉及经抗病诱导提高的香蕉均表现出较低的SOD、POD和PPO活性,表明活性氧和酚类物质增加可能参与香蕉抗病性的形成机制。
受病原微生物侵染刺激后植物组织可产生活性氧自由基,故推测在枯萎病菌侵染时,感枯萎病香蕉品种桂蕉6号根系因未适应水培系统和病菌侵染,而产生大量活性氧自由基,亟需大量SOD清除过多的活性氧;随着病菌侵染时间的延长,以较低的SOD清除部分多余活性氧,并积累部分活性氧对病原微生物进行杀伤,阻止病菌的侵染扩散。宝岛蕉、南天黄和桂蕉9号3个抗枯萎病香蕉品种的根系SOD活性均呈先下降后上升再急速下降的变化趋势,与李赤等(2010)、曾蕊等(2014)、张曼(2016)的研究结果相似,但与胡莉莉(2006)的研究结果存在差异。在枯萎病侵染初期,3个抗枯萎病香蕉品种根系SOD活性均低于侵染前的水平,可能是抗枯萎病香蕉品种能以较低的SOD活性清除部分活性氧,并积累部分活性氧对枯萎病菌进行杀伤,而形成第一道防卫屏障;也可能是抗枯萎病香蕉品种较早启动自动调节体内抗氧化酶系统的动态平衡以适应水培环境并响应枯萎病菌诱导;当枯萎病菌侵染到香蕉根系内部后,3个抗枯萎病香蕉品种根系SOD活性上升,可能是超氧化物生成量开始增加,需更多的SOD来清除多余超氧化物。此外,3个抗枯萎病香蕉品种的根系SOD活性在侵染第4 d高于感枯萎病香蕉品种,但在侵染第2和6 d低于感枯萎病香蕉品种,故推测不同抗性香蕉品种清除超氧化物的机制不同,且抗氧化酶系统平衡能力及发挥作用时间点也存在差异。
本研究结果表明,Foc37-GFP侵染后,宝岛蕉和桂蕉6号的根系POD活性均呈先上升后下降的变化趋势,南天黄和桂蕉9号的根系POD活性则呈先下降后上升再下降的变化趋势,至侵染第6 d,宝岛蕉、桂蕉9号和桂蕉6等3个香蕉品种的根系POD活性均高于Foc37-GFP侵染前的水平,说明在菌液水培条件下,抗/感枯萎病香蕉品种的根系POD活性受Foc37-GFP直接诱导,可快速清除植株体内产生的多余活性氧和H2O2。4个香蕉品种中,以桂蕉9号根系POD活性相对较高,其次为宝岛蕉和南天黄,而桂蕉6号根系POD活性相对较低,说明根系POD活性与香蕉品种的抗病性密切相关。在Foc37-GFP侵染后,南天黄和桂蕉6号的根系CAT活性变化趋势相似,即先上升后逐渐下降并接近Foc37-GFP侵染前的水平,与在巴西假茎(曾蕊等,2014)上的研究相似。宝岛蕉根系CAT活性呈先稍微下降后急剧上升再略有下降;桂蕉9号根系CAT活性则呈先急剧下降后急剧上升的V形变化趋势,在侵染第4 d出现极低的CAT活性水平,随后在侵染第6 d急速上升并接近宝岛蕉根系CAT活性水平,极显著高于南天黄和桂蕉6号。
SOD、POD和CAT等抗氧化酶具有协调一致及共同作用的方式,能对植物体内的自由基和过氧化物进行有效清除,促使细胞抵御活性氧的伤害,保护细胞膜结构及其稳定性(黄雪梅等,2005;张成玲等,2020)。为了深入探究香蕉对枯萎病的生理抗性机制,不仅要对单个抗氧化酶活性变化与病菌侵染的关系进行分析,还应综合分析SOD、POD和CAT三者活性变化与病菌侵染的关系。本研究通过比较4个香蕉品种根系SOD、POD和CAT活性的变化趋势,结果发现桂蕉6号根系SOD、POD和CAT的活性变化趋势基本一致,宝岛蕉、桂蕉9号及南天黄的根系SOD、POD和CAT活性变化趋势则相反。因此,推测在枯萎病菌侵染6 d内,不同抗性香蕉品种根系SOD、POD和CAT可能以协同或互补的方式清除多余活性氧和H2O2,从而维持抗氧化系统的平衡状态。桂蕉6号根系的SOD、POD和CAT可能是以协同方式发挥清除作用,而宝岛蕉、桂蕉9号及南天黄根系的SOD、POD和CAT可能是以互补方式发挥清除作用。由于仅针对香蕉某组织部位的抗氧化酶与病菌侵染的关系进行研究,得出结果不足以从整体上揭示抗氧化酶与香蕉抗病性的关系,因此今后应系统分析香蕉根系、假茎和叶片抗氧化酶在香蕉响应枯萎病菌浸染的变化规律。
3. 2 香蕉根系PAL活性对枯萎病菌侵染的响应
植物本身拥有一套抵御病原微生物入侵的复杂防御机制,其中苯丙烷类代谢途径激活是许多植物产生的抗病反应之一。在苯丙烷类代谢途径中,PAL是催化产生植物次生代谢产物(木质素、植保素和黄酮等)的关键酶,与植物的抗病性密切相关。胡莉莉(2006)研究表明,随着香蕉苗龄的增加,金手指和威廉斯芽变的PAL活性呈先下降后上升的变化趋势,而耐枯萎病品种1282及2个感枯萎病品种(天宝和威廉斯)的PAL活性呈缓慢下降趋势。曾蕊等(2014)研究发现,接种枯萎病菌的粉蕉和巴西蕉其体内PAL活性均高于未接种枯萎病菌的对照香蕉苗。本研究结果表明,Foc37-GFP侵染后不同抗性香蕉品种根系PAL活性变化差异明显,其中,感枯萎病香蕉品种桂蕉6号的根系PAL活性呈先上升后下降的变化趋势,但在Foc37-GFP侵染初期上升幅度明显低于抗枯萎病品种宝岛蕉和南天黄;宝岛蕉和南天黄的根系PAL活性呈先上升后下降再上升的变化趋势,桂蕉9号根系PAL活性的变化则相反,呈先下降后上升再下降的变化趋势,于侵染第4 d达最高值,且极显著高于其他香蕉品种,与SOD活性变化趋势相似。可见,桂蕉9号根系PAL响应枯萎病菌侵染的时间点及作用与其他抗病品种有所不同,可能是苯丙烷类代谢途径的激活迟于其他香蕉品种,但具体机理有待进一步探究。
3. 3 香蕉根系O[-2]·清除率和总抗氧化能力对枯萎病菌侵染的响应
O[-2]·作为生物体代谢过程中产生的一种自由基,可攻击生物大分子,引起细胞结构及其功能的破坏,与机体衰老和病变有密切联系。O[-2]·是一种活性氧自由基,在细胞核中SOD能催化O[-2]·歧化为H2O2。生理条件下,生物体内O[-2]·的产生与清除处于平衡状态,若其处于非平衡状态则会导致组织损伤(汪承润等,2012)。在本研究中,Foc37-GFP侵染后,桂蕉9号根系O[-2]·清除率呈先下降后上升再下降的变化趋势,与其SOD活性的变化趋势相似;宝岛蕉根系O[-2]·清除率变化趋势与桂蕉6号相似,但其变化趋势与SOD和CAT活性相反;南天黄与桂蕉6号也呈相同的变化趋势,但变化幅度较小。在不同香蕉品种中,以桂蕉6号根系O[-2]·清除率较高,桂蕉9号的较低。因此,推测不同抗性香蕉品种体内产生O[-2]·的途径不同,对O[-2]·的清除机制也不同,不同抗氧化酶在清除O[-2]·过程中发挥作用不同。在Foc37-GFP侵染4 d内,桂蕉6号根系总抗氧化能力变化不显著,至侵染第6 d则呈极显著下降趋势,且极显著低于宝岛蕉、南天黄和桂蕉9号3个抗枯萎病香蕉品种,与POD和CAT活性变化趋势相似,说明随着枯萎病菌侵染时间的延长,桂蕉6号的抗氧化能力不断下降,POD、CAT和PAL在抗氧化过程中发挥主导作用。在枯萎病菌侵染前期,3个抗枯萎病香蕉品种的总抗氧化能力变化趋势各不相同,至侵染第6 d三者的抗氧化能力则无显著差异。由此推测,SOD、POD和CAT在抗氧化过程中发挥主要作用,而其他酶类如多酚氧化酶(PPO)、抗坏血酸氧化酶(AAO)可能也在抗氧化过程中发挥重要作用,但具体原因还有待进一步探究。
4 结论
枯萎病菌侵染对不同抗性香蕉品种根系抗氧化酶和抗氧化能力的影响存在明显差异。感枯萎病香蕉品种桂蕉6号根系抗氧化酶主要通过协同方式发挥抗氧化作用,抗枯萎病香蕉品种宝岛蕉、南天黄和桂蕉9号抗氧化酶主要通过互补方式发挥抗氧化作用;在枯萎病菌侵染期间,不同抗性香蕉品种根系中不同抗氧化酶发挥的主导作用各不相同,从而保持抗氧化酶系统的动态平衡。
参考文献:
陈利锋,宋玉立,徐雍皋,聂理,徐朗莱. 1997. 抗感赤霉病小麦品种超氧化物歧化酶和过氧化氢酶的活性比较[J]. 植物病理学报,27(3):209-213. doi:10.13926/j.cnki.apps.1997.03.004. [Chen L F,Song Y L,Xu Y G,Nie L,Xu L L. 1997. Comparison for activities of superoxide dismutase and catalase between scab-resistant and susceptible wheat varieties[J]. Acta Phytopathologica Sinica,27(3):209-213.]
陳雅婷,罗永忠,申海宁,惠雅佞. 2020. 新疆大叶苜蓿生物量及抗氧化酶类对土壤水分胁迫的响应[J]. 甘肃农业大学学报,55(4):128-136. doi:10.13432/j.cnki.jgsau.2020. 04.018. [Chen Y T,Luo Y Z,Shen H N,Hui Y N. 2020. Response of biomass and antioxidant enzyme activity of Medicago sativa cv. Xinjiang Daye to soil water stress[J]. Journal of Gansu Agricultural University,55(4):128-136.]
董鲜,马玉楠,马晓惠,李维蛟,徐福荣. 2017. 尖孢镰刀菌侵染下香蕉幼苗抗病生理响应研究[J]. 热带农业科学,37(5):56-62. doi:10.12008/j.issn.1009-2196.2017.05.011. [Dong X,Ma Y N,Ma X H,Li W J,Xu F R. 2017. Physiological resistance response of banana seedlings to Fusarium oxysporum[J]. Chinese Journal of Tropical Agri-culture,37(5):56-62.]
韩树全. 2014. 酚类物质抗香蕉枯萎病的作用机理[D]. 武汉:华中农业大学. doi:10.7666/d.Y2565496. [Han S Q. 2014. Mechanism of phenolics on resisting Fusarium wilt of banana[D]. Wuhan:Huazhong Agricultural University.]
胡莉莉. 2006. 香蕉抗枯萎病生理生化基础的研究[D]. 儋州:华南热带农业大学. [Hu L L. 2006. Studies on basic of physiological and biochemical resistance of banana to Fusarium wilt[D]. Danzhou:South China University of Tropical Agriculture.]
黄雪梅,张昭其,季作梁. 2005. 青香蕉和黄熟香蕉果皮感病过程中5种酶活性的变化[J]. 果树学报,22(6):662-666. doi:10.3969/j.issn.1009-9980.2005.06.014. [Huang X M,Zhang Z Q,Ji Z L. 2005. Activity changes of five enzymes in green maturing and yellow ripening banana fruit infected with Colletotrichum musae[J]. Journal of Fruit Science,22(6):662-666.]
姬万丽. 2018. 四倍体西瓜抗枯萎病生理小种1的机理研究[D]. 北京:中国农业科学. [Ji W L. 2018. Research on the mechanism of resistance to Fusarium oxysporum f. sp. niveum Race 1 in tetraploid watermelon[D]. Beijing:Chinese Academy of Agricultural Science.]
劇虹伶,张曼,阮云泽,赵艳,邓燕,尹黎燕,何朝族,王蓓蓓. 2017. 不同品种香蕉抗枯萎病效果及抗性生理研究[J]. 植物保护,43(2):82-87. doi:10.3969/j.issn.0529-1542. 2017.02.013. [Ju H L,Zhang M,Ruan Y Z,Zhao Y,Deng Y,Yin L Y,He C Z,Wang B B. 2017. The effects and mechanisms of different banana varieties to Fusarium wilt disease[J]. Plant Protection,43(2):82-87.]
李赤,黎永坚,于莉. 2010. 香蕉枯萎病菌对不同香蕉品种防御酶系的影响[J]. 中国农学通报,26(17):251-255. [Li C,Li Y J,Yu L. 2010. Effect of Fusarium oxysporum f. sp. cubense on the defensive enzymes of different banana varieties[J]. Chinese Agricultural Science Bulletin,26(17):251-255. ]
李华平,李云锋,聂燕芳. 2019. 香蕉枯萎病的发生及防控研究现状[J]. 华南农业大学学报,40(5):128-136. doi:10.7671/j.issn.1001-411X.201905062. [Li H P,Li Y F,Nie Y F. 2019. Research status of occurrence and control of Fusarium wilt of banana[J]. Journal of South China Agricultural University,40(5):128-136.]
马鹏图,苏世平,李毅,种培芳,后有丽,魏斌. 2020. 外源脯氨酸对自然干旱下白刺叶片渗透调节与抗氧化酶活性的影响[J]. 甘肃农业大学学报,55(4):121-127. doi:10. 13432/j.cnki.jgsau.2020.04.017. [Ma P T,Su S P,Li Y,Chong P F,Hou Y L,Wei B. 2020. Effects of exogenous proline on osmotic adj ustment and antioxidant enzymes in the leaves of Nitraria tangutorum under natural drought stress[J]. Journal of Gansu Agricultural University,55(4):121-127.]
潘汝谦,黄旭明,古希昕. 1998. 活性氧清除酶类在黄瓜感染霜霉病过程中的活性变化[J].植物病理学报,29(3):287-288. doi:10.13926/j.cnki.apps.1999.03.022. [Pan R Q,Huang X M,Gu X X. 1998. Activity change in active-oxygen scavenging enzymes in cucumber infected by downy mildew[J]. Acta Phytopathologica Sinica,29(3):287-288.]
庞学群,黄雪梅,李军,张昭其. 2008. 热水处理诱导香蕉采后抗病性及其对相关酶活性的影响[J]. 农业工程学报,24(2):221-225. doi:10.3321/j.issn:1002-6819.2008.02.041. [Pang X Q,Huang X M,Li J,Zhang Z Q. 2008. Hot water dipping induced resistance to disease Colletotrichum musae on banana fruits and its effect on related enzymes[J]. Transactions of the Chinese Society of Agricultural Engineering,24(2):221-225.]
汪承润,何梅,李月云,姜传军,田刘敏,王勤英. 2012. 植物体超氧阴离子自由基不同检测方法的比较[J]. 环境化学,31(5):726-730. [Wang C R,He M,Li Y Y,Jiang C J,Tian L M,Wang Q Y. 2012. Comparative study on diffe-rent detection methods of superoxide radicals in plant tissues[J]. Environmental Chemistry,31(5):726-730.]
韦绍龙,黄素梅,韦莉萍,韦弟,李朝生,覃柳燕,田丹丹,张进忠,周维,龙盛风,杨柳. 2016. 香蕉抗(耐)枯萎病新品种桂蕉9号的选育及其高产栽培技术[J]. 南方农业学报,47(4):530-536. doi:10.3969/j:issn.2095-1191.2016.04. 530. [Wei S L,Huang S M,Wei L P,Wei D,Li C S,Qin L Y,Tian D D,Zhang J Z,Zhou W,Long S F,Yang L. 2016. Breeding on new banana variety Guijiao 9 resistant or tolerant to Fusarium wilt (Fusarium oxysporum f. sp. Cubence,race 4) and its high-yield cultivation technologies[J]. Journal of Southern Agriculture,47(4):530-536.]
吴超,毕可可,黄华枝,何世庆. 2015. 香蕉枯萎病抗性防御酶的测定[J]. 安徽农业科学,43(3):107-109. doi:10.13989/ j.cnki. 0517-6611.2015.03.040. [Wu C,Bi K K,Huang H Z,He S Q. 2015. Analysis of defensive enzymes activities of banana Fusarium wilt[J]. Journal of Anhui Agricultural Sciences,43(3):107-109.]
杨腊英,刘磊,郭立佳,汪军,王国芬,黄俊生. 2015. 水培致病测定体系在Foc致病机理分析与香蕉品种抗性评价中的应用[J]. 植物保护学报,42(5):787-794. doi:10.13802/j.cnki.zwbhxb.2015.05.013. [Yang L Y,Liu L,Guo L J,Wang J,Wang G F,Huang J S. 2015. Application of the hydroponic virulence test system to pathogenic mechanism analysis of Fusarium oxysporum f. sp. cubense strains and resistance evaluation[J]. Acta Phytophylacica Sinica,42(5):787-794.]
曾蕊,陈琦光,禄璐,唐倩菲,周而勋. 2014. 香蕉与枯萎病菌4号小种互作过程中防御酶活性的变化[J]. 华中农业大学学报,33(2):61-64. doi:10.13300/j.cnki.hnlkxb.2014. 02.007. [Zeng R,Chen Q G,Lu L,Tang Q F,Zhou E X. 2014. Changes of defensive enzyme activities during the interactions of banana plantlets with Fusarium oxysporum f. sp. cubense race 4[J]. Journal of Huazhong Agricultural University,33(2):61-64.]
張成玲,孙厚俊,谢逸萍,杨冬静,马居奎. 2020. 甘薯黑斑病菌胁迫对不同甘薯品种抗氧化酶活性及MDA含量的影响[J]. 江西农业学报,32(9):64-67. doi:10.19386/j.cnki.jxnyxb.2020.09.12. [Zhang C L,Sun H J,Xie Y P,Yang D J,Ma J K. 2020. Effects of ceratocystis fimbriata stress on antioxidant enzyme activity and MDA content of diffe-rent sweetpotato varieties[J]. Acta Agriculturae Jiangxi,32(9):64-67.]
张曼. 2016. 抗香蕉枯萎病品种的抗性机理及对土壤微生物群落的影响[D]. 海口:海南大学. [Zhang M. 2016. The mechanism of disease-resistant varieties to banana Fusa-rium wilt disease and the effects on soil microbial community structure[D]. Haikou:Hainan University.]
周维,李佳林,黄素梅,覃柳燕,李朝生,田丹丹,龙盛风,黄曲燕,韦绍龙. 2020. 广西香蕉枯萎病发生现状及防控措施[J]. 福建农业科技,(5):46-50. doi:10.13651/j.cnki.fjnykj. 2020.05.008. [Zhou W,Li J L,Huang S M,Qin L Y,Li C S,Tian D D,Long S F,Huang Q Y,Wei S L. 2020. Occurrence status of banana wilt in Guangxi and its preven-tion and control measures[J]. Fujian Agricultural Science and Technology,(5):46-50.]
周晓慧,Joseph N. Wolukau,李英,陈劲枫. 2007. 甜瓜蔓枯病抗性与SOD、CAT和POD活性变化的关系[J]. 中国瓜菜,(2):4-6. doi:10.16861/j.cnki.zggc.2007.02.002. [Zhou X H,Wolukau J N,Li Y,Chen J F. 2007. Relationships between activity changes of superoxide dismutases,catalase,peroxidase and resistance to gummy stem blight in melon[J]. China Cucurbits and Vegetables,(2):4-6.]
Ghag S B,Shekhawat U K S,Ganapathi T R. 2015. Fusarium wilt of banana:Biology,epidemiology and management[J]. International Journal of Pest Management,61(3):250-263. doi:10.1080/09670874.2015.1043972.
Ploetz R C. 2006. Fusarium wilt of banana is caused by se-veral pathogens referred to as Fusarium oxysporum f. sp. cubense[J]. Phytopathology,96(6):653-656. doi:10.1094/ PHYTO-96-0653.
Ploetz R C. 2015. Fusarium wilt of banana[J]. Phytopathology,105(12):1512-1521. doi:10.1094/PHYTO-04-15-0101-RVW.
(责任编辑 兰宗宝)

