2017—2019年贵州省H3N2亚型流感病毒流行特征及NA基因遗传特性分析
郑勤妮,庄 丽,任丽娟,万永虎
流行性感冒(简称流感,Influenza)是由流行性感冒病毒(简称流感病毒,Influence virus)甲(A)、乙(B)和丙(C)3型流感病毒引起的急性呼吸道传染病[1]。流感病毒属正黏病毒科,单股负链、分节段的RNA病毒。具有传染性强、传播快、发病率高的特点。由于病毒极易发生变异,每年流感都会发生不同规模的流行,全球每年病死人数高达50万[2]。上世纪以来,先后引起4次全球流感大流行的均是甲型流感病毒,造成数千万人死亡和严重经济损失[3-5]。H3N2亚型流感病毒于1968年7月中旬首发于我国香港特区,并引起全球流感大流行,之后一直在人群中存在、流行并不断发生变异,甚至造成聚集性暴发疫情的发生[6]。NA基因的主要功能是切断流感病毒与宿主细胞之间的连接,利于子代病毒的释放,进而感染其他细胞,在流感病毒复制周期中扮演着重要角色[7]。在药物压力和进化选择压力作用下,NA基因的药物靶点可能发生氨基酸位点替换,引起抗原漂移,导致流感暴发或流行[8]。此外,抗原漂移也会对现用疫苗的免疫效果产生一定的影响。贵州省近年来H3N2亚型毒株出现频率较高,季节性流感流行以H3N2亚型流感病毒为优势型别。另外,仅由H3N2亚型流感病毒引起的暴发疫情就有30余起,给人群造成一定的健康威胁和经济损失。然而流感病毒的变异在人群中常表现为流感的流行和暴发,为了解2017—2019年贵州省H3N2亚型流感病毒流行特征和遗传变异情况,本研究对2017—2019年贵州省H3N2亚型流感的流行特征和NA基因遗传变异特征进行分析,以期为流感病毒的科学防控提供一定的理论基础。
1 材料与方法
1.1 标本采集 按全国流感监测方案,贵州省13家流感监测哨点医院发热门诊采集发病3 d内的ILI(体温≥38 ℃,伴咳嗽或咽痛之一)病人上呼吸道鼻咽拭子标本,4 ℃保存并48 h内送至流感网络实验室,不能在48 h内送到的置-70 ℃保存。
1.2 主要试剂和仪器 病毒核酸提取试剂盒(西安天隆DNA/RNA自动提取试剂盒)、核酸检测试剂(TakaRa ONE Step RNA PCR Kit)购自中山达安生物科技有限公司。MDCK细胞培养液(美国HYCLONE)、流感病毒培养分离液(北京友康恒业生物科技)、流感病毒血清学鉴定试剂盒(中疾控季流实验室提供)、ABI7500荧光定量PCR仪(美国ABI公司,器号:287880380)、32孔核酸自动提取仪(西安天隆)、生物安全柜(器号:130044040909)。PCR用琼脂糖购自北京东方荣盛生物科技有限公司,测序/引物合成送生工生物工程(上海)股份有限公司完成。
1.3 核酸提取和PCR检测 吸取200 μL咽拭子标本,按照西安天隆DNA/RNA自动提取试剂盒说明书,利用32孔核酸自动提取仪(西安天隆)自动提取纯化系统提取核酸。按照中山达安流感病毒核酸测定试剂盒的说明书,按PCR反应液A 17 μL,PCR反应液B 3 μL,待测样本核酸5 μL配置25 μL的反应体系,并设置好RT-PCR反应程序(50 ℃ 15 min,1个循环;95 ℃ 15 min,1个循环;94 ℃ 15 s, 55 ℃ 45 s 收集荧光,40个循环),在ABI7500荧光定量PCR仪上进行流感病毒的核酸检测及分型。H3N2亚型流感病毒的阳性标本进行后续实验。
1.4 H3N2亚型流感病毒的MDCK细胞分离及血清学鉴定 核酸检测为H3N2亚型流感病毒的阳性标本,取1 mL标本液接种于事先准备好的MDCK细胞上(MDCK细胞密度为长满培养瓶底90%左右,且细胞代次连续培养不超过20代),从第2 d起每天观察MDCK细胞病变情况,24 h内细胞病变的为非特异性,24 h以后的病变为特异性细胞病变。收集病毒培养液进行血清学鉴定。
1.5 序列测定及生物信息学分析 从核酸阳性流感样病例标本MDCK细胞分离的H3N2亚型流感毒株中随机选取21株H3N2亚型毒株,其中2017年度8株、2018年度2株及2019年度11株,提取病毒RNA,进行RT-PCR扩增H3N2亚型流感毒株的NA基因,扩增引物为:uNA-I-M13F:TGTAAAACGACGGCCAGTAGCAAAAGCAGGAG-T,N2-I-M13R:CAGGAAACAGCTATGACCC-GACATGCTGAGCACTYCCTGAC;N2-II-M13F:TGTAAAACGACGGCCAGTGAACTTGTRCAG-TRGTAATG,uNA-II-M13R:CAGGAAACAGCTATGACCAGTAGAAACAAGGAG。反应体系30 μL,其中PrimeScript 1 Step EnzymeMix 1.2 μL,2X1 Step Buffer 15 μL,上游引物和下游引物各1.2 μL,RNA 5 μL,RNase Free dH2O 6.4 μL;反应条件50 ℃ 30 min,1个循环;94 ℃ 2 min,1个循环;94 ℃ 30 s, 55 ℃ 30 s,72℃ 1 min,38个循环;72 ℃ 7 min,1个循环。扩增产物纯化后进行测序,用MEGA7.0软件和Clustal W2软件进行同源性、遗传进化和耐药位点分析。
2 结 果
2.1 2017—2019年贵州省H3N2亚型流感病毒流行特征 2017—2019年贵州省流感网络实验室共采集ILI 46 065份,全部进行RT-PCR检测,共检测出H3N2亚型流感病毒阳性标本2 096份,阳性率为4.55%。其中暴发疫情、不明原因肺炎、国家级哨点医院监测标本检出H3N2亚型流感病毒阳性标本分别为224、6和1 875份,分别占总阳性的10.69%、0.29%和89.46%。由此可见,不同监测周期H3N2亚型流感病毒阳性数主要来源于国家级哨点医院的检测标本,其次为暴发疫情来源。2017年H3N2亚型流感病毒阳性数为797例,阳性率为5.12%,而2018年流感流行期H3N2亚型流感阳性数急剧下降,阳性数为122例,阳性率降到0.8%,可能是人群接种了疫苗或因感染而产生H3N2亚型流感病毒抗体。但随着人群抗体效价的降低和病毒本身的变异,2019年H3N2亚型流感病毒感染阳性数又上升到1 177例,阳性率为7.66%(表1)。从图1中可以看出,H3N2亚型流感病毒在2018年活动明显减弱。2017—2019年监测中,H3N2亚型流感病毒具有明显的季节分布,主要在1-3月和10-12月份较为活跃,这与全国H3N2亚型流感病毒的流行相吻合,2017年7-9月份出现H3N2亚型流感病毒流行小高峰,这可能与贵州省独特的地理气候或病毒变异有关。
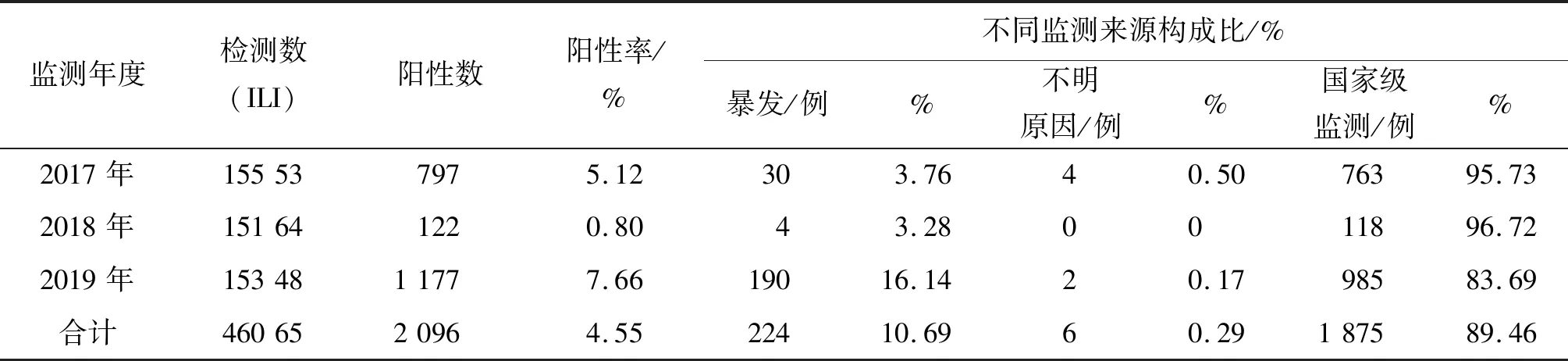
表1 2017—2019年贵州省H3N2亚型流感病毒监测情况Tab.1 Surveillance of H3N2 subtype influenza viruses in Guizhou Province from 2017 to 2019
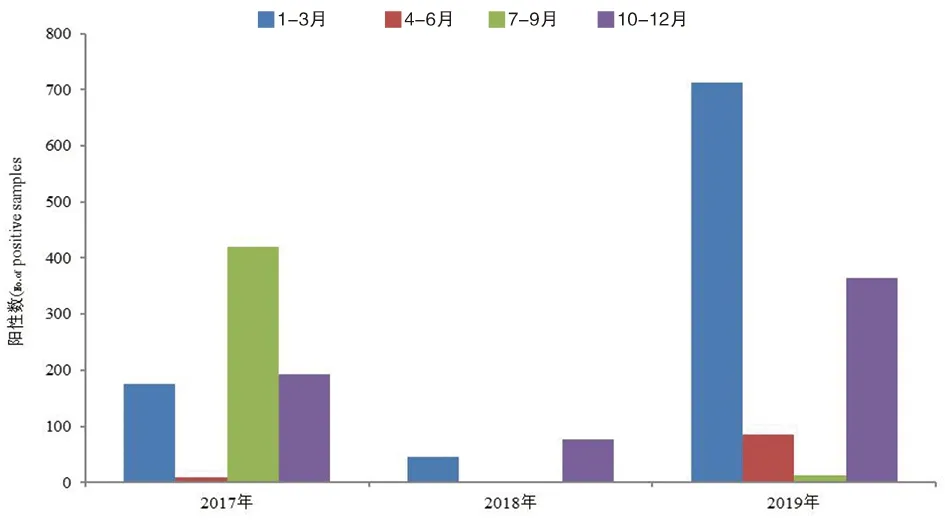
图1 2012—2019年贵州省H3N2亚型流感病毒时间分布Fig.1 Phylogenic tree of the H3N2 virus NA gene in Guizhou Province, 2017-2019
2.2 2017—2019年贵州省H3N2亚型流感病毒NA基因分子特征
2.2.1 2017—2019年H3N2亚型流感病毒NA基因同源性分析 2017—2019年贵州省H3N2亚型NA基因核苷酸同源性为97.5%~100%;其中2017年H3N2毒株之间同源性为97.9%~99.6%,2018年为98.2%,2019年98.7%~100%,可见2017年H3N2毒株之间差距较大;2017年与2018年同源性为97.4%~99.5%,2017年与2019年同源性为97.4%~99.2%,2018年与2019年同源性为98.2%~99.9%,提示随着时间的延长,变异在不断的积累,毒株之间差距逐渐增大;贵州省所有毒株与2017年WHO推荐的疫苗株相比同源性为97.7%~98.4%,与2018年推荐的疫苗株的同源性为98.4%~99.5%,与2019年推荐的疫苗株的同源性为97.7%~98.9%,可见贵州省H3N2毒株与2018年推荐的疫苗株的同源性最高,匹配性可能更好,提示对于我省而言,不一定最新的疫苗株保护效果就最好(表2)。

表2 2017—2019年贵州省H3N2亚型流感病毒NA基因核苷酸同源性分析Tab.2 Nucleotide homology analysis of the NA gene of H3N2 subtype influenza virus from 2017 to 2019 in Guizhou Province
2.2.2 2017—2019年H3N2亚型流感病毒NA基因遗传进化分析 对2017—2019年贵州省21株H3N2亚型流感病毒的NA基因核苷酸序列构建遗传进化树,结果显示贵州省21株H3N2亚型流感病毒主要分为2大分支(图2)。2017年遵义市、安顺西秀区、黔西南州兴义和贵阳市南明区部分毒株聚集为一个大分支,与福建省分离的毒株遗传距离最短,亲缘关系最近,2017年贵阳市南明区部分毒株、黔南州都匀、六盘水市钟山区的毒株和2018年与2019年所有毒株处于另一个大分支上,且随着时间的推移在不断地朝着远端进化;2018年的毒株遗传距离相差较远;2019年的毒株聚为2簇,分别处于2个小分支,处于进化的最顶端,提示2018年和2019年的毒株可能就由2017年的这部分毒株遗传演化而来,也提示2017年H3N2毒株可能发生了较大程度的变异,且部分毒株没有演化流行下来。2017—2019年WHO推荐的疫苗株也处于后面一个大分支,但是当年度推荐的疫苗株与流行株遗传距离相对较远,保护效果可能不佳,且随着时间的推移,毒株遗传演变的增快,应及时更新更加匹配的疫苗株或根据我国或是南方省份来推荐更加合适的疫苗株。

●代表疫苗株;△代表贵州省2017年的毒株;□代表贵州省2018年的毒株;◇代表贵州省2019年的毒株。图2 2017—2019年贵州省H3亚型流感病毒NA基因遗传进化分析Fig.2 Phylogenetic tree of the H3N2 virus NA gene in Guizhou Province, 2017-2019
2.2.3 2017—2019年H3N2亚型流感病毒NA基因耐药分子位点分析 NA 蛋白E119V、Q136K、D151A、I222V、H274Y、R292K、N294S共7个位点的突变可导致神经氨酸酶抑制剂类药物的耐药,贵州省所测定的毒株均未在上述位点发生突变,提示贵州省H3N2毒株对神经氨酸酶抑制剂仍然敏感。
3 讨 论
流感病毒2个主要的表面蛋白血凝素(HA)和神经氨酸酶(NA)可识别靶细胞受体并与受体结合,具有与宿主细胞融合的活性,并能诱导产生保护性中和抗体[1]。H3N2亚型流感病毒基因包括8个基因片段,NA是由第6个片段所编码,其作用是切断流感病毒与宿主细胞之间的连接[9]。NA基因发生变异,能引起抗原漂移,从而导致流感的局部流行[10]。NA具有酶活性,这种活性对病毒脱离宿主细胞,释放子代病毒感染其他细胞起到重要的作用[8,11]。NA诱导产生的抗体能提供保护作用,同时针对NA酶活性的抑制可以作为治疗流感病毒的药物使用。免疫选择压力的强弱对流感病毒变异快慢起到一定的作用,在人群免疫压力和病毒自身的变异下,NA易发生抗原漂移,引起病毒抗原性的改变,使以往人群在流感病毒感染后机体内所产生的特异性抗体,不能阻止新病毒的侵入,从而引起流感的暴发或流行[12-14]。另外环境因素也与流感的变异以及流行趋势密切相关。潮湿低温的气候季节适合流感病毒的存活和传播[15]。2017年贵州省H3N2亚型流感病毒阳性率为5.12%,然而2018年急剧下降到0.8%,2019年阳性率又急剧上升为7.66%,这可能是因为人群接种疫苗或因感染而产生H3N2亚型流感病毒抗体,随着人群抗体效价的减弱而后又易感染导致的结果。另外,2017年7-9月份出现H3N2亚型流感病毒流行小高峰,这可能与贵州省低温阴雨绵绵的气候及病毒变异有关。时间分布方面,2017—2019年贵州省H3N2亚型流感病毒主要分布在春冬两季,这与全国相一致[16]。
2017—2019年贵州省H3N2亚型NA基因核苷酸同源性为97.5%~100%,随着时间的延长,变异的不断积累,毒株之间差距逐渐增大。贵州省所有毒株与WHO 2018年推荐的疫苗株的同源性最高,匹配性更好,说明最新推荐的疫苗株保护效果不一定最好。NA基因的系统进化树表明,2017—2019年21株H3N2亚型流感病毒主要分为2大分支,2017年的部分毒株与福建省分离的毒株遗传距离最短,亲缘关系最近;而2017年部分毒株和2018—2019年所有毒株处于另一个大分支上,且随着时间的推移在不断地朝着远端进化。2018年的毒株遗传距离相差较远,2019年的毒株聚为2簇,处于进化的最顶端。说明2018—2019年的毒株可能就由2017年的这部分毒株遗传演化而来,也说明2017年H3N2毒株可能发生了较大程度的变异,且部分毒株没有演化流行下来,这可能也是2017年全年均有流行的部分原因。当然对于流感病毒的流行原因不仅仅局限于NA基因,HA基因和其他内部基因可能对病毒致病力、毒力和传播能力方面也能产生一定的影响[9,17],导致病毒流行的原因是一个综合的结果,有必要在其他基因方面做进一步的研究。但整体上,密切关注H3N2流感病毒的基因变异,对预测H3N2亚型流感病毒的流行具有重要的意义。

