艾滋病患者精液和血液中HIV释放和序列差异的研究进展
陆珍珍,蓝光华,张景云,林 玫
艾滋病是由HIV感染引起的免疫缺陷综合征。近年来的研究报告显示,全球新发艾滋病患者大多数通过性传播途径感染HIV所致[1],男男性行为者(man who has sex with man, MSM)的感染数也迅猛增加[2]。精液传播是MSM感染HIV的主要传播途径[3],因此精液中HIV的特性与病毒传播特征相关,但是精液与血液中HIV并不完全相同,本文从精液和血液中HIV的释放、病毒序列差异、产生差异的机制这几方面进行综述。
1 HIV在精液和血液中的病毒释放差异
“病毒释放”指HIV载量在检测限以上,即“病毒可测得到”。近年来较多研究报道,即使经高效抗反转录病毒治疗(highly active antiretroviral therapy, HAART)成功抑制了血液中HIV的感染者,其精液中仍然存在HIV释放,但是这个“释放”国际研究报道差异较大。在国外研究中,当血液中HIV抑制到检测不到的水平时,精液中HIV释放率为1.8%~48.0%,HIV载量在80~16 026 copies/ml,大部分报道均>200 copies/ml[4-6]。这些报道中HIV感染者精液中影响病毒释放的因素也各不相同:合并性传播疾病,如非淋菌性尿道炎、细菌感染[7-8];生殖系统中较低的抗病毒药物浓度[9-10];血液中潜伏HIV DNA的浓度及吸毒[11];合并巨细胞病毒感染[12]及异常的免疫T细胞激活状态[13],并且发现精液中的HIV有间断释放的规律[14]。
当血液中HIV载量<200 copies/ml,可以认为HIV通过感染者传给性伴侣的可能性极低或可忽略不计,即“undetectable=untransmited(U=U)[15]”。虽然在外周血中病毒载量降低的情况下,精液中的病毒载量也会降低,但仍存在部分患者的精液中病毒载量高于外周血,了解精液和血液HIV毒株不一致的机制对艾滋病的预防和治疗都具有一定的意义。由于艾滋病治疗的病毒学反应与HIV毒株的亚型相关[16],也与抗病毒治疗用药方案相关[10],针对我国的药物资源和病毒亚型,国内也开展了一些这方面研究。
北京一项纳入19例HIV感染的MSM的研究发现,HAART 6个月后,当大部分(17/19)感染者血液中的HIV得到抑制时,还有大部分(16/19)患者的精液中可以检测到HIV,病毒载量在306~60 500 copies/ml之间[17]。广州的一项研究发现,20例外周血HIV得到抑制的男性HIV感染者中有2例精液中HIV仍可测到,病毒载量分别为47 copies/ml、221 copies/ml[18]。浙江研究发现当54例HIV感染者外周血中病毒抑制到检测不到水平的时候,有3例精液中仍可以检测到HIV,病毒载量为20.4~7470.0 copies/ml[19]。广西一项纳入48例有男男性行为的艾滋病患者的研究发现,当HAART≥18个月,且在没有合并其他性传播疾病时,48例患者的精液与血液中均测不到HIV(病毒载量<50 copies/ml)[20]。广州、浙江和广西进行的研究都发现这些成功进行HAART的艾滋病患者,治疗后其精液中HIV释放率不高,这与泰国的研究结果相一致[21],而且绝大多数患者的病毒载量<200 copies /ml,此种情况下可以认为HIV通过性传播途径传给阴性伴侣的几率低[15]。
不同地区、不同研究中HIV在精液和血液中释放的差异,可能与不同HIV亚型病毒学反应[16]、抗病毒治疗方案[22]、抗病毒时间长短[14]、不同种族[23]等有关,需要更多的研究加以证实。
2 精液和血液中HIV的序列差异
对来自世界不同地区共纳入142例男性HIV感染者的13个独立研究数据进行总结显示,61.3%感染者的精液与血液中HIV毒株不同[24]。这些研究都是通过扩增HIV 膜区即env区的V1~V5段或env区全长进行精液和血液毒株的比较。Env区代表毒株的传播能力,其中的CXCR4或CCR5辅助受体使用代表病毒的嗜性和致病能力,CXCR4嗜性的病毒致病性更强,但是env区变异程度较大。国内报道HAART前不同HIV亚型对辅助受体CXCR4和CCR5的使用差异较大,HAART之后所有毒株均变成使用CCR5辅助受体,精液和血液中均测不到CXCR4的使用[20,25]。
对HIV序列稳定的pol区研究发现,血液中HIV毒株序列有无耐药突变不能完全代表生殖道中HIV耐药情况。美国2014年一项包含14个治疗点的多中心研究纳入的143例艾滋病患者血浆中HIV载量均>2000 copies/ml,其中20%男性和24%女性患者的生殖道中HIV载量明显高于血液中病毒载量,收集血浆和生殖道/唾液样本进行核酸扩增,部分患者样本扩增失败,最后男性63例,女性83例获得匹配样本结果,分析发现:生殖道中和血液中HIV释放不一致患者约占22%~24%,男性高于女性;约14%患者血液中HIV序列无耐药突变但是生殖道中的HIV发生了耐药突变,这种情况不仅发生在曾经行HAART患者,也发生在未行HAART患者中,耐药位点主要为D67N、K103N、184V。比较不同种类抗病毒药物的耐药率,两个解剖学部位的标本(血液、生殖道分泌物)HIV耐药突变率的发生情况,分别为:核苷类77% vs. 68%、非核苷类36% vs. 36%,蛋白酶类32% vs. 27%[26]。与我国HIV药物资源相近的泰国在2018年报道,从811例新发现HIV感染的MSM中筛选出7例存在基线基因型耐药突变,比较血液、精液、肛门分泌物中HIV毒株的耐药突变,发现只有3例血液和精液中HIV毒株突变情况一致;1例患者肛门分泌物中存在多重耐药突变毒株,血液中却没有发生多重耐药的情况,但是两个部位的毒株突变位点均是CRF01_AE;另外3例肛门/精液中发生的耐药突变位点与血液中不一致[27]。
3 精液和血液HIV毒株不一致的机制
精液由来自男性生殖器官和导管中产生的分泌物和细胞组成,在包括前列腺、睾丸、附睾、储精囊、输精管、尿道、龟头在内的外分泌器官和导管均可检测到被HIV/猴免疫缺陷病毒(simian immunodeficiency virus, SIV)感染的巨噬细胞、T细胞[24]。
3.1 疾病进程相关性 在HIV感染急性期,感染者的精液具有很强的传染性,表现为精液中高水平的HIV载量,白细胞中HIV DNA检出率高,白细胞增多,炎症与白细胞聚集有关的标志物增多[28-29]。此时原发感染者精液中的HIV毒株在遗传特征上与血液中毒株相似,表明这些毒株直接或近期从血液中输入。对感染SIV的猕猴模型研究发现,SIV感染的白细胞数量(主要是T淋巴细胞)在感染2周内比在感染慢性期时明显增多[30-31]。这些被感染的细胞以新浸润的白细胞作为代表,很可能作为记忆性T细胞成为HIV/SIV的早期靶细胞,在感染急性期的生殖道黏膜组织中大量浸润、增殖。一直到感染11周,雄性猕猴的生殖道组织和血液中SIV毒株依然相似[32]。表明在感染早期,生殖道中HIV/SIV主要来源于血液中病毒的直接浸润、扩散和转入,此时精液和血液中病毒毒株是一致的。
HIV感染进入慢性期,精液和血液中病毒载量进入平台期,研究显示此时精液和血液中HIV载量和HIV基因型相关性低[33]。用单基因扩增技术在SIV感染猕猴模型中研究发现,从感染造模开始,在SIV感染2周内,精液和血液中SIV毒株序列相似度高,此时差异没有统计学意义,但是到感染第十六周,体内病毒载量进入平台期,对HIV env区扩增进行进化树分析显示,此时精液和血液中SIV毒株之间序列的差异有统计学意义(P<0.05)[34]。说明在HIV/SIV感染慢性期,精液中的毒株发生了局域化,生殖系统成为一个HIV潜伏池,局部生殖器官组织的HIV复制,是生殖道精液中病毒的重要来源。这种HIV在生殖系统中的“局域化”,在感染急性期之后进入平台期即开始形成[35]。对造模感染SIV进入感染慢性期(感染后6~15个月)的亚洲猕猴模型的生殖器官解剖、SIV毒株序列分析,也发现这些组织器官中SIV与精液中SIV有遗传相似性[36],进一步支持了生殖系统中毒株的局域化论点。但是,对人体精液和血液中HIV毒株来源进行分析发现,精液中HIV来源具有多样性和复杂性。Anderson等[37]对没有接受HAART的HIV感染慢性期男性患者(其中C亚型12例,B亚型4例)进行精液和血液中病毒毒株分析。使用单基因扩增技术,从血浆和精浆中提取的病毒RNA生成cDNA作为病毒env基因单基因组扩增的模板,分析精浆和血浆中HIV毒株env区全长,以此推断样本中毒株的同源性。结果显示:不同患者精液和血液中HIV毒株有不同的关系特征,有患者精-血毒株一致,没有发现精液中局域化毒株的特征,称为精-血毒株“平衡”;有患者精液中毒株来自血液毒株的“克隆”复制;也有患者出现精液中病毒的“局部复制”。HIV毒株演变如图1所示。
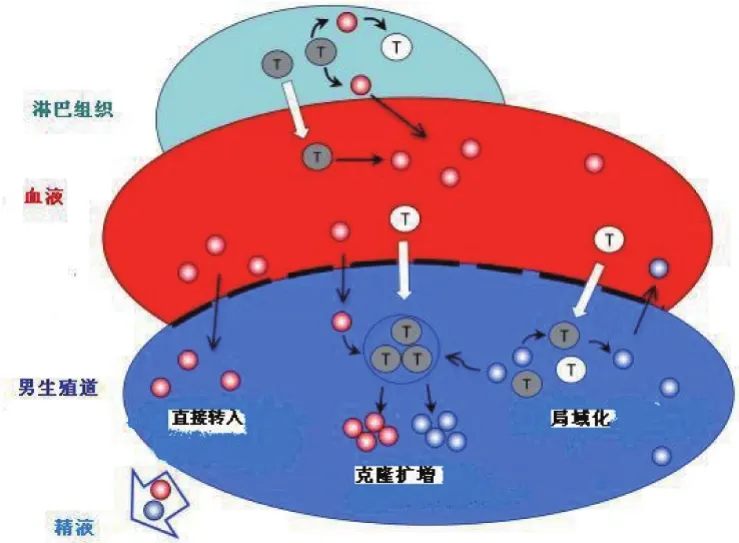
图1 血液和男性生殖道中HIV毒株演变[37]Figure 1 Evolution of HIV strains in blood and male reproductive tract[37]
3.2 药物浓度相关性 HAART情况下,抗病毒药物在精液和血液中的浓度差别较大:核苷类抗病毒药物在精液中的浓度明显高于血液中,如拉米夫定的精/血药物浓度AUC为6.67(四分位距为4.10~9.14);而非核苷类药物在生殖道中浓度低于血液中;蛋白酶抑制剂在精液中浓度大约为血液中浓度的10%~20%[38]。国内广泛使用的一线药物依非韦伦(efavirenz, EFV),在男性患者生殖道中的浓度仅为其血液中浓度的3%~10%[39-40]。精、血药物浓度的差异主要是由于血-睾丸屏障的存在,这种屏障由支持细胞之间的紧密连接复合物组成,它限制了某些大分子进入生精小管的通道[41]。
事实证明,有效HAART启动后,精液中HIV载量随着血液中病毒载量下降而下降[42-43],“治疗即预防”是全球认同的阻断HIV经性途径传播的有效方式[44-45]。然而,一些案例报道,血液病毒抑制的HIV阳性患者可通过性传播途径将HIV传给阴性配偶[46-47]。一些研究探索精、血病毒的不一致与抗病毒药物浓度差异的相关性。法国一项纳入了33例血液病毒抑制艾滋病患者的多中心研究中,2例患者的精液中可检测到病毒并且伴随耐药位点突变,其中1例是奈非那韦组合,精液和血液中病毒浓度比值为0.8∶1;另1例是洛匹那韦/利托那韦组合,精液和血液中浓度比值是0.07∶1[48]。Lorello等[49]发现在33例血液中HIV抑制(<50 copies/ml)已经超过1年以上的患者中有2例(6.1%)精液中HIV载量>700 copies/ml,2例都没有合并其他性病,都是服用含EFV组合,且EFV在精液中浓度不超过血液中的10%。这些研究都不同程度提示精、血抗HIV药物浓度差异可能与与精、血病毒释放、病毒序列不一致有关,但是也未能证明是精、血药物浓度差异导致精、血病毒载量的不一致。另外有研究发现,尽管抗病毒药物的精、血总浓度有差异,但是具有抗病毒活性的药物浓度另有规律。如:核苷类反转录酶抑制剂类的三磷酸拉米夫定在精、血中浓度相当,而三磷酸齐多夫定在精液中浓度为血液中的36%,三磷酸替诺福韦活化在精液中浓度比血液中高[50]。EFV虽然在精液中总浓度远低于血液中,但是游离状态的EFV(被认为有抗病毒治疗作用的形式)在精、血中的浓度相当[51]。值得提出的是,同一个抗病毒治疗组合,不同个体之间药物浓度的差异更为突出,这又涉及到不同个体转运药物的载体数量及活性、代谢酶的水平和多态性等多方面的因素[52],是否这才是精、血药物浓度与毒株变异差异的原因,须要更多研究进一步探索。
4 小 结
精液和血液中HIV释放、HIV序列结构不完全一致。由膀胱、睾丸、附睾、储精囊、前列腺、阴茎、尿道、龟头这些生殖道器官组成的生殖系统形成特殊的“黏膜屏障”,导致精液和血液中HIV毒株存在不一致的解剖结构。黏膜组织是一个特殊的动态微环境,疾病进程、局部免疫压力、药物渗透性不同、个体的代谢差异等均可能是HIV毒株在局部生殖系统发生变异的生理病理基础。

