多色流式细胞术检测HIV/AIDS患者CD4+ T细胞亚群变化
王芯栎,汪 笛,魏雨晴,张瓃丹,李 蓓,杜 娟,赵红心,孔雅娴
AIDS是由HIV感染引起的一种病死率极高的恶性传染病。CD4+T细胞是HIV攻击的主要靶细胞[1-2],其数量减少和功能下降是导致HIV/AIDS患者免疫应答水平低下、各种机会性感染高发的主要原因。初始的CD4+T细胞活化后分化成不同的辅助性T细胞(helper T cells, Th)亚群,包括 Th1、Th2、Th9、Th17、滤泡辅助性 T细胞(T follicular helper cell, Tfh)等。Th的分化过程受T细胞受体信号、特异的细胞因子和转录因子的协同调控,并产生谱系特异性的细胞因子[3]。Th1分泌IFN-γ、TNF-α、IL-12,并特异性表达转录因子T-bet;Th2分泌IL-4、IL-5、IL-13,并选择性地依赖于GATA3的表达;Th17在转录因子RORγt的调节下特异性地产生IL-17;Th22的特征是分泌IL-22及表达转录因子AHR;Th9是Th的一个新亚群,它分泌IL-9和IL-10并表达转录因子PU.1[3-5]。Th不仅通过分泌细胞因子引起慢性炎症来参与HIV的感染进程,还是HIV复制的场所[1,7]。因此,检测Th亚群的数量与比例,对于研究HIV/AIDS患者的免疫状态与预后判断至关重要。
既往研究通过检测细胞因子来确定Th亚群的数量和比例。最初利用酶联免疫斑点法或原位杂交等方法,只能确定单一细胞因子,也不能准确地确定细胞类型[8-9]。随着多色流式细胞术的发展,后续研究能在单细胞水平检测多种细胞因子指标,弥补了检测单一细胞因子的不足。然而,多色流式检测胞内细胞因子的实验过程和分析方法复杂[10-11],并且细胞在体外被长时间刺激后已不能反映体内的真实情况。
不同的Th亚群除了产生的细胞因子具有谱系特异性,其迁移能力也具有高度保守的专一性,因此才能介导不同的免疫反应。趋化因子受体分子表达水平的异质性是协调Th迁移、定位到适当位置的分子基础。Th1表达的趋化因子受体包括CXCR3和CCR5,这些分子有利于Th1向感染或炎症部位迁移和与抗原提呈细胞相互作用;Th2则表达CCR3、CCR4和CCR8等趋化因子受体;Th17表面的CCR6与细胞迁移至中枢神经系统密切相关[12-14]。细胞表面特异的分子表达不仅起着协调Th发挥免疫功能的作用,也是替代细胞因子识别Th的关键分子。因此,使用表面趋化因子受体识别Th更有利于研究其在体内的真实数量和比例。近年来,有研究使用不同趋化因子受体组合来区分Th亚群,比如:Th1(CXCR3+)、Th2(CCR10-CCR4+CCR6-)、Th9(CCR4-CCR6+)等;但仅局限于1种或少数几种Th,并没有同时检测多个亚群[15-21]。综上,本研究建立了十一色流式方案,通过11种表面标志物的不同组合对Th1、Th2、Th9、Th17、Th22、Tfh、ThG亚群进行检测分析。
1 对象与方法
1.1 对象 选取2019年9月24日—12月18日在首都医科大学附属北京地坛医院皮肤科门诊就诊的未治疗HIV/AIDS患者15例和性别、年龄匹配的健康对照15例作为研究对象。15例患者皆为男性,年龄19~56岁,平均(31.4±10.89)岁;CD4+T细胞计数处于43~742个/μl之间,HIV载量在2.2~5.5 lg copies/ml之间。纳入标准为:①年龄18~65周岁;②ELISA检测HIV-1抗体阳性并通过Western Blot法确认;③在北京地坛医院初始治疗并未服用抗病毒药物者。排除标准:①合并HBV/HCV感染者;②合并梅毒螺旋体感染者;④留取血液标本时有现症机会性感染或AIDS相关恶性肿瘤者;⑤妊娠期、哺乳期的妇女。本研究经首都医科大学附属北京地坛医院伦理委员会的批准,所有参与者均签署知情同意书。
1.2 试剂和仪器 抗体(美国BD Biosciences公司,美国BioLegend 公司)、7-AAD染料(美国BD Biosciences公司)、淋巴细胞分离液(德国Stemcell Technologies公司)、流式细胞仪Fortessa(美国BD Biosciences公司)、含EDTA-K2的真空采血管(奥地利Greiner Bio-One公司)。
1.3 方法
1.3.1 细胞的分离 通过密度梯度离心法提取外周血单个核细胞。在15 ml离心管中加入4 ml淋巴细胞分离液,随后将8 ml全血轻轻铺在淋巴细胞分离液上;2000 r/min,20 min离心;吸取血浆层和分层液界面之间的白膜状单个核细胞进行重悬和洗涤;1500 r/min,10 min离心,弃去上清,加入10 ml 1640培养液再次重悬洗涤细胞,1200 r/min,5 min离心;用1640培养液重悬细胞至 1×107个细胞 /ml,取 1×106个细胞 /管至流式管中染色。
1.3.2 抗体的选择和表面标志物的染色 根据多色流式细胞术检测配色原则:弱表达的抗原搭配强荧光抗体,高表达的抗原选择较低强度荧光抗体。选择CD3-BV786、CD4-APC- fire750、CD8-BV510、CD45RA-BV711、CCR7-BV421、CXCR5-FITC、CXCR3-APC、CCR10-PE、CCR6-PE-CF594、CCR4-PE-Cy7,室温避光染色30 min后,PBS洗涤;加入3 μl 7-AAD染色3 min,区分细胞的生存状态。
1.3.3 流式细胞术检测人外周血中Th的比例 用流式细胞仪(BD LSRFortessa)检测,在淋巴细胞中以FSC-A和FSC-H设门,去除粘连的细胞。根据前向角(FSC)和侧向角(SSC)圈出淋巴细胞,而后使用7-AAD表达圈出活的CD3+T细胞,再进一步圈出CD4+T细胞(图1A)。确定CD4亚群后,根据各亚群趋化因子搭配圈出Th,采用Flowjo软件进行多色分析,并计算各Th亚群比例。
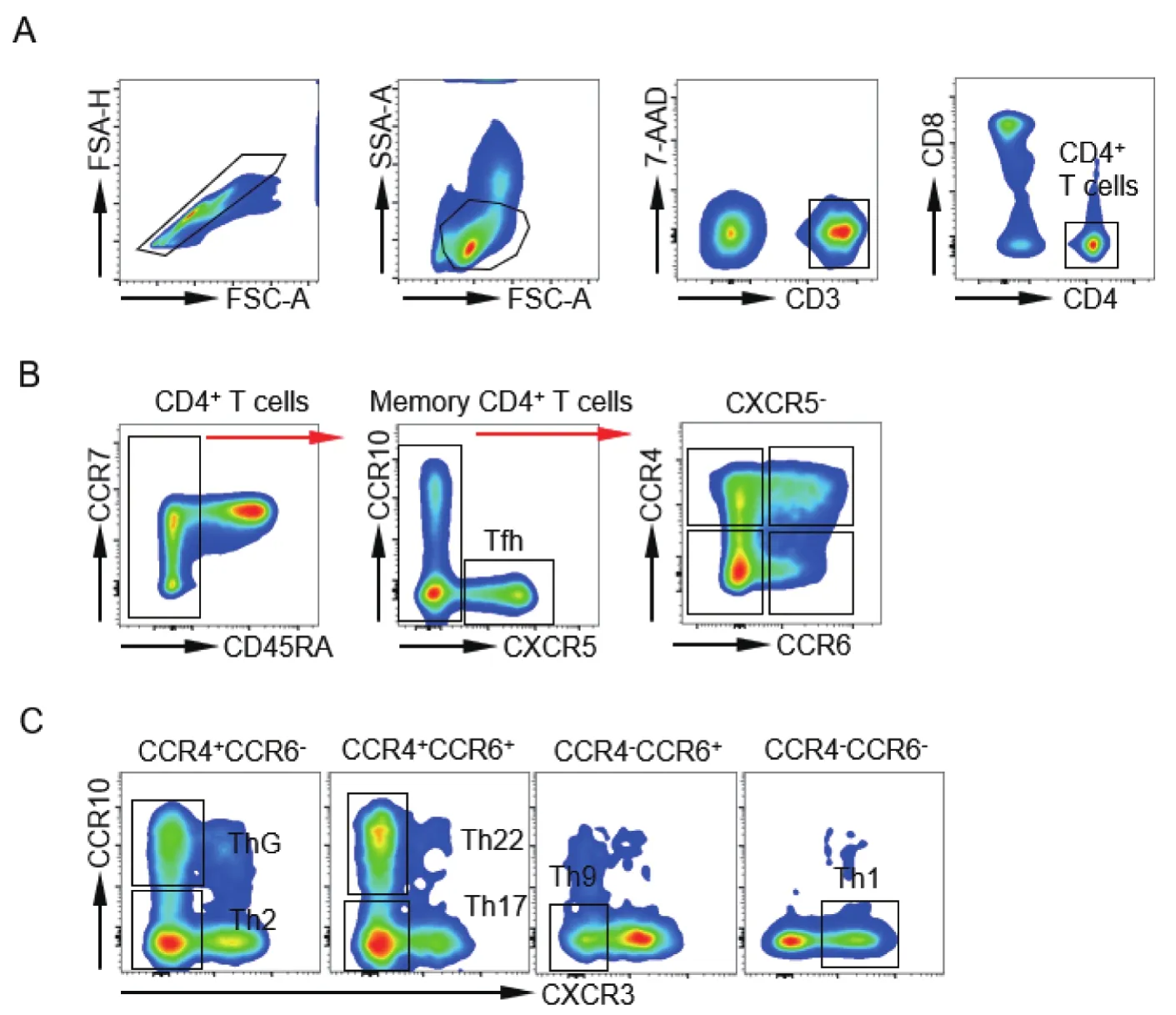
图1 HIV/AIDS患者外周血中Th的分析策略A.用SSC和FSC圈出淋巴细胞后,通过CD3和CD4圈出CD4+ T细胞;B.选择CD45RA阴性细胞,根据CXCR5圈出阳性的Tfh,在CXCR5-群中根据CCR6和CCR4将细胞分为4个亚群;C.根据CXCR3和CCR10圈出其他6种ThFigure 1 Analysis strategies of Th in peripheral blood from HIV/AIDS patients
1.4 统计学处理 采用GraphPadPrism 8.0软件进行数据统计分析制图。计量资料采用中位数和四分位数表示,即M(Q1, Q3),通过Kolmogorov-Smirnov test检测数据是否满足正态分布,若符合正态分布,组间比较采用非配对t检验;若数据为偏态分布,组间比较采用非参数Mann-Whitney U检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 基于表面标志物的人外周血Th分析策略 利用建立的多色流式细胞术检测方案检测HIV/AIDS患者外周血标本,其设门策略在圈出CD4+T细胞以后主要分成三步。首先,排除CD45RA阳性的细胞群(初始CD4+T细胞),在CD45RA阴性细胞群(记忆CD4+T细胞)里,根据CXCR5和CCR10设门圈出CXCR5+CCR10-的Tfh,这些细胞特异性表达CXCR5,使生发中心的滤泡状树突状细胞归巢,辅助浆细胞的成熟。第二步是在CXCR5阴性细胞群里根据CCR4和CCR6设门,将细胞分成4群,即CCR4+CCR6-、CCR4+CCR6+、CCR4-CCR6+和 CCR4-CCR6-(图1B)。最后,根据CXCR3和CCR10的表达确定Tfh以外的6种Th,分别是ThG(CXCR5-CCR4+CCR6-CCR10+CXCR3-)、Th2(CXCR5-CCR4+CCR6-CCR10-CXCR3-)、Th22(CXCR5-CCR4+CCR6+CCR10+CXCR3-)、Th17( CXCR5-CCR4+CCR6+CCR10-CXCR3-)、Th9(CXCR5-CCR4-CCR6+CCR10-CXCR3-) 和 Th1(CXCR5-CCR4-CCR6-CCR10-CXCR3+)(图1C),并计算各亚群的比例。
2.2 HIV/AIDS患者和健康对照中Th的比例情况 基于上述检测,15例HIV/AIDS患者和15例健康对照外周血中7种Th和初始CD4+T细胞的比例情况见表1。在HIV/AIDS患者中比例增加的Th包括Th1、Th2、Tfh、ThG。其中Th2在HIV/AIDS患者中的比例为6.0(4.8,10.6)%显著高于健康对照组4.3(3.2,6.3)%,(P=0.029);健康对照的Tfh比例为10.1(9.3,11.1)%,而HIV/AIDS患者的Tfh比例为11.6(8.8,15.5)%,差异无统计学意义(P=0.052)。Th1、ThG比例在2组之间差异均无统计学意义(P均>0.05)。Th9、Th17以及Th22的比例在HIV/AIDS患者中均低于健康对照,其中Th22比例下降最为显著(P=0.032)。
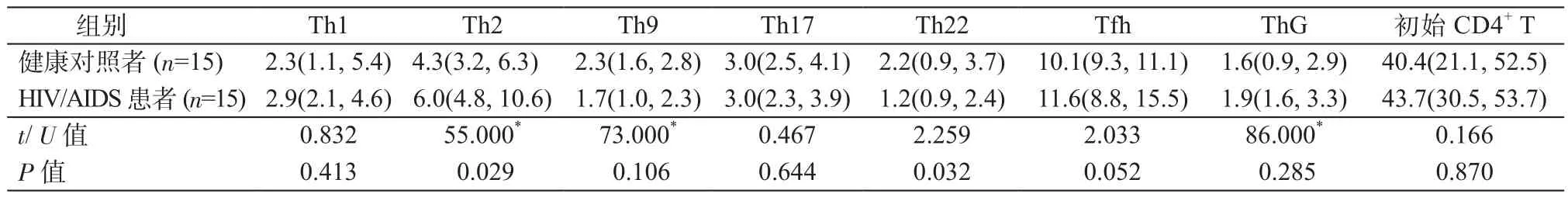
表1 HIV/AIDS患者和健康对照者外周血中Th的比例情况(%)Table 1 Comparisons of Th proportion in peripheral blood between HIV/AIDS patients and healthy controls(%)
3 讨 论
初始CD4+T细胞活化后分化为多个Th亚群,并且分泌谱系特异性细胞因子。不同Th亚群通过这些特异性的细胞因子,参与多种感染的免疫应答,以及过敏、哮喘等多种自身免疫性疾病的发病机制[18]。Th作为HIV靶细胞CD4+T细胞的主要亚群,其数量与功能的改变严重影响AIDS的疾病进展。因此,建立与优化 Th亚群的检测方法对于深入研究HIV/AIDS患者的免疫状态与预后判断至关重要。
根据Th亚群分泌的特异性细胞因子确定Th的亚型,是既往研究中经常用到的实验方法[11,19-20]。酶联免疫斑点法和流式细胞术是最典型的2种方法,它们通过对胞浆内细胞因子的染色,在单细胞水平上检测Th。2者相比,流式细胞术不仅能同时检测多种细胞因子,而且可以结合转录因子和表面标志物,较为准确地确定Th亚群的数量和比例。此外,根据荧光强度的强弱还可以判断细胞因子的分泌情况,从侧面分析细胞的功能。然而检测细胞因子的实验方法都基于在体外对细胞的额外刺激,不仅实验过程复杂、不易控制变量,且不能客观地反映Th在体内真实的数量和比例。Th的异质性一方面源于分泌的细胞因子的特异性,另一方面是归巢受体(选择素、整合素、趋化因子受体)的表达水平,这些受体不同的组合方式便决定了不同类型的Th归巢到不同组织的能力[21]。因此,使用趋化因子受体作为替代细胞因子和转录因子的工具将有助于Th的识别和检测。目前基于趋化因子区分Th亚群方式还没有明确的定义,有文献报道称Th1表型为CCR4-CCR6-CCR10-CXCR3+,Th2 为 CCR4+CCR6-CXCR3-,Th17为CCR4+CCR6+CCR10-CXCR3-;其他的研究则认为Th1为CXCR3+,Th2为CCR10-CCR4+CCR6-,Th17 为 CCR10-CCR4+CCR6+[17,22]。目前文献里报道的趋化因子的分析策略纷繁复杂,不同的策略各有重点,大多数的研究偏向于分析某一种或少数几种的Th。这些因素都导致了研究者不能很好地分析目前大部分的Th在体内的数量和比例。故本研究建立了十一色流式染色策略,能够同时对7种Th进行检测,实验步骤简单快捷,且对细胞的人为伤害相对较小,能够较为真实地反映细胞的体内状态,有利于纯化细胞进行后续的实验安排。
基于上述的染色方案,本研究检测了15例HIV/AIDS患者和15例健康对照外周血中Th的比例,并且对比分析2组之间的差异。研究发现,Th2和Tfh数量在HIV/AIDS患者体内均有不同程度的增加。既往文献表明HIV/AIDS患者的CD4+T细胞表达IL-2和IFN-γ的细胞百分比降低,同时产生IL-4和IL-10的细胞比例增加[23]。在本研究中,HIV/AIDS患者体内Th2比例确实高于健康对照,但是并没有观察到Th1数量的显著变化,推测可能与样本量小和患者都处于感染早期有关。本研究中观察到的Tfh变化趋势与既往文献报道是一致的,在机体受到HIV攻击以后,Tfh的数量不减反增,其作为HIV增殖的场所,为HIV的长期潜伏创造了一个良好的环境[24]。
Th具有各自的特点,它们在HIV感染过程中的变化也不相同。本研究发现Th22的比例在HIV/AIDS患者体内显著降低。既往研究表明Th22的比例变化与全身的炎症状态和黏膜免疫能力密切相关,如牛皮癣和哮喘等[23,25-27]。Th22数量和比例的减少能够在一定程度上促进HIV引起的慢性感染,使得疾病进一步地恶化[28-29]。此外,有文献报道了Th17数量在HIV感染进程中会减少,降低机体对HIV感染的抵御能力[30];Th9分泌的IL-9在HIV急性感染与慢性感染中浓度不同[29]。但是在本研究中,并没有观察到Th17和Th9以及ThG比例在2组之间的差异。推测这与样本量小,并且与患者感染时间短、病程都处于初级阶段有关,有待在今后的研究中进一步扩大样本量和在不同疾病进程的患者体内检测Th的数量和比例。
总之,Th及其分泌的细胞因子在HIV感染中发挥的作用不尽相同。本研究设计的十一色流式染色策略使得分析Th的亚群更加方便和快捷。全面且详实地了解Th在HIV感染过程中的变化有利于研究HIV/AIDS患者的免疫状态和判断预后。

