牦牛多杀性巴氏杆菌地方血清型灭活疫苗免疫效果评价
魏 歆,林芳明,雷生妍,张红见,贾彩惠,葛丽萍,赵 静*
(1.青海大学农牧学院,青海 西宁 810016;2.青海省食品检验检测院,青海 西宁 810008;3.陕西省畜牧技术推广总站,陕西 西安 710016)
多杀性巴氏杆菌可引起牦牛出血性败血症,它是一种急性呼吸系统传染病,简称为牛出败,俗称“嗓喉”。该病通常由致病菌内源感染引起发病,健康牦牛通过直接接触而感染,虽大多数牦牛接种了牛出败疫苗,但是该病在牦牛养殖区仍然频发,药物治疗也仅对早期发病的牦牛有效。青海省是我国主要的牦牛养殖地,牛出败对青海省牦牛的健康养殖造成了极大的危害和巨大的经济损失[1-2]。目前防治牦牛出血性败血症最有效的方法便是抗生素治疗和接种疫苗两种,但随着抗生素滥用导致多杀性巴氏杆菌耐药问题愈渐严重[3],使用抗生素临床治疗牦牛牛出败效果不容乐观,所以疫苗成了防治该病最好的手段。现有的牛出败疫苗有灭活疫苗[4]、弱毒疫苗[5]、亚单位疫苗[6]、重组疫苗[7]以及DNA疫苗[8],后三种疫苗虽免疫效果良好,但因为操作复杂、技术还不太成熟等多方面原因,没有被广泛应用。现目前应用最广泛的是灭活疫苗和弱毒疫苗两种。弱毒疫苗相较于灭活疫苗,能诱导血清型间交叉保护且细胞免疫应答效果优于灭活疫苗,但缺点是安全性不如灭活疫苗,它会引起牦牛全身性感染和疫病爆发的危险[9],且极不便于运输[10],所以本次试验选用了灭活疫苗。灭活疫苗的优点在于安全性好,制品稳定,且方便运输。目前国内上市的牦牛多杀性巴氏杆菌病灭活疫苗有B群C45-2、C46-2以及C47-2三种疫苗株,青海省常用的为C45-2疫苗株。
本研究制备了地方血清型野生株P0910和临床常用的商品疫苗株C45-2灭活疫苗,分别免疫20头牦牛后通过高效、快速的间接ELISA试剂盒检测牦牛血清抗体水平,评价两种疫苗的免疫效果,以期为青海省牦牛出血性败血症的防控提供候选菌株。
1 材料与方法
1.1 试验材料
试验菌株:多杀性巴氏杆菌疫苗株C45-2(青海省生物药品制品厂)、地方血清型野生株P0910(青海大学农牧学院传染病实验室分离)。
试验动物:6周龄昆明系小白鼠(18~22 g,雌雄各半),购自青海省地方病研究所;健康家兔(1.5~2 kg),购自青海大学农牧学院实习牧场;牦牛,青海省黄南藏族自治州尖扎县牦牛养殖场。
血清:试验血清采自用多杀性巴氏杆菌疫苗株C45-2、地方血清型野生株P0910制成的疫苗免疫健康牦牛;阴性血清是健康牦牛血清;阳性血清是试剂盒自带,ELISA试剂盒购自上海恒远生物科技有限公司。
1.2 试验方法
1.2.1 C45-2和P0910菌株的活化培养 将保存的疫苗株C45-2和野生株P0910两种菌株分别用血清平板复苏,然后分别挑取单个菌落依次各接种于2个5mL TSB肉汤中,37 ℃,180 r/min,摇床震荡培养20 h后,再分别将其全部接种于500 mL TSB液体培养基中,37 ℃温箱培养46 h。
1.2.2 C45-2和P0910的菌落计数 将已培养好的菌液进行稀释,并接种于TSA培养基平板上,37 ℃温箱内培养18~24 h,所得C45-2和P0910菌落数乘以稀释倍数,则为该菌的总活菌数。参照张红见等[11]的测定方法用生理盐水将培养的菌液做10倍系列的梯度稀释度10-6~10-10,做成5组等级梯度剂量。用麦氏比浊管来判定这两株菌液的菌数是否达到30亿/mL。分别将2株菌的这五个稀释度的稀释菌液每个TSA板上滴加 0.1 mL进行涂布,每组3个重复,置于37 ℃温箱培养30 min后,倒置培养24 h,备用。数出每个平板的总菌落数,计算出每3个平板上的平均菌落数,然后乘以稀释倍数,再乘以10,即为1 mL原菌液中所含的总菌数。
1.2.3 疫苗的制备 在纯度经过检验的菌液中无菌加入菌液总量的0.5%的甲醛溶液,放入摇床,37 ℃,200 rpm,震荡培养12 h。将用甲醛灭活后的C45-2和P0910菌液用接种环依次各划线接种于3个TSA培养基平板中,37 ℃温箱内培养72 h以上。观察有无细菌生长,验证菌液是否完全灭活。然后将已用甲醛灭活后的C45-2和P0910菌液分别按5∶1的比例加入灭菌的Al(OH)3胶(因为铝胶佐剂本身会在注射部位产生肉芽肿,还容易引发变态反应等一系列不良反应[12],所以添加铝胶佐剂必须得严格按照《兽用生物制品规程》规定的比例添加铝胶佐剂)进行配苗,同时按疫苗总量的0.005%加入0.2%苯酚,充分震荡摇匀,放置于4 ℃冰箱内保存备用。
1.2.4 疫苗安全性检验 小白鼠安全性检验:分别将制备好的C45-2、P0910疫苗各皮下注射4只小白鼠(雌雄各半),每只注射0.3 mL,设立试验对照组,连续观察14 d。
家兔安全性检验:分别将制备好的C45-2、P0910疫苗各皮下注射4只家兔,每只注射5 mL,并设立试验对照组,连续观察14~21 d。
1.2.5 毒力试验 最小致死量的测定是将6只体重为1.5~2 kg的兔子(雌雄各半)随机分成 2组,每组3只,每只兔子皮下注射不同的活菌数,观察3 d,测定最小致死量。其方法:分别将C45-2、P0910接种于TSB培养液,37 ℃振荡培养24 h,用灭菌生理盐水将菌液分别做10倍系列稀释,每个稀释度需更换一个枪头,稀释至 1×10-11,选择10-7~10-9三个稀释度,分别将2株菌的三个稀释度的稀释菌液用200μL的移液枪各接种于3个TSA平板上,每个平板滴加0.1 mL,轻轻晃动平板,并用灭菌的涂布棒使菌液均匀散开,置于37 ℃温箱培养30 min后,倒置培养24 h,计算出1~5个活菌数的菌液量,按前面分好的组,分别注射到相对应的兔子体内,对照组兔子则注射PBS。
1.2.6 效力检验 疫苗免疫:用体重1.5~2 kg的12只兔子(雌雄各半)随机分成3组,1、2组兔子分别皮下注射1 mL 已制备好的C45-2、P0910疫苗,第3组兔子注射1 mL PBS作对照。连续观察14~21 d。
攻毒保护试验:连续观察14 d后,将上述已免疫的3组兔子,分别用相对应的强毒株菌液1 mL攻毒(注射方式同上),连续观察14 d,统计各组兔子死亡数,计算各免疫组的保护率。通过该试验便可知道自制的疫苗的免疫效果如何。
1.2.7 应用商品化ELISA试剂盒检测C45-2、P0910疫苗的免疫效果 试验血清的制备,取4、5 mL的疫苗株C45-2灭活疫苗分别免疫10头牦牛;取4、5 mL的地方血清型野生株P0910灭活疫苗同样分别免疫10头牦牛,共计免疫40头牦牛。分别在30、90、180 d采取免疫后牦牛血液,无菌分离血清,并分装灭菌EP管,-20 ℃冰箱保存。
用商品化的ELISA试剂盒按操作说明检测上述所制备好的血清临床样品,共计120份。将试剂盒中自带的标准品用稀释液稀释五个梯度,以五个标准品的稀释梯度浓度为纵坐标,OD450值为横坐标绘制出标准曲线,再根据标准曲线得到其直线回归方程式,将样品的 OD450值代入方程式,便可计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。且以标准品的最大稀释倍数即最小浓度为判定样品阴阳性的临界值。
2 结果与分析
2.1 C45-2和P0910的活菌计数
由表1、表2可知,C45-2的稀释度为10-6、10-7、10-8时的菌液浓度分别为5.35×109、1.78×1010、5.30×1010CFU/mL,C45-2的菌液浓度取这三个浓度的平均值,即2.54×1010CFU/mL;P0910的稀释度为10-7、10-8、10-9的菌液浓度则为3.10×1010、4.23×1010、4.43×1010CFU/mL,所以P0910的菌液浓度为3.93×1010CFU/mL。由此可看出两株菌都在很短的时间内到达了3×109CFU/mL,达到了制备疫苗的标准[13]。
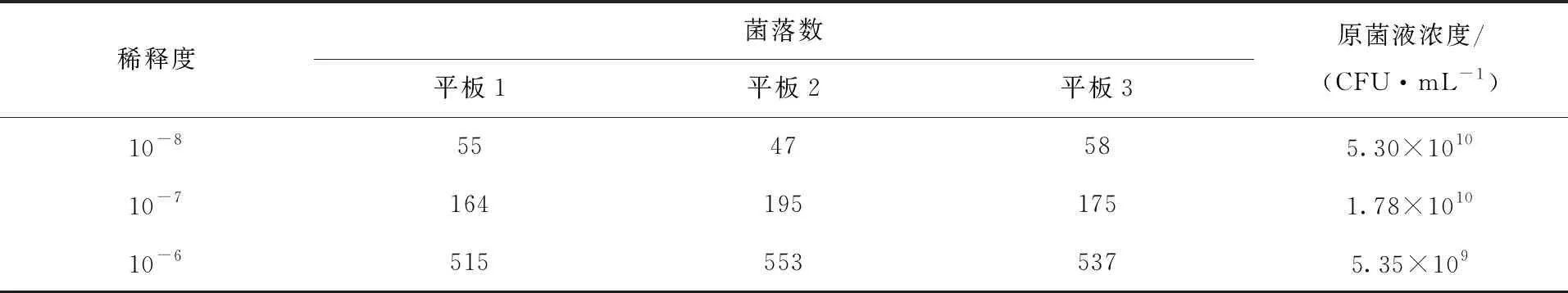
表1 C45-2活菌计数

表2 P0910活菌计数
2.2 疫苗的无菌检验
将接种菌苗的TSA置于37 ℃温箱,连续培养7 d后未见到任何菌落形成,则说明所制备疫苗无菌检验合格。
2.3 疫苗的安全性检验
2.3.1 小白鼠安全性检验 接种疫苗株C45-2、野生株P0910灭活疫苗后个别小白鼠在最初的5~7 h内表现为轻度精神沉郁,之后很快恢复正常。所有小白鼠在约14 d的观察期内未见任何异常表现,注射部位无硬块和溃烂,这说明疫苗的安全性符合标准要求。
2.3.2 家兔安全性检验 接种疫苗株C45-2、野生株P0910灭活疫苗后个别家兔在最初的 1~2 d 内有轻度精神沉郁,摄食量减少等表现,之后很快恢复正常。但是在接种疫苗株C45-2灭活疫苗的第4天有一只家兔死亡,经剖检观察,各脏器均无明显的异常变化,触片镜检也并未发现菌体存在。
2.4 毒力试验
2.4.1 C45-2和P0910的最小致死量(MLD)测定 每只兔子皮下注射不同的活菌数,两组兔子的死亡情况见表3、表4。由表3可知,接种疫苗株C45-2疫苗的这组小鼠,注射2个活菌数就已经死亡;从表4可知,接种野生株P0910疫苗,注射2个活菌数小鼠存活,而注射了3个活菌数时小鼠死亡,说明野生株P0910的最小致死量为3个活菌数。

表3 接种C45-2的活菌计数

表4 接种P0910的活菌计数
2.5 攻毒保护试验
由表5可知,经C45-2、P0910全菌灭活疫苗免疫后的兔子均可在一定程度上抵抗强毒株的攻击,其中P0910灭活苗保护效果较好,保护率为100%,高于C45-2灭活疫苗(保护率为90%)。

表5 攻毒试验结果
2.6 间接ELISA方法检测C45-2和P0910疫苗的免疫效果
2.6.1 样品浓度的计算 测量3次采样样品的标准曲线如图1所示。
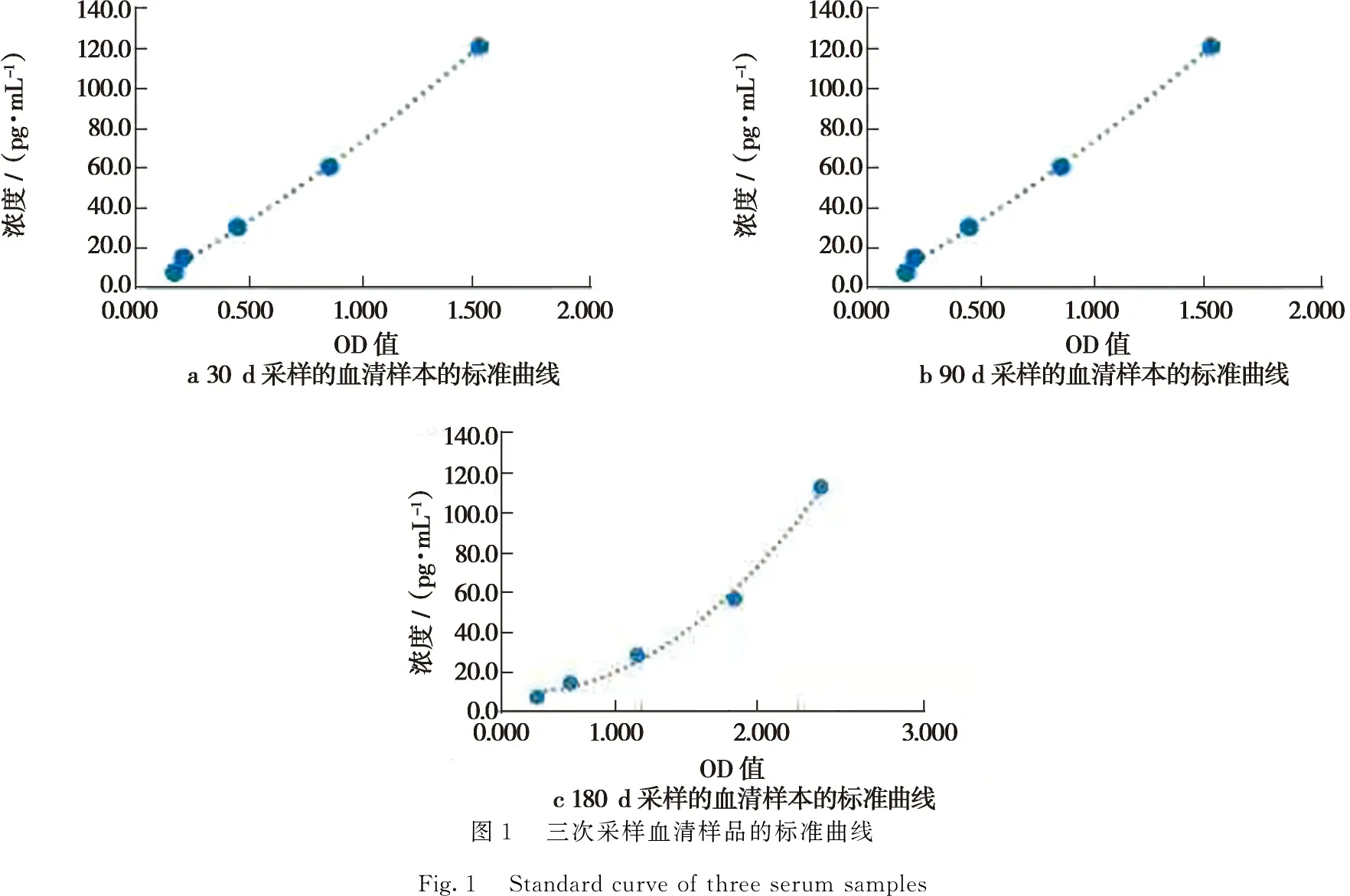
直线回归方程为y30 d=11.476x2+62.502x-1.281 2(R2=0.998 4)、y90 d=2.534 9x2+72.854x-8.214 1(R2=0.996 3)、y180 d=29.239x2-13.237x+11.301(R2=0.993 8)。从直线回归方程的R2系数可看出该曲线的拟合程度比较高,可以用此来计算样品的浓度。
2.6.2 临床样品检测
将 120份临床血清样品用 ELISA 试剂盒进行检测,检测抗体消长规律,结果见表6和图2。
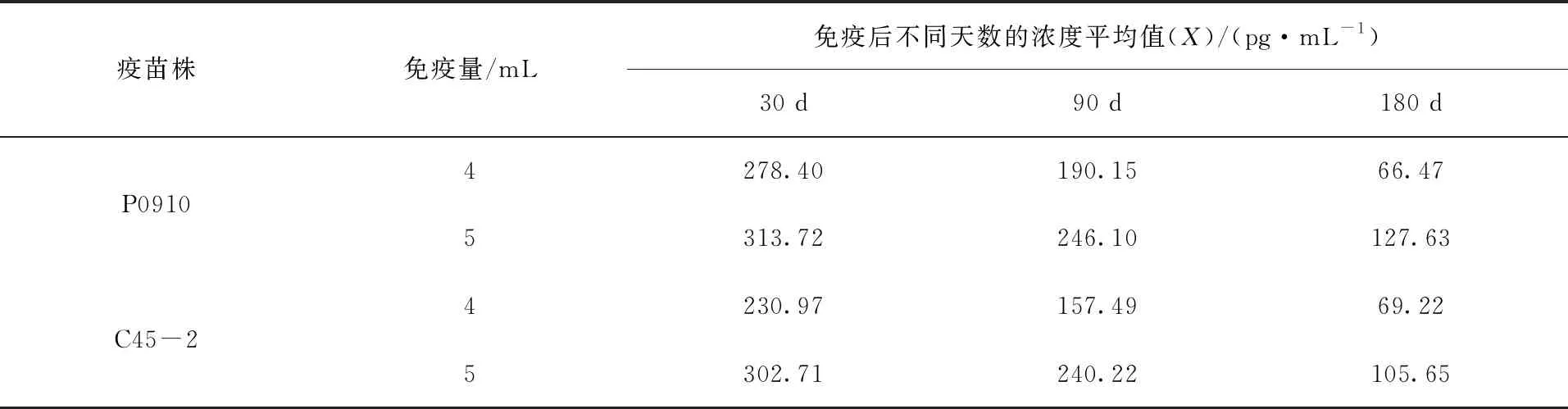
表6 待测血清浓度平均值
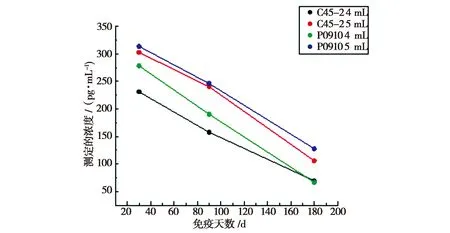
图2 四组疫苗免疫牦牛后抗体消长的曲线
由表6、图2可知,免疫牦牛血清抗体水平在接种后一个月达到高峰,随后逐渐下降。相同免疫剂量时地方血清型野生株P0910抗体水平高于疫苗株C45-2;不同免疫剂量,接种5 mL灭活疫苗的抗体水平要高于4 mL灭活疫苗的抗体水平。
3 讨论与结论
牦牛养殖业作为高原地区的重要经济产业之一,对促进牧民增收、牧业增效具有重要的推动作用,但牦牛出血性败血症作为危害牦牛的常发和多发病,给青海省牦牛养殖业带来了巨大的经济损失。从安全性和经济适用性方面来看,制备高效特异的地方血清型多杀性巴氏杆菌灭活疫苗是作为防控青海省牦牛出血性败血症最有效的途径之一。
本研究中用于制备免疫疫苗的菌株P0910为课题组分离的地方血清型野生菌株,而作为对照的C45-2为生产中使用的疫苗株。从活菌计数的试验结果可以看出P0910和C45-2两株菌都可以在短时间内达到制备标准疫苗的浓度,即3.93×1010CFU/mL和2.54×1010CFU/mL,并由此可知地方血清型野生株P0910的生长繁殖速度要略快于疫苗株C45-2,这可能是由于C45-2长期作为疫苗菌株,经过多次传代培养,病原菌失去荚膜,导致其活力逐渐下降的缘故[14],而新分离到的野生株P0910活力强,做成疫苗的效果也会高于疫苗株C45-2。从毒力试验结果来看,C45-2注射2个活菌数试验兔便死亡,而P0910的最小致死量则为3个活菌数,说明C45-2的毒力要高于野生株P0910,毒力差异之间的分子机制还需进一步研究。疫苗的安全性对于制备疫苗来说是十分重要的,它主要表现为注射疫苗后动物机体产生的不适反应。从安全性试验结果可以看出疫苗株C45-2和地方血清株P0910疫苗免疫小鼠和家兔后都无严重的不良反应,只在注射初期表现出轻度精神沉郁、摄食量减少等表现,后期恢复正常。其中有一只家兔注射了C45-2疫苗4 d后死亡,剖检后发现兔子脏器无任何明显的病变,触片镜检后也未发现有菌体存在,这证明了该兔子的死亡与注射疫苗无直接的关系,这可能和兔子的个体差异有关。从攻毒保护试验的结果可以看出P0910的保护率(100%)要优于C45-2(90%),说明野生株P0910疫苗的效力高于疫苗株C45-2。由此可知无论是基于疫苗的安全性考虑还是从疫苗保护效率来看,P0910制备的灭活疫苗都能够为牦牛提供良好的保护,所以将P0910 灭活疫苗作为新型的青海省当地牦牛免疫候选疫苗型是可行的。
本试验应用间接ELISA方法对用疫苗株C45-2和野生株P0910灭活疫苗免疫的牦牛血清进行检测,从试验结果可以看出P0910疫苗的免疫效果优于C45-2,接种疫苗一个月后抗体水平达到最高,然后逐渐下降,直至6个月后抗体水平达到最低。黄忠等[15]用巴氏杆菌株C48-1制作的禽霍乱疫苗免疫樱桃谷鸭,利用间接ELISA方法检测试验鸭的抗体滴度,结果显示在免疫禽霍乱疫苗4周后抗体滴度达到最高值,之后抗体水平逐渐下降,这与本研究试验结果类似。同时接种5mL疫苗的牦牛体内抗体达到了较高的水平,说明疫苗的免疫效果与其剂量是呈正相关的。据此可制定再次接种疫苗的时间,为科学制定牦牛出血性败血症免疫程序提供了基础数据,节约了生产成本。
综上所述,本试验室自制的地方血清型野生株P0910灭活疫苗具有较高的安全性,且通过疫苗保护性试验以及抗体检测结果可以看出,地方型血清株P0910的免疫效果较疫苗株C45-2要高,具备作为防控青海省牦牛出血性败血症灭活疫苗候选株的良好潜质。

