Wnt/β-catenin信号通路主要成员及在昆虫中的功能
赵特, 李瑞, 付晓政, 邱琪琪, 王梦珂, 周琳
(河南农业大学植物保护学院/河南省新型农药创制与应用重点实验室/河南省绿色 农药创制工程技术研究中心, 河南 郑州 450002)
Wnt一词来源于Integration1(Int-1)基因和wingless(wg)基因。1982年NUSSE等[1]对小鼠乳腺肿瘤研究时发现一种可以在细胞间传递增殖分化信号的蛋白,并命名为Int-1,该基因的异常激活会导致肿瘤的发生;随后发现Int-1基因就是果蝇中的无翅基因[2],因而统一命名为Wnt。Wnt是一类分泌性糖蛋白,能够调节细胞的增殖、分化、迁移、极性化和不对称分裂。由Wnt配体蛋白激活的信号通路主要有3条:(1)Wnt/β-catenin信号通路(Canonical Wnt/β-catenin Pathway);(2)平面细胞极性通路(Planar Cell Polarity Pathway);(3)Wnt/Ca2+通路。目前对Wnt/β-catenin通路研究比较多,它是一个复杂的蛋白作用网络系统,各种蛋白质之间彼此联系、相互制约,共同调控多种生命过程。本文就Wnt/β-catenin信号通路的主要成员、作用机制及其昆虫中的研究进展进行综述,并对其在未来的研究方向提出展望,以期为Wnt信号通路功能的拓展研究提供指引。
1 Wnt/β-catenin信号通路的主要成员
1.1 受体和配体
Wnt蛋白作为Wnt信号通路的配体,通过与膜表面受体结合而发挥作用,其在进化上高度保守,目前在哺乳动物中已被发现19种,大约可以分为12个亚家族。Wnt蛋白由350~400个氨基酸组成,含一段疏水的信号肽,富含半胱氨酸残基,这些半胱氨酸残基之间可以形成二硫键,指挥着Wnt蛋白的正确折叠和运输[3]。Wnt蛋白是一类分泌型糖蛋白,具有分泌型生长因子的特点。Wnt蛋白被分泌后,既可与自身细胞的膜受体结合发挥自分泌调节作用,也可与邻近细胞的膜受体结合发挥旁分泌作用。由于其脂质化修饰,Wnt蛋白分子的溶解性并不强,虽然其近距离作用可以通过扩散和旁分泌来实现,但其长距离作用需要依赖其他分子协助。N-糖基化和棕榈酰化是Wnt蛋白2种重要的修饰方式,对Wnt的分泌和行使正常功能都十分重要,例如小鼠Wnt3a的糖基化修饰对Wnt蛋白的分泌是必不可少的[4],位于N端第77位半胱氨酸(C77)棕榈酰化的缺失影响其活性[5],第209位丝氨酸(S209)棕榈酰化的缺失导致Wnt蛋白滞留于内质网内无法正常分泌[6]。
Wnt蛋白受体主要有2类:Fzd(Frizzled)和辅助受体LRP5/6(Low-density lipoprotein receptor-related protein 5/6)。Fzd受体是一类7次跨膜的蛋白,结构上与G蛋白偶联受体相似,目前已经发现10个成员,并编号至Fzd10(Fzd1、Fzd2、Fzd3、Fzd4、Fzd5、Fzd6、Fzd7、Fzd8、Fzd9、Fzd10)。Fzd胞外N端是高度保守的富含半胱氨酸的配体结合区称之为CRD(Cystine Rich Domain),能与Wnt蛋白结合[7]。胞内C端是同样保守的KTXXXW motif结构域,能够作用于蓬乱蛋白Dvl,通过将胞外信号传递到Dvl进而阻断β-catenin的降解调节靶标基因的表达[8-10]。LRP5/6是一种单次跨膜的辅助受体,属于低密度脂蛋白受体相关蛋白(LDL-receptor-related protein),其胞内区域大约含有200个氨基酸,其中包含5个PPPS/TPxS/T模体,可与Axin和GSK-3等蛋白相互作用[11-12]。胞外区由表皮生长因子结构域(Epidermal Growth Factor Like,EGF)和低密度脂蛋白受体(Low Density Lipoprotein Receptor,LDLR)结构域组成,其中EGF为Wnt的结合位点[13]。当有Wnt信号存在时,Wnt与Fzd和LRP5/6结合并相互作用,三者形成复合物并将信号从胞外传入胞内。
1.2 β-catenin
β-catenin是Wnt信号通路向细胞核内传递过程中的重要信号分子,Wnt信号转导的关键就是胞浆中是否存在稳定的β-catenin。β-catenin最开始是作为粘合连接(Adhesion Junction)的一员被发现,而后发现是果蝇中Armadillo蛋白的同源物,并且是Wnt信号通路的核心成员[14]。β-catenin属于犰狳家族蛋白,由位于染色体3p21-22的CTNNbl基因编码,其N末端有130个氨基酸,富含Ser、Thr位点,调控分子的稳定性;C末端由100个氨基酸组成,负责激活靶基因的转录,能够结合一系列通用的转录辅助因子如组蛋白乙酰转移酶、染色质重塑因子等促进转录的开始和延伸;中间是由550个氨基酸组成的中间连接臂重复区,其分成12个Arm重复区(R1~R12),每个重复区含有3个螺旋,12个重复区形成一个棒状的超螺旋结构,能避免蛋白水解[15]。当没有Wnt配体时,Wnt/β-catenin信号通路处于关闭的状态,β-catenin N末端的4个Ser、Thr位点会被由Axin、APC、GSK-3和CK1等组成的坏复合物磷酸化,进而在E3泛素化酶的作用下被泛素化标记,最终被蛋白酶体识别并降解。
1.3 Axin和APC
Axin和APC是Wnt信号通路2个重要的负调控因子。作为破坏复合物的支架蛋白,Axin是非折叠蛋白,没有固定的三级结构,含有与Wnt信号途径多个成员相互结合的功能区域。其N末端为G蛋白信号肽调控因子(RGS)结构域,也是APC与Axin的结合位点;C末端是Axin形成同源寡聚体的区域,也叫DIX结构域(Dishevelled/Axin Homologous Domain);中间为GSK-3、β-catenin和CK1的结合区域。Axin的这些结构域对调节β-catenin水平是至关重要的。例如APC需要与Axin的RGS位点结合才能促进GSK-3对β-catenin的磷酸化[14];若DIX结构域缺失,即使Axin能够结合GSK-3和β-catenin,也不能下调β-catenin的水平[16]。Axin除了作为破坏复合物的支架蛋白下调β-catenin的水平外,还存在一个与此独立的机制下调β-catenin:Axin具有核输出信号序列NES(Nuclear Export Sequenc)和核定位序列NLS(Nuclear Localization Sequence),能够作为一种分子伴侣,通过核质穿梭协同β-catenin在细胞核或细胞质中的分布,促进β-catenin定位于细胞质中[17]。
APC是一个相对分子质量较大的蛋白质,通过与Axin和GSK-3等结合形成功能复合体来调节胞质中β-catenin的蛋白水平[18]。APC中含有多个能与β-catenin结合的独立保守的结构域,这些结构域含有15~20个氨基酸(20-mer)[19],此外这些结构域之间还有2~3个大约16个氨基酸的Axin结合结构域:丝氨酸-丙氨酸-蛋氨酸-脯氨酸Ser-Ala-Met-Pro(SAMP)重复序列。GSK-3或CK1对β-catenin磷酸化后紧接着会对APC的20-mer磷酸化,被磷酸化的20-mer会与β-catenin结合,而APC和Axin与β-catenin的结合区域存在重叠,APC对β-catenin的亲和力更高,会替代Axin与β-catenin结合,从而释放出Axin与新的未被磷酸化的β-catenin结合[18]。
1.4 GSK-3和CK1
GSK-3(果蝇中为Shaggy)和CK1是Wnt/β-catenin信号通路2个重要的磷酸化激酶,根据磷酸化的底物不同发挥不同的调节作用。
GSK-3是一种丝氨酸/苏氨酸激酶,具有α螺旋的C端和β折叠的N端2个结构域,其结合口袋ATP(AMP-NP的同系物)位于2个结构域之间,该催化区域主要由Lys85、Thr138、Asp133和Gin185等氨基酸残基组成[20]。在Wnt/β-catenin信号通路中,GSK-3不仅可以磷酸化β-catenin促进其被降解从而发挥负调控的作用,也可以通过磷酸化LRP6发挥正向调控因子的作用。当有Wnt信号存在时,Dvl与Fzd结合并招募Axin/GSK-3到细胞膜上与LRP6结合,进而磷酸化LRP6上的PPPSPxS位点,LRP6一旦被磷酸化后将招募更多的Axin/GSK-3到细胞膜上参与该位点的磷酸化,阻止了GSK-3对β-catenin的磷酸化,使得β-catenin能在胞质中积累而不被分解,达到正向调控的作用[11-12,21]。此外,Dvl或Axin也可能将CK1招募到细胞膜上参与磷酸化LRP6[11,22]。
CK1因其对酪蛋白的磷酸化而得名,是最早被分离出丝氨酸/苏氨酸蛋白活性之一的蛋白激酶,广泛存在于真核生物中,目前在哺乳动物中已发现7种亚型,包括α、β、γ1、γ2、γ3、δ和ε。这些亚型的N端均含有一个约为290个氨基酸残基组成的高度保守的激酶结构域,C端序列差异较大,根据不同成员亚细胞定位及酶活性调节不同长度从40到180个氨基酸不等。CK1可作为负调控因子直接参与β-catenin的磷酸化反应,当没有Wnt信号时,CK1会对β-catenin的氨基端第45位丝氨酸(Ser45)磷酸化,进而导致第33位丝氨酸(Ser33)、第37位丝氨酸(Ser37)和第41位苏氨酸(Thr41)被GSK-3磷酸化[18],其中S33/S37位点被磷酸化后会被E3泛素连接酶β-Trcp识别并与之结合,泛素化后的β-catenin在蛋白酶体的作用下被降解[23]。CK1也可作为正向调控因子参与LRP6的磷酸化,抑制破坏复合物的形成[22]。另外,CK1和GSK-3也对Axin和APC磷酸化,加强他们与β-catenin之间的相互作用[24]。Axin被磷酸化后会增强它与β-catenin的亲和力,有助于促进β-catenin的降解。APC被磷酸化后会与Axin竞争性的结合到β-catenin上,这将导致磷酸化的β-catenin从复合体中释放出来并进行下一步的泛素化。
1.5 Dvl
多功能支架蛋白Dvl(在果蝇中为Dsh)是机体组织细胞中广泛存在的包浆蛋白,对Wnt/β-catenin信号通路在胞内的转到至关重要,由670个氨基酸残基组成,含有3个主要的结构域:N端有与部分Axin蛋白相同的51个氨基酸DIX(Dishevelled, Axin)区;中间为PDZ(Postsynaptic Density 95, Disc Large, Zona Occludens-1)区,是由80~90个氨基酸组成的存在于PSD-95和ZO-1等50多种蛋白内的基本序列;C端为DEP(Dishevelled, Egl-10, Pleckstrin)区,是能够结合Dvl,EGL10以及Pleekstrin蛋白的部位[25]。另外,在PDZ的前后还各有一个小的结构域分别称为B(Basic Domain)和PR(Proline Rich Domain)[26]。Fzd在胞内的C端可与Dvl的PDZ和DEP相互作用并将其招募到细胞膜上[27],而Dvl的DIX区域可与Axin的DIX区域结合将其招募到细胞膜上形成Dvl-Axin多聚体,继而与Axin相互作用的CK1、GSK-3等也定位到细胞膜上,同时促进Wnt-Fz-LRP5/6复合物的形成[28]。此外,Dvl上也存在NES和NLS,可以进出入细胞核中,在核内Dvl能与β-catenin相互作用促进形成稳定的β-catenin/TCF复合物,激活靶标基因的转录[25]。
1.6 TCF/LEF
TCF/LEF家族是调控Wnt信号通路下游靶基因的重要的转录因子(果蝇中为Pangolin),其家族成员包括TCF1(TCF7)、TCF3(TCF7L1)、TCF4(TCF7L2)和LEF1(TCF7L3),在结构上有多个保守的结构域,通过与DNA或蛋白质结合调控靶基因的表达。DBD是一个可以与DNA结合的结构域,由高度保守的HMG框和一段富含碱性氨基酸的Basic tail组成。其中,HMG结构可以介导TCF/LEF识别特定的靶标序列,另外还能使靶标序列DNA发生折叠,这有助于其他转录因子的结合。在Wnt信号通路关闭的状态下,TCF/LEF通过DBD结构域结合在WRE序列上并与一些转录抑制因子Groucho家族成员形成复合物合,抑制下游靶基因的转录[29]。TCF/LEF与β-catenin的结合位点位于N端,在Wnt信号通路开启的状态下,β-catenin进入细胞核通过取代转录抑制因子与TCF/LEF结合并招募一系列的转录辅助因子,开启下游基因的转录。目前,多种转录辅助因子的作用已经被证明,例如CBP(CREBBP)和p300可以结合β-catenin的C端从而乙酰化组蛋白,激活靶基因的转录[30],而Bcl9可以与β-catenin的N端结合形成复合物,这对于绝大部分下游基因的转录是必要的[31]。
2 Wnt/β-catenin信号通路主要成员在昆虫中的功能研究进展
Wnt/β-catenin信号通路在昆虫进化过程中高度保守,参与昆虫附肢的发育、体节的分化、翅的形成等多个生理过程,通路中任何成员都有十分重要的作用。以果蝇为例,目前在果蝇中发现了7种Wnt配体,即Wg、Dwnt2、Dwnt3、Dwnt4、Dwnt6、WntD/8和Wnt10。Wg控制果蝇胚胎体节的极性,并涉及气管、中胚层、中枢神经系统、眼睛、附肢、翅等多个器官的发育[2,32-34]。Dwnt2(Wnt7)参与果蝇雄性生殖道的发育,Dwnt2突变体由于睾丸鞘内肌肉细胞畸形而显示出异常的睾丸形态,在雌性中异位表达Dwnt2可以在卵巢中诱导雄性特异性色素细胞,成年后的突变体不仅不育,而且表现出翅发育不健全[35-36]。此外,Dwnt2还参与神经系统的发育,Dwnt2的突变会改变肌神经接点突触前运动神经元形态和突触前蛋白的分布[37]。Dwnt3(Wnt5)参与果蝇唾液腺的移动[38],并在腹神经索中通过与受体Derailed/Ryk结合以确保在轴突引导过程中正确形成连合轴突束[39]。Dwnt4(Wnt9)的过表达会导致果蝇体节分割产生缺陷[40],而Dwnt4的缺失会导致果蝇心脏发育不健全[41]。另外,Dwnt4对于视网膜轴突沿着背腹轴发育具有重要的指导作用[42]。Dwnt6(Wnt6)在成虫盘中的表达模式与Wg相似,它的突变导致果蝇缺少触须,但对翅的发育没有影响[43]。WntD/8涉及果蝇背腹轴的形成和先天性免疫应答[44]。Wnt10在果蝇胚胎发育期间的多个组织中都有表达,包括内脏、头部、体壁中胚层和中枢神经系统等[45],但对于Wnt10在这些组织中的功能还有待进一步的研究。在果蝇中总共发现了4种Fzd受体:Fzd1、Fzd2、Fzd3和Fzd4。Fzd1的表达受到Engrailed转录因子的抑制。在胚胎表皮上提高Fzd1的表达有助于Wg的捕获,提高Wg的稳定性避免被降解。Fzd1的突变会导致果蝇复眼中的平面极性被破坏[46]。Fzd2的表达受到Wg信号的抑制,另外,Fzd2也能保护Wg免受降解,并扩大Wg在翅成虫盘上的作用范围[47]。Fzd3的表达模式与Fzd2正好相反,它在转录上通过Wg信号被上调。研究显示Fzd3对果蝇的生存不是必要的,Fzd3突变后的果蝇几乎没有形态缺陷,但是Fzd3的缺失可以抑制Wg等位基因突变产生的影响,在Wg等位基因突变体中Fzd3可能起着削弱Wg信号的作用[48]。有研究认为,Fzd3可能和Fzd1及Fzd2通过协同作用在成虫盘中转换或运输Wg信号[49]。在胚胎发育过程中Fzd4在中胚层,肠道和中枢神经系统中以动态模式表达[44],对于其功能有待进一步研究。
在果蝇中总共发现2种APC,即APC1和APC2,其在通过Wnt信号通路调节胚胎表皮和成虫盘发育上存在功能的冗余[50]。APC1和APC2同时沉默会导致整个发育过程中Armadillo在核内积累和Wg转导的组成性激活,表明APC1和APC2的联合活性可以严格调控Armadillo的转录激活[51]。2种APC还参与幼虫大脑的发育。研究显示,APC1和APC2在大脑中的表达区域完全不同,APC1主要在中心体和微管中表达,APC2主要在大脑皮层中表达,然而二者在大脑中的功能仍然存在重叠。单个APC突变对大脑发育几乎没有影响,但是二者都突变会严重减少神经细胞的数量,并导致视神经叶发育中的严重缺陷[52-53]。在果蝇中还发现了一个APC的同源物E-APC,其转录本在果蝇的所有发育阶段中普遍存在,可以与Armadillo 结合在上皮细胞中起黏附连接的作用,也可以与Shaggy、Axin等结合影响Armadillo的稳定性;E-APC的突变产生的胚胎表型与Shaggy产生的表型相似,即胚胎显示出高度异常的齿状结构[54]。另外,E-APC还是一种高机动蛋白,可以在不同的亚细胞位点之间组成性地穿梭[55]。Shaggy影响果蝇的生物钟,Shaggy的过表达会缩短果蝇的生物钟周期,而降低Shaggy的活性会延长周期[56]。Shaggy还调控运动神经元中的微管细胞骨架动力系统,并负调控NMJ(neuromuscular junction)的增长[57]。Shaggy的突变还会导致果蝇有丝分裂中期延长[58],并且无法完成减数分裂[59]。Axin作为Wnt信号通路的负调控因子,其突变导致Armadillo和Wg的一个靶标基因Distalless的积累[60],并导致胚胎表皮所有的齿状结构消失,进而表现出光滑的表皮结构,这与Wg的过表达表型相似;而Axin的过表达产生的表型与Wg的缺失产生的表型相似,即胚胎表皮覆满齿状结构[61]。Dsh的突变会导致大部分果蝇在老熟幼虫或化蛹早期死亡,只有少部分会发育为成虫,这些成虫表现出缺少触角和腿部畸形[62]。Pangolin的缺失会导致Wg信号通路靶标基因Distalless和Vestigial的表达量降低[63]。
除果蝇外,Wnt信号通路在其他昆虫中也得到了一定的研究。在赤拟谷盗(Triboliumcastaneum)中,Wnt1影响胚胎期足的发育及幼虫期足的再生能力[64-65],对蛹期翅的发育以及羽化十分重要[66];Wnt8的缺失会造成体节发育缺陷,Wnt8和Wnt1同时沉默会加强这种突变表型[67];Fzd1的缺失导致足发育缺陷,Fzd1和Fzd4同时沉默会增强足的缺陷表型并使后肠发育不完全,Fzd1和Fzd2同时沉默导致体轴伸长缺陷[68];Axin的沉默会导致胚胎期间头部、胸部和腹部发育受阻[69];GSK-3的沉默导致胚胎中糖原水平升高,发育提前终止,雌性成虫不孕或产卵量大大降低[70]。在家蚕(Bombyxmori)中,Wnt1基因的缺失导致胚胎无法孵化,并且表现出体节分割和色素沉积异常[71];GSK-3的磷酸化与家蚕的滞育过程有关[72]。在马尾松毛虫(Dendrolimuspunctatus)中,Wnt1的突变导致胚胎高致死率,并表现出胸足和腹足的缺失以及头部发育畸形[73]。在美国白蛾(Hyphantriacunea)中,Wnt1影响体节分化和附肢形成,Wnt1基因的缺失会导致头部畸形、体节缺失和附肢缺失,并使美国白蛾在胚胎期死亡[74]。在棉铃虫中,Wnt1与蛹的滞育有关[75]。在乳草长蝽(Oncopeltusfasciatus)中,Wg的沉默导致体节分割和眼睛的发育产生缺陷[76]。在双斑蟋蟀(Gryllusbimaculatus)中,Wg参与调节附肢的再生[77];Armadillo的沉默导致腹节部分节数缺失[78]。在白背飞虱中,Wg参与翅的发育和生长,Wg的沉默会导致翅明显变短并表现畸形[79]。Wnt信号通路还与其他信号通路存在交互作用,共同调控昆虫的发育。例如在美洲大蠊(Periplanetaamericana)中,Wnt信号通路与caudal和Notch信号通路共同在调节昆虫发育和体节分割中发挥作用[80]。在果蝇中,Wnt与Hh(Hedgehog)信号通路共同调控成虫肠道干细胞的自我更新、增殖和分化[81]。
3 Wnt/β-catenin信号通路的作用机制
Wnt/β-catenin信号途径通常的作用方式分为2种。当机体中没有Wnt信号或Wnt受体受阻时,胞质中游离的β-catenin将被由APC、Axin、CK1和GSK-3组成的破坏复合物结合,之后CK1对β-catenin的氨基端Ser45磷酸化,进而导致Ser33、Ser37和Thr41被GSK-3磷酸化,S33/S37位点被磷酸化后会被E3泛素连接酶β-Trcp识别并与之结合,泛素化后的β-catenin在蛋白酶体的作用下被降解,因此无法进入细胞核中。而此时在细胞核中,LEF/TCF转录因子家族与转录抑制因子Groucho结合形成复合蛋白结构,无法作用于下游靶基因,细胞表面上处于一个相对静止的状态(图1-A)[82-83]。当有Wnt信号存在时,Wnt与细胞膜表面的Fzd受体以及辅助受体LRP5/6结合形成复合物,激活胞内的Dvl蛋白并招募到细胞膜上,Fzd的C端与Dvl蛋白的PDZ和DEP区域相结合并使其磷酸化,而Dvl的DIX通过与Axin的DIX区域相互作用从而将Axin招募到细胞膜上,同时与Axin结合的激酶GSK-3和CK1也转移到膜上并磷酸化LRP5/6 C端的PPPSPxS位点,阻止了GSK-3对β-catenin的磷酸化,破坏复合体也无法形成。因此β-catenin不能正常降解而在胞质中异常聚集。大量游离的β-catenin进入细胞核破坏LEF/TCF家族与转录抑制因子Groucho形成的复合蛋白,并与LEF/TCF家族的转录因子结合,同时招募转录辅助因子,从而激活转录因子,进一步激活下游靶基因的表达(图1-B)[82-83]。
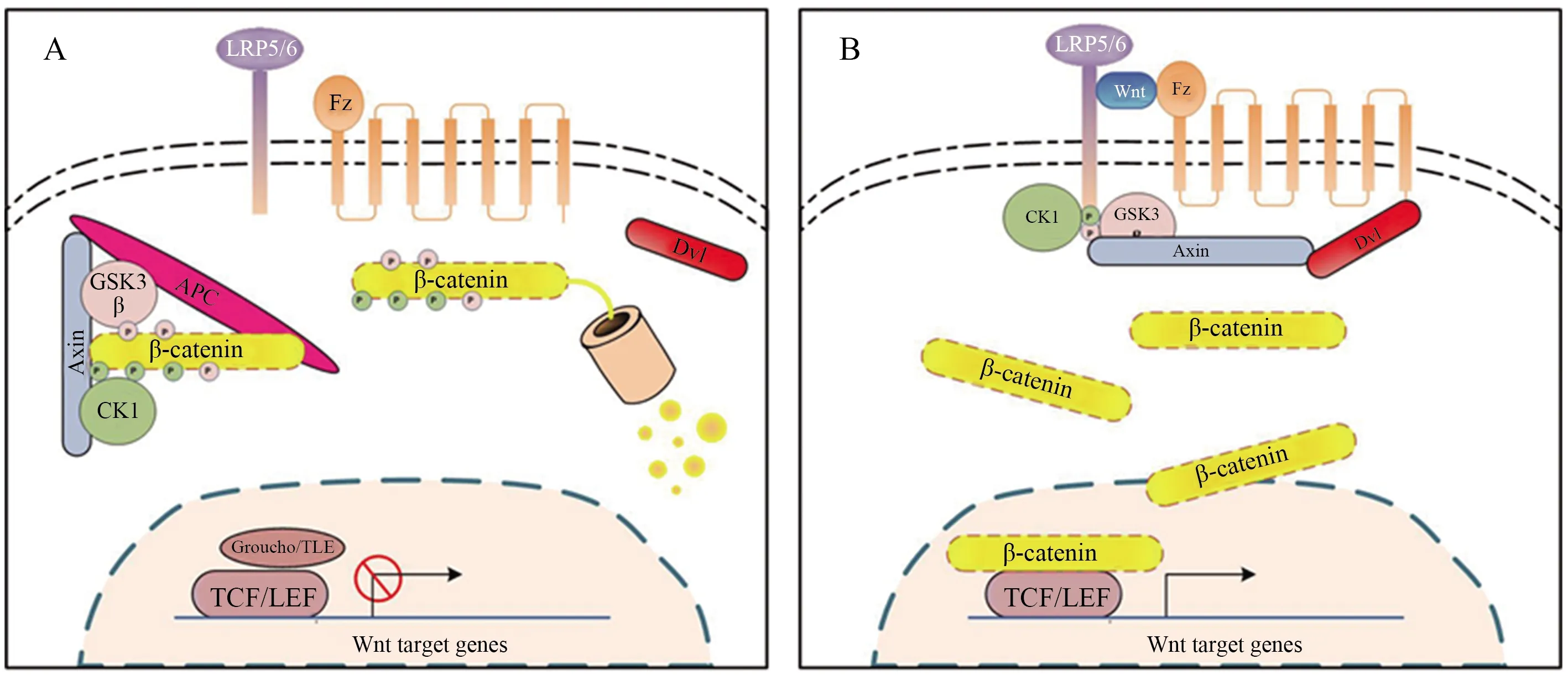
图1 Wnt/β-catenin信号通路作用机制Fig.1 Wnt/β-catenin signaling mechanism
4 展望
Wnt/β-catenin信号通路在生物进化过程中高度保守参与调控多个发育过程,在昆虫早期发育中参与胚层建立、器官发育、体节分割和背腹轴的形成等多种生物学过程,并对细胞的增殖、分化、迁移、极性化和凋亡起到十分重要的作用,是分子生物学和细胞学的一大研究热点。目前,对Wnt信号通路研究取得了一定的成果,但这些成果却引发了更多有待科学家解决的问题:Wnt信号通路调控着大量与生长代谢相关的基因,只有其中少部分基因被发现并研究,具体还有哪些以及这些基因在生长发育等过程中分别发挥何等功能和作用有待探索;信号通路中各成员之间的作用机制并未完全阐明,并且可能还有未发现的相关因子在其中产生作用,对该途径的组成、功能以及功能如何实现等一系列问题的探索还需要漫长的时间。
此外,Wnt信号通路是一个网状结构,除了本身对生物有重要的调控作用外,还与Notch、Dpp、Hh、成纤维细胞生长因子(Fibroblast Growth Factor,FGF)、转化生长因子β和骨形成蛋白(Transfo-rming Growth Factor β/Bone Morphogenetic Protein,TGFβ/BMP)、血管内皮生长因子(Vascular Endo-theliurn Growth Factor,VEGF)等多条信号通路存在交互作用,构成纷繁复杂的调控体系。例如Notch信号通路可以抑制神经和肌肉前体的发育,而这种抑制受到Wnt信号的对抗;Wnt信号通路中的Dvl蛋白可以结合到Notch胞内结构域的羧基端上,通过稳定Notch非活化的构象来阻断Notch信号通路;生物体背腹轴极性的产生就是由于Wnt于Hh信号通路的相互对抗;FGF可以通过诱导E-钙黏蛋白水平的下调,来调节细胞质中自由存在的β-catenin的量,并以此来影响Wnt信号的转导[84]。Wnt信号通路与其他信号通路的交互方式复杂多样,人们对其研究还远远不够,交互的具体过程和机制的认识还不够充分,需要更深入的研究,才能全面理解生物体内多种信号通路如何实现有效分工、各司其职, 从而保证细胞、组织和生物体的正常生命活动。这对于研究昆虫在Wnt信号传导通路中的生长发育、寻找发育调控中的重要分子及药物标靶等具有重要意义。

