壳聚糖Ⅰ型胶原天然支架材料对滑膜间充质干细胞成软骨能力的实验研究
耿岚,黄海波,孟繁华,房尚华
(1. 北京大学深圳医院,广东 深圳 518034;2.深圳市人民医院转化医学协同创新中心,广东 深圳 518020)
0 引言
组织生物工程中细胞支架占据很重要的位置,其能够为细胞的增殖分化以及组织的形成提供合适的三维空间[1]。目前软骨组织工程支架的应用中主要分为人工合成支架以及天然支架,其中人工合成支架的材料有聚乙醇酸和聚乳酸以及两者进行结合的聚合物[2]。天然支架材料主要有胶原以及壳聚糖等。人工合成的支架具有操作容易以及相对较好的机械性能等优点,但是其对于细胞基质的产生不利。相比较而言,天然材料来源主要为动物或者是人,其能够降解、无毒并且具有很好的生物相容性,能够促进细胞外基质的产生并且对细胞的黏附有利,故而,天然支架材料受到了广泛的关注[3]。壳聚糖广泛存在于自然界之中,其具有很好的生物相容性并且可降解,故而在细胞支架中应用广泛[4]。Ⅰ型胶原由于其为多组织细胞外基质成分,故而在细胞支架中应用广泛[5]。目前有不少壳聚糖Ⅰ型胶原复合支架的研究报导,但是关于壳聚糖Ⅰ型胶原天然支架对滑膜间充质干细胞成软骨能力的研究较少,本研究探讨壳聚糖Ⅰ型胶原天然支架材料对滑膜间充质干细胞成软骨能力的实验研究。
1 材料与方法
1.1 材料
MTT(Amresco);壳聚糖(Sigma);Ⅰ型胶原(Biosharp);胎牛血清(Hyclone)、高糖DMEM(Gibco);二酰荧光素(Sigma)。
1.2 方法
1.2.1 壳聚糖I型胶原天然支架的制备
利用0.1M的醋酸溶液对壳聚糖以及Ⅰ型胶原进行溶解,配置1%以及0.5%的壳聚糖以及Ⅰ型胶原溶液,然后将壳聚糖以及Ⅰ型胶原按照体积比2∶3进行混合搅拌,之后过滤,将过滤得到的溶液加入48孔板中,没空的体积为0.5mL.将之进行-70℃、-40℃、-20℃以及4℃的梯度冷冻,之后对其进行真空处理后冷冻干燥48h。同时配置2%的壳聚糖溶液以相同方法制备存壳聚糖支架作为对照组。
1.2.2 对支架材料的物理性能进行检测
将制备的支架于样品基台进行黏附,使用二氧化碳临界点对其进行干燥,真空条件下喷金镀膜,使用扫描电镜(Phenom LE,荷兰)对支架的形态进行观察,并利用Image Pro Plus 6.0软件选取扫描电镜中的孔隙,对其孔径直径进行记录。利用乙醇置换法对制备的支架的孔隙率进行检测。支架的吸水率的检测:将干重条件下的支架重量记为m1,然后将支架浸润在蒸馏水中,支架吸取蒸馏水饱和之后去除称重记为m2,则其吸水率为(m2-m1)/m2×100%,对其吸水率反复测量五次之后取其平均值则为支架最终的吸水率。
1.2.3 滑膜细胞的培养以及扩增
将SD大鼠进行称重之后,对其进行麻醉,待其起效之后,将其从大鼠的膝关节正中皮肤中间切开,对其组织进行分离直到滑膜处,然后切取滑膜组织放入EP管中,使用0.4%的Ⅰ型胶原酶对滑膜组织进行消化,然后放摇床以200rpm/min的条件振摇4h。然后将之取出对细胞进行离心过滤,将收集到的细胞使用含15%胎牛血清的高糖DMEM培养基进行培养,接种密度为2×105个/cm2,于37℃以及5%CO2条件下进行培养。等待细胞铺满培养皿80%左右进行传代,接种比例为1∶4到1∶3,使用培养基为高糖DMEM培养基,将之传代到3代后待应用于后续研究。
1.2.4 滑膜间充质干细胞-壳聚糖I型胶原复合培养以及细胞黏附的检测
使用无菌滤纸吸干高糖DMEM浸润的支架用于后续研究,将传代至第三代的滑膜间充质干细胞使用胰酶进行消化之后,将其密度进行调整,具体为6×106个/mL。支架置于24孔板中,然后向支架表面加入细胞悬液100μL,放置于培养箱中进行3h的培养,再将支架进行翻转之后,同样加入细胞悬液100μL于其表面,继续进行3h的培养之后向其中加入1.5mL高糖DMEM(含10%胎牛血清)培养。细胞支架复合物进行24h的培养之后,使用胰酶对其进行消化,将未黏附于支架的细胞悬浮并利用Vi-cell对其计数,计算细胞黏附率。细胞支架复合物培养48h之后使用二乙酰荧光素对支架上活细胞进行标记。其中二乙酰荧光素的浓度未15μg/mL,其溶剂为二甲基亚砜。然后将标记大的复合物加入培养液孵育15min之后,使用PBS对其进行漂洗,洗净二乙酰荧光素,然后将复合物于共聚焦显微镜下拍照观察。
1.2.5 噻唑蓝检测
将制备好的壳聚糖Ⅰ型胶原天然支架以及纯壳聚糖支架材料各选择12块放入24孔板中,然后将细胞支架以1.5×105cell/支架的密度接种于支架的表面,同时设置12个空白对照,接种密度相同,在对其接种3h后,向孔板中加入含有10%胎牛血清的高糖DMEM培养液继续培养,在对其培养的过程中每两天进行1次换液。在培养到第1、3、5以及7天时进行检测,并且每个时间点选取3个支架材料。使用酶标仪测量其吸光度值,选取的波长为570nm。
1.3 统计学处理
采用SPSS 22.0软件对所得数据进行统计分析,计量资料用(±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 支架的材料的形态学特点
对制备的支架进行观察,支架呈现圆柱状,并且具有弹性,质地均一的特点。通过扫描电镜对壳聚糖Ⅰ型胶原以及纯壳聚糖支架进行观察,其表面以及纵剖面均呈现为蜂窝状并且孔隙相连,其孔隙分布为六边形,且具有孔壁厚度一致的特点,具体见图1、2。

图1 壳聚糖Ⅰ型胶原天然支架材料扫描电镜图像(×200)

图2 纯壳聚糖支架材料扫描电镜图片(×200)
2.2 支架材料的物理性能
壳聚糖Ⅰ型胶原天然支架于纯壳聚糖支架材料在孔径以及孔隙率之间对比差异无统计学意义(P>0.05),但是壳聚糖Ⅰ型胶原天然支架材料相比较纯壳聚糖支架材料其吸水率明显更高(P<0.05),具体见表1。
表1 壳聚糖Ⅰ型胶原以及纯壳聚糖支架材料物理性能检测结果(±s)
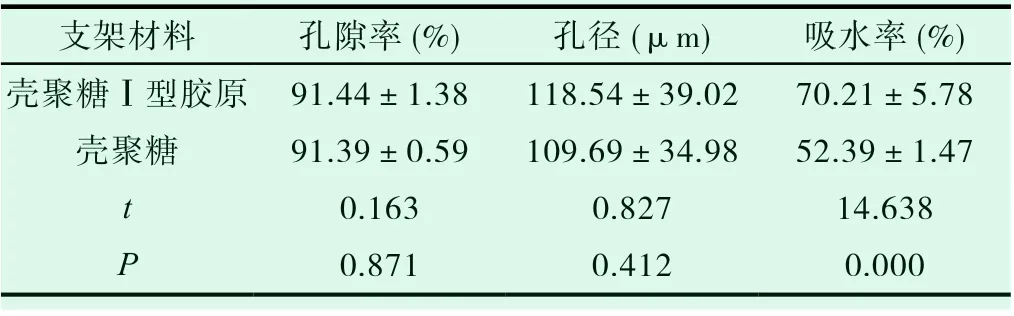
表1 壳聚糖Ⅰ型胶原以及纯壳聚糖支架材料物理性能检测结果(±s)
支架材料 孔隙率(%) 孔径(μm) 吸水率(%)壳聚糖Ⅰ型胶原91.44±1.38 118.54±39.02 70.21±5.78壳聚糖 91.39±0.59 109.69±34.98 52.39±1.47 t 0.163 0.827 14.638 P 0.871 0.412 0.000
2.3 支架材料对滑膜间充质干细胞的黏附以及增殖的影响
对壳聚糖Ⅰ型胶原天然支架材料细胞的黏附率进行检测结果为96.49%,对纯壳聚糖支架材料细胞黏附率检测结果为92.14%,两者对比差异无统计学意义。对壳聚糖Ⅰ型胶原支架材料中的滑膜间充质干细胞生长状况进行检测,其培养48h后形状为梭形,并且在支架材料的全层均有分布,具体如图3。利用MTT法对支架材料对细胞增殖影响进行检测,结果显示培养第1天,两组材料对细胞增殖无影响。培养第3到7天,两组之间对比差异具有统计学意义(P<0.05);壳聚糖Ⅰ型胶原以及纯壳聚糖材料均对细胞增殖具有促进作用,但是壳聚糖Ⅰ型胶原支架材料的促进作用更为明显。

图3 滑膜间充质干细胞在支架中生长情况
3 讨论
使用组织工程复合物对患者的软骨组织进行修复有很多潜在的好处,首先,细胞能够在支架上进行预分化;其次,可以减少人体的损伤,利用关节镜等技术将支架放入软骨的缺损处,减少患者的二次损伤[6]。细胞支架能够为患者提供一个稳定的三维空间结构,能够促进软骨的物质交换以及生长代谢,在软骨修复过程中对组织形成具有引导作用[7]。目前使用的支架材料主要有天然支架材料以及人工合成支架材料,而使用人工合成的支架材料由于具有亲水性差,不利于细胞的吸附并且易引起患者炎性反应等缺点,故而应用偏少[8]。本研究探讨壳聚糖Ⅰ型胶原天然支架对滑膜间充质干细胞成软骨能力研究。
本研究结果显示通过扫描电镜对壳聚糖Ⅰ型胶原以及纯壳聚糖支架进行观察,其表面以及纵剖面均呈现为蜂窝状并且孔隙相连,其孔隙分布为六边形,且具有孔壁厚度一致的特点,为细胞的黏附提供了有利的条件。同时吸水率提高更能保护患者软骨的微环境,更有利于细胞的生长[9]。对支架的物理性能进行探究,结果显示壳聚糖Ⅰ型胶原天然支架于纯壳聚糖支架材料在孔径以及孔隙率之间对比差异无统计学意义(P>0.05),但是壳聚糖Ⅰ型胶原天然支架材料相比较纯壳聚糖支架材料其吸水率明显更高(P<0.05),说明使用壳聚糖Ⅰ型胶原天然支架材料效果更好,其具有更好的吸水性,为软骨的物质交换以及生长代谢提供了有利的条件。对滑膜间充质干细胞黏附以及增殖影响进行研究结果显示,壳聚糖Ⅰ型胶原天然支架材料细胞的黏附率进行检测结果为96.49%,对纯壳聚糖支架材料细胞黏附率检测结果为92.14%,两者对比无统计学差异。对壳聚糖Ⅰ型胶原支架材料中的滑膜间充质干细胞生长状况进行检测,其培养48h后形状为梭形,并且在支架材料的全层均有分布。利用MTT法对支架材料对细胞增殖影响进行检测,结果显示培养第1天,两组材料对细胞增殖无影响。培养第3到7天,两组之间对比差异具有统计学意义(P<0.05);壳聚糖Ⅰ型胶原以及纯壳聚糖材料均对细胞增殖具有促进作用,但是壳聚糖Ⅰ型胶原支架材料的促进作用更为明显。这也表明壳聚糖Ⅰ型胶原天然支架更利于细胞的黏附以及增殖,为细胞的增殖以及分化提供更好的环境。
综上所述,壳聚糖Ⅰ型胶原天然支架能够为滑膜间充质干细胞的生长以及分化和组织的形成提供很好的环境,在软骨组织工程支架领域发展前景广泛。

