米曲菌胰酶片配合四联疗法治疗功能性消化不良伴H.pylori感染的效果观察
罗丹 王玮 吴伟东
口服药物目前仍作为治疗功能性消化不良伴幽门螺杆菌(H.pylori)感染的首选手段,其中莫沙必利即为临床治疗功能性消化不良的代表性药物之一,该药可有效刺激胃肠道而发挥促胃动力作用[1,2]。并且,功能性消化不良伴H.pylori感染患者因H.pylori感染可引起胃局部炎性反应,影响胃运动功能,加重消化障碍,加重病情。因而,功能性消化不良伴H.pylori感染患者在常规治疗基础上还需结合根除H.pylori治疗,以提高治疗效果。四联疗法是在传统三联疗法基础上创新的一种根除H.pylori感染方法,可有效避免传统三联疗法耐药性高的不足,提高根除率,现已在临床H.pylori感染疾病中得到广泛应用[3]。但有研究表明,多数功能性消化不良患者均伴有不同程度的消化酶分泌障碍,导致仅采用莫沙必利联合根治H.pylori治疗的效果欠佳,病情改善不理想。米曲菌胰酶片是一种复合消化酶制剂,经口服可直接补充消化酶,改善消化功能[4]。结合上述,推测将米曲菌胰酶片配合莫沙必利和四联疗法应用治疗功能性消化不良伴H.pylori感染,可提高治疗效果,但目前相关研究较少,具体效果及机制也未被证实。为明确上述联合用药方案在功能性消化不良伴H.pylori感染患者中的应用效果,本研究重点观察米曲菌胰酶片配合四联疗法治疗功能性消化不良伴H.pylori感染的价值。报道如下。
1 资料与方法
1.1 一般资料 前瞻选取2018年4月至2019年12月医院就诊的功能性消化不良伴H.pylori感染患者82例,随机分为对照组和观察组,每组41例。全部患者及家属对研究知情,同意参与研究,并签署研究知情同意书。研究实施获得医院伦理委员会批准同意。对照组男25例,女16例;年龄41~58岁,平均年龄(49.61±2.14)岁;功能性消化不良病程1~5年,平均病程(2.59±0.54)年。观察组男29例,女12例;年龄41~59岁,平均年龄(49.73±2.16)岁;功能性消化不良病程1~6年,平均病程(2.68±0.56)年。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 入选标准 (1)纳入标准:①符合《中国功能性消化不良专家共识意见》[5]中功能性消化不良相关诊断标准;②经13C呼气试验显示H.pylori阳性;③消化酶减少引起的消化不良。(2)排除标准:①其他疾病引起的消化不良;②近3个月内应用抗生素、胃肠动力调节等药物治疗的患者;③有上消化道手术史的患者;④伴肠易激综合征的患者;⑤药物过敏史;⑥既往行H.pylori根除的患者。
1.3 方法
1.3.1 对照组:实施莫沙必利+四联疗法治疗。四联疗法:均口服用药;雷贝拉唑肠溶胶囊(珠海润都制药股份有限公司,生产批号20171123,规格:20 mg×7粒)20 mg/次,2次/d,于饭前服用;甲硝唑片(陕西汉王药业有限公司,生产批号20171120,规格:0.2 g)0.4 g/次,2次/d,于饭后1 h服用;橼酸铋钾口服液(吉林延边朝药药业有限公司,生产批号20180125,规格:含铋110 mg)10 ml/次,2次/d,于饭前服用;阿莫西林胶囊(昆明贝克诺顿制药有限公司,生产批号20171214,规格:0.5 g×24粒)1 g/次,2次/d,于饭后1 d服用。莫沙必利(鲁南贝特制药有限公司,生产批号20171125,规格:5 mg×4粒)用法:口服,5 mg/次,3次/d,于饭前服用,连续治疗2周。
1.3.2 观察组:在对照组基础上配合米曲菌胰酶片治疗。米曲菌胰酶片[NORDMARK ARZNEIMITTEL GmbH & Co.KG(德国),批准文号H20170092,规格:10片×2板]用法:口服米曲菌胰酶片,1片/次,3次/d,连续治疗2周。
1.4 评价指标 (1)临床症状:治疗前、治疗2周时,对患者的腹部不适、食欲不振、上腹疼痛或灼烧、餐后饱胀感等症状进行评估对比,采用0~3分4级制,分值越高症状越严重。0分:无症状;1分:经提醒可记起有症状;2分:有症状主诉但未影响生活;3分:症状影响生活。(2)胃泌素(G-17):治疗前、治疗2周时,分别采集2组清晨空腹静脉血3~5 ml,进行离心处理,以3 500 r/min的离心速度共离心20 min,离心完毕后取上清液待检。使用美国R&D公司的试剂盒测定G-17水平。(3)不良反应:治疗期间,记录2组皮疹、腹泻、恶心呕吐等不良反应发生。皮疹:可见患者周身起皮疹,发红。腹泻和恶心呕吐均通过临床表现及患者主诉进行判定。
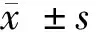
2 结果
2.1 临床症状 治疗2周,2组临床各症状积分及总分均较治疗前降低,且观察组低于对照组,差异有统计学意义(P<0.05)。见表1。
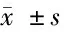
表1 2组临床症状积分比较 n=41,分,
2.2 G-17水平 治疗2周时,2组G-17水平较治疗前降低,且观察组低于对照组,差异有统计学意义(P<0.05)。见表2。
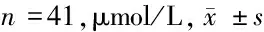
表2 2组G-17水平比较
2.3 不良反应 2组不良反应发生率比较,差异有统计学意义(P>0.05)。见表3。
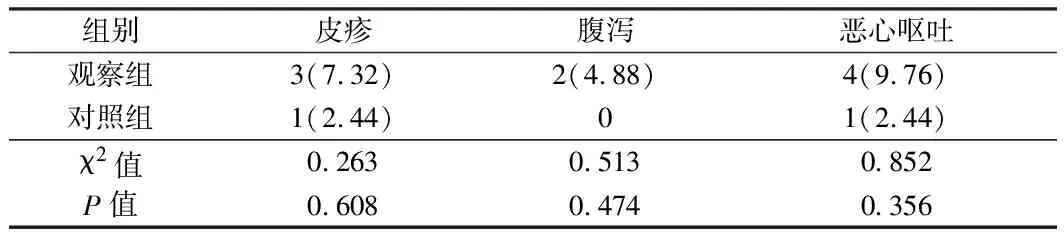
表3 2组不良反应发生情况比较 n=41,例(%)
3 讨论
文献指出,功能性消化不良与H.pylori感染相关,该疾病患者的H.pylori感染率显著高于正常人[6]。并且,另有研究指出,H.pylori感染可影响胃肠激素水平,继而影响脑-肠轴机制,形成恶性循环,促进功能性消化不良患者的病情加重,治疗难度提高[7]。
临床通常采用药物治疗功能性消化不良伴H.pylori感染患者,如莫沙必利即为常用药物之一,该药物是一种促胃肠动力剂,可促使乙酰胆碱合成分泌,加强胃肠道蠕动,从而改善胃肠道症状,且不会增加胃酸分泌量[8,9]。但对于功能性消化不良伴H.pylori感染患者而言,在消化不良的常规基础治疗上,还需联合根除H.pylori治疗,以促进症状缓解,且可预防溃疡及胃癌的发生,提高患者整体获益。四联疗法是近年来在临床中得以广泛应用的根治H.pylori的主要方案,主要包括质子泵抑制剂、胃黏膜保护剂及两种联合使用的抗菌素,可降低传统三联疗法的耐药性,提高根除率[10,11]。同时,有研究指出,功能性消化不良的发病可能与消化酶缺陷有关,消化酶大幅减少,继而导致患者胃肠功能障碍,可诱发并加重消化不良[12]。而莫沙必利仅可促进功能性消化不良患者的胃肠动力,难以有效改善消化酶缺失情况,因而患者整体获益欠佳。因此,为功能性消化不良伴H.pylori感染患者在促胃动力和根治H.pylori治疗的基础上,仍需结合其他药物治疗。米曲菌胰酶片中含有高稳定活性的米曲菌酶和胰酶,药物中的纤维素酶可在人体胃肠道内分解植物细胞壁和骨架,分解食物中的碳水化合物,使小肠中的蛋白质继续消化,继而充分发挥对食物的酶解作用,达到改善食欲不振、腹泻等上、下消化道症状,可用于消化不良的治疗[13,14]。
本研究结果显示,治疗2周,观察组各症状积分及总分低于对照组,表明米曲菌胰酶片配合四联疗法更利于改善功能性消化不良伴H.pylori感染患者的临床症状。分析原因可能是由于四联疗法可有效清除H.pylori感染,帮助患者胃肠道内炎性反应更好更快缓解,从而促进症状改善[15]。而联合米曲菌胰酶片可直接补充胃肠道内消化酶,促进食物分解,进一步改善胃肠道状态,因此症状改善更好[16]。本研究还对比了2组G-17水平,结果显示,治疗2周时,2组G-17水平较治疗前降低,且观察组低于对照组。G-17约占全部胃泌素的85%左右,具有促进胃肠蠕动、胃酸分泌等作用,其水平升高时则表明有萎缩性胃体胃炎、功能性消化不良等风险[17]。本研究结果显示,G-17水平在米曲菌胰酶片配合四联疗法治疗后明显降低,表明米曲菌胰酶片配合四联疗法更利于降低功能性消化不良伴H.pylori感染患者的G-17水平。究其原因:米曲菌胰酶片可在肠道内释放胰酶,使胰酶保持活性并在肠内有效释放,从而在肠道内发挥消化作用,改善消化功能,促进胃肠道蠕动,G-17水平降低[18]。此外,本研究对比了两种用药方案的安全性,结果显示,2组不良反应发生率对比相近,表明米曲菌胰酶片配合四联疗法治疗功能性消化不良伴H.pylori感染的安全性好。但本研究也存在一定不足,如研究时间短可能导致安全性结果真实性受影响,还需要在未来展开大样本、长时间、前瞻性、多中心的研究加以探讨。
综上所述,米曲菌胰酶片配合四联疗法更利于减轻功能性消化不良伴H.pylori感染患者主要症状,患者G-17水平明显降低,且不会增加不良反应风险,安全可靠。

