miR-210在卵巢上皮性癌组织及细胞系中的表达及意义
闫娟 宋玉霞 薛颖 金立娟 闫闪闪
卵巢癌在女性生殖系统中的发病率仅次于宫颈癌和宫体癌[1],据统计,2016年美国卵巢癌新增病例人数为22 440例,死亡人数为14 080例,卵巢癌目前己成为致死率最高的妇科恶性肿瘤[2],随着彻底肿瘤细胞减灭术(R0)+铂类为基础的联合化疗这一治疗模式的推广,卵巢癌的疗效获得了明显改善,但5年生存率仍低于45%[3]。早期诊断困难及化疗耐药是影响目前卵巢癌临床疗效和预后的主要原因[4]。虽然多年来通过众多学者的努力工作,在原癌基因、抑癌基因和相关信号转导通路研究等方面做出了不懈的努力,取得了不少成果,但是卵巢癌的发生及化疗耐药的产生机制仍未完全阐明。近些年一类新的非蛋白质编码microRNAs(miRNAs)的出现,为卵巢癌的研究提供了新思路[5]。miR-210茎环结构序列位于11p15.5,并且参与肿瘤细胞的增殖、血管生成、侵袭和凋亡[6]。miR-210 在许多肿瘤中表达,有学者通过基因芯片技术证明miR-210在卵巢癌组织及细胞系中表达[7]。但是目前miR-210参与卵巢上皮性癌生物学行为的具体分子机制仍不清楚,我们利用实时定量PCR方法检测了卵巢上皮性癌组织、正常卵巢组织中,以及卵巢上皮性癌细胞系HO-8910/HO-8910PM、COC1、OVCAR3及SKOV3/SKOV3-TR30/SKOV3-DDP中miR-210的表达,分析miR-210与卵巢癌临床病理特征及患者预后的关系,应用生物信息学软件预测miR-210的靶基因,分析其参与的信号通路,为研究miR-210与卵巢上皮性癌生物学行为的关系提供研究基础。
1 资料与方法
1.1 一般资料 收集2012年1月至2015年1月在石家庄市人民医院妇产科行手术切除的卵巢癌组织共56例,并选取同期因子宫脱垂于我科行全子宫加双附件切除及术前BRCA基因检测突变阳性行预防性双附件切除者的卵巢组织33例。纳入研究的卵巢癌患者年龄35~75岁,平均年龄(50±12.3)岁;其中<50岁19例,≥50岁37例。根据FIGO分期标准进行区分:Ⅰ期9例,Ⅱ期10例,Ⅲ期29例,Ⅳ期8例;浆液性42例,粘液性5例,子宫内膜样5例,透明细胞癌3例,其他类型1例。正常卵巢组患者年龄39~70岁,平均年龄(52±11.6)岁。切除组织于离体30 min内留存,经液氮冷冻处理后保存于-80℃冰箱内。随访方式主要为电话随访和门诊复查,随访截止日期为2020年1月。随访截止时仍存活的患者、随访过程中失访的患者均视为截尾数据,其生存期为确诊至末次随访之间的时间;随访过程中已死亡的患者视为完全数据,其生存期为确诊至死亡之间的时间。本研究得到本院伦理委员会批准,且所有纳入研究的患者签署知情同意书,并自愿参与本研究。
1.2 纳入与排除标准
1.2.1 纳入标准:①经过病理确诊未卵巢癌;②术前未经过放化疗等抗肿瘤治疗;③临床资料及随访记录完整。
1.2.2 排除标准:①合并其他系统肿瘤;②合并严重急慢性感染性疾病;③合并心、肝、肾等实质性脏器严重功能不全。
1.3 细胞系 高转移人卵巢癌细胞系HO-8910PM、人卵巢癌细胞系HO-8910、人卵巢癌细胞系OVCAR3及人卵巢癌细胞系COC1由河北医科大学第四医院河北省肿瘤研究所提供;人卵巢癌细胞系SKOV3及其紫杉醇耐药细胞亚系SKOV3-TR30、顺铂耐药细胞亚系SKOV3/DDP购自浙江大学医学院附属妇产科医院;人正常卵巢细胞系IOSE386,购自中国医科大学国家卫健委细胞生物学重点实验室。
1.4 主要试剂 细胞培养基RPMI 1640gou购自美国Gibco公司,McCoy’s 5A购自美国Invitrogen公司; M199购自美国Sigma公司,胎牛血清购自杭州四季青公司,Trizol购自美国 Invitrogen公司,逆转录试剂盒购自美国Thermo Scientific公司,荧光定量 PCR检验试剂盒购自珠海莫纳生物科技公司,PCR引物由上海生工生物有限公司合成,qRT-PCR 采用ABI Step One Plus PCR 仪(美国应用生物系统公司)。
1.5 方法
1.5.1 细胞培养: HO-8910、HO-8910PM、COC1及 OVCAR3细胞系,采用RPMI 1640培养基;SKOV3、SKOV3-TR30及SKOV3/DDP细胞系,采用McCoy’s 5A培养基;培养基中加入10%胎牛血清。IOSE386细胞系采用含10%胎牛血清的M199培养。所有耐药细胞系均按培养要求加入规定浓度化疗药物。于37℃、5%CO2、饱和湿度的恒温密闭培养箱内传代、培养。
1.5.2 RNA提取及realtime-PCR:按照Trizol说明书对各组组织及细胞行总RNA抽提,逆转录成cDNA,miR-210上游引物:5’-GGAGATCTGACCAGGTCATTT
GCATAC-3’;下游引物:5’-GGGAATTCGATATGACCA
CACCTGTG-3’;U6:上游引物:5’-GCTTCGGCAOCACA
TATACTAAAAT-3’;下游引物:5’-CGCTTCACGAATTT
GCGTCAT-3’, 应用按以下程序进行扩增:预95℃变性5 min,95℃10 s;60℃ 20 s;72℃ 20 s;78℃ 20 s,共40个循环。将内参引物U6与目的基因引物加入同一反应体系,反应条件相同,每一样本PCR反应重复3次。数据采用2-△△Ct值进行分析。
1.5.3 靶基因预测及信号通路分析:利用生物信息学分析软件 Target Scan(http:∥ targetscan.org)、miRanda (http:∥www.microrna.org / miranda_new.html) 和 miR Base Targets (http:∥microna.sanger.ac.uk /targets /v4 /) 综合分析, 选取3种软件的共同结果, 作为表达差异 miRNA 的可能靶基因,并通过miRWalk数据库中的KEGG pathway(http:// www.ma.uni-heidelberg.de/apps/zmf/mirwalk/)功能聚类分析miR-210调控的靶基因及参与的与肿瘤相关信号通路[8]。
2 结果
2.1 miR-210在2组组织中的表达 miR-210在卵巢癌组织中的相对表达量为1.539±0.363,显著高于正常卵巢组织中miR-210的相对表达量(1.017±0.289),差异有统计学意义(t=5.438,P<0.001)。见图1。

图1 miR-210在卵巢癌及正常卵巢组织中的表达情况
2.2 miR-210在卵巢癌细胞系中的表达 在卵巢癌细胞系及正常卵巢上皮细胞IOSE386,miR-210存在差异表达,与人正常卵巢细胞系IOSE386(1.000±0.043)相比,miR-210在卵巢癌细胞系HO-8910/HO-8910PM、COC1、OVCAR3、SKOV3/SKOV3-TR30/SKOV3-DDP均呈上调表达,差异有统计学意义(F=12.64,P<0.001)。HO-8910 与HO-8910 PM 相比(t=7.328,P=0.0004),SKOV3 与SKOV3-TR30 相比(t=9.869,P=0.0001),SKOV3与SKOV-3/DDP相比(t=6.6376,P=0.0006),miR-210的表达差异均有统计学意义。见表1。
表1 miR-210在卵巢癌细胞系中的表达情况
2.3 miR-210的表达与卵巢癌临床病理特征的关系 将卵巢癌组织中的miR-210表达量按照其中位数分为高表达(n=31)和低表达(n=25),并对表达水平和卵巢癌患者的临床病理特征进行相关性分析。研究结果表明,miR-210表达与年龄及病理类型无关(P>0.05),miR-210与FIGO分期、分化类型存在相关(P<0.05)。见表2。
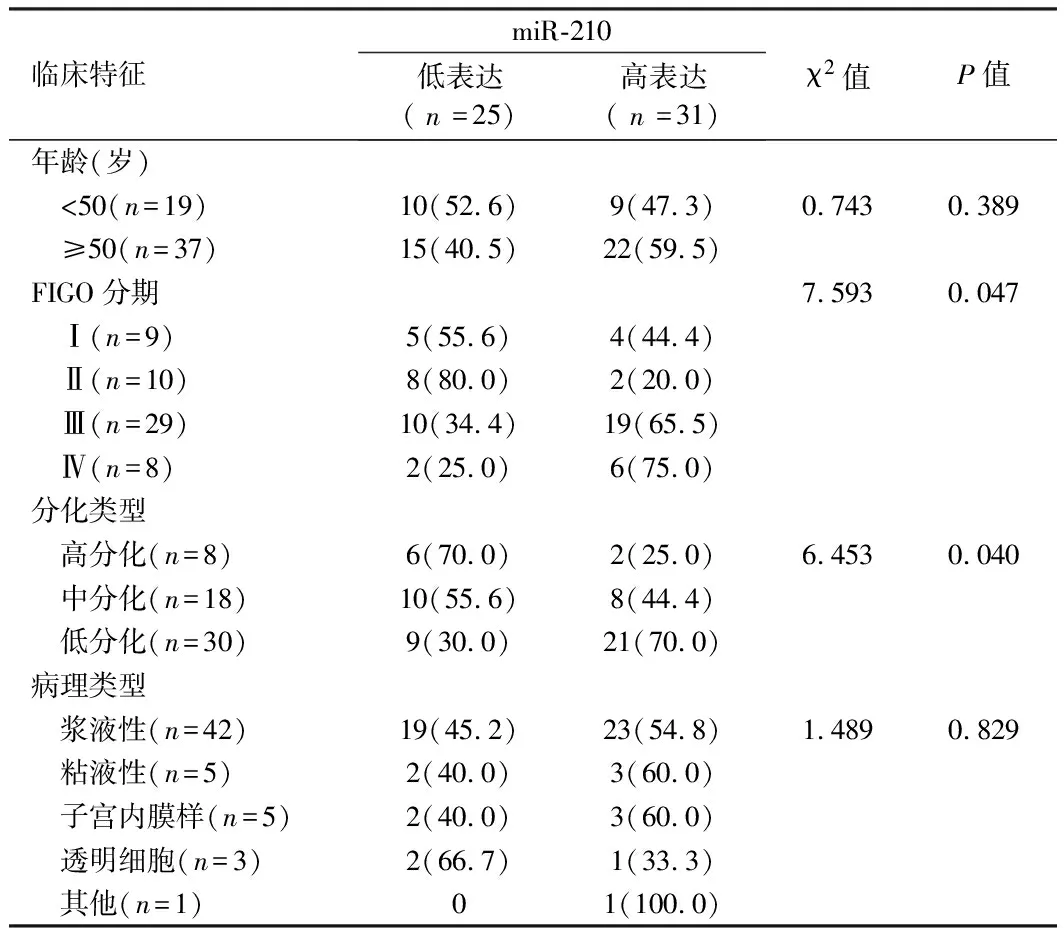
表2 miR-210表达与卵巢癌临床病理特征的关系 例(%)
2.4 miR-210的表达与卵巢癌患者预后的关系 miR-210低表达组患者术后的3年生存率为80.0%、5年生存率为36.0%,中位生存时间为49个月;miR-210高表达患者术后的3年生存率为32.3%、5年生存率为25.8%,中位生存时间为23.5个月。经过Log-Rank检验,miR-210高表达组5年生存率低于低表达组的5年生存率,差异有统计学意义(χ2=5.380,P=0.020)。见图2。
2.5 miR-210调控的靶蛋白及参与的信号通路分析 通过查询Target Scan、miRanda 和 miR Base Targets数据库,取3个数据库中共同预测的靶基因作为miR-210的可能靶基因,包括GPD1L、NFKB1、ABCB9、U2AF2、XPA、RAD52、MRE11A、ACVR1B、BDNF、APC、NFKB1、E2F3、ESPL1、EFNA3、NCAM1、PTPN1、PIM1、BDNF、PIM1、HOXA9、FGFRL1、EFNA3、VEGF共23个基因。应用miRWalk数据库中的KEGG pathway功能聚类分析miR-210调控的靶基因参与的与肿瘤相关的信号通路,可见miR-210参与了包括MAPK信号通路,Wnt信号通路等。见图3、表3。
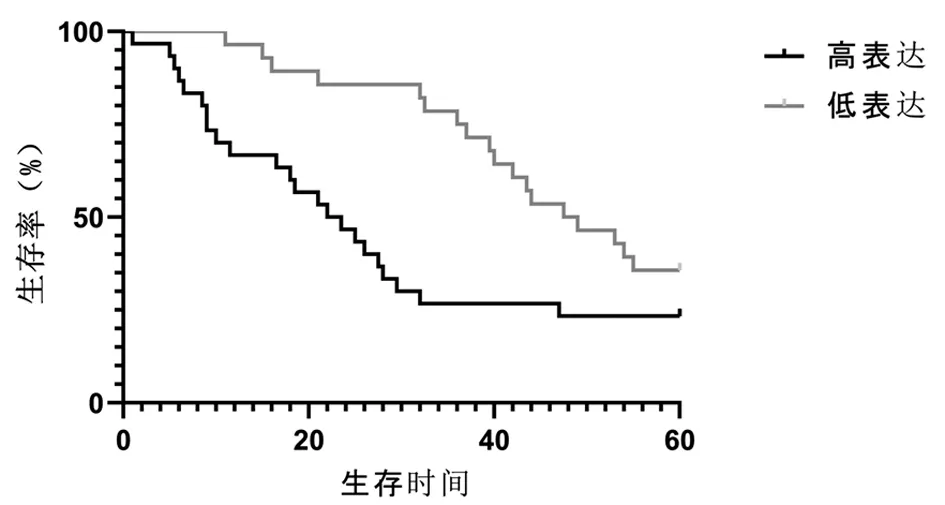
图2 miR-210 高表达组和低表达组患者生存率比较(Kaplan-Meier法)
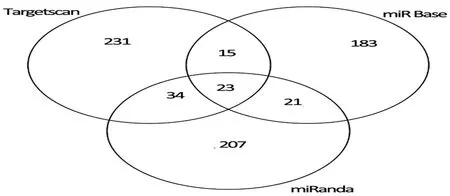
图3 miR-210靶基因的预测结果分析

表3 miR-210调控的靶基因参与肿瘤相关信号通路分析
3 讨论
卵巢癌是妇科三大恶性肿瘤之一,其病死率在女性生殖道肿瘤中居首位,5年生存率长期徘徊在30~45%左右[2]。目前对卵巢癌主要的治疗以手术+铂类为基础的化疗为主,并辅以放疗、靶向治疗等,但晚期患者远期存活率并无明显改善。其主要原因是:(1)由于卵巢癌患者缺乏早期的典型临床症状,因此大多数患者在就诊时已属晚期;(2)对化疗药物易产生耐药。因此对于卵巢癌患者的早期发现及化疗耐药的预防及逆转就显得尤为重要。通过探究卵巢癌的发生、发展及耐药机制,从而为卵巢癌患者提供新的早期诊断标志物和耐药治疗靶点已经成为研究者迫切需要解决的问题[9]。
miRNA 是一类长度约20-25个核苷酸的非编码RNA,以往认为miRNA 无生物学功能[10]。但随后研究发现人类各种类型肿瘤发生、发展均与miRNA的异常表达相关[11]。miRNA可通过调控其靶mRNA的表达参与肿瘤的生长、侵袭、血管生成和免疫逃避的发生及进展[12]。miRNA 是通过与靶基因的3’端非翻译区互补结合进而发挥转录后水平的调节作用,并且同时调控多个目标基因。因此,miRNA在生物体的生理及病理过程中发挥广泛作用。目前研究认为:与肿瘤相关的miRNAs 被分为两类:抑癌miRNAs 和促癌miRNAs[13]。尽管如此,有关人类miRNAs 异常表达导致恶性肿瘤发生发展的研究才刚刚开始,这是因为一个miRNA可以同时调控多个靶基因,一个靶基因也可以被多个miRNA调控,miRNA与靶基因之间形成了复杂调控网络。研究表明,在卵巢癌患者中,miRNA异常表达参与不同卵巢癌通路在卵巢癌的发病机制和发生过程中发挥着重要作用[14,15]。
miR-210 是近年来发现的一种与缺氧环境密切相关的miRNA,其下游靶基因通过调控细胞周期、分化、凋亡、恶变、糖酵解等过程而发挥着重要作用,与肿瘤发生发展密切相关[6,8]。正因为如此,miR-210成为科学家关注的热点之一。国内学者以miRNA微阵列技术为平台,最终筛选了卵巢癌化疗耐药与敏感组织之间表达差异的miRNA,其中在耐药组织中表达上调为has-miR-210、has-miR-1307,表达下调为has-miR-134[7]。本研究通过Real-time PCR方法检测了卵巢癌组织中miR-210的表达情况,结果提示与正常卵巢组织相比,miR-210在卵巢癌组织中表达明显上调(1.539±0.363 vs 1.017±0.289),进一步分析显示卵巢癌组织中miR-210的表达水平与卵巢癌的FIGO分期、分化类型具有明显相关性,这提示miR-210的上调表达可能参与了卵巢癌的疾病进展和肿瘤细胞的分化。同时,我们检测了卵巢上皮性癌细胞系中miR-210的表达,结果显示miR-210在各卵巢上皮性癌细胞系中均高表达,并且卵巢癌耐药细胞系与各对应卵巢癌细胞系miR-210的表达存在明显差异性,这一结果提示miR-210可能参与了卵巢癌发生、发展、耐药等各生物学过程。目前研究认为在绝大多数肿瘤中,miR-210的表达通常是升高的,例如头颈部肿瘤、胰腺癌等,这与miR-210能够促进细胞周期进程有关[16,17]。研究表明miR-210是缺氧条件下变化最明显的miRNA,这种过表达可能只是肿瘤乏氧的反应,但也有学者认为miR-210表达有可能参与肿瘤乏氧状态下的发生、发展[18]。另外,在某些肿瘤中观察到miR-210表达下降和基因缺失,暗示它具有潜在的抑制肿瘤功能。有研究发现miR-210能够明显地抑制癌细胞生长[19]。根据这些研究,我们认为miR-210在肿瘤发生和发展过程中的作用具有多面性,它可能是调节细胞自身稳态的重要分子,扰乱细胞内miR-210水平将不利于细胞的生存。因此,阐明miR-210参与卵巢癌发生、发展、耐药的具体分子机制可为卵巢癌早期诊断和治疗提供新的靶点。
在我们检测的多种卵巢上皮性癌细胞系中miR-210均有不同程度的高表达,但是通过比较具有高转移特性的HO-8910PM与亲本HO-8910细胞系,miR-210呈下调表达(35.857VS21.970,P=0.0004),通过对靶基因的分析可知:miR-210可能调控ACVR1B,PTPN1,NCAM1,而这些蛋白参与细胞运动生物学过程,这提示在卵巢上皮性癌的发生、发展过程中miR-210是一重要的角色。同时,我们对比SKOV3与耐药细胞系发现,在耐药细胞系中miR-210明显上调,这一结果与双婷等[7]对miR-210在卵巢癌耐药与敏感组织中的检测结果一致,这是否说明miR-210的表达水平差异,参与通过细胞信号通路,改变肿瘤细胞对化疗药物的敏感度,为此,我们认为进一步研究miR-210在卵巢癌化疗耐药中的机制有重要的意义。
此外,在本研究中,我们对miR-210的表达情况与卵巢癌患者的生存情况进行了分析,结果表明,miR-210高表达的卵巢癌患者中位生存时间为23.5个月,5年生存率为25.8%;miR-210低表达患者的中位生存期为49个月,5年生存率为36.0%,经Log-Rank检验,差异有统计学意义(P=0.020),miR-210高表达卵巢癌患者的生存较低表达患者差。Greither等[20]在胰腺癌患者中研究结果表明miR-210高表达胰腺癌患者的预后差于miR-210低表达患者,这与我们的研究结果是一致的。虽然CA125、HE4等肿瘤标记物在临床工作中广泛应用,但其都存在敏感性或特异性不高的问题。因此,目前卵巢癌的诊疗过程中仍然缺乏较为有效的评价预后的生物标志物,进一步研究miR-210在卵巢癌预后中的价值可以为卵巢癌的诊疗过程及预后判断提供新分子标志物。
综上所述,本研究的结果提示miR-210在卵巢癌组织及卵巢癌细胞系中均表达上调,其异常表达与卵巢癌患者的年龄及病理类型无关,与卵巢癌FIGO分期及肿瘤细胞分化程度显著相关,并且与卵巢癌患者的不良预后相关,可以作为预后判断指标,具有潜在的临床应用价值,深入研究miR-210在卵巢癌发生、发展过程中的详细分子机制,探讨其所起到的作用,可为将来卵巢癌的临床诊断、治疗以及预后判断提供详细的理论依据。

