338.15 K时四元体系CaCl2-SrCl2-BaCl2-H2O相平衡测定及溶解度计算
曹大群,金艳,陈杭,于建国
(1华东理工大学资源过程工程教育部工程研究中心,上海 200237;2苏州聚智同创环保科技有限公司,江苏常熟215513)
引 言
我国四川盆地地下卤水资源丰富[1],油气开采过程中,页岩气采出水中蕴含大量的钙、锶、钡等资源,如涪陵C井采出水中Ca、Sr和Ba的浓度为972、313和767 mg·L-1[2],而四川某页岩气田采出水 中Ca、Sr和Ba的浓度可高达14011、1337和1340 mg·L-1[3],钙、锶、钡资源具有较大的回收利用价值。地下卤水和气田采出水多属氯化物型,由于氯化锶与氯化钙会形成固溶体结构,且多元体系中水合物盐结晶水数量与温度和共存离子有关,增加了从油田采出水中分离提取卤水资源的难度。
针对含钙、锶、钡水盐体系,CaCl2-H2O二元体系中[4-6],CaCl2·6H2O存在温度为220~303 K,CaCl2·4H2O为300~318 K,CaCl2·2H2O为318~450 K,且结晶水数量也与CaCl2浓度相关[7]。袁梦霞等[8]开展了308.15 K下AlCl3-CaCl2-H2O和FeCl3-CaCl2-H2O三元体系的研究,发现平衡固相CaCl2·6H2O会失去两个结晶水转变为CaCl2·4H2O。Cao等[9]和Tan等[10]研究了Ca(H2PO2)2+CaCl2+H2O三元体系相平衡,结果表明298 K时氯化钙固相为CaCl2·6H2O,323 K时为CaCl2·2H2O。Assarsson等[11-13]开 展 了 多 元 体 系NaCl-KCl-CaCl2-MgCl2-SrCl2-H2O所含子体系的研究。二 元 体 系SrCl2-H2O中,SrCl2·6H2O向SrCl2·2H2O的转变温度为333.8~334.3 K时,当温度高于317.7 K,体系中不存在固溶体。Steiger等[14]对SrCl2-H2O体系研究结果表明,氯化锶的结晶水数量也与其浓度有关。毕玉敬等[15]开展了三元体系CaCl2-SrCl2-H2O在298.15 K时的相平衡研究,该温度下平衡固相为CaCl2·6H2O、SrCl2·6H2O和钙锶固溶体。对323 K时CaCl2-SrCl2-H2O三元体系的相平衡研究中,张晓[16]发现该温度时平衡固相中为CaCl2·2H2O、SrCl2·6H2O和钙锶固溶体,Han等[17]的研究结果表明平衡固相为CaCl2·2H2O、SrCl2·2H2O和SrCl2·6H2O,体系中不存在固溶体。Li等[18]研究了CaCl2-SrCl2-H2O三元体系的多温度相平衡,发现303 K时平衡固相为CaCl2·4H2O、SrCl2·2H2O、钙锶固溶体和SrCl2·6H2O,323 K时平衡固相为CaCl2·2H2O、SrCl2·2H2O和SrCl2·6H2O,而333 K时固溶体重新出现。乔占平[19]研究了303.15 K时三元体系BaCl2-LaCl3-H2O相平衡,周久龙等[20]研究了353.15 K时三元体系BaCl2-NaCl-H2O相平衡,结果表明水盐体系平衡固相中,氯化钡多以BaCl2·2H2O形式存在。卤水体系中,以往大多采用硫酸盐沉淀法[21]分离Ba2+,所以含钡卤水体系相平衡数据较少。为高效分离和回收采气废水中的钙、锶、钡元素,本文开展钙、锶和钡的氯化物水盐体系相平衡研究,获取338.15 K时四元体系CaCl2-SrCl2-BaCl2-H2O的溶解度数据,明晰338.15 K时该体系下的平衡固相及结晶规律,为油田卤水的综合开发和高效利用提供理论依据和数据支撑。
1 实验材料和方法
1.1 仪器与药品
主要仪器:分析天平(ME204E/02,Mettler-Toledo,精度0.0001g),原子吸收光谱仪(AAS-3000,ThermoFisher Scientific),电感耦合等离子体发射光谱 仪(ICP-OES,Spectro),恒温振荡水浴(SW23,Julabo,精度±0.01 K),X射线粉晶衍射仪(D8 advanced,Bruker AXS)。本实验所采用药品:CaCl2(纯 度≥96.0%)、SrCl2·6H2O(纯 度≥99.0%)和BaCl2·2H2O(纯度≥99.5%),均为国药集团生产的分析纯试剂,其中CaCl2经重结晶后使用。
1.2 实验方法
采用等温溶解平衡法测定三元体系的相平衡溶解度数据。首先按照不同配比分别称量药品,配制成一系列饱和溶液置于恒温振荡水浴中,设定实验温度338.15 K(±0.01 K),振荡速率为180 r/min。随后每隔6 h对上清液取样进行化学分析,当样品中各离子的浓度差连续三次均小于0.5%时,可认为溶液中化学组成不变,该体系已达溶解平衡。静置24 h后,分析其液相组成,测定溶液密度,平衡固相采用湿渣法和X射线粉晶衍射法测定。
1.3 分析方法
液相及湿渣中各离子的组成分析参照国标进行。Cl-浓度采用硝酸银标准溶液滴定(GB/T 13025.5—2012),误差≤0.5%。由于Ca2+、Sr2+和Ba2+同时对铬黑T指示剂产生颜色变化,无法采用滴定法分别测定其含量,因此采用原子吸收光谱(AAS)测定Ca2+和Sr2+浓度,误差≤1%,同时采用ICP-OES测定Sr2+和Ba2+浓度,误差≤2%。平衡固相进行X射线多晶衍射分析时的光管为铜靶Kα,扫描范围10°~80°,扫描速率10(°)/min,步长0.02°。
2 实验结果与讨论
2.1 CaCl2-SrCl2-H2O三元体系
338.15 K时CaCl2-SrCl2-H2O三元体系平衡液相组成、液相密度和湿渣组成列于表1,平衡液相与湿渣组成以质量分数(%)表示,密度以g/cm3表示。由此绘制的平衡相图如图1所示。对应密度-组成图和XRD谱图分别如图2和图3所示。
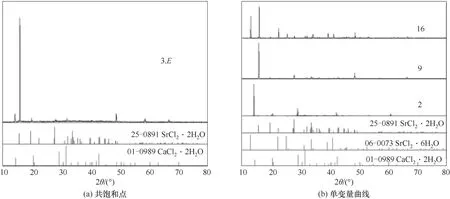
图3 CaCl2-SrCl2-H2O三元体系在338.15 K时的固相XRD谱图Fig.3 XRD patterns of the solid phases in the ternary system CaCl2-SrCl2-H2O at 338.15 K
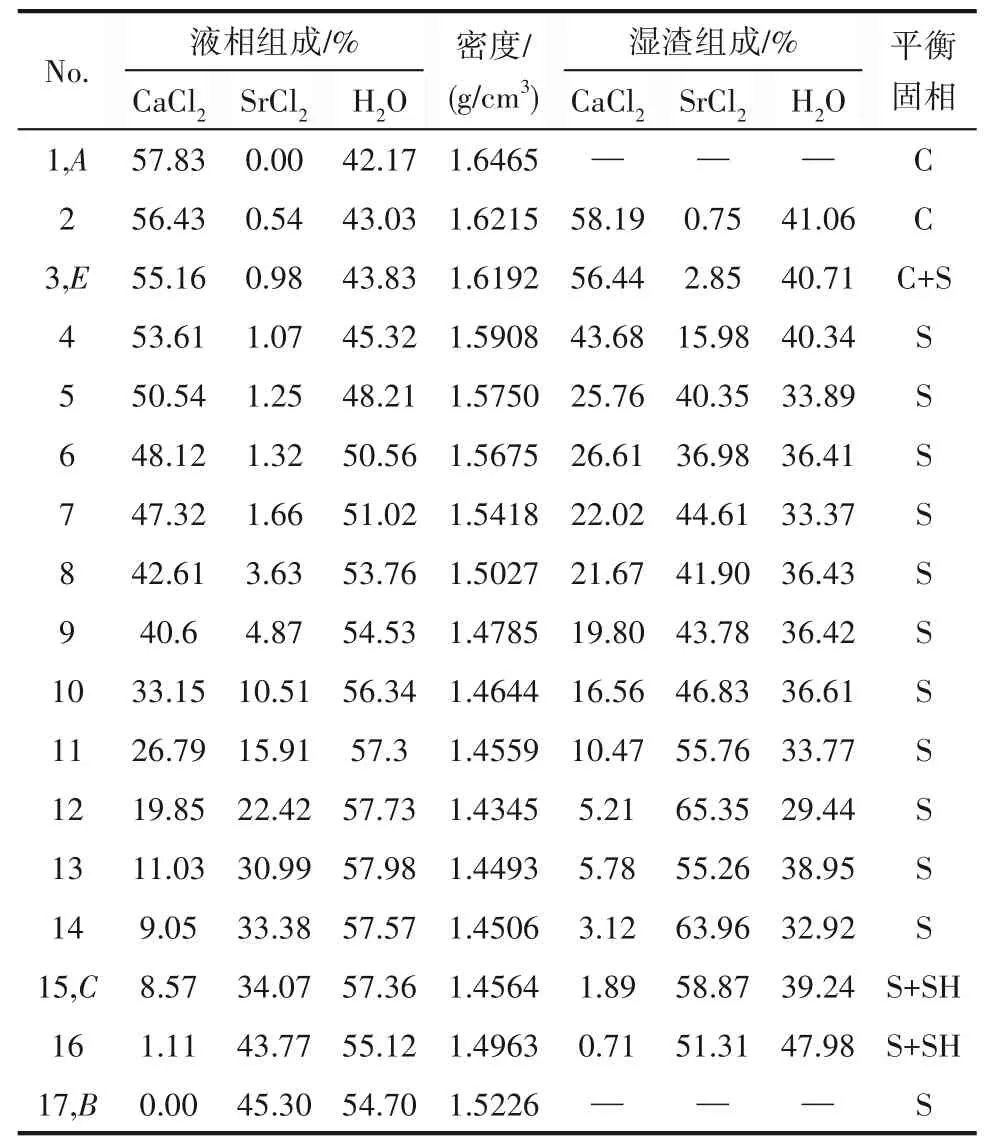
表1 CaCl2-SrCl2-H2O三元体系在338.15 K时的溶解度数据Table 1 Solubility data of the ternary system CaCl2-SrCl2-H2O at 338.15 K
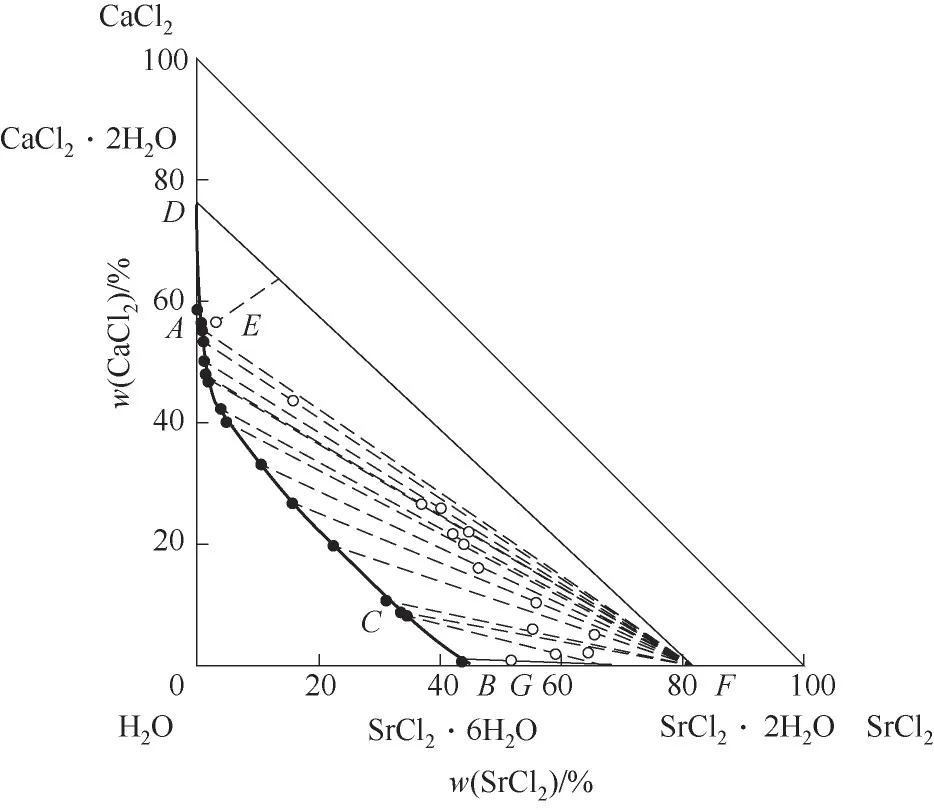
图1 CaCl2-SrCl2-H2O三元体系在338.15 K时的相图Fig.1 Phase diagram of the ternary system CaCl2-SrCl2-H2O at 338.15 K
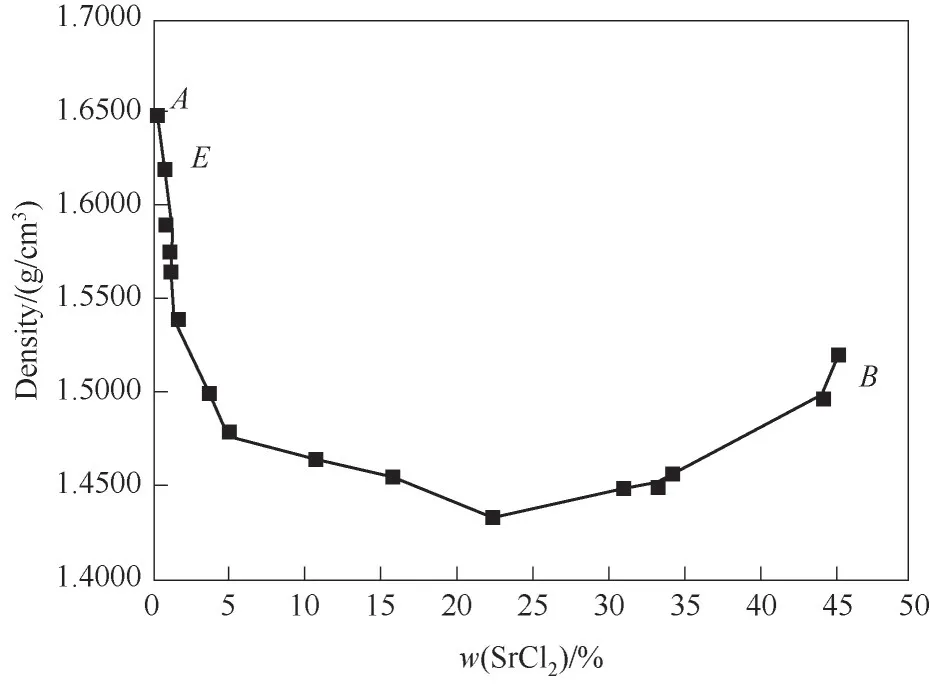
图2 CaCl2-SrCl2-H2O三元体系在338.15 K时的密度-组成图Fig.2 Density composition diagram of ternary system CaCl2-SrCl2-H2O at 338.15 K
338.1 5 K时CaCl2-SrCl2-H2O三元体系中无复盐和固溶体产生,属简单共饱和型体系,平衡相图中包含2个不变点,3条单变量曲线和3个结晶区。不变点E是CaCl2和SrCl2的共饱点,其液相组成为w(CaCl2)=55.16%,w(SrCl2)=0.98%,不变点C对应的平衡固相为SrCl2·6H2O与SrCl2·2H2O,其液相组成为w(CaCl2)=8.57%,w(SrCl2)=34.04%。点A和B分别代表CaCl2和SrCl2的二元饱和点,点E、G和F分别对应CaCl2·2H2O、SrCl2·6H2O和SrCl2·2H2O的纯固相组成点。单变量曲线AE、EC和CB分别为CaCl2·2H2O、SrCl2·2H2O和SrCl2·2H2O+SrCl2·6H2O的溶解度 曲 线,对应的3个结晶区 为CaCl2·2H2O结 晶 区(ADE区域)、SrCl2·2H2O结晶区(CEF区域)和SrCl2·2H2O+SrCl2·6H2O共结晶区(BCF区域)。
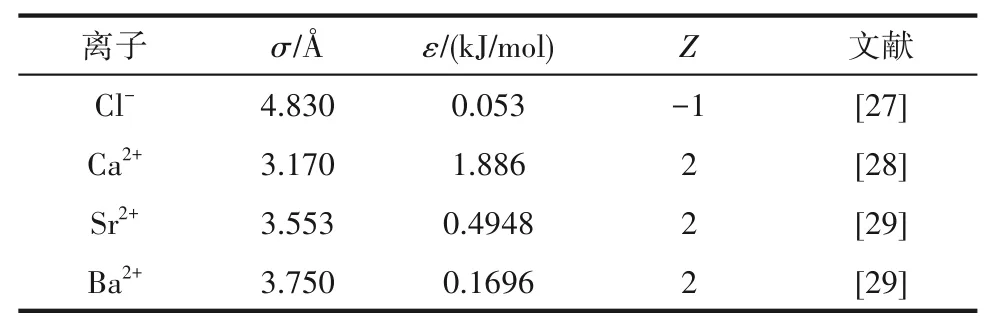
从相图中可以看出,在SrCl2·2H2O+SrCl2·6H2O共结晶区内,即液相组成w(CaCl2)为0~8.57%,w(SrCl2)为34.07%~45.30%,液相点与湿渣点相连的延长线与SrCl2坐标轴相交,交点在SrCl2·2H2O组成与SrCl2·6H2O组成之间,即在[59.46,84.48]区间内。XRD结果 表明,SrCl2·6H2O和SrCl2·2H2O特征 衍射峰同时存在。分析原因:在SrCl2-H2O二元溶液中,SrCl2·6H2O向SrCl2·2H2O的 转 变温度为61.4℃,即334.55 K,而当溶液中存在其他离子时,SrCl2·6H2O向SrCl2·2H2O的转变温度会发生变化[22]。338.15 K时体系中平衡固相仍存在SrCl2·6H2O固相,但其结晶区面积远小于SrCl2·2H2O结晶区面积,XRD衍射结果表明第15个点和第16个点同时存在SrCl2·6H2O和SrCl2·2H2O的特征峰,可判断在Ca2+少量存在 时,CaCl2-SrCl2-H2O三 元 体 系 中SrCl2·6H2O向SrCl2·2H2O转变温度高于SrCl2-H2O二元溶液中的334.55 K。
相图中SrCl2·mH2O(m=2,6)结晶区面积明显大于CaCl2·2H2O结晶区面积,表明体系中CaCl2溶解度大于SrCl2溶解度,结合体系密度-组成图,随着w(SrCl2)增加,溶液密度呈现先下降再增大的趋势,溶液总溶解度先降低后略微上升,说明在CaCl2-SrCl2-H2O体系中,CaCl2对SrCl2有盐析作用,SrCl2更易从溶液中析出。
2.2 CaCl2-BaCl2-H2O三元体系
338.15 K时CaCl2-BaCl2-H2O三元体系相平衡数据如表2所示,平衡相图如图4所示,对应密度-组成图和XRD谱图分别如图5和图6所示。
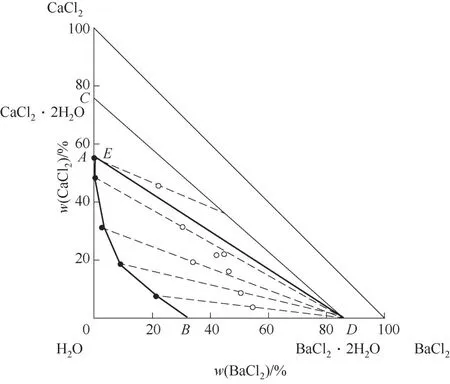
图4 CaCl2-BaCl2-H2O三元体系在338.15 K时的相图Fig.4 Phase diagram of the ternary system CaCl2-BaCl2-H2O at 338.15 K
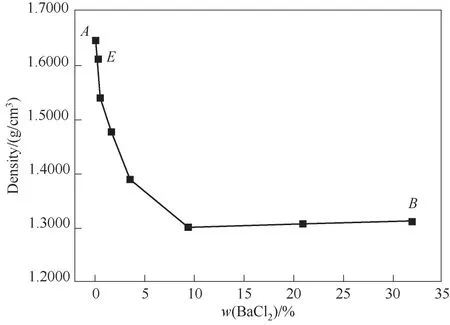
图5 CaCl2-BaCl2-H2O三元体系在338.15 K时的密度-组成图Fig.5 Density composition diagram of ternary system CaCl2-BaCl2-H2O at 338.15 K
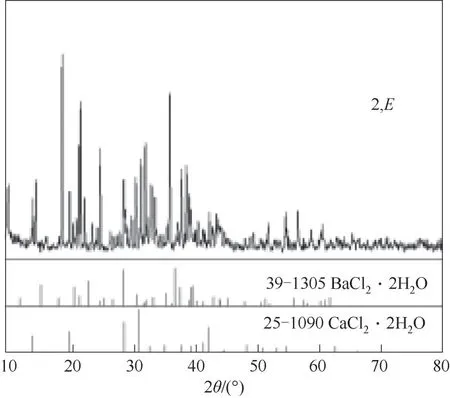
图6 CaCl2-BaCl2-H2O三元体系在338.15 K时共饱和点的固相XRD谱图Fig.6 XRD patterns of the solid phases of co-saturation point in the ternary system CaCl2-BaCl2-H2O at 338.15 K
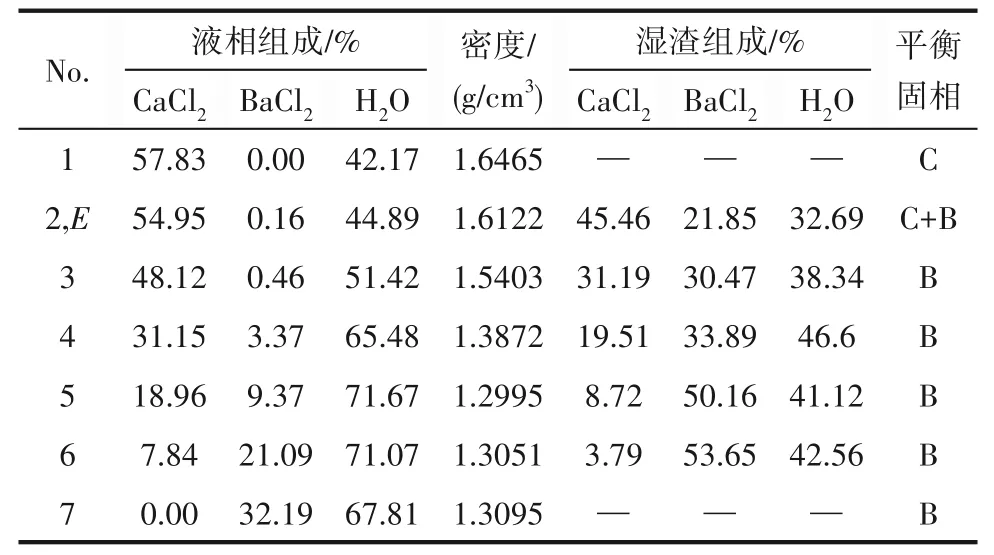
表2 CaCl2-BaCl2-H2O三元体系在338.15 K时的溶解度数据Table 2 Solubility data of the ternary system CaCl2-BaCl2-H2O at 338.15 K
338.15 K时三元体系CaCl2-BaCl2-H2O属简单共饱和型体系,无复盐和固溶体产生,相图中包含1个共饱和点,2条单变量曲线,2个结晶区。共饱和点组成为w(CaCl2)=54.95%,w(BaCl2)=0.16%,对应的平衡固相为CaCl2·2H2O和BaCl2·2H2O。单变量曲线AE和BE分 别是CaCl2·2H2O和BaCl2·2H2O的 溶解度曲线,对应的2个结晶区为CaCl2·2H2O结晶区(ACE区 域),BaCl2·2H2O结 晶 区(BDE区 域)。CaCl2·2H2O结晶区比BaCl2·2H2O结晶区小得多,且CaCl2·2H2O单变量溶解度曲线也非常短,表明CaCl2对BaCl2的盐析作用比较明显,BaCl2极易以BaCl2·2H2O结晶盐的形式析出。
2.3 SrCl2-BaCl2-H2O三元体系
338.1 5 K时SrCl2-BaCl2-H2O三元体系的相平衡数据如表3所示,由此绘制的平衡相图如图7所示。对应密度-组成图和XRD谱图分别如图8和图9所示。
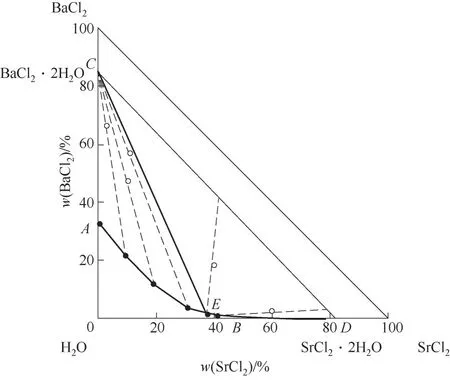
图7 SrCl2-BaCl2-H2O三元体系在338.15 K时的相图Fig.7 Phase diagram of the ternary system SrCl2-BaCl2-H2O at 338.15 K
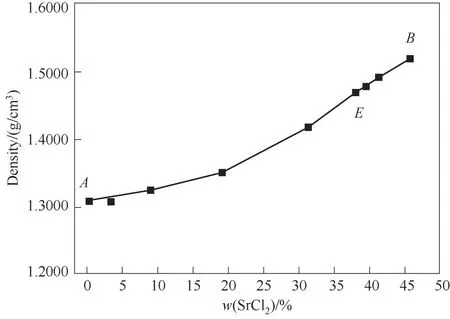
图8 SrCl2-BaCl2-H2O三元体系在338.15 K时的密度-组成图Fig.8 Density composition diagram of ternary system SrCl2-BaCl2-H2O at 338.15 K

图9 SrCl2-BaCl2-H2O三元体系在338.15 K时共饱和点的固相XRD谱图Fig.9 XRD patterns of the solid phases of co-saturation point in the ternary system SrCl2-BaCl2-H2O at 338.15K
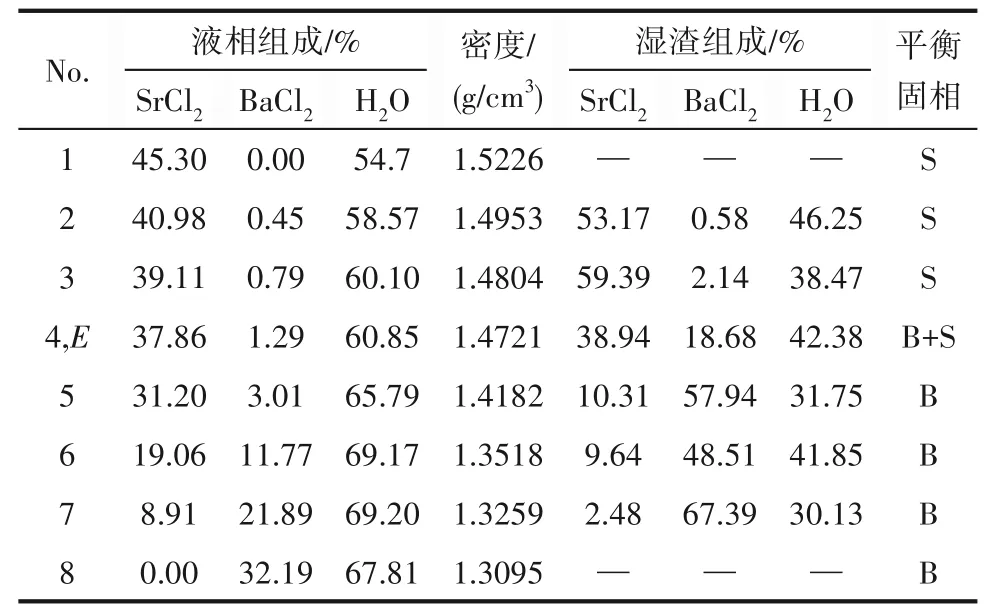
表3 SrCl2-BaCl2-H2O三元体系在338.15 K时的溶解度数据Table 3 Solubility data of the ternary system SrCl2-BaCl2-H2O at 338.15 K
338.1 5 K时三元体系SrCl2-BaCl2-H2O属简单共饱和型体系,无复盐和固溶体形成,相图中包含1个共饱和点,2条单变量曲线和2个结晶区。共饱和点E液相组成w(SrCl2)=37.86%,w(BaCl2)=1.29%,共饱和点对应的平衡固相为BaCl2·2H2O和SrCl2·2H2O。单变量曲线AE和BE分 别 是BaCl2·2H2O和SrCl2·2H2O的饱和曲线,对应的2个结晶区为BaCl2·2H2O结晶区(ACE区域)和SrCl2·2H2O结晶区(BDE区域)。相比BaCl2结晶区,SrCl2·2H2O结晶区要小许多,从密度-组成图也可看出随SrCl2含量增大,溶液密度增大,SrCl2溶解度比BaCl2溶解度更大,BaCl2更易从溶液中以BaCl2·2H2O的形式析出。
2.4 CaCl2-SrCl2-BaCl2-H2O四元体系
采用等温溶解平衡法研究四元体系时,应先配制三元子体系共饱和点,再依次加入第三种盐,搅拌至平衡。例如,在CaCl2-SrCl2-H2O三元体系的共饱和点,依次加入BaCl2配制成一系列四元饱和溶液,放置于恒温水浴振荡器中,不断振荡以达到平衡。其余过程与三元相平衡实验相同,定期取上层清液分析液相组成,以其含量组成不变作为达到平衡的标志。平衡后取液相和湿渣进行化学分析,采用比重瓶法测定液相密度,固相过滤烘干后采用X射线粉晶衍射分析,并绘制等温相图、水图及密度-组成图。
四元相图液相浓度分析时除了采用质量分数(%)表示,还常采用单盐的干基浓度表达[23],即系统中各组分在100 g干盐中的质量,具体表达为Jänecke指数J(i),单位为g/(100 g干盐)。该体系中各组分的Jänecke指数满足如下关系:
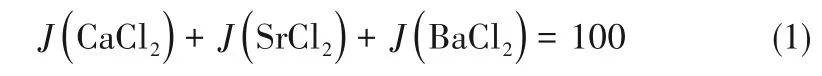
其中各组分的Jänecke指数按照式(2)~式(4)计算:
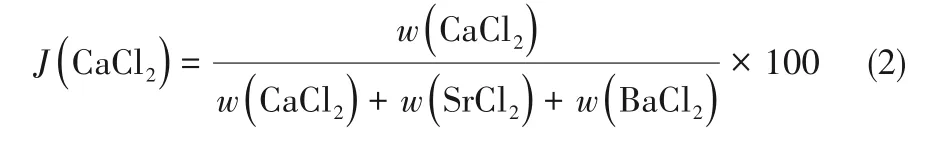
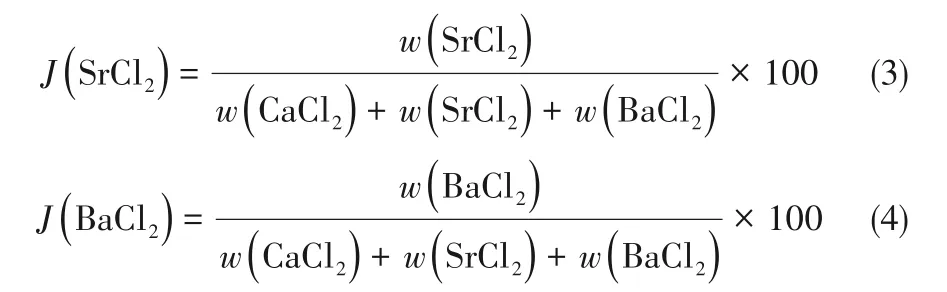
338.1 5 K时 四元体系CaCl2-SrCl2-BaCl2-H2O的溶解度数据如表4所示,图10为绘制的空间立体图、干盐图和干盐线放大图。图11为水图和密度-组成图。
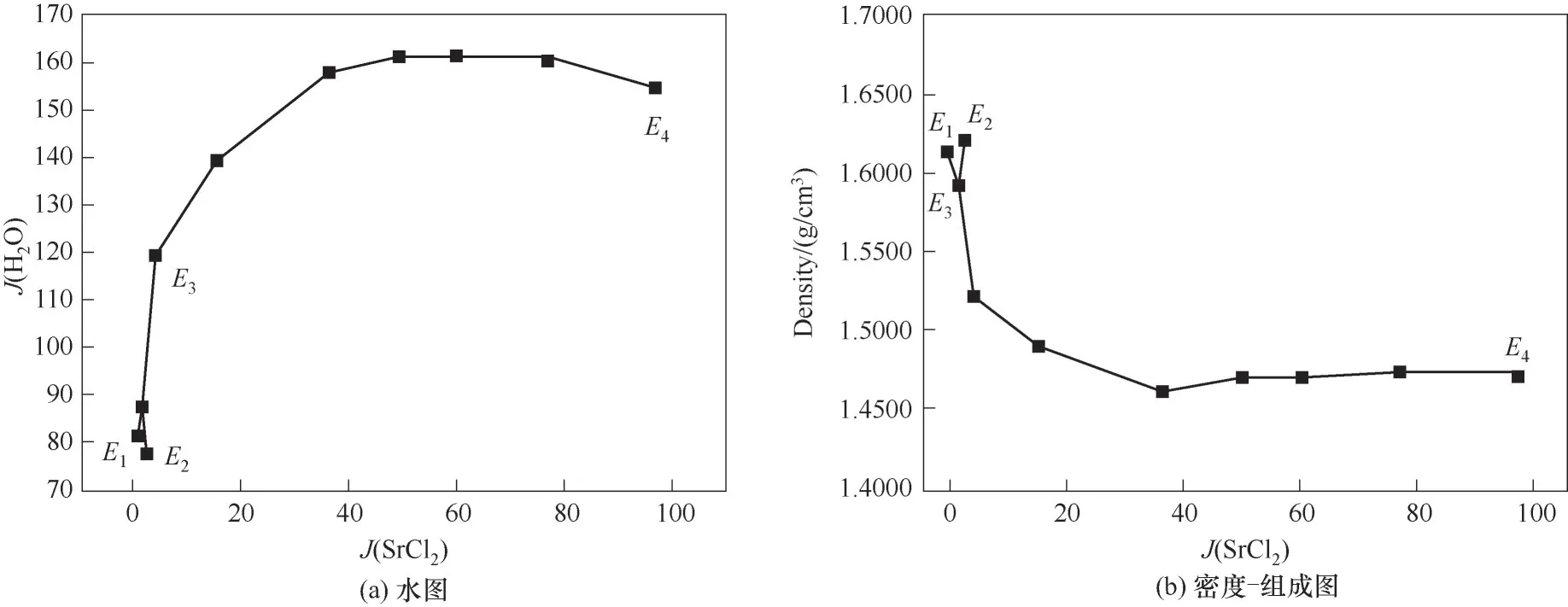
图11 CaCl2-SrCl2-BaCl2-H2O四元体系在338.15 K时的水图和密度-组成图Fig.11 Water content diagram and density composition diagram of the quaternary system CaCl2-SrCl2-BaCl2-H2O at 338.15 K
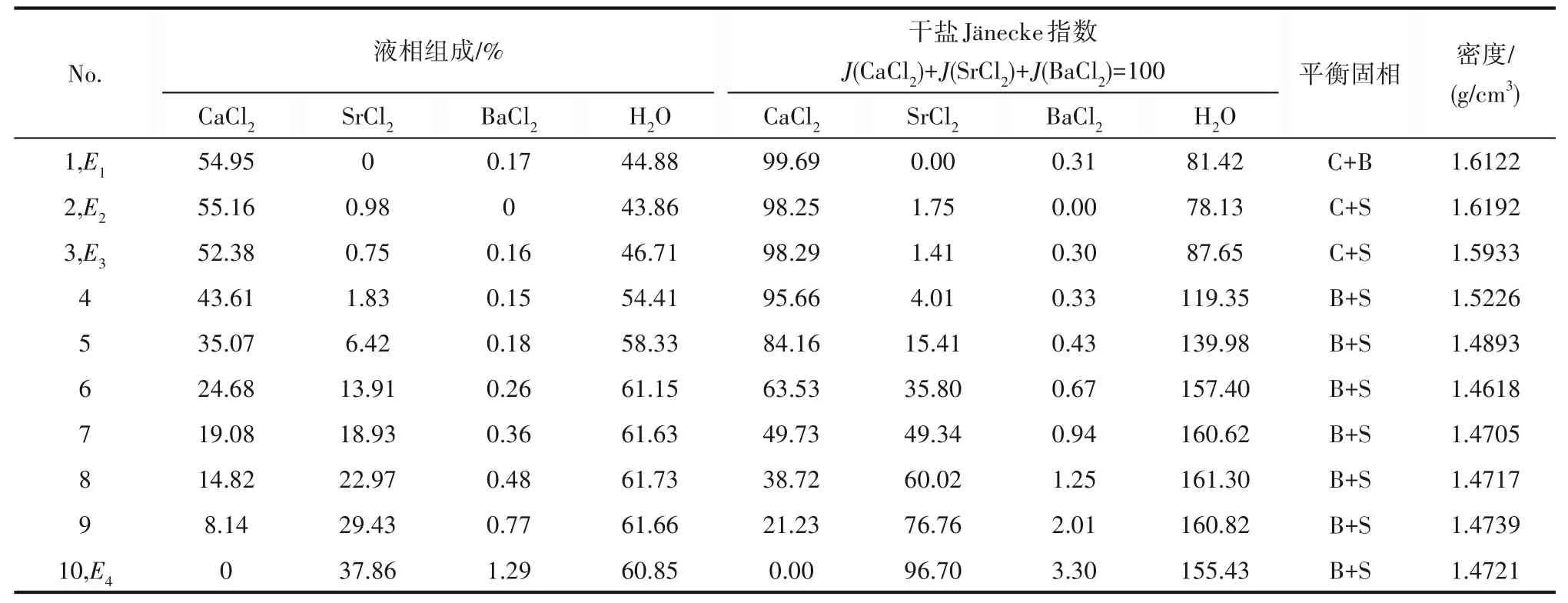
表4 CaCl2-SrCl2-BaCl2-H2O四元体系在338.15 K时的溶解度数据Table 4 Solubility data of the quaternary system CaCl2-SrCl2-BaCl2-H2O at 338.15 K
图10(a)为四元体系空间立体图,3条侧棱柱代表3个二 元体 系:CaCl2-H2O、SrCl2-H2O和BaCl2-H2O;3个侧面分别表示3个三元体系:CaCl2-SrCl2-H2O、CaCl2-BaCl2-H2O和SrCl2-BaCl2-H2O;三棱柱内部的点为四元体系的系统点;将四元体系空间立体三棱柱向底面投影,投影后得到的底面三角形为CaCl2-SrCl2-BaCl2-H2O四元体系的干基三角相图,如图10(b)干盐图。由于体系中BaCl2溶解度非常小,为了更直观显示干盐图中的干盐线,将图10(b)横坐标从0~100缩短至0~4,即为图10(c)干盐线放大图。
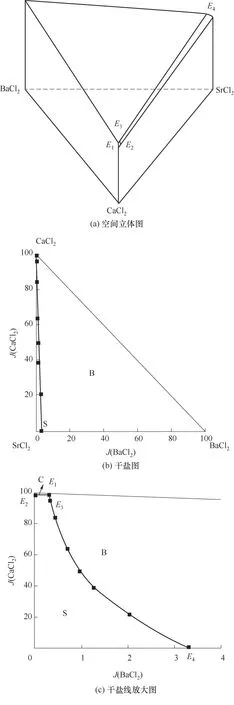
图10 CaCl2-SrCl2-BaCl2-H2O四元体系338.15 K时相图Fig.10 Phase diagrams of the quaternary system CaCl2-SrCl2-BaCl2-H2O at 338.15 K
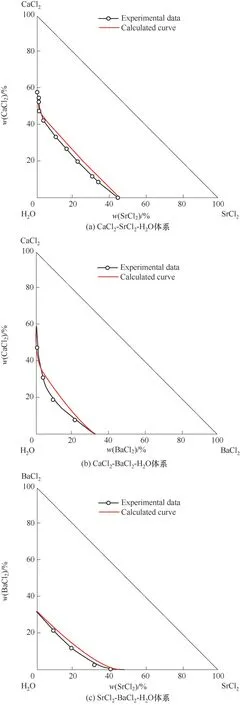
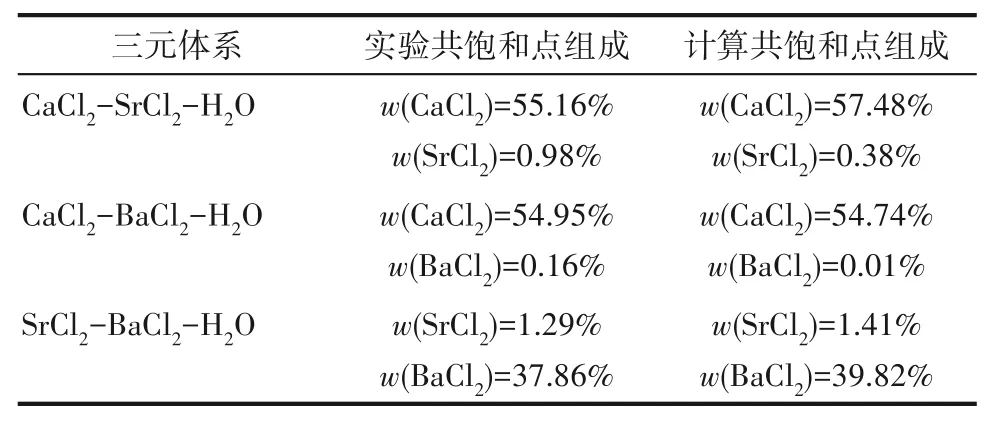
如相图所示,338.15 K时四元体系CaCl2-SrCl2-BaCl2-H2O中存在1个四元共饱和点,3个不同种类盐结晶区和3条单变量曲线。点E3是该体系的四元共饱和点,平衡液相组成为w(CaCl2)=52.38%,w(SrCl2)=0.75%,w(BaCl2)=0.16%,对应的平衡固相为CaCl2·2H2O+SrCl2·mH2O+BaCl2·2H2O。3条单变量曲线E1E3、E2E3和E3E4分别表示CaCl2+BaCl2干盐曲线、CaCl2+SrCl2干盐曲线、SrCl2+BaCl2干盐曲线。各曲线对应的平衡固相XRD谱图如图12所示。3个结晶区分别为CaCl2·2H2O结晶区、BaCl2·2H2O结晶区和SrCl2·mH2O结晶区。BaCl2结晶区最大,其次是SrCl2结晶区,而CaCl2结晶区非常小,表明单盐溶解度大小的顺序依次为BaCl2 图12 338.15 K时CaCl2-SrCl2-BaCl2-H2O四元体系XRD谱图Fig.12 XRD patterns of the solid phase of the quaternary system CaCl2-SrCl2-BaCl2-H2O at 338.15 K 根据密度泛函(density functional theory,DFT)理论[24],进 行338.15 K三元体系CaCl2-SrCl2-H2O、CaCl2-BaCl2-H2O和SrCl2-BaCl2-H2O的溶解度计算。三元水盐体系Am1Cn1-Bm2Cn2-H2O中,离子Ax+、By+、Cz-以及盐Am1Cn1和Bm2Cn2,分别用1、2、3、4和5指代。引入数密度ρ表示单位体积的粒子数目,反映溶液中各离子的组成浓度。体系中溶液呈电中性: 完全电离的强电解质水溶液体系中,解离过程中各溶质分子的化学势等于解离而得的各离子化学势之和,所以有: 溶液达到饱和后,溶液体系的化学势不再发生改变。DFT理论中,计算溶液体系的巨势后,则可以计算得到溶液中各物质的溶解度。溶液体系的巨势可以表示为体系中各粒子组成的函数: 式中,Ω为溶液的巨势;V为体系的总体积;ρi、μi分别为各物质的数密度和化学势;F(ρ1,ρ2,ρ3)为盐溶液的固有Helmholtz自由能。对于强电解质溶液体系的模型预测计算,可忽略未电离的溶质分子对体系巨势的作用。三元水盐体系中,将式(5)代入式(7)中消去ρ3,同式(6)联立,则有: 无机盐的溶解过程是自发进行的,溶液体系的巨势在溶解过程中不断减小直至溶液达饱和态。饱和溶液中,溶解过程达到平衡时,巨势值最低,此时: 三元水盐体系中,只有盐Am1Cn1和盐Bm2Cn2都在溶液中达饱和,式(9)才成立。但当溶液中只有一种盐达饱和,例如盐Bm2Cn2在溶液中达到饱和,而Am1Cn1未达饱和,该条件下式(9)仅对i=2成立。将式(8)和式(9)联立,得到盐Am1Cn1的溶解度曲线方程: DFT理论模型中,式(10)溶解度曲线方程也适用于单盐Am1Cn1的二元体饱和溶液,即ρ2=0。相同热力学条件,体系中物质的化学势是一个固有属性,其值恒定不变,则有: 式(11)即为DFT理论中溶解度计算的核心方程。其物理意义为:在一定的热力学条件下,对盐Am1Cn1,无论在二元水盐体系还是三元水盐体系,其饱和水溶液的化学势始终不变,为一定值,该值可通过该热力学条件下二元体系的溶解度求得。由相平衡理论中相律可知,温度压力不变,相图中的溶解度曲线上的自由度为1,盐Am1Cn1的溶解度随着溶液中盐Bm2Cn2含量的变化而相应改变,由式(11)可知,只需指定盐Bm2Cn2的组成便可确定此时盐Am1Cn1的溶解度。 同理,盐Bm2Cn2的溶解度曲线为: 式(11)和式(12)为在三元水盐体系中两种盐的溶解度方程,是DFT模型中用于计算溶解度的核心方程。由两式可分别计算出两种盐的溶解度数密度曲线,当两式同时成立,即两种盐同时达到饱和,两条数密度曲线的交点即为该三元体系共饱和点的组成。 溶液的固有Helmholtz能由理想项和超额项组成: Helmholtz自由能超额项中,Fexc代表离子间的相互作用,相互作用由L-J势(Lennard-Jones potential)和库仑力两部分组成[25]。理想均质流体的条件下,依据EOS状态方程和电解质溶液亚原始模型可近似计算超额Helmholtz自由能。此时,超额Helmholtz自 由 能Fexc由L-J相 互 作 用(Lennard-Jones interaction)和库仑力作用两部分组成。 (1)Helmholtz自由能的理想部分 式中,kB为Boltzmann常数;T为体系的热力学温度;Λi=,h为Planck常数,mi为离子i的质量。在三元水盐体系计算过程中,式(14)中只有两个独立变量ρ1和ρ2,计算自由能时需考虑所有离子对体系的贡献,即i=1,2,3。 (2)Helmholtz自由能超额项的L-J作用部分 计算出MBWR-EOS状态方程的模型参数[26]后,即可通过式(17)~式(20)计算溶液中自由能超额项,根据式(16)汇总计算得到体系自由能超额项的L-J作用贡献部分FexcL-J。 其中,A=exp(-γρ*2);γ是一个可调参数,通常取γ=3[26]。相关离子的L-J作用参数见表5。 表5 各离子L-J作用参数Table 5 L-J parameters adopted in the present work (3)Helmholtz自由能超额项的静电力作用部分 根据式(21)计算得到溶液中Helmholtz自由能超额项的静电作用贡献部分。 式(21)中,Γ是一个尺度参数,可由式(23)和式(24)迭代计算得到。 (4)溶解度曲线计算 根据Helmholtz自由能计算结果,由式(7)得到溶液体系的巨势,结合DFT理论模型溶解度计算方程,将各盐的二元溶解度数据代入式(11)和式(12),计算三元水盐体系中两种盐的溶解度曲线。 需注意的是,若上述函数中包含ρ3,需按偏导数计算规则,求导过程中做以下变换: 根据表6中各盐的二元溶解度数据,结合DFT计算方程,计算338.15 K时三元体系CaCl2-SrCl2-H2O、CaCl2-BaCl2-H2O和SrCl2-BaCl2-H2O的理论相平衡数据。 表6 338.15 K时各盐的二元溶解度数据Table 6 Solubility data of the involved pure salts in water at 338.15 K 由图13和表7可以看出,三元体系CaCl2-SrCl2-H2O、CaCl2-BaCl2-H2O和SrCl2-BaCl2-H2O的DFT理论计算相图和实验相图的共饱点位置基本吻合,溶解度曲线趋势相同,三种体系的理论相图均能较好反映其溶解度规律。从两种盐的总溶解度来看,DFT模型计算溶解度比实验值大,计算值与实验值存在一定差异,在CaCl2-BaCl2-H2O三元体系中,该差异更明显,这是因为CaCl2对BaCl2有较强的盐析作用,而DFT模型是基于二元体系溶解度计算得到三元体系溶解度,对离子间相互作用较大的体系,DFT模型预测准确性下降。 图13 338.15 K三元体系中实验数据和DFT计算结果的溶解度曲线Fig.13 Solubility curves of the experimental data and the calculated results in the ternary systems at 338.15 K 表7 三元体系共饱和点的实验组成和计算结果Table 7 Experimental composition and calculation results of co-saturation point of ternary system DFT模型对三元体系预测时,模型中参数均来自研究较为成熟的MBWR状态方程,不需要通过实验数据拟合模型参数,仅需知道三元体系中两种盐的二元体系溶解度数据,便可以计算得到三元体系的相图,对于快速预测相平衡数据,缩短工艺确定周期,提高工业化效率具有重要意义。但是当溶液体系为四元或以上时,溶液中离子交互关系和相互作用复杂,DFT理论模型已不适用。 (1)采用等温溶解平衡法研究了338.15 K时四元体系CaCl2-SrCl2-BaCl2-H2O及其三元子体系的稳定相平衡。测定体系平衡时各组分的溶解度、液相密度,并根据溶解度数据绘制了三元体系的平面相图和密度-组成图,四元体系的立体相图、干基图、水图和密度-组成图。 (2)338.15 K时三元体系CaCl2-SrCl2-H2O相图中存在1个共饱和点、2条单变量溶解度曲线和3个结 晶 区(分 别 为CaCl2·2H2O、SrCl2·2H2O和SrCl2·2H2O+SrCl2·6H2O)。其中,SrCl2·6H2O向SrCl2·2H2O的转变温度受溶液中CaCl2浓度的影响。三元体系CaCl2-BaCl2-H2O相图中存在1个共饱和点、2条单变量溶解度曲线和2个结晶区(分别为CaCl2·2H2O和BaCl2·2H2O),CaCl2对BaCl2具有较强的盐析效应。三元体系SrCl2-BaCl2-H2O相图中存在1个共饱和点、2条单变量溶解度曲线和2个结晶区(分别为SrCl2·2H2O和BaCl2·2H2O)。 (3)338.15 K时 四 元 体 系CaCl2-SrCl2-BaCl2-H2O相图中存在1个共饱和点、3条单变量干盐曲线和3个结晶 区[分 别为CaCl2·2H2O、BaCl2·2H2O和SrCl2·mH2O(m=2,6)]。CaCl2·2H2O结晶区非常小,BaCl2·2H2O结晶区非常大,三种盐溶解能力的大小为CaCl2>SrCl2>BaCl2,即BaCl2最容易从混合溶液中析出BaCl2·2H2O晶体,CaCl2的析出则非常困难。 (4)基于DFT理论模型完成了三元体系CaCl2-SrCl2-H2O、CaCl2-BaCl2-H2O和SrCl2-BaCl2-H2O在338.15 K的相平衡理论计算,实验结果与计算结果吻合较好。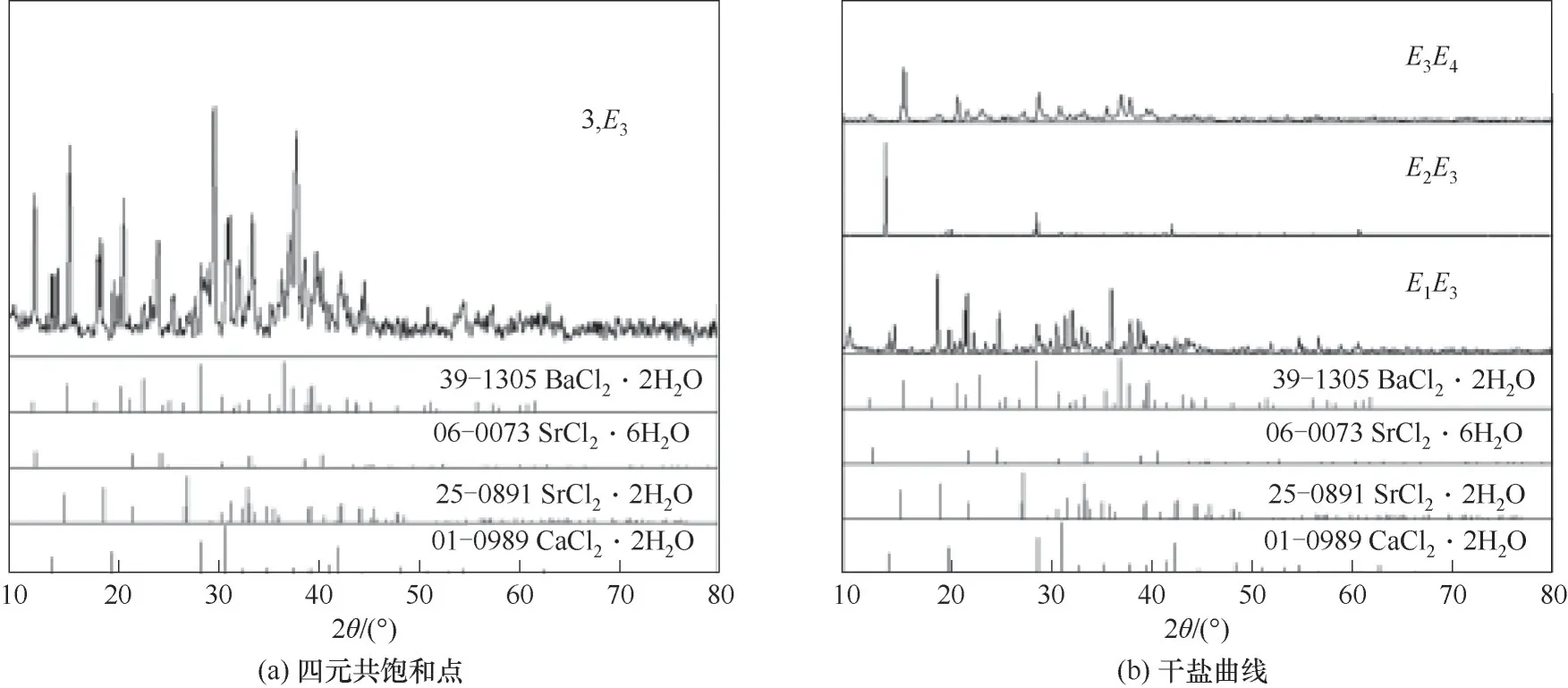
3 溶解度计算

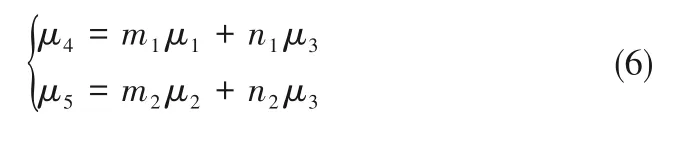
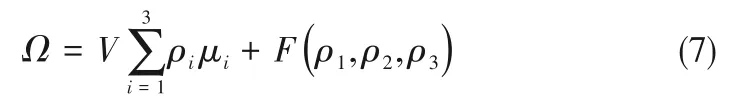
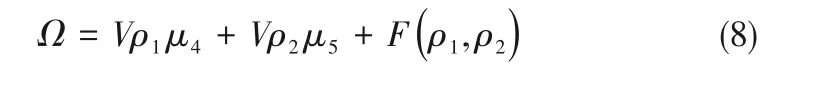
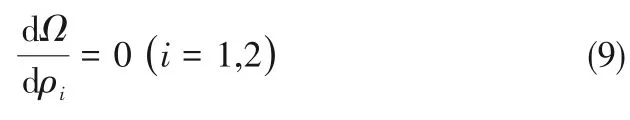

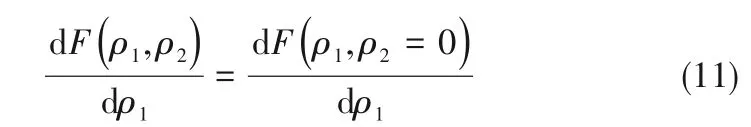
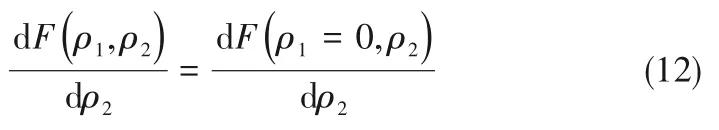

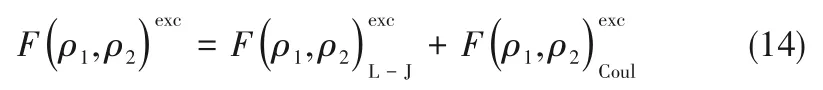
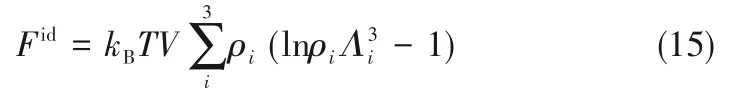
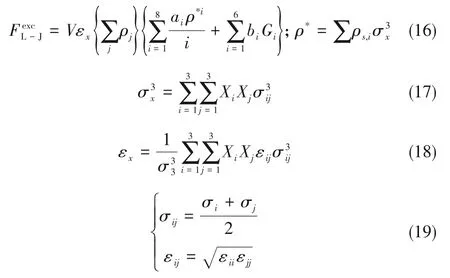
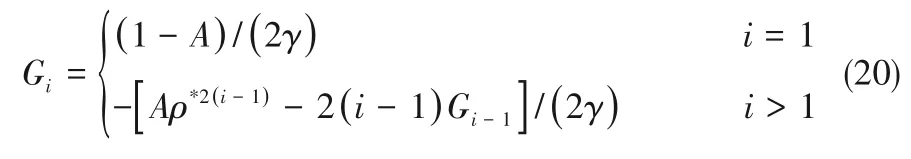

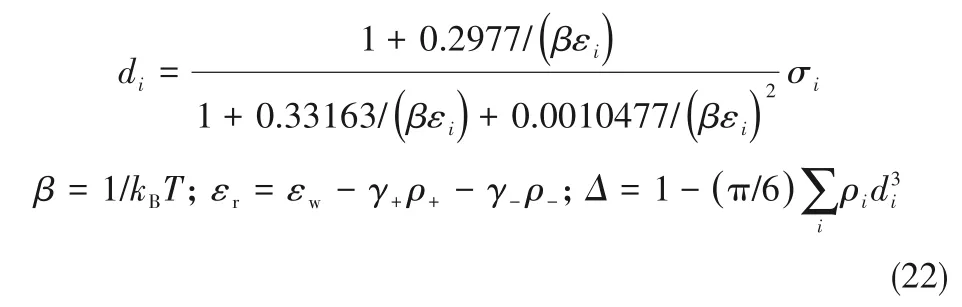
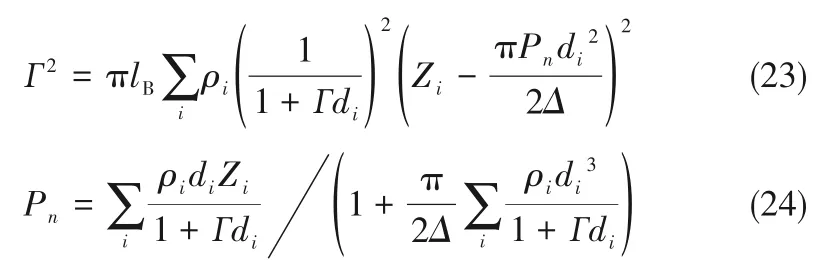
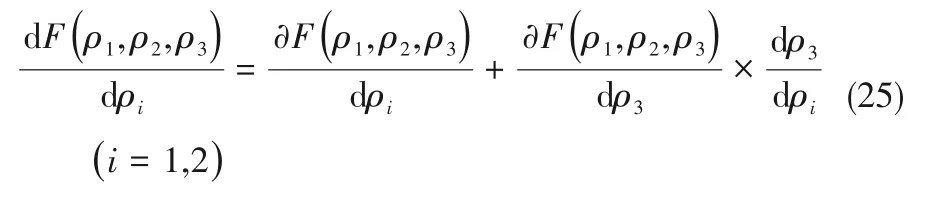
4 结 论

