AEE在人工胃/肠液和肠道菌群及生物样品中的稳定性
陶 琦,秦 哲,白莉霞,刘希望,李世宏,杨亚军,李剑勇 (中国农业科学院 兰州畜牧与兽药研究所 农业农村部兽用药物创制重点实验室/甘肃省新兽药工程重点实验室,甘肃 兰州 730050)
阿司匹林丁香酚酯(aspirin eugenol ester,AEE)是利用结构拼合的前药原理,以丁香酚对阿司匹林进行酯化修饰而合成的一种新型药用化合物,其降低了阿司匹林对胃肠道的刺激性,同时增强了挥发油丁香酚的稳定性。研究表明,AEE具有确切的抗炎[1]、抗氧化[2-3]、降血脂[4-5]、预防动脉粥样硬化[6-7]和预防血栓形成[8-10]和抗急性肝损伤[11]等作用,效果优于前体药物阿司匹林和丁香酚,具有很好的成药性。
口服是最为便捷的给药途径之一,但大多数药物经口服给药后,会受到胃肠道中多种因素的影响[12],如胃液的酸性和肠液的碱性环境、胃肠道消化酶、肠道上皮细胞中的酶,以及肠道菌群的影响等,使其在到达作用部位前发生降解和代谢[13]。本课题组前期研究发现,大鼠及犬口服给药后,血浆中AEE及其前体药物阿司匹林、丁香酚的浓度均极低,而代谢产物水杨酸的浓度较高[14-15]。本研究采用高效液相色谱法(HPLC),考察了AEE在人工胃/肠液和组织样品中的稳定性,同时考察了SD大鼠肠道菌群对AEE的降解作用,为后续的制剂设计和开发提供理论参考。
1 材料与方法
1.1 药品与试剂AEE对照品(含量99.8%,中国农业科学院兰州畜牧与兽药研究所自制,批号:20190815);丁香酚对照品(含量99.95%,中国食品药品检定研究院,批号:20032206);水杨酸(含量99.7%,中国食品药品检定研究院,批号:100106-201605);乌拉坦(NJKOCED,梯希爱化成工业发展有限公司);胰蛋白酶(酶活:250 NFU/mg,北京索莱宝科技有限公司,批号:T8150);胃蛋白酶(酶活:3 000-3 500 NFU/g,北京索莱宝科技有限公司,批号:P8390);磷酸盐缓冲液(北京索莱宝科技有限公司,批号:D1040-500);厌氧培养基(CM1513 北京陆桥技术股份有限公司);乙腈(色谱纯,赛默飞世尔科技有限公司);盐酸、磷酸二氢钾、氢氧化钠等均为国产分析纯试剂。
1.2 主要仪器超高效液相色谱仪-紫外检测器,品牌:安捷伦,型号:1290;匀浆机(IKA®T25easy clean digital);厌氧培养箱(Thermo Forma 1029)。
1.3 实验动物6只清洁级SD大鼠,雄性,8~10周龄,体质量210~230 g,购买于中国农业科学院兰州兽医研究所,动物生产许可证号:NKMYD201907018。
1.4 溶液的制备
1.4.1储备液与溶液 分别称取AEE、水杨酸和丁香酚对照品适量,以乙腈溶解制成质量浓度为1 g/L的储备液,于4℃储备。使用前用乙腈稀释得到相应质量浓度的对照品溶液。
1.4.2人工胃液的制备 按文献[16]方法,取稀盐酸(盐酸234 mL,加水稀释至1 000 mL)16.4 mL,加水约800 mL,胃蛋白酶10 g,摇匀后,用0.1 mol/L盐酸溶液调pH=1.3,加水稀释并定容到1 000 mL,即得人工胃液。空白人工胃液的配制:除不含胃蛋白酶,其余与人工胃液配制相同。
1.4.3人工肠液的制备 按文献[16]方法,取磷酸二氢钾6.8 g,加水500 mL使其溶解,用0.1 mol/L氢氧化钠溶液调节pH=6.8;称取胰蛋白酶10 g,加适量水溶解;将上述两种溶液混合后,再加水稀释并定容到1 000 mL,即得人工肠液。空白人工肠液的配制:除不含胰蛋白酶,其余与人工肠液配制相同。
1.4.4SD大鼠肠道菌群的制备 SD大鼠禁食12 h,刺激腹部采集新鲜粪便,将粪便与生理盐水按比例(1 g∶5 mL)涡旋混合制成悬浊液,2 000 r/min离心10 min (4℃),再将上清液与厌氧培养液按比例(1∶9)混合,置厌氧培养箱中过夜,制得肠道菌群培养液[17]。
1.4.5空白组织样品的制备 参考文献[18-20]制备样品。230~250 g SD大鼠6只,禁食不禁水过夜,腹腔注射乌拉坦麻醉后迅速处死,取出肝脏、胃、小肠和大肠,用预冷的磷酸盐缓冲液(4℃预冷2 h)冲洗表面后剪碎,再将各组织与磷酸盐缓冲液按比例(1 g∶5 mL)混合,置于匀浆机中均质后,2 000 r/min 离心10 min(4℃),取上清液备用。上述操作均在冰浴条件下进行。
1.4.6厌氧培养基的制备 称取厌氧培养基9.5 g,加水800 mL摇匀,加水稀释并定容到1 000 mL,高压灭菌后分装到试管中,制成厌氧培养基,4℃保存备用。
1.5 样品处理
1.5.1人工胃/肠液样品处理 移取AEE储备液4份,每份500 μL,分别置于50 mL容量瓶中,再分别用空白人工胃液、空白人工肠液、人工胃液、人工肠液稀释并定容,充分混匀后,再分装到EP管中(每管1 mL,每个时间点平行3份),于37℃水浴中孵育不同时间后分别取样300 μL,加入冰乙腈700 μL终止反应,涡旋混匀,于4℃下14 000×g离心10 min,取上清液,按1.6色谱条件进样分析,记录色谱峰面积。
1.5.2SD大鼠肠道菌群处理 取1.4.4制备好的肠道菌群培养液1 mL于EP管中,分别加入AEE储备液10 μL,涡旋混匀后置入厌氧培养箱,培养不同时间后分别取样0.5 mL于EP管中(每个时间点平行3份),加入冰乙腈(-20℃预冷2 h)1 mL终止反应,12 000×g离心10 min,取上清液,按1.6色谱条件进样分析,记录色谱峰面积。以培养相同时长不含AEE的培养液为空白对照,同法操作。
1.5.3空白组织样品处理 将1.4.5制备好的上清液迅速分装到EP管中(每管1 mL,每个时间点平行3份),加入AEE储备液10 μL,混匀后置37℃水浴中孵育不同时间后,移取300 μL,加入700 μL冰乙腈终止反应,涡旋2 min,14 000×g离心10 min,取上清液,按1.6色谱条件进样分析,记录色谱峰面积。
1.6 含量测定色谱条件使用Phenomenex Luna C18色谱柱(150 mm×4.6 mm,5 μm)对样品进行色谱分析。流动相A为0.5%磷酸,流动相B为乙腈。梯度洗脱步骤:0 min,A 60%;10 min,A 40%;30 min,A 40%;35 min,A 60%。柱温35℃,检测波长279 nm,流速1.0 mL/min,进样量为10 μL。
2 结果
2.1 含量测定方法
2.1.1专属性 分别取空白人工胃液、空白人工肠液、人工胃液、人工肠液、人工胃液+AEE储备液、人工肠液+ AEE储备液、空白人工胃液+AEE储备液、空白人工肠液+AEE储备液,按1.5.1方法处理,再按1.6色谱条件进样分析,记录色谱图;另取空白肠道菌液、空白肠道菌液+AEE储备液,按1.5.2方法处理,再按1.6色谱条件进样分析,记录色谱图;再取空白肝液、空白胃液、空白大肠及其内容物、空白小肠及其内容物、空白肝液+ AEE储备液、空白胃液+AEE储备液、空白大肠及其内容物+ AEE储备液、空白小肠及其内容物+AEE储备液,按1.5.3方法处理,再按1.6色谱条件进样分析,记录色谱图。结果如图1所示,在该色谱条件下,AEE能被检出,保留时间为13.985 min,分离度良好,不受其他物质干扰。

A.空白人工胃液;B.空白人工胃液+AEE;C.人工胃液;D.人工胃液+AEE;E.空白人工肠液;F.空白人工肠液+AEE;G.人工肠液;H.人工肠液+AEE;I.空白菌液;J.空白菌液+AEE;K.大肠及内容物;L.小肠及内容物;M.胃液;N.肝液。AEE出峰时间13.985 min图1 代表性色谱图
2.1.2线性关系的考察 精密吸取AEE储备液,用乙腈分别稀释成质量浓度为0.3,0.6,1.2,2.5,5.0,10.0,20.0 mg/L的一系列对照品溶液,按1.6色谱条件进样测定,记录相应的峰面积。以AEE储备液的质量浓度(mg/L)为横坐标,峰面积为纵坐标,进行线性回归分析,AEE回归方程:y=8.108 3x+0.944 7(R2=0.999 9),结果表明,AEE储备液质量浓度在0.3~20.0 mg/L时与峰面积线性关系良好。
2.1.3仪器精密度 精密吸取同一份AEE储备液,再按1.6色谱条件连续进样6次,计算得到峰面积 RSD 值为1.98%,说明仪器精密度良好。
2.2 AEE在人工胃/肠液中的稳定性以0 h时 AEE的峰面积为100%,计算各时间段的剩余百分比。结果见图2:AEE在空白人工胃液中孵育0~2 h 剩余百分比基本没有发生变化,随着时间的增加,剩余百分比有明显的下降,到6 h时下降到71%;在人工胃液中的剩余百分比随着时间的增加,逐渐下降,从0 h的98%降到6 h的65%。AEE在空白人工肠液中孵育,AEE的剩余百分比随着时间延长逐渐下降,从0 h的98%降到6 h的75%;而在人工肠液中孵育0~1 h,稍微下降,但1~3 h,剩余百分比迅速下降,从77%降到22%,孵育到5 h,剩余百分比降为0%。

图2 AEE在人工胃肠液中的孵育后的剩余百分比(n=3)
2.3 AEE在SD大鼠肠道菌群中的稳定性以0 h 时AEE的峰面积为100%,计算各时间点的剩余百分比。AEE在SD大鼠肠道菌群中孵育时发生降解,随着时间的延长,AEE的剩余百分比逐渐下降(图3),而生成的两个主要色谱峰的面积随着时间的增加而增加。为了探究代谢生成产物,测定了水杨酸标准品和丁香酚标准品,按1.6色谱条件进样分析,记录色谱图。结果AEE代谢生成的主要色谱峰与水杨酸标准品色谱峰和丁香酚标准品色谱峰比较,在相同的保留时间上显示相同的色谱峰。由此可知,AEE的代谢产物主要是水杨酸和丁香酚,生成水杨酸和丁香酚的色谱峰面积与时间的关系如图4。
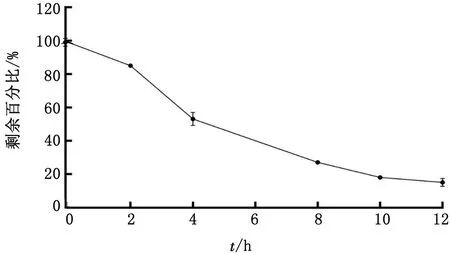
图3 AEE在SD大鼠肠道菌群中孵育后剩余百分比(n=3)
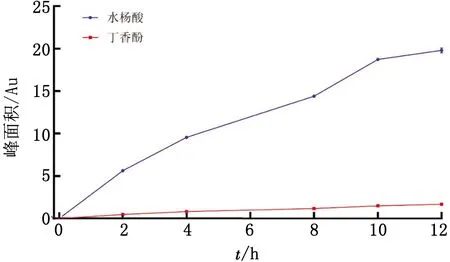
图4 AEE在SD大鼠肠道菌群中孵育生成水杨酸和丁香酚的色谱峰面积(n=3)
2.4 AEE在生物样品中的稳定性AEE在生物制品中发生明显降解,孵育0.5 h时,此色谱条件下已检测不到AEE的色谱峰,而生成两个主要的色谱峰,与2.3中已测得的水杨酸和丁香酚标准品色谱峰比较,在相同的保留时间上显示相同的色谱峰,表明AEE的代谢产物主要是水杨酸和丁香酚。生成水杨酸和丁香酚的色谱峰面积与时间的关系如图5,6。

图6 AEE在生物样品中孵育后生成丁香酚的色谱峰面积(n=3)
3 讨论
口服药物在胃肠道环境下的稳定性检测是新药开发的重要研究内容,药物在胃肠道中的含量变化是关键环节[21]。本研究测定了AEE在人工胃/肠液、肠道菌群及生物样品中的稳定性,结果发现AEE在空白胃液、人工胃液、空白人工肠液中发生了降解(约30%),在人工肠液中降解最明显,5 h时基本完全降解,表明胰蛋白酶对AEE的影响较大,胃蛋白酶对其影响较小。鉴于进入肠道的药物会受到肠道菌群的影响[22],因此另外测定了AEE在SD大鼠肠道菌群中的稳定性,结果表明AEE剩余百分比与时间成反比,主要的代谢产物水杨酸和丁香酚的色谱峰面积随时间延长而增加,说明肠道菌群对AEE代谢有一定的作用。
为了使试验条件更加接近生物体内代谢环境[23],进一步检测了AEE在生物制品中的稳定性,结果发现AEE在空白大鼠肝脏、空白大鼠胃液、空白大鼠大肠及内容物、空白大鼠小肠及内容物中不稳定,0.5 h时基本完全降解,主要代谢产物为水杨酸和丁香酚,二者的含量比较稳定,不会随着孵育时间的增加而变化。
综上所述,动物体内的酶对AEE具有较强的代谢作用,AEE在体内的代谢主要发生在小肠,在胰酶、肠上皮细胞中的酶、肠道菌群等作用下会产生水杨酸和丁香酚两种主要代谢产物。此结果与前期的研究结果相似[14-15,24],前期研究发现大鼠及犬口服给药后,血浆中AEE及其前体药物阿司匹林、丁香酚的浓度均较低,而代谢产物水杨酸的浓度较高。本研究的结果表明,在开发AEE口服制剂时需要进行特殊的处理来防止AEE在体内的降解。

