肾脏尤文肉瘤/原始神经外胚层肿瘤与乳头状肾细胞癌的CT征象比较
魏晋艳,刘静妮,张学凌,王丹,刘显旺,赵建洪,周俊林*
1.兰州大学第二医院放射科,兰州大学第二临床医学院,甘肃省医学影像重点实验室,甘肃 兰州 730030;2.甘肃省武威市人民医院,甘肃 武威 733000;*通信作者 周俊林 lzuzjl601@163.com
肾脏尤文肉瘤/原始神经外胚层肿瘤(renal Ewing's sarcoma/primitive neuroectodermal tumor,RES/PNET)是一种少见的、具有高度侵袭性的小圆细胞恶性肿瘤,起源于神经外胚层神经嵴细胞,约占全部肾脏肿瘤的1%[1-2]。乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)是发病率仅次于肾透明细胞癌的肾上皮性恶性肿瘤,占全部肾细胞癌的10%~20%[3]。RES/PNET的临床表现及影像学表现与PRCC存在重叠,容易造成误诊,但2种肿瘤的治疗方法及预后存在差异。与PRCC相比,RES/PNET侵袭性强且术后复发率极高,根治性肾脏切除术并辅助以术后放、化疗是RES/PNET的标准治疗方法[2,4]。PRCC对放、化疗缺乏敏感性,且对于部分PRCC患者,可以使用保留肾单位的肾部分切除术[5]。因此,术前准确地区分两种肿瘤,对手术方案的制订及治疗方法的选择非常重要。本研究拟探讨RES/PNET与PRCC在CT征象上的差异,提高对两者的认识及诊断能力,为临床诊疗方案的制订提供参考。
1 资料与方法
1.1 研究对象 回顾性分析2010年1月—2020年10月兰州大学第二医院和甘肃省武威市人民医院经手术病理证实的12例RES/PNET与15例PRCC的术前临床、病理与CT资料。RES/PNET组中,男5例,女7例;年龄15~50岁,平均(29.5±11.9)岁;临床表现:血尿5例,腰痛4例,3例为无症状或体检时发现。PRCC组中,男10例,女5例;年龄29~80岁,平均(59.6±12.8)岁;临床表现:血尿3例,腰痛7例,5例为无症状或体检时发现。本研究经兰州大学第二医院伦理委员会批准(批准号:2019A-063),所有患者均签署知情同意书。
1.2 仪器与方法 CT检查使用GE Discovery CT 750 HD或Siemens Somatom Defnition Flash扫描仪,患者取仰卧位,扫描范围从肝脏上缘至髂前上棘。扫描参数:平扫管电压120 kVp,采用自动管电流技术,管电流100~600 mA。准直器宽度0.625 mm,机架转速0.6 s/r,螺距0.983,重建层厚和层间距均为1.25 mm。增强扫描对比剂采用碘海醇(300 mgI/ml),流速3.5~4.0 ml/s,剂量1 ml/kg,经肘前静脉高压团注,腹主动脉监测触发阈值为100 Hu,皮质期及髓质期分别于触发后20 s及60 s扫描。
1.3 图像分析 所有CT图像均由2名副主任以上级别的腹部放射诊断医师采用双盲法分析。定性结果不一致时,由2名医师通过协商达成一致;定量指标由2名医师测量3次取平均值。观察征象包括定性指标肿瘤部位、形态、边界、出血、坏死囊变、钙化和定量指标肿瘤平均最大直径、平扫CT值、皮质期CT值、髓质期CT值、皮质期强化值(ΔCTA)、髓质期强化值(ΔCTV),其中ΔCTA=肿瘤皮质期CT值-平扫期CT值,ΔCTV=肿瘤髓质期CT值-平扫期CT值。肿瘤部位:根据肿瘤发生部位分为左肾或右肾;形态:肿瘤为圆形、椭圆形定义为规则形,否则定义为不规则形;边界:肿瘤浸润周围组织定义为不清晰,否则定义为清晰;肿瘤平均最大直径:在肿瘤的轴位、矢状位、冠状位上选取瘤体最大径线为肿瘤最大径;测量CT值时,避开出血、坏死囊变及钙化区,将圆形的感兴趣区(ROI)放置在距肿瘤边缘2 mm以上,肿瘤实质成分强化最明显的区域,ROI为0.05~0.1 cm2[6]。
1.4 统计学方法 采用SPSS 23.0软件,计数资料组间比较采用χ2检验或Fisher确切概率法,计量资料以±s表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 基本临床指标 12例RES/PNET及15例PRCC肿瘤均为单发,RES/PNET组患者发病年龄小于PRCC组(t=-6.274,P<0.001);患者性别及是否出现肉眼血尿差异均无统计学意义(P>0.05),见表1。
2.2 CT征象定性指标 RES/PNET组肿瘤形态、肿瘤边界及坏死囊变等与PRCC组比较,差异均有统计学意义(P<0.05),RES/PNET组病灶形态多不规则,边界不清晰,病灶内易出现坏死囊变,部分病灶内可见出血;PRCC组病灶形态常较规则、边界多较清晰,病灶内坏死囊变,未见出血。两组肿瘤在肿瘤发病部位、出血及钙化等方面差异均无统计学意义(P均>0.05;表1,图1、2)。

图1 女,21岁,右肾RES/PNET。A~C依次为CT平扫、增强扫描皮质期及髓质期轴位图像。右肾下极可见形态不规则的囊实性软组织肿块,与周围组织分界欠清,增强扫描呈不均匀性中度渐进性强化(箭);D.病理镜下示瘤细胞呈小圆形,排列密集,核大、深染,弥漫性分布,核分裂象易见,局部可见Homer-Wright菊型团(HE,×100)

表1 RES/PNET组与PRCC组患者主要临床资料与CT定性指标比较
2.3 CT征象定量指标 RES/PNET组患者肿瘤平均最大直径明显大于PRCC组(t=3.063,P<0.05)。两组肿瘤的平扫CT值、皮质期CT值、髓质期CT值、皮质期强化值(ΔCTA)及髓质期强化值(ΔCTV)见表2。RES/PNET组患者肿瘤平扫CT值小于PRCC组,而ΔCTV大于PRCC组,差异均有统计学意义(t=2.610,P<0.05;t=2.323,P<0.05),但两组肿瘤间皮质期CT值、髓质期CT值及ΔCTA等差异均无统计学意义(P均>0.05)。
表2 RES/PNET组与PRCC组患者CT定量指标比较(±s)

表2 RES/PNET组与PRCC组患者CT定量指标比较(±s)
注:RES/PNET为肾脏尤文肉瘤/原始神经外胚层肿瘤,PRCC为乳头状肾细胞癌,D为肿瘤最大直径,ΔCTA为动脉期强化值,ΔCTv为髓质期强化值
指标RES/PNET(n=12)PRCC(n=15)t值P值D(cm) 8.0±4.5 4.1±1.8 3.063 0.005 CT平扫(Hu)0.015 CT皮质(Hu) 55.8±7.4 59.9±6.7 -1.542 0.136 39.0±4.8 45.9±8.0-2.610 CT髓质(Hu)0.599 ΔCTA(Hu) 16.8±6.7 14.1±7.1 1.000 0.327 72.3±13.2 70.1±7.9 0.533 ΔCTv(Hu)32.3±11.4 24.2±8.9 2.323 0.029
3 讨论
RES/PNET由Seemayer等[7]于1975年首次报道,具有生长迅速、侵袭性强、恶性程度高、容易出现复发及转移的特点,因此临床多采用根治性肾脏切除术并辅助以术后放、化疗[2,8-9]。既往研究表明,接受或不接受肾切除术患者的2年总生存期分别为80%和30%[9],而术后辅助放、化疗可以将5年生存率从不足10%提高到45%~55%[10]。PRCC对放、化疗缺乏敏感性,且保留肾单位的肾部分切除术更有利于部分PRCC的预后[11]。RES/PNET与PRCC的临床表现及影像学特征存在较多重叠,术前容易误诊。本研究结果表明,CT征象结合临床指标有助于提高术前鉴别诊断RES/PNET与PRCC的准确性。
既往研究显示,RES/PNET好发于青少年,Risi等[4]回顾性分析116例RES/PNET的临床资料,中位发病年龄为28岁,22%的患者发病年龄<15岁;而PRCC的发病年龄通常较大[12]。本研究结果表明,PRCC患者的发病年龄大于RES/PNET,因此,可以认为年龄是鉴别RES/PNET与PRCC的重要临床指标之一。既往研究报道RES/PNET以男性多见[13],本研究RES/PNET患者男5例,女7例,与文献结果不符,可能与病例数过少有关;PRCC组中男女比例为2∶1,符合PRCC好发于男性的流行病学特点[3,11],但两组患者性别无显著差异。RES/PNET与PRCC的临床表现均缺乏特异性,最常见的症状是腰背部胀痛,部分患者还可伴有肉眼血尿,多为瘤组织侵犯肾盂或输尿管所致,尽管RES/PNET恶性程度高于PRCC,但本研究中两组患者是否出现肉眼血尿无显著差异。
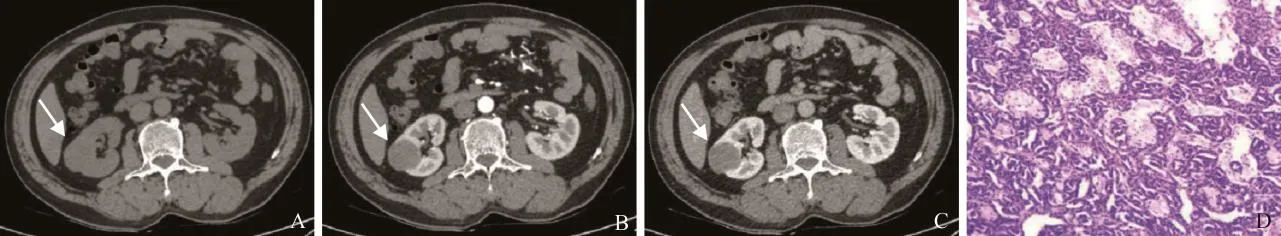
图2 男,55岁,右肾PRCC。A~C依次为CT平扫、增强扫描皮质期及髓质期轴位图像。右肾中极可见形态规则、密度均匀的圆形软组织肿块,与周围肾组织分界清晰,增强扫描呈不均匀性轻度强化(箭);D.病理镜下示肿瘤细胞呈小管状排列,并可见乳头状结构,胞质嗜酸,未见明显异型性及病理性核分裂象(HE,×200)
既往研究[14]显示,RES/PNET与PRCC的肿瘤发生部位无显著差异,与本研究结果相符。本研究中,RES/PNET多表现为形态不规则的软组织肿块;而大多数PRCC形态较规则,仅少数形态不规则,这可能是由于RES/PNET恶性程度极高,生长速度快,瘤体内各区域肿瘤细胞增殖活跃,但增殖速度不一所致。此外,与PRCC相比,RES/PNET边界常不清晰[15],Ellinger等[11]报道,57.6%的RES/PNET患者初诊时已处于临床进展期,59%的RES/PNET可浸润周围组织或出现远处转移;而PRCC生长多较缓慢,常伴有假包膜形成,也极少侵犯周围组织或出现远处转移[12],因此肿瘤边界多较清晰。本研究发现,RES/PNET肿瘤边界表现为不清晰的患者明显多于PRCC组,符合RES/PNET具有高度侵袭性、浸润性生长的特点,与文献报道相符[2,8,16]。李世杰等[12]报道,PRCC多表现为密度均匀的实性软组织肿块,而瘤体内伴有囊变坏死是RES/PNET最常见的影像学特征之一。本研究中,12例RES/PNET瘤体内均出现不同程度的坏死囊变,与文献报道一致[2],可能与肿瘤生长速度过快、肿瘤滋养血管不能满足肿瘤生长需要有关。本研究显示,RES/PNET与PRCC瘤体是否伴有出血无明显差异。钙化是RES/PNET与PRCC瘤体内较为少见的征象,本研究中,仅1例RES/PNET与3例PRCC瘤体内出现点状钙化,且RES/PNET与PRCC瘤体内是否存在钙化无明显差异,与既往研究结论一致[2,17]。
既往研究表明,RES/PNET的平均最大直径常大于肾细胞癌,Kumar等[14]纳入21例RES/PNET,肿瘤最大直径为(13.76±5.35)cm;Murugan等[8]研究显示,RES/PNET肿瘤最大直径为12(6,20)cm;李世杰等[12]纳入60例PRCC,肿瘤直径为5(1.2,12)cm。本研究中RES/PNET组肿瘤最大直径为(7.98±4.54)cm,明显大于PRCC组的(4.07±1.81)cm,与既往研究结果一致[14],可能原因为RES/PNET属于高度恶性的侵袭性肿瘤,肿瘤细胞增殖活跃、生长速度快;而PRCC恶性程度相对较低,肿瘤生长速度缓慢。本研究结果表明,尽管RES/PNET和PRCC均呈轻/中度渐进性强化,但RES/PNET的肿瘤平扫CT值低于PRCC,ΔCTV高于PRCC。RES/PNET的肿瘤平扫CT值较低,可能是由于RES/PNET恶性程度高,肿瘤细胞易发生坏死、囊变,测量肿瘤平扫CT的ROI包含肉眼难以区分的微囊变区域,与RES/PNET光镜下可见大小不一的坏死、囊变区的病理特点相符[4]。增强CT在反映肿瘤形态及内部特征的同时,还可以反映肿瘤的血供情况[18],侵袭性较高的恶性肿瘤新生血管增多,血管基底膜不完整,通透性相对较高,因此对比剂更易进入瘤组织中,即表现为较高的强化程度,并能通过CT值进行量化评估[19]。本研究中,RES/PNET的肿瘤ΔCTV高于PRCC,也间接提示RES/PNET具有较高的恶性程度。
本研究存在以下不足:纳入样本量相对较少,所得结果可能存在偏差;此外,本研究为回顾性研究,未结合CT灌注参数、能谱CT参数等多模态CT指标,有待未来扩大样本量及成像方法后进行更深入的研究。
总之,CT征象结合临床指标对于RES/PNET与PRCC的鉴别诊断具有一定的价值,其中患者年龄、肿瘤形态、边界、坏死囊变结合CT定量参数有助于术前有效区分RES/PNET与PRCC,为临床诊疗方案的制订提供参考。

