第三代双源CCTA扫描体型特异性剂量估计的临床应用研究
聂壮,雷子乔,范文亮,杨明,余建明
1.华中科技大学同济医学院附属协和医院 放射科,湖北 武汉 430022;2.分子影像湖北省重点实验室,湖北 武汉 430022
引言
心脏冠脉CTA成像(Coronary CT Angiography,CCTA)可无创性地实现对心脏冠状动脉以及心肌的三维立体评估,是临床中冠状动脉相关疾病筛查的首选方案[1]。CT技术的发展使得CCTA筛查进一步普及[2],同时临床医生和患者也越来越关注其辐射剂量水平,需要更为有效的指标对患者CCTA检查所接受的辐射剂量水平进行个体化评估和管理。2011年美国物理师协会204工作组报告(AAPM work group 204)中提出体型特异性剂量估算值(Size Specific Dose Estimation,SSDE)[3]。SSDE最初应用于儿童患者辐射剂量的评估,之后其应用扩展到成人胸腹盆CT扫描的剂量评估[4-5]。Westra等[6]报道了使用SSDE评估胸部CTA的研究,探讨SSDE在CT血管成像中剂量评估的可行性。本研究旨在探讨使用SSDE对第三代双源CCTA进行个性化辐射剂量评估的可行性,并与传统的容积CT剂量指数(Volume CT Dose Index,CTDIvol)方法进行对比。
1 资料与方法
1.1 病例
回顾性分析了2019年8至9月之间的CCTA病例。纳入标准:连续性纳入采用前瞻性心电门控触发轴扫方案完成检查的CCTA病例。排除标准:冠脉搭桥术后,起搏器植入,以及由于金属伪影可能造成辐射剂量估算不准的病例数据。本回顾性研究获得了机构伦理审查委员会批准,并免去患者知情同意要求。
1.2 设备
(1)CT扫描仪:本研究所有CCTA病例均使用德国西门子SOMATOM Force CT进行扫描。Force CT为西门子第三代双源CT,探测器准直器为0.6 mm×192,配有CARE kV管电压技术、Care Dose4D智能电流技术以及ADMIRE迭代技术。
(2)高压注射器:使用三腔式高压注射器(CT MOTION,ulrich medical)。
1.3 扫描方案
(1)患者准备与扫描技术:去除患者体外金属物品,扫描前3~5 min给患者舌下服硝酸甘油0.5 mg,有青光眼或其他硝酸甘油使用禁忌症或不良反应患者除外。建立静脉通道,连接心电门控电极,进行屏气训练。患者体位为足先进,双臂上举过头伸直,扫描范围为气管隆突下1~2 cm至心脏膈面。扫描方案为前瞻性心电门控触发轴扫模式,所有检查均使用3个心动周期完成整个心脏数据采集。X线球管电压采用CARE kV技术根据所扫描患者定位像进行自适应选择,管电压中位数为80 kV(管电压范围:70~120 kV);同时采用Care Dose4D技术行实时管电流调制,参考管电流设置为110 mAs。准直器组合根据实际扫描范围调整;螺距根据患者心率自适应,螺距中位数为0.85,平均球管旋转时间为0.58 s。根据患者心率选择相应时相原始数据重建图像,图像采集矩阵为512×512,重建层厚为0.75 mm,层间距0.5 mm,重建卷积核为Bv46,图像重建联合使用ADMIRE迭代重建技术。
(2)对比剂注射方案:对比剂使用碘迈伦(400 mg/mL)。本研究根据kV条件调整对比剂注射流速以适配所需的碘流率[7],具体为:70 kV,2.5 mL/s;80 kV,3 mL/s;90 kV,3.5 mL/s ;100 kV,4 mL/s;110 kV 及以上,4.5~5 mL/s。对比剂注射量为扫描时间加上经验值7 s之和再乘以注射流速计算所得,随后同速注射生理盐水30 mL。注射对比剂后,触发扫描方式为团注追踪法(Bolus-Tracking),在升主动脉设置一个ROI检测区,设定CT阈值100 HU,达到阈值后即刻施加口令通知患者配合屏气启动扫描。
1.4 辐射剂量参数
记录每个患者设备报告辐射剂量参数,包括CTDIvol和DLP。所有病例图像数据再导入Radimetrics平台(Radimetrics Inc,Bayer)进行相关辐射剂量参数值的计算分析,包括器官剂量、有效剂量)、患者水等效直径(Water-Equivalent Diameter,WED)以及SSDE。患者器官剂量通过一系列对应男性和女性的标准化模拟人体数学模型,使用蒙特卡罗模拟推算[8]。本研究分别计算出患者扫描范围内的表层脏器皮肤,深层脏器肺部以及受检脏器心脏的辐射剂量。有效剂量通过应用国际放射防护委员会(ICRP103)提出的辐射敏感性权重因子进行计算[9]。
1.5 SSDE计算
本研究通过定位图计算患者WED,WED为与人体有相同衰减特性的圆柱形水模的直径,可体现患者身体密度与成分差异等体型特征[10]。然后根据美国物理师协会220工作组(AAPM Task Group 220)报告的转换因子(基于32 cm体模)表[11-12],按式(1)计算SSDE。
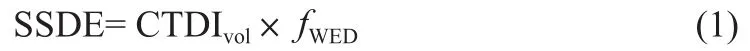
其中,fWED为不同WED对应的转换因子。
1.6 统计学分析
数据统计分析使用R语言开源软件。计数资料使用频数或百分比表示。计量资料(CTDIvol、SSDE、DLP、有效剂量和器官剂量)进行Shapiro-Wilk正态性检验,为偏态分布故以中位数和四分位间距表示。SSDE分别与各器官剂量行相关分析。双变量相关性分析,符合正态分布使用Pearson相关分析,偏态分布使用Spearman相关分析。分别行SSDE、CTDIvol与各器官剂量的线性回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 研究队列
本研究共纳入453例研究对象,其中男性265例,平均年龄(56.3±13.4)岁;女性188例,平均年龄(60.0±12.3)岁。患者WED平均值为(24.3±2.6)cm,其中大于32 cm的3例;扫描平均长度为(11.7±1.2)cm;管电压中位数为80(Q1:70,Q3:90)kV,其中40%(181/453)患者使用 70 kV,28% (125/453)为80 kV,17%(80/453)为90 kV,11%(50/453)为100 kV,4%(17/453)为110 kV及以上。
2.2 辐射剂量参数
CTDIvol、DLP、有效剂量、SSDE及器官剂量(分别包括:人体表层脏器皮肤,深层脏器肺部以及受检脏器心脏)结果以中位数和四分卫间距表示(Q1和Q3),见表1。

表1 辐射剂量参数
2.3 患者体型与辐射剂量
WED大于32 cm的3例中,患者的CTDIvol(平均值56.8 mGy)均高于SSDE(平均值54.1 mGy)(表2)。其余450例患者WED均<32 cm,CTDIvol中位数为14.9(11.2,20.0)mGy,SSDE中位数为19.2(14.9,24.6)mGy。CTDIvol较SSDE低约22.4%(19% ~ 24.8%),两者间有统计学差异(P<0.05)(图1)。
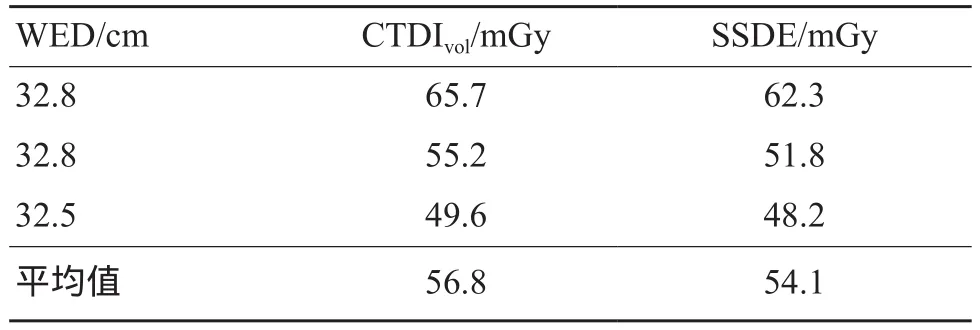
表2 WED大于32 cm的3例患者CTDIvol均大于SSDE

图1 对于WED<32 cm的患者SSDE均>CTDIvol
2.4 SSDE相关分析
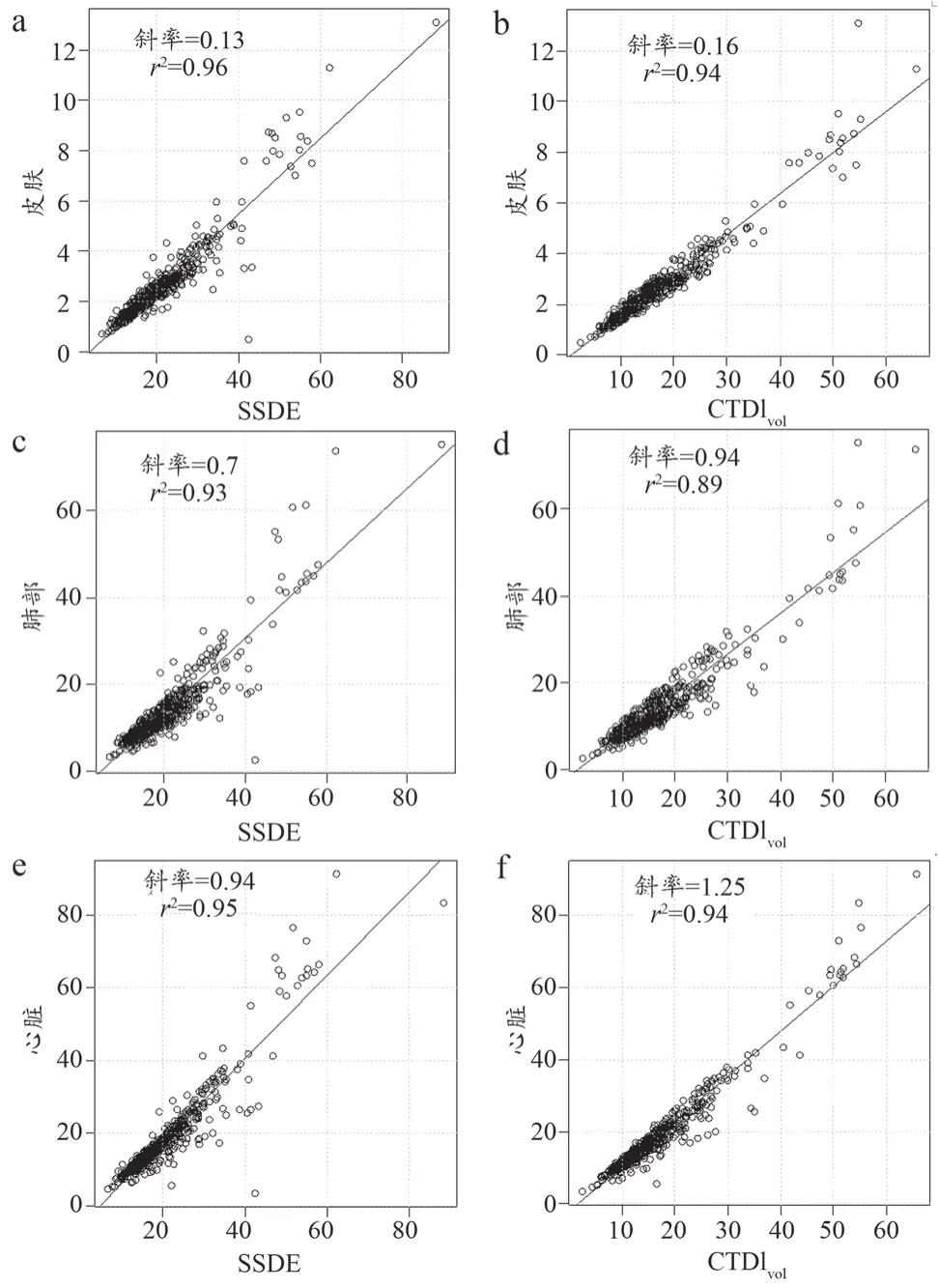
SSDE与器官剂量均为显著性正相关。SSDE与器官剂量相关程度线性回归分析组,皮肤:P<0.001,r2=0.96,斜率 =0.13 ;肺部:P<0.001,r2=0.93,斜率 =0.70;心脏:P<0.001,r2=0.95,斜率 =0.94。CTDIvol与器官剂量相关程度线性回归分析组,皮肤:P<0.00.1,r2=0.94,斜率=0.16;肺部:P<0.001,r2=0.89,斜率=0.94;心脏:P<0.001,r2=0.94, 斜率 = 1.25。通过体型校准的SSDE相关度高于CTDIvol(图2)。
3 讨论
本研究使用SSDE对第三代双源CCTA患者辐射剂量进行评估,SSDE与器官剂量表现出高度的正相关,表明SSDE可有效评估患者CCTA检查中的吸收剂量,验证了SSDE评估CCTA辐射剂量临床应用可行性。
CCTA目前已成为冠心病的一线筛查手段,近年来在临床中使用频率快速增长,同时CCTA亦是CT检查中辐射剂量最高的检查之一[2,13],相关辐射风险亦引起广泛关注,所以需要一个有效辐射剂量参数对患者辐射剂量水平进行评估,指导扫描方案的优化。目前研究主要使用CTDIvol和DLP评估CCTA辐射剂量,但存在一定局限性。CTDIvol描述多排(层)螺旋 CT 在整个扫描容积范围内的平均辐射剂量输出,通过采用固定尺寸体模分别测量CT扫描仪在各种不同曝光条件的辐射剂量所得,其中应用于CCTA的一般是32 cm体模。所以CTDIvol反应了CT扫描仪的辐射输出量,其数值决定于扫描协议中的曝光条件,不能反映患者个体化辐射剂量的差异。其次,CTDIvol是基于32 cm体模测量,该体模大于正常患者体型,特别是中国患者体型。Nickoloff等[14]研究发现对于相同扫描参数,6 cm 直径体模所测量得到中心 CTDI 比 32 cm 尺寸体模大 3~5 倍。这意味着患者实际接受剂量与体型相关,故常规CTDIvol难以准确评估患者的实际吸收剂量[4]。DLP亦是使用标准尺寸体模测量的设备输出辐射剂量,主要与扫描长度相关,也不能个性化反应患者的辐射剂量水平。SSDE是美国物理师协会204工作组报告中提出[3],通过结合患者体型差异对CTDIvol进行修正的辐射剂量计算参数,主要是为了满足更为准确的患者个体化辐射剂量评估和管理策略的需求,相关研究证实了SSDE用于儿童及成人患者体部CT扫描辐射剂量评估的可行性[4-6]。SSDE相对于传统的CTDIvol等参数能够个性化计算出患者辐射剂量[4],有潜力成为一个更有临床意义的CCTA辐射剂量评估指标。
Kidoh等[15]研究对37名患者CCTA检查的CTDIvol与SSDE进行了对比,结果显示SSDE平均比CTDIvol高出约34%,使用CTDIvol会低估患者辐射剂量。本研究队列中亦得到相似趋势,SSDE较CTDIvol高约22.4%(19%~24.8%)。此外本研究有3例患者WED>32 cm,这3例患者的SSDE均 患者器官剂量能真实反映患者身体实际吸收的辐射剂量以及辐射危害。本研究使用蒙特卡罗模拟估算患者的相关器官剂量,包括人体表层脏器皮肤,深层脏器肺部以及受检脏器心脏。如图2所示,SSDE与相关器官剂量线性相关度高于CTDIvol。与皮肤的线性相关度,SSDE的r2=0.96,稍高于CTDIvol的r2=0.94。本研究中SSDE与CTDIvol线性相关性的差异低于Westra等[6]在儿童CTA中的结果(SSDE:r2=0.96,CTDIvol:r2=0.91),这可能是因为本研究对象为成人,体型相较于儿童更接近于32 cm的体模。此外,本研究还对比了SSDE,CTDIvol与心脏和肺部两个脏器线性相关度。肺部是辐射较为敏感脏器,SSDE与其线性相关度高于CTDIvol(SSDE:r2=0.93,CTDIvol:r2=0.89)。心脏是CCTA扫描中的直接辐射受体,SSDE的线性相关度稍高于CTDIvol(SSDE:r2=0.95,CTDIvol:r2=0.94)。本研究中,SSDE与各器官剂量的线性相关度均高于CTDIvol,SSDE可以更有效反应CCTA检查过程中,被照射脏器的吸收剂量。所以SSDE有潜力成为CCTA检查中评估器官剂量的代替参数,对于患者辐射危害的评估具有临床意义,同时也可作为剂量优化的评估指标。 图2 SSDE与CTDIvol分别与人体器官剂量的线性回归分析 本研究存在一定不足:① 本研究病例均来自单中心,且时间跨度较小,可能存在一定偏差,未来需进一步扩大样本验证研究结果;② 因为是回顾性研究所以使用WED代表患者体型,未来研究中可引入患者身体质量指数进一步完善;③ 研究中使用蒙特卡罗进行脏器的估算,还需物理测量的进一步验证,但相关研究也证实了蒙特卡罗评估脏器剂量的可行性[17]。 总之,CCTA因其扫描部位解剖成分的复杂性,使用传统CTDIvol等参数不能有效评估患者实际吸收辐射剂量水平。使用WED进行患者体型个性化校准后的SSDE是更为准确的辐射剂量评估参数。应用SSDE可有效评估第三代双源Force CCTA剂量水平,同时有利于患者个性化辐射剂量管理与优化。